10.1: Forças intermoleculares
- Page ID
- 184796
- Descreva os tipos de forças intermoleculares possíveis entre átomos ou moléculas em fases condensadas (forças de dispersão, atrações dipolo-dipolo e ligação de hidrogênio)
- Identifique os tipos de forças intermoleculares experimentadas por moléculas específicas com base em suas estruturas
- Explicar a relação entre as forças intermoleculares presentes dentro de uma substância e as temperaturas associadas às mudanças em seu estado físico
Como foi o caso das substâncias gasosas, a teoria molecular cinética pode ser usada para explicar o comportamento de sólidos e líquidos. Na descrição a seguir, o termo partícula será usado para se referir a um átomo, molécula ou íon. Observe que usaremos a popular frase “atração intermolecular” para nos referirmos às forças de atração entre as partículas de uma substância, independentemente de essas partículas serem moléculas, átomos ou íons.
Considere esses dois aspectos dos ambientes de nível molecular em matéria sólida, líquida e gasosa:
- As partículas em um sólido são bem compactadas e geralmente dispostas em um padrão regular; em um líquido, elas estão juntas sem nenhum arranjo regular; em um gás, elas estão distantes sem nenhum arranjo regular.
- As partículas em um sólido vibram em posições fixas e geralmente não se movem em relação umas às outras; em um líquido, elas se movem umas sobre as outras, mas permanecem em contato essencialmente constante; em um gás, elas se movem independentemente umas das outras, exceto quando colidem.
As diferenças nas propriedades de um sólido, líquido ou gás refletem os pontos fortes das forças de atração entre os átomos, moléculas ou íons que compõem cada fase. A fase na qual uma substância existe depende da extensão relativa de suas forças intermoleculares (IMFs) e das energias cinéticas (KE) de suas moléculas. Os FMI s são as várias forças de atração que podem existir entre os átomos e as moléculas de uma substância devido a fenômenos eletrostáticos, conforme será detalhado neste módulo. Essas forças servem para manter as partículas próximas umas das outras, enquanto o KE das partículas fornece a energia necessária para superar as forças de atração e, assim, aumentar a distância entre as partículas. \(\PageIndex{1}\)A figura ilustra como as mudanças no estado físico podem ser induzidas pela alteração da temperatura, portanto, do KE médio, de uma determinada substância.
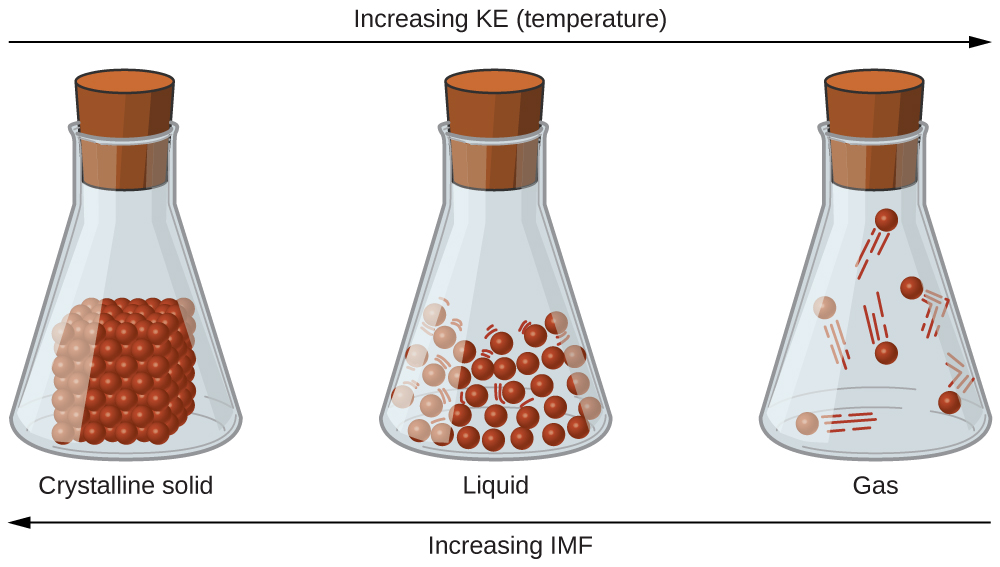
Como exemplo dos processos descritos nesta figura, considere uma amostra de água. Quando a água gasosa é resfriada o suficiente, as atrações entre as moléculas de H 2 O serão capazes de mantê-las unidas quando elas entrarem em contato umas com as outras; o gás condensa, formando líquido H 2 O. Por exemplo, água líquida se forma na parte externa de um copo frio como a água o vapor no ar é resfriado pelo vidro frio, como pode ser visto na Figura\(\PageIndex{2}\).

Também podemos liquefazer muitos gases comprimindo-os, se a temperatura não estiver muito alta. O aumento da pressão aproxima as moléculas de um gás, de forma que as atrações entre as moléculas se tornam fortes em relação ao KE. Consequentemente, eles formam líquidos. O butano, C 4 H 10, é o combustível usado em isqueiros descartáveis e é um gás em temperatura e pressão padrão. Dentro do compartimento de combustível do isqueiro, o butano é comprimido a uma pressão que resulta em sua condensação no estado líquido, conforme mostrado na Figura\(\PageIndex{3}\).

Finalmente, se a temperatura de um líquido ficar suficientemente baixa ou a pressão sobre o líquido ficar suficientemente alta, as moléculas do líquido não terão mais KE suficiente para superar o FMI entre elas e um sólido se forma. Uma discussão mais aprofundada sobre essas e outras mudanças de estado, ou transições de fase, é fornecida em um módulo posterior deste capítulo.
Forças entre moléculas
Sob condições apropriadas, as atrações entre todas as moléculas de gás farão com que elas formem líquidos ou sólidos. Isso se deve às forças intermoleculares, não às forças intra moleculares. As forças intra moleculares são aquelas dentro da molécula que mantêm a molécula unida, por exemplo, as ligações entre os átomos. As forças intermoleculares são as atrações entre as moléculas, que determinam muitas das propriedades físicas de uma substância. A figura\(\PageIndex{4}\) ilustra essas diferentes forças moleculares. Os pontos fortes dessas forças de atração variam muito, embora geralmente os FMI entre moléculas pequenas sejam fracos em comparação com as forças intramoleculares que unem átomos dentro de uma molécula. Por exemplo, para superar os IMFs em um mol de HCl líquido e convertê-lo em HCl gasoso, são necessários apenas cerca de 17 quilojoules. No entanto, quebrar as ligações covalentes entre os átomos de hidrogênio e cloro em um mol de HCl requer cerca de 25 vezes mais energia - 430 quilojoules.
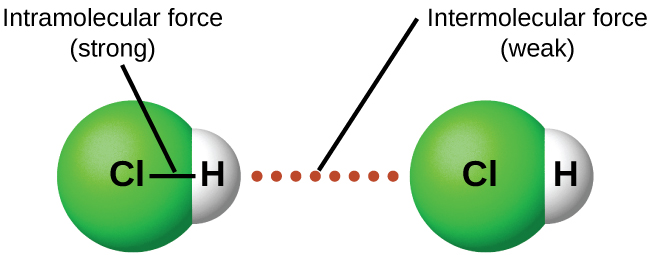
Todas as forças de atração entre átomos e moléculas neutras são conhecidas como forças de van der Waals, embora geralmente sejam chamadas mais informalmente de atração intermolecular. Vamos considerar os vários tipos de FMI nas próximas três seções deste módulo.
Forças de dispersão
Uma das três forças de van der Waals está presente em todas as fases condensadas, independentemente da natureza dos átomos ou moléculas que compõem a substância. Essa força atrativa é chamada de força de dispersão de Londres em homenagem ao físico americano nascido na Alemanha Fritz London, que, em 1928, a explicou pela primeira vez. Essa força é geralmente chamada simplesmente de força de dispersão. Como os elétrons de um átomo ou molécula estão em constante movimento (ou, alternativamente, a localização do elétron está sujeita à variabilidade da mecânica quântica), a qualquer momento, um átomo ou molécula pode desenvolver um dipolo temporário e instantâneo se seus elétrons forem distribuídos de forma assimétrica. A presença desse dipolo pode, por sua vez, distorcer os elétrons de um átomo ou molécula vizinha, produzindo um dipolo induzido. Esses dois dipolos temporários de flutuação rápida resultam, portanto, em uma atração eletrostática relativamente fraca entre as espécies - a chamada força de dispersão, como a ilustrada na Figura\(\PageIndex{5}\).
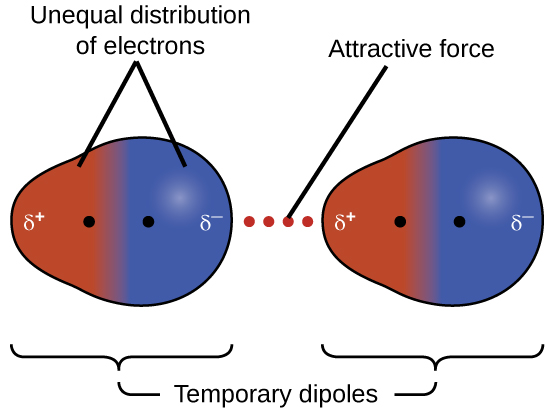
As forças de dispersão que se desenvolvem entre átomos em moléculas diferentes podem atrair as duas moléculas uma para a outra. As forças são relativamente fracas, no entanto, e só se tornam significativas quando as moléculas estão muito próximas. Átomos e moléculas maiores e mais pesados exibem forças de dispersão mais fortes do que átomos e moléculas menores e mais leves. F 2 e Cl 2 são gases à temperatura ambiente (refletindo forças de atração mais fracas); Br 2 é um líquido e I 2 é um sólido (refletindo forças de atração mais fortes). As tendências nos pontos de fusão e ebulição observados para os halogênios demonstram claramente esse efeito, conforme visto na Tabela\(\PageIndex{1}\).
| Halogênio | Massa molar | Raio atômico | Ponto de fusão | Ponto de e |
|---|---|---|---|---|
| flúor, F 2 | 38 g/mol | 72 pm | 53 KG | 85 KG |
| cloro, Cl 2 | 71 g/mol | 99 pm | 172 KM | 238 KM |
| bromo, Br 2 | 160 g/mol | 114pm | 266 KG | 332 KG |
| iodo, I 2 | 254 g/mol | 133pm | 387 QUILOGRAMAS | 457 QUILOMETROS |
| astatina, At 2 | 420 g/mol | 150pm | 575 KG | 610 KG |
O aumento nos pontos de fusão e ebulição com o aumento do tamanho atômico/molecular pode ser racionalizado considerando como a força das forças de dispersão é afetada pela estrutura eletrônica dos átomos ou moléculas na substância. Em um átomo maior, os elétrons de valência estão, em média, mais distantes dos núcleos do que em um átomo menor. Assim, eles são mantidos com menos força e podem formar mais facilmente os dipolos temporários que produzem a atração. A medida de quão fácil ou difícil é para outra carga eletrostática (por exemplo, um íon próximo ou molécula polar) distorcer a distribuição de carga de uma molécula (sua nuvem de elétrons) é conhecida como polarizabilidade. Diz-se que uma molécula que tem uma nuvem de carga facilmente distorcida é muito polarizável e terá grandes forças de dispersão; uma com uma nuvem de carga difícil de distorcer não é muito polarizável e terá pequenas forças de dispersão.
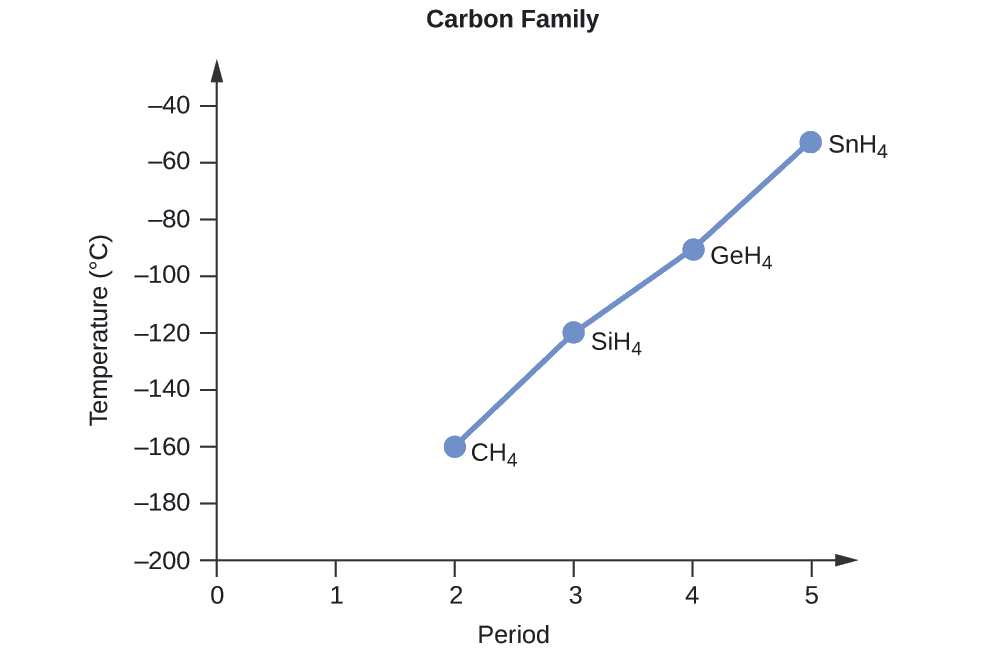
Ordene os seguintes compostos de um elemento do grupo 14 e hidrogênio do ponto de ebulição mais baixo para o mais alto: CH 4, SiH 4, GeH 4 e SnH 4. Explique seu raciocínio.
Solução
Aplicando as habilidades adquiridas no capítulo sobre ligação química e geometria molecular, prevê-se que todos esses compostos sejam apolares, então eles podem experimentar apenas forças de dispersão: quanto menor a molécula, menos polarizável e mais fracas as forças de dispersão; quanto maior a molécula, maior a forças de dispersão. As massas molares de CH 4, SiH 4, GeH 4 e SnH 4 são aproximadamente 16 g/mol, 32 g/mol, 77 g/mol e 123 g/mol, respectivamente. Portanto, espera-se que CH 4 tenha o ponto de ebulição mais baixo e SnH 4 o ponto de ebulição mais alto. Espera-se que o pedido do ponto de ebulição mais baixo para o mais alto seja
CH 4 < SiH 4 < GeH 4 < SnH 4
Um gráfico dos pontos de ebulição reais desses compostos versus o período dos elementos do grupo 14 mostra que essa previsão está correta:
Ordene os seguintes hidrocarbonetos do ponto de ebulição mais baixo para o mais alto: C 2 H 6, C 3 H 8 e C 4 H 10.
- Resposta
-
Todos esses compostos são não polares e têm apenas forças de dispersão de London: quanto maior a molécula, maiores as forças de dispersão e maior o ponto de ebulição. Portanto, a ordenação do ponto de ebulição mais baixo para o mais alto é
C 2 H 6 < C 3 H 8 < C 4 H 10.
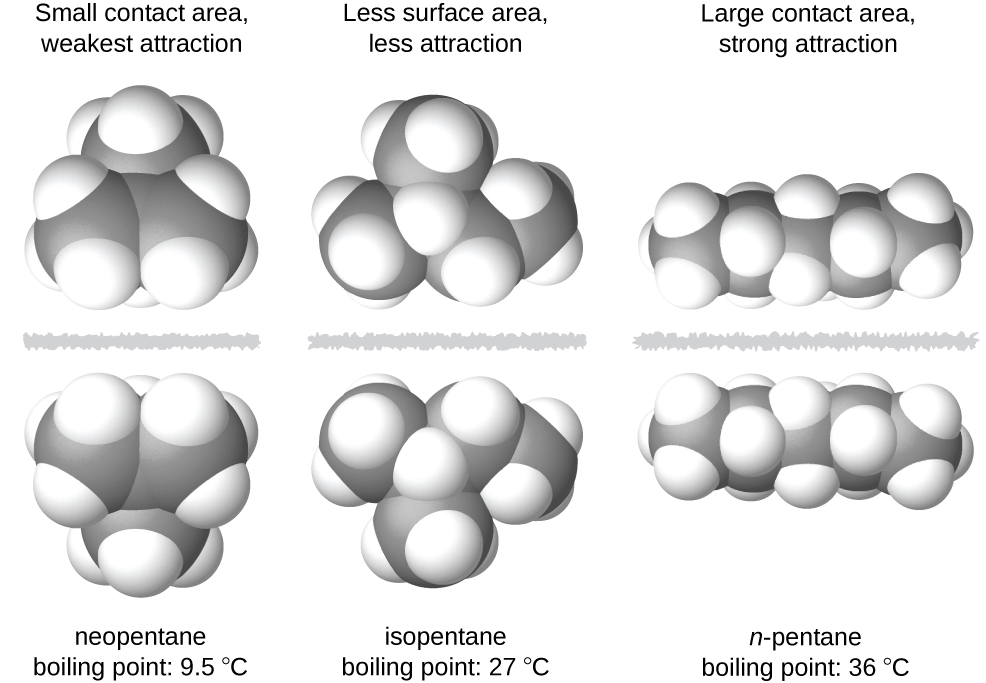
As formas das moléculas também afetam as magnitudes das forças de dispersão entre elas. Por exemplo, os pontos de ebulição dos isômeros n -pentano, isopentano e neopentano (mostrados na Figura\(\PageIndex{6}\)) são 36 °C, 27 °C e 9,5 °C, respectivamente. Embora esses compostos sejam compostos por moléculas com a mesma fórmula química, C 5 H 12, a diferença nos pontos de ebulição sugere que as forças de dispersão na fase líquida são diferentes, sendo maiores para o n-pentano e menos para o neopentano. A forma alongada do n-pentano fornece uma maior área de superfície disponível para contato entre moléculas, resultando em forças de dispersão correspondentemente mais fortes. A forma mais compacta do isopentano oferece uma área de superfície menor disponível para contato intermolecular e, portanto, forças de dispersão mais fracas. As moléculas de neopentano são as mais compactas das três, oferecendo a menor área de superfície disponível para contato intermolecular e, portanto, as forças de dispersão mais fracas. Esse comportamento é análogo às conexões que podem ser formadas entre tiras de fixadores da marca VELCRO: quanto maior a área de contato da tira, mais forte é a conexão.
As lagartixas têm uma incrível capacidade de aderir à maioria das superfícies. Eles podem subir rapidamente por paredes lisas e tetos sem apoios para os pés, e fazem isso sem ter ventosas ou uma substância pegajosa nos dedos dos pés. E embora uma lagartixa possa levantar os pés facilmente enquanto caminha por uma superfície, se você tentar pegá-la, ela grudará na superfície. Como as lagartixas (assim como as aranhas e alguns outros insetos) são capazes de fazer isso? Embora esse fenômeno tenha sido investigado por centenas de anos, cientistas só recentemente descobriram os detalhes do processo que permite que os pés das lagartixas se comportem dessa maneira.

Os dedos das lagartixas são cobertos por centenas de milhares de pequenos pêlos conhecidos como cerdas, com cada seta, por sua vez, se ramificando em centenas de pontas minúsculas, planas e triangulares chamadas espátulas. O grande número de espátulas em suas cerdas fornece uma lagartixa, mostrada na Figura\(\PageIndex{7}\), com uma grande área de superfície total para aderir a uma superfície. Em 2000, Kellar Autumn, que lidera uma equipe multiinstitucional de pesquisa de lagartixas, descobriu que as lagartixas aderem igualmente bem ao dióxido de silício polar e ao arseneto de gálio não polar. Isso provou que as lagartixas aderem às superfícies por causa das forças de dispersão — atrações intermoleculares fracas decorrentes de distribuições temporárias e sincronizadas de carga entre moléculas adjacentes. Embora as forças de dispersão sejam muito fracas, a atração total sobre milhões de espátulas é grande o suficiente para suportar muitas vezes o peso da lagartixa.
Em 2014, dois cientistas desenvolveram um modelo para explicar como as lagartixas podem fazer a transição rápida de “pegajosas” para “não pegajosas”. Alex Greaney e Congcong Hu, da Oregon State University, descreveram como as lagartixas podem conseguir isso alterando o ângulo entre suas espátulas e a superfície. Os pés das lagartixas, que normalmente não são pegajosos, ficam pegajosos quando uma pequena força de cisalhamento é aplicada. Ao enrolar e desenrolar os dedos dos pés, as lagartixas podem alternar entre grudar e soltar de uma superfície e, assim, se mover facilmente por ela. Investigações adicionais podem eventualmente levar ao desenvolvimento de melhores adesivos e outras aplicações.
Assista a este vídeo para saber mais sobre a pesquisa de Kellar Autumn que determinou que as forças de van der Waals são responsáveis pela habilidade de uma lagartixa de se agarrar e escalar.
Atrações de Dipole-Dipole
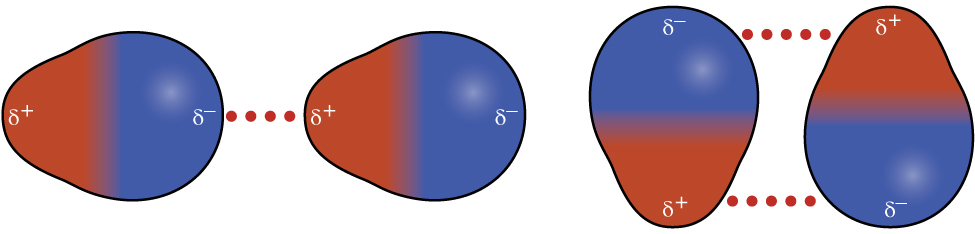
Lembre-se do capítulo sobre ligação química e geometria molecular que as moléculas polares têm uma carga positiva parcial em um lado e uma carga negativa parcial no outro lado da molécula - uma separação de carga chamada dipolo. Considere uma molécula polar, como cloreto de hidrogênio, HCl. Na molécula de HCl, o átomo de Cl mais eletronegativo carrega a carga negativa parcial, enquanto o átomo H menos eletronegativo carrega a carga positiva parcial. Uma força atrativa entre as moléculas de HCl resulta da atração entre a extremidade positiva de uma molécula de HCl e a extremidade negativa de outra. Essa força atrativa é chamada de atração dipolo-dipolo - a força eletrostática entre a extremidade parcialmente positiva de uma molécula polar e a extremidade parcialmente negativa de outra, conforme ilustrado na Figura\(\PageIndex{8}\).
O efeito de uma atração dipolo-dipolo é aparente quando comparamos as propriedades das moléculas de HCl com as moléculas F 2 não polares. Tanto o HCl quanto o F 2 consistem no mesmo número de átomos e têm aproximadamente a mesma massa molecular. A uma temperatura de 150 K, as moléculas de ambas as substâncias teriam a mesma média de KE. No entanto, as atrações dipolo-dipolo entre as moléculas de HCl são suficientes para fazer com que elas “grudem” para formar um líquido, enquanto as forças de dispersão relativamente mais fracas entre as moléculas de F 2 não polares não são, portanto, essa substância é gasosa a essa temperatura. O ponto de ebulição normal mais alto do HCl (188 K) comparado ao F 2 (85 K) é um reflexo da maior força das atrações dipolo-dipolo entre as moléculas de HCl, em comparação com as atrações entre moléculas F 2 não polares. Freqüentemente, usamos valores como pontos de ebulição ou congelamento, ou entalpias de vaporização ou fusão, como indicadores das forças relativas dos FMI de atração presentes em diferentes substâncias.
Preveja qual terá o maior ponto de ebulição: N 2 ou CO. Explique seu raciocínio.
Solução
CO e N 2 são moléculas diatômicas com massas de cerca de 28 amu, então eles experimentam forças de dispersão semelhantes em Londres. Como o CO é uma molécula polar, ele experimenta atrações dipolo-dipolo. Como o N 2 é apolar, suas moléculas não podem exibir atrações dipolo-dipolo. As atrações dipolo-dipolo entre as moléculas de CO são comparativamente mais fortes do que as forças de dispersão entre moléculas de N 2 não polares, portanto, espera-se que o CO tenha o ponto de ebulição mais alto.
Um método comum para preparar oxigênio é a decomposição
Preveja qual terá o maior ponto de ebulição:\(\ce{ICl}\) ou\(\ce{Br2}\). Explique seu raciocínio.
- Resposta
-
iCl. iCl e Br 2 têm massas semelhantes (~ 160 amu) e, portanto, experimentam forças de dispersão de Londres semelhantes. iCl é polar e, portanto, também exibe atrações dipolo-dipolo; Br 2 é apolar e não. As atrações dipolo-dipolo relativamente mais fortes requerem mais energia para serem superadas, então o iCl terá o ponto de ebulição mais alto.
Ligação de hidrogênio
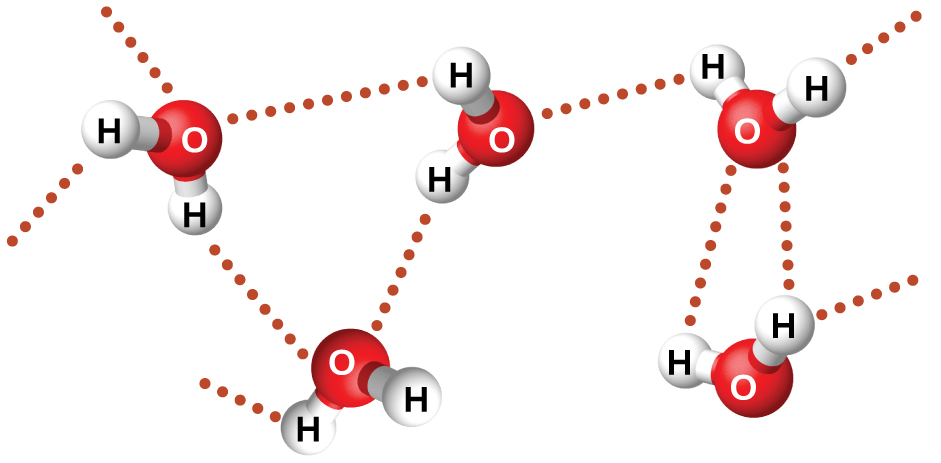
O fluoreto de nitrosilo (ONF, massa molecular 49 amu) é um gás à temperatura ambiente. A água (H 2 O, massa molecular 18 amu) é um líquido, embora tenha uma massa molecular menor. Claramente, não podemos atribuir essa diferença entre os dois compostos às forças de dispersão. Ambas as moléculas têm aproximadamente a mesma forma e o ONF é a molécula mais pesada e maior. Espera-se, portanto, que experimente forças de dispersão mais significativas. Além disso, não podemos atribuir essa diferença nos pontos de ebulição às diferenças nos momentos de dipolo das moléculas. Ambas as moléculas são polares e exibem momentos de dipolo comparáveis. A grande diferença entre os pontos de ebulição se deve a uma atração dipolo-dipolo particularmente forte que pode ocorrer quando uma molécula contém um átomo de hidrogênio ligado a um átomo de flúor, oxigênio ou nitrogênio (os três elementos mais eletronegativos). A diferença muito grande na eletronegatividade entre o átomo H (2.1) e o átomo ao qual está ligado (4,0 para um átomo F, 3,5 para um átomo O ou 3,0 para um átomo N), combinada com o tamanho muito pequeno de um átomo H e os tamanhos relativamente pequenos dos átomos F, O ou N, leva a uma concentração parcial altamente concentrada cargas com esses átomos. Moléculas com porções F-H, O-H ou N-H são fortemente atraídas por porções similares em moléculas próximas, um tipo particularmente forte de atração dipolo-dipolo chamada ligação de hidrogênio. Exemplos de ligações de hidrogênio incluem HF HF, H 2 OHOH e H 3 NHNH 2, em que as ligações de hidrogênio são indicadas por pontos. A figura\(\PageIndex{9}\) ilustra a ligação de hidrogênio entre as moléculas de água.
Apesar do uso da palavra “ligação”, lembre-se de que as ligações de hidrogênio são forças atrativas intermoleculares, não forças atrativas intramoleculares (ligações covalentes). As ligações de hidrogênio são muito mais fracas do que as ligações covalentes, apenas cerca de 5 a 10% mais fortes, mas geralmente são muito mais fortes do que outras atrações de dipolo-dipolo e forças de dispersão.
As ligações de hidrogênio têm um efeito pronunciado nas propriedades das fases condensadas (líquidos e sólidos). Por exemplo, considere as tendências nos pontos de ebulição para os hidretos binários do grupo 15 (NH 3, PH 3, AsH 3 e SBH 3), hidretos do grupo 16 (H 2 O, H 2 S, H 2 Se e H 2 Te) e hidretos do grupo 17 (HF, HCl, HBr e OI). Os pontos de ebulição dos três hidretos mais pesados para cada grupo são plotados na Figura\(\PageIndex{10}\). À medida que avançamos para baixo em qualquer um desses grupos, as polaridades das moléculas diminuem ligeiramente, enquanto os tamanhos das moléculas aumentam substancialmente. O efeito de forças de dispersão cada vez mais fortes domina o efeito de atrações dipolo-dipolo cada vez mais fracas, e observa-se que os pontos de ebulição aumentam constantemente. Para os hidretos do grupo 15, 16 e 17, os pontos de ebulição para cada classe de compostos aumentam com o aumento da massa molecular dos elementos nos períodos 3, 4 e 5.
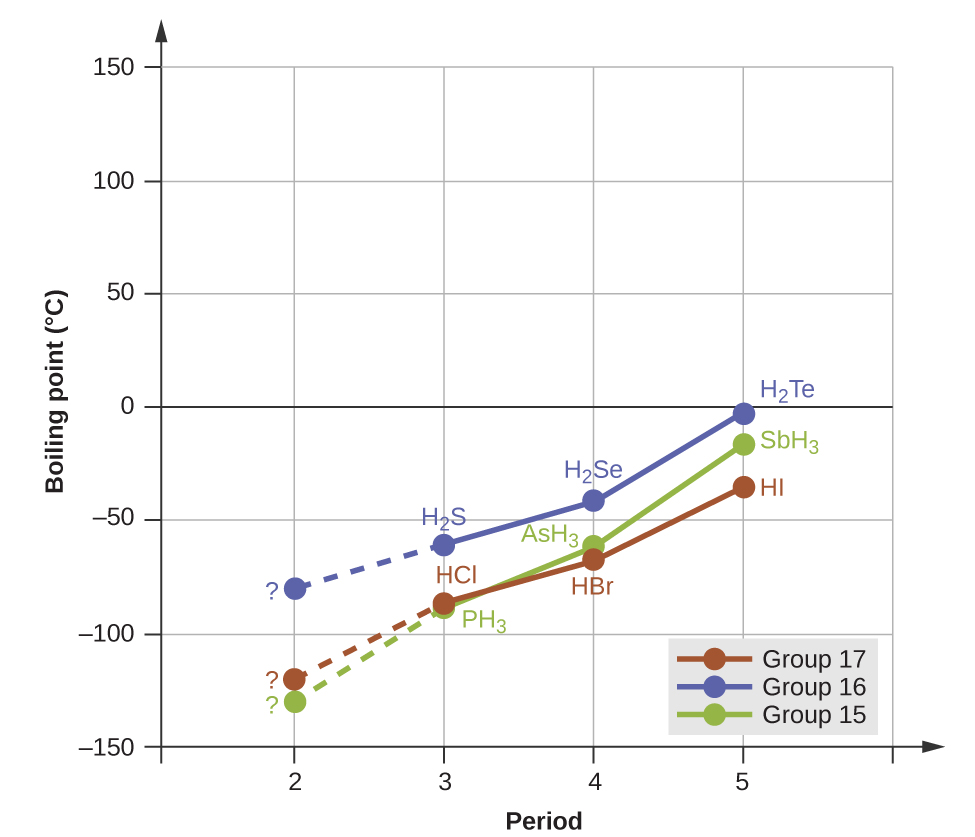
Se usarmos essa tendência para prever os pontos de ebulição do hidreto mais leve para cada grupo, esperaríamos que o NH 3 ferva a cerca de −120° C, H 2 O ferva a cerca de −80° C e o HF ferva a cerca de −110° C. No entanto, quando medimos os pontos de ebulição desses compostos, descobrimos que eles são dramaticamente mais alto do que as tendências previriam, conforme mostrado na Figura\(\PageIndex{10}\). O forte contraste entre nossas previsões ingênuas e a realidade fornece evidências convincentes da força da ligação de hidrogênio.
Considere os compostos éter dimetílico (CH 3 OCH 3), etanol (CH 3 CH 2 OH) e propano (CH 3 CH 2 CH 3). Seus pontos de ebulição, não necessariamente em ordem, são −42,1 °C, −24,8 °C e 78,4 °C. Combine cada composto com seu ponto de ebulição. Explique seu raciocínio.
Solução
As formas previstas pelo VSEPR de CH 3 OCH 3, CH 3 CH 2 OH e CH 3 CH 2 CH 3 são semelhantes, assim como suas massas molares (46 g/mol, 46 g/mol e 44 g/mol, respectivamente), então elas exibirão forças de dispersão semelhantes. Como o CH 3 CH 2 CH 3 é não polar, ele pode exibir apenas forças de dispersão. Como o CH 3 OCH 3 é polar, ele também experimentará atrações dipolo-dipolo. Finalmente, CH 3 CH 2 OH tem um grupo −OH e, portanto, experimentará a atração dipolo-dipolo excepcionalmente forte conhecida como ligação de hidrogênio. Portanto, a ordem em termos de força dos FMI e, portanto, dos pontos de ebulição, é CH 3 CH 2 CH 3 < CH 3 OCH 3 < CH 3 CH 2 OH. O ponto de ebulição do propano é −42,1° C, o ponto de ebulição do éter dimetílico é −24,8° C e o ponto de ebulição do etanol é 78,5° C.
O etano (CH 3 CH 3) tem um ponto de fusão de −183° C e um ponto de ebulição de −89° C. Preveja os pontos de fusão e ebulição da metilamina (CH 3 NH 2). Explique seu raciocínio.
- Resposta
-
Prevê-se que o ponto de fusão e o ponto de ebulição da metilamina sejam significativamente maiores do que os do etano. CH 3 CH 3 e CH 3 NH 2 são semelhantes em tamanho e massa, mas a metilamina possui um grupo −NH e, portanto, pode exibir ligação de hidrogênio. Isso aumenta muito seus FMI e, portanto, seus pontos de fusão e ebulição. É difícil prever valores, mas os valores conhecidos são um ponto de fusão de −93 °C e um ponto de ebulição de −6 °C.
Ligação de hidrogênio e DNA
O ácido desoxirribonucléico (DNA) é encontrado em todos os organismos vivos e contém as informações genéticas que determinam as características do organismo, fornece o modelo para a produção das proteínas necessárias para a vida e serve como um modelo para transmitir essas informações aos descendentes do organismo. Uma molécula de DNA consiste em duas cadeias (anti-) paralelas de nucleotídeos repetidos, que formam sua conhecida estrutura de dupla hélice, conforme mostrado na Figura\(\PageIndex{10}\).
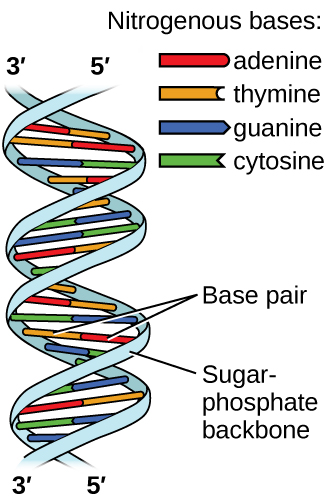
Cada nucleotídeo contém um açúcar (desoxirribose) ligado a um grupo fosfato de um lado e uma das quatro bases nitrogenadas do outro. Duas das bases, citosina (C) e timina (T), são estruturas de anel único conhecidas como pirimidinas. As outras duas, adenina (A) e guanina (G), são estruturas de anel duplo chamadas purinas. Essas bases formam pares de bases complementares que consistem em uma purina e uma pirimidina, com adenina emparelhada com timina e citosina com guanina. Cada par de bases é mantido unido por ligação de hidrogênio. A e T compartilham duas ligações de hidrogênio, C e G compartilham três, e ambos os pares têm forma e estrutura semelhantes Figura\(\PageIndex{12}\)
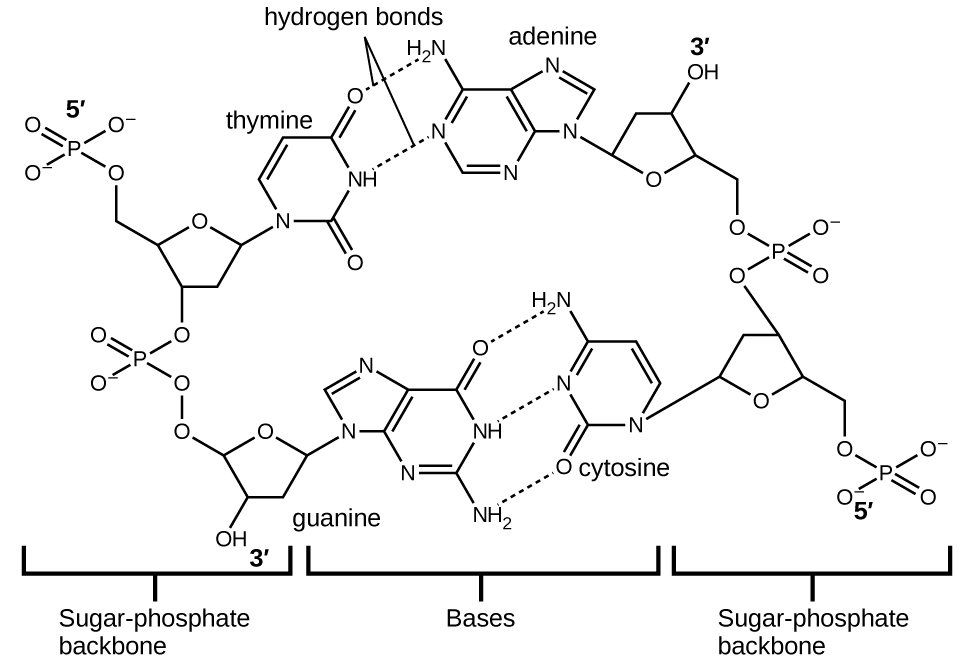
O efeito cumulativo de milhões de ligações de hidrogênio mantém efetivamente as duas cadeias de DNA unidas. É importante ressaltar que as duas fitas de DNA podem “se descompactar” com relativa facilidade no meio, já que as ligações de hidrogênio são relativamente fracas em comparação com as ligações covalentes que mantêm os átomos das moléculas de DNA individuais juntos. Isso permite que ambas as vertentes funcionem como um modelo para replicação.
Resumo
As propriedades físicas da matéria condensada (líquidos e sólidos) podem ser explicadas em termos da teoria molecular cinética. Em um líquido, as forças atrativas intermoleculares mantêm as moléculas em contato, embora elas ainda tenham energia cinética suficiente para se moverem umas sobre as outras. As forças de atração intermoleculares, coletivamente chamadas de forças de van der Waals, são responsáveis pelo comportamento de líquidos e sólidos e são de natureza eletrostática. As atrações dipolo-dipolo resultam da atração eletrostática da extremidade negativa parcial de uma molécula dipolar pela extremidade positiva parcial de outra. O dipolo temporário que resulta do movimento dos elétrons em um átomo pode induzir um dipolo em um átomo adjacente e dar origem à força de dispersão de London. As forças de Londres aumentam com o aumento do tamanho molecular. As ligações de hidrogênio são um tipo especial de atração dipolo-dipolo que resulta quando o hidrogênio é ligado a um dos três elementos mais eletronegativos: F, O ou N.
Glossário
- atração dipolo-dipolo
- atração intermolecular entre dois dipolos permanentes
- força de dispersão
- (também, força de dispersão de Londres) atração entre dois dipolos temporários que flutuam rapidamente; significativa somente quando as partículas estão muito próximas umas das outras
- ligação de hidrogênio
- ocorre quando dipolos excepcionalmente fortes se atraem; ligação que existe quando o hidrogênio é ligado a um dos três elementos mais eletronegativos: F, O ou N
- dipolo induzido
- dipolo temporário formado quando os elétrons de um átomo ou molécula são distorcidos pelo dipolo instantâneo de um átomo ou molécula vizinho
- dipolo instantâneo
- dipolo temporário que ocorre por um breve momento quando os elétrons de um átomo ou molécula são distribuídos de forma assimétrica
- força intermolecular
- força atrativa não covalente entre átomos, moléculas e/ou íons
- polarizabilidade
- medida da capacidade de uma carga de distorcer a distribuição de carga de uma molécula (nuvem de elétrons)
- força de van der Waals
- força atrativa ou repulsiva entre moléculas, incluindo dipolo-dipolo, dipolo induzido por dipolo e forças de dispersão de London; não inclui forças devidas à ligação covalente ou iônica, ou a atração entre íons e moléculas


