15.1: Precipitação e dissolução
- Page ID
- 195438
- Escreva equações químicas e expressões de equilíbrio representando equilíbrios de solubilidade
- Execute cálculos de equilíbrio envolvendo solubilidade, expressões de equilíbrio e concentrações de soluto
A preservação de amostras de sangue de laboratório médico, a mineração de magnésio da água do mar, a formulação de medicamentos vendidos sem receita médica, como leite de magnésia e antiácidos, e o tratamento da presença de água dura no abastecimento de água de sua casa são apenas algumas das muitas tarefas que envolvem o controle do equilíbrio entre um sólido iônico levemente solúvel e uma solução aquosa de seus íons.
Em alguns casos, queremos evitar que a dissolução ocorra. A cárie dentária, por exemplo, ocorre quando a hidroxilapatita de cálcio, que tem a fórmula Ca 5 (PO 4) 3 (OH), em nossos dentes se dissolve. O processo de dissolução é auxiliado quando as bactérias em nossas bocas se alimentam dos açúcares de nossas dietas para produzir ácido lático, que reage com os íons hidróxido na hidroxilapatita de cálcio. Evitar a dissolução evita a deterioração. Por outro lado, às vezes queremos que uma substância se dissolva. Queremos que o carbonato de cálcio em um antiácido mastigável se dissolva porque os\(\ce{CO3^2-}\) íons produzidos nesse processo ajudam a aliviar dores de estômago.
Nesta seção, descobriremos como podemos controlar a dissolução de um sólido iônico levemente solúvel pela aplicação do princípio de Le Chatelier. Também aprenderemos como usar a constante de equilíbrio da reação para determinar a concentração de íons presentes em uma solução.
A constante do produto de solubilidade
O cloreto de prata é conhecido como um sólido iônico moderadamente solúvel (Figura\(\PageIndex{1}\)). Lembre-se das regras de solubilidade em um capítulo anterior que os haletos de Ag + não são normalmente solúveis. No entanto, quando adicionamos um excesso de AgCl sólido à água, ele se dissolve em pequena medida e produz uma mistura que consiste em uma solução muito diluída de íons Ag + e Cl — em equilíbrio com cloreto de prata não dissolvido:
\[\ce{AgCl}(s)\mathrm{\xrightleftharpoons[\:precipitation\:]{\:dissolution\:}}\ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
Esse equilíbrio, como outros equilíbrios, é dinâmico; alguns dos sólidos AgCl continuam a se dissolver, mas, ao mesmo tempo, os íons Ag + e Cl — na solução se combinam para produzir uma quantidade igual do sólido. Em equilíbrio, os processos opostos têm taxas iguais.
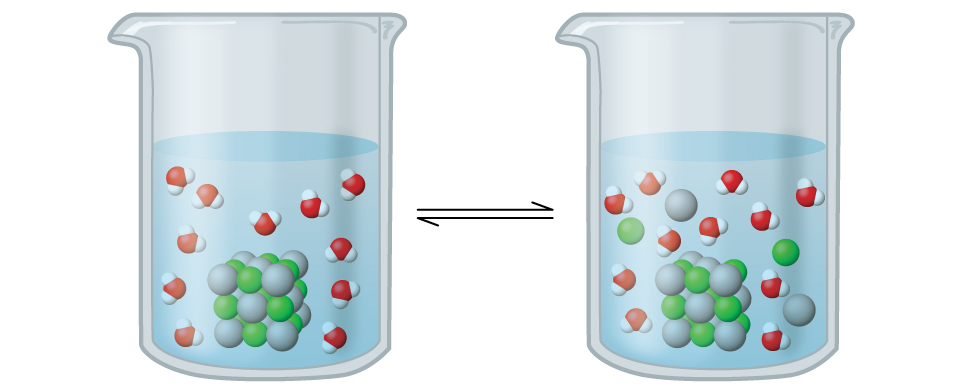
A constante de equilíbrio para o equilíbrio entre um sólido iônico levemente solúvel e uma solução de seus íons é chamada de produto de solubilidade (K sp) do sólido. Lembre-se do capítulo sobre soluções e coloides que usamos a concentração de um íon como uma aproximação de sua atividade em uma solução diluída. Para cloreto de prata, em equilíbrio:
\[\ce{AgCl}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
com
\[K_\ce{sp}=[\ce{Ag+}(aq)][\ce{Cl-}(aq)] \nonumber \]
Ao observar reações de dissolução como essa, o sólido é listado como um reagente, enquanto os íons são listados como produtos. A constante do produto de solubilidade, como acontece com toda expressão constante de equilíbrio, é escrita como o produto das concentrações de cada um dos íons, elevadas à potência de seus coeficientes estequiométricos. Aqui, a constante do produto de solubilidade é igual a Ag + e Cl — quando uma solução de cloreto de prata está em equilíbrio com AgCl não dissolvido. Não há denominador representando os reagentes nessa expressão de equilíbrio, pois o reagente é um sólido puro; portanto, [AgCl] não aparece na expressão de K sp.
| Substância | K sp a 25 °C |
|---|---|
| CuCl | 1,2 × 10 —6 |
| CuBr | 6,27 × 10 —9 |
| Um Gi | 1,5 × 10 —16 |
| PBs | 7 × 10 —29 |
| Al (OH) 3 | 2 × 10 —32 |
| Fez (OH) 3 | 4 × 10 —38 |
Alguns produtos de solubilidade comuns estão listados na Tabela de\(\PageIndex{1}\) acordo com seus valores de K sp, enquanto uma compilação mais extensa de produtos aparece na Tabela E3. Cada uma dessas constantes de equilíbrio é muito menor do que 1 porque os compostos listados são apenas ligeiramente solúveis. Um pequeno K sp representa um sistema no qual o equilíbrio está à esquerda, de modo que relativamente poucos íons hidratados estariam presentes em uma solução saturada.
Escreva a equação iônica para a dissolução e a expressão do produto de solubilidade para cada um dos seguintes compostos iônicos levemente solúveis:
- AgI, iodeto de prata, um sólido com propriedades antissépticas
- CaCO 3, carbonato de cálcio, o ingrediente ativo de muitos antiácidos mastigáveis vendidos sem receita
- Mg (OH) 2, hidróxido de magnésio, o ingrediente ativo do Leite de Magnésia
- Mg (NH 4) PO 4, fosfato de magnésio e amônio, uma substância essencialmente insolúvel usada em testes de magnésio
- Ca 5 (PO 4) 3 OH, o mineral apatita, uma fonte de fosfato para fertilizantes
(Dica: Ao determinar como dividir (d) e (e) em íons, consulte a lista de íons poliatômicos na seção sobre nomenclatura química.)
Solução
- \(\ce{AgI}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{I-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ag+][I- ]}\)
- \(\ce{CaCO3}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{CO3^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ca^2+][CO3^2- ]}\)
- \(\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mg^2+][OH- ]^2}\)
- \(\ce{Mg(NH4)PO4}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{NH4+}(aq)+\ce{PO4^3-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mg^2+][NH4+][PO4^3- ]}\)
- \(\ce{Ca5(PO4)3OH}(s) \rightleftharpoons \ce{5Ca^2+}(aq)+\ce{3PO4^3-}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ca^2+]^5[PO4^3- ]^3[OH- ]}\)
Escreva a equação iônica para a dissolução e o produto de solubilidade para cada um dos seguintes compostos ligeiramente solúveis:
- BaSO 4
- Idade 2: ISO 4
- Al (OH) 3
- Pb (OH) Cl
- Responda a um
-
\(\ce{BaSO4}(s) \rightleftharpoons \ce{Ba^2+}(aq)+\ce{SO4^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ba^2+][SO4^2- ]}\)
- Resposta b
-
\(\ce{Ag2SO4}(s) \rightleftharpoons \ce{2Ag+}(aq)+\ce{SO4^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ag+]^2[SO4^2- ]}\)
- Resposta c
-
\(\ce{Al(OH)3}(s) \rightleftharpoons \ce{Al^2+}(aq)+\ce{3OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Al^3+][OH- ]^3}\)
- Resposta d
-
\(\ce{Pb(OH)Cl}(s) \rightleftharpoons \ce{Pb^2+}(aq)+\ce{OH-}(aq)+\ce{Cl-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Pb^2+][OH- ][Cl- ]}\)
Agora, estenderemos a discussão sobre K sp e mostraremos como a constante do produto de solubilidade é determinada a partir da solubilidade de seus íons, bem como como K sp pode ser usado para determinar a solubilidade molar de uma substância.
K sp e solubilidade
Lembre-se de que a definição de solubilidade é a concentração máxima possível de um soluto em uma solução a uma determinada temperatura e pressão. Podemos determinar o produto de solubilidade de um sólido levemente solúvel a partir dessa medida de sua solubilidade em uma determinada temperatura e pressão, desde que a única reação significativa que ocorra quando o sólido se dissolve seja sua dissociação em íons solvatados, ou seja, o único equilíbrio envolvido é:
\[\ce{M}_p\ce{X}_q(s) \rightleftharpoons p\mathrm{M^{m+}}(aq)+q\mathrm{X^{n−}}(aq) \nonumber \]
Nesse caso, calculamos o produto de solubilidade tomando a solubilidade do sólido expressa em unidades de moles por litro (mol/L), conhecida como solubilidade molar.
Começamos o capítulo com uma discussão informal sobre como o mineral fluorita é formado. A fluorita, CaF 2, é um sólido ligeiramente solúvel que se dissolve de acordo com a equação:
\[\ce{CaF2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2F-}(aq) \nonumber \]
A concentração de Ca 2 + em uma solução saturada de CaF 2 é 2,1 × 10 —4 M; portanto, a de F - é 4,2 × 10 —4 M, ou seja, o dobro da concentração de Ca 2 +. Qual é o produto de solubilidade da fluorita?
Solução
Primeiro, escreva a expressão K sp, depois substitua em concentrações e resolva por K sp:
\[\ce{CaF2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2F-}(aq) \nonumber \]
Uma solução saturada é uma solução em equilíbrio com o sólido. Assim:
\[\begin{align*} K_\ce{sp} &=\ce{[Ca^2+][F^{-}]^2} \\[4pt] &=(2.1×10^{−4})(4.2×10^{−4})^2 \\[4pt] &=3.7×10^{−11} \end{align*} \nonumber \]
Como acontece com outras constantes de equilíbrio, não incluímos unidades com K sp.
Em uma solução saturada que está em contato com o sólido Mg (OH) 2, a concentração de Mg 2 + é 3,7 × 10 —5 M. Qual é o produto de solubilidade para Mg (OH) 2?
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
- Resposta
-
2,0 × 10 —13
O K sp do brometo de cobre (I), CuBr, é 6,3 × 10 —9. Calcule a solubilidade molar do brometo de cobre.
Solução
A constante do produto de solubilidade do brometo de cobre (I) é\(6.3 \times 10^{–9}\).
A reação é:
\[\ce{CuBr}(s) \rightleftharpoons \ce{Cu+}(aq)+\ce{Br-}(aq) \nonumber \]
Primeiro, escreva a expressão constante de equilíbrio do produto de solubilidade:
\[K_\ce{sp}=\ce{[Cu+][Br- ]} \nonumber \]
Crie uma tabela ICE (conforme apresentada no capítulo sobre conceitos fundamentais de equilíbrio), deixando a coluna CuBr vazia, pois é sólida e não contribui para o K sp:
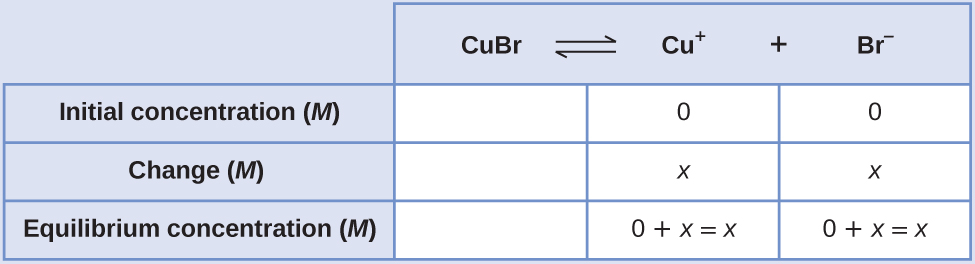
Em equilíbrio:
\[\begin{align*} K_{sp} &=\ce{[Cu+][Br- ]} \\[4pt] 6.3×10^{−9} &=(x)(x)=x^2 \\[4pt] x &=\sqrt{(6.3×10^{−9})}=7.9×10^{−5} \end{align*} \nonumber \]Portanto, a solubilidade molar do CuBr é 7,9 × 10 —5 M.
O K sp do AgI é 1,5 × 10 —16. Calcule a solubilidade molar do iodeto de prata.
- Resposta
-
1,2 × 10 —8 M
Determinação da solubilidade molar de K sp, Parte II O K sp do hidróxido de cálcio, Ca (OH) 2, é 8,0 × 10 —6. Calcule a solubilidade molar do hidróxido de cálcio.
Solução
A constante do produto de solubilidade do hidróxido de cálcio é 1,3 × 10 —6.
A reação é:
\[\ce{Ca(OH)2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
Primeiro, escreva a expressão constante de equilíbrio do produto de solubilidade:
\[K_\ce{sp}=\ce{[Ca^2+][OH- ]^2} \nonumber \]
Crie uma tabela ICE, deixando a coluna Ca (OH) 2 vazia, pois ela é sólida e não contribui para o K sp:
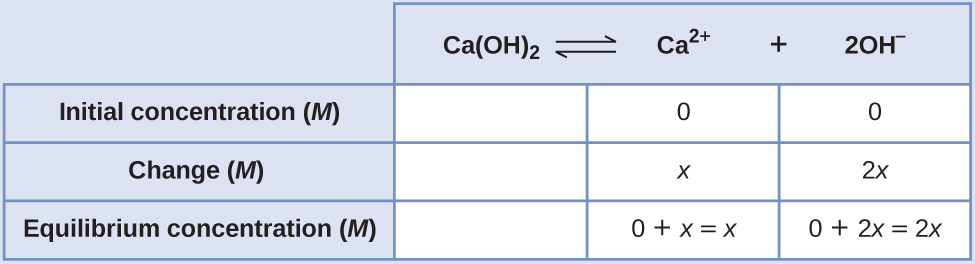
Em equilíbrio:
\[ \begin{align*} K_\ce{sp} &=\ce{[Ca^2+][OH- ]^2} \\[4pt] 1.3×10^{−6} &=(x)(2x)^2=(x)(4x^2)=4x^3 \\[4pt] x &=\sqrt[3]{\dfrac{1.3×10^{-6}}{4}}=6.9×10^{-3} \end{align*} \nonumber \]
Portanto, a solubilidade molar de Ca (OH) 2 é 6,9 × 10 —3 M.
O K sp de PBi 2 é 1,4 × 10 —8. Calcule a solubilidade molar do iodeto de chumbo (II).
- Resposta
-
1,5 × 10 —3 M
Observe que a solubilidade nem sempre é dada como um valor molar. Quando a solubilidade de um composto é dada em alguma unidade diferente de moles por litro, devemos converter a solubilidade em moles por litro (ou seja, molaridade) para usá-la na expressão constante do produto de solubilidade. \(\PageIndex{5}\)O exemplo mostra como realizar essas conversões de unidades antes de determinar o equilíbrio do produto de solubilidade.
Muitos dos pigmentos usados pelos artistas em tintas à base de óleo (Figura\(\PageIndex{2}\)) são moderadamente solúveis em água. Por exemplo, a solubilidade do pigmento amarelo cromado do artista, PbCrO 4, é 4,6 × 10 —6 g/L. Determine a constante de equilíbrio do produto de solubilidade para PbCrO 4.

Solução
Recebemos a solubilidade do PbCro 4 em gramas por litro. Se convertermos essa solubilidade em moles por litro, podemos encontrar as concentrações de equilíbrio de Pb 2 + e\(\ce{CrO4^2-}\), em seguida, K sp:
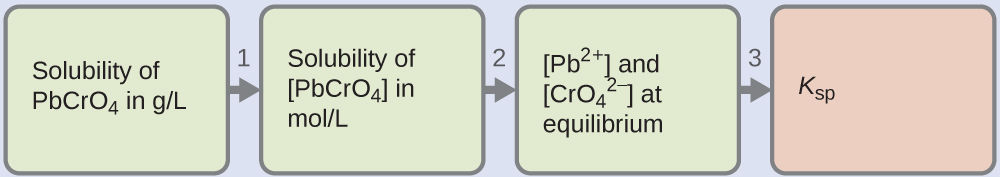
- Use a massa molar de PbCrO 4\(\mathrm{\left(\dfrac{323.2\:g}{1\:mol}\right)}\) para converter a solubilidade do PbCro 4 em gramas por litro em moles por litro:
\(\mathrm{[PbCrO_4]=\dfrac{4.6×10^{−6}\:g\: PbCrO_4}{1\:L}×\dfrac{1\:mol\: PbCrO_4}{323.2\:g\: PbCrO_4}}\)
\(\mathrm{=\dfrac{1.4×10^{−8}\:mol\: PbCrO_4}{1\:L}}\)
\(=1.4×10^{−8}\:M\)
- A equação química para a dissolução indica que 1 mol de PbCro 4 fornece 1 mol de Pb 2 + (aq) e 1 mol de\(\ce{CrO_4^{2-}}(aq)\):
\(\ce{PbCrO4}(s) \rightleftharpoons \ce{Pb^2+}(aq)+\ce{CrO4^2-}(aq)\)
Assim, tanto [Pb 2 +] quanto\(\ce{[CrO4^2- ]}\) são iguais à solubilidade molar de PbCro 4:
\(\ce{[Pb^2+]}=\ce{[CrO4^2- ]}=1.4×10^{−8}\:M\) - Resolver. K sp = [Pb 2 +]\(\ce{[CrO4^2- ]}\) = (1,4 × 10 —8) (1,4 × 10 —8) = 2,0 × 10 —16
A solubilidade do TLCl [cloreto de tálio (I)], um intermediário formado quando o tálio está sendo isolado dos minérios, é de 3,46 gramas por litro a 20 °C. Qual é seu produto de solubilidade?
- Resposta
-
2,08 × 10 —4
Calomel, Hg 2 Cl 2, é um composto composto pelo íon diatômico de mercúrio (I),\(\ce{Hg2^2+}\), e íons cloreto, Cl -. Embora agora se saiba que a maioria dos compostos de mercúrio são venenosos, os médicos do século XVIII usaram o calomel como medicamento. Seus pacientes raramente sofreram intoxicação por mercúrio devido aos tratamentos porque o calomel é bastante insolúvel:
\[\ce{Hg2Cl2}(s) \rightleftharpoons \ce{Hg2^2+}(aq)+\ce{2Cl-}(aq) \hspace{20px} K_\ce{sp}=1.1×10^{−18} \nonumber \]
Calcule a solubilidade molar de Hg 2 Cl 2.
Solução
A solubilidade molar de Hg 2 Cl 2 é igual à concentração de\(\ce{Hg2^2+}\) íons porque para cada 1 mol de Hg 2 Cl 2 que se dissolve, 1 mol de\(\ce{Hg2^2+}\) forma:
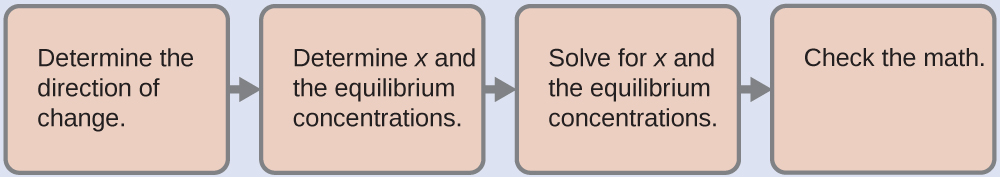
- Determine a direção da mudança. Antes que qualquer Hg 2 Cl 2 se dissolva, Q é zero e a reação mudará para a direita para alcançar o equilíbrio.
- Determine as concentrações de x e equilíbrio. As concentrações e mudanças são dadas na seguinte tabela ICE:
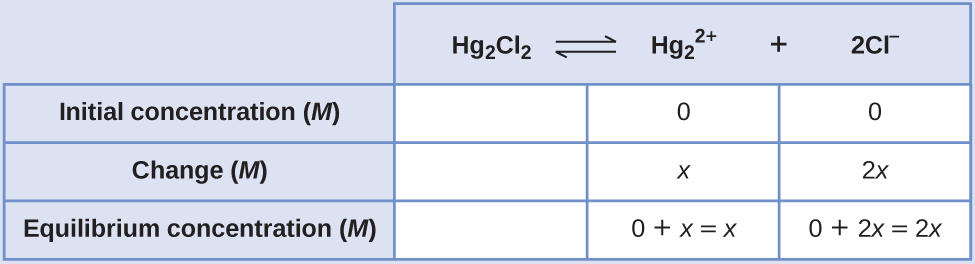
Observe que a mudança na concentração de Cl — (2 x) é duas vezes maior que a mudança na concentração de\(\ce{Hg2^2+}\) (x) porque 2 mol de Cl — se formam para cada 1 mol\(\ce{Hg2^2+}\) dessa forma. Hg 2 Cl 2 é um sólido puro, portanto, não aparece no cálculo.
- Resolva para x e as concentrações de equilíbrio. Substituímos as concentrações de equilíbrio na expressão de K sp e calculamos o valor de x:
\[\begin{align*} K_\ce{sp} &=\ce{[Hg2^2+][Cl- ]^2} \\[4pt] 1.1×10^{−18} &=(x)(2x)^2 \\[4pt] 4x^3 &=1.1×10^{−18} \\[4pt] x &=\sqrt[3]{\left(\dfrac{1.1×10^{-18}}{4}\right)}=6.5×10^{-7}\:M \end{align*} \nonumber \]
Portanto, as concentrações são
\[\begin{align*} \ce{[Hg2^2+]} &=6.5×10^{−7}\:M=6.5×10^{−7}\:M \\[4pt] \ce{[Cl- ]} &=2x=2(6.5×10^{−7})=1.3×10^{−6}\:M \end{align*} \nonumber \]
A solubilidade molar de Hg 2 Cl 2 é igual a\(\ce{[Hg2^2+]}\), ou 6,5 × 10 —7 M.
Verifique o trabalho.
Em equilíbrio, Q = K sp:
\[Q=\ce{[Hg2^2+][Cl- ]^2}=(6.5×10^{−7})(1.3×10^{−6})^2=1.1×10^{−18} \nonumber \]
A verificação dos cálculos.
Determine a solubilidade molar de MgF 2 a partir de seu produto de solubilidade: K sp = 6,4 × 10 —9.
- Resposta
-
1,2 × 10 —3 M
Os valores tabulados de K sp também podem ser comparados aos quocientes de reação calculados a partir de dados experimentais para dizer se um sólido precipitará em uma reação sob condições específicas: Q é igual a K sp em equilíbrio; se Q for menor que K sp, o sólido se dissolverá até que Q seja igual a K sp; se Q for maior que K sp, a precipitação ocorrerá em uma determinada temperatura até que Q seja igual a K sp.
Vários tipos de técnicas de imagem médica são usados para auxiliar no diagnóstico de doenças de forma não invasiva. Uma dessas técnicas utiliza a ingestão de um composto de bário antes de tirar uma imagem de raio-X. Uma suspensão de sulfato de bário, um pó calcário, é ingerida pelo paciente. Como o K sp do sulfato de bário é 1,1 × 10 —10, muito pouco dele se dissolve ao revestir o revestimento do trato intestinal do paciente. As áreas do trato digestivo revestidas com bário aparecem então em um raio-X como brancas, permitindo maiores detalhes visuais do que uma radiografia tradicional (Figura\(\PageIndex{3}\)).
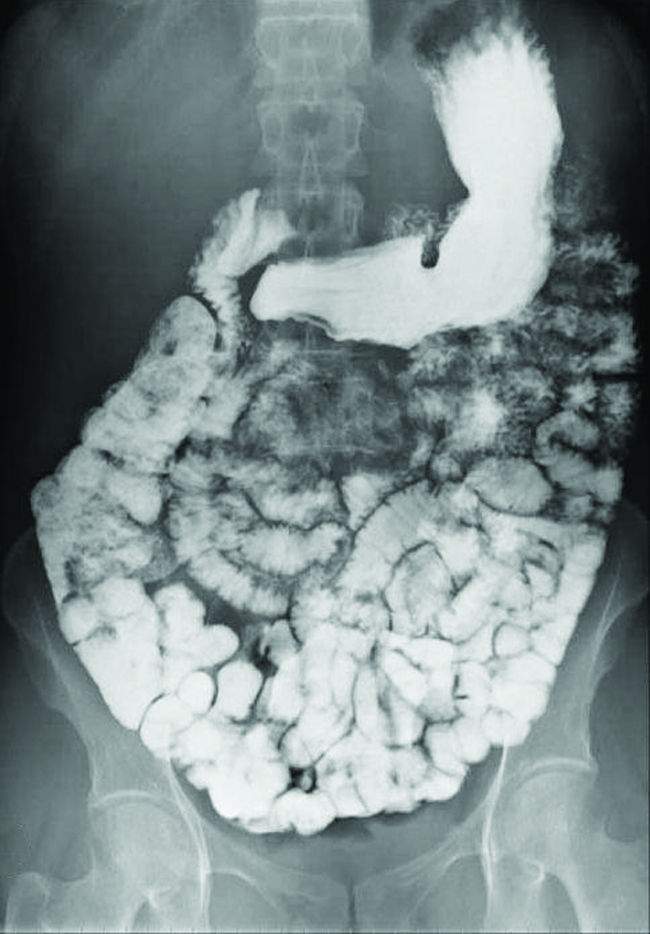
Testes diagnósticos adicionais podem ser feitos usando sulfato de bário e fluoroscopia. Na fluoroscopia, uma radiografia contínua é passada pelo corpo para que o médico possa monitorar, na TV ou na tela do computador, o movimento do sulfato de bário ao passar pelo trato digestivo. Imagens médicas usando sulfato de bário podem ser usadas para diagnosticar a doença do refluxo ácido, doença de Crohn e úlceras, além de outras condições.
Prevendo a precipitação
A equação que descreve o equilíbrio entre o carbonato de cálcio sólido e seus íons solvatados é:
\[\ce{CaCO3}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{CO3^2-}(aq) \nonumber \]
Podemos estabelecer esse equilíbrio adicionando carbonato de cálcio sólido à água ou misturando uma solução que contém íons de cálcio com uma solução que contém íons carbonato. Se adicionarmos carbonato de cálcio à água, o sólido se dissolverá até que as concentrações sejam tais que o valor do quociente da reação\(\ce{(Q=[Ca^2+][CO3^2- ])}\) seja igual ao produto de solubilidade (K sp = 4,8 × 10 —9). Se misturarmos uma solução de nitrato de cálcio, que contém íons Ca 2 +, com uma solução de carbonato de sódio, que contém\(\ce{CO3^2-}\) íons, o sólido iônico CaCO 3 levemente solúvel precipitará, desde que as concentrações de Ca 2 + e \(\ce{CO3^2-}\)os íons são tais que Q é maior que K sp para a mistura. A reação muda para a esquerda e as concentrações dos íons são reduzidas pela formação do sólido até que o valor de Q seja igual a K sp. Uma solução saturada em equilíbrio com o sólido não dissolvido resultará. Se as concentrações forem tais que Q seja menor que K sp, a solução não está saturada e nenhum precipitado se formará.
Podemos comparar valores numéricos de Q com K sp para prever se a precipitação ocorrerá, como\(\PageIndex{7}\) mostra o exemplo. (Nota: Como todas as formas de constantes de equilíbrio dependem da temperatura, assumiremos um ambiente de temperatura ambiente daqui para frente neste capítulo, a menos que um valor de temperatura diferente seja explicitamente especificado.)
O primeiro passo na preparação do magnésio metálico é a precipitação de Mg (OH) 2 da água do mar pela adição de cal, Ca (OH) 2, uma fonte barata e facilmente disponível de íon OH:
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=8.9×10^{−12} \nonumber \]
A concentração de Mg 2 + (aq) na água do mar é de 0,0537 M. Mg (OH) 2 precipitará quando Ca (OH) 2 suficiente for adicionado para dar um [OH —] de 0,0010 M?
Solução
Esse problema pergunta se a reação:
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
muda para a esquerda e forma Mg (OH) 2 sólido quando [Mg 2 +] = 0,0537 M e [OH —] = 0,0010 M. A reação muda para a esquerda se Q for maior que K sp. O cálculo do quociente de reação sob essas condições é mostrado aqui:
\[\mathrm{Q=[Mg^{2+}][OH^-]^2=(0.0537)(0.0010)^2=5.4×10^{−8}} \nonumber \]
Como Q é maior que K sp (Q = 5,4 × 10 —8 é maior que K sp = 8,9 × 10 —12), podemos esperar que a reação mude para a esquerda e forme hidróxido de magnésio sólido. Mg (OH) 2 (s) se forma até que as concentrações de íon magnésio e íon hidróxido sejam reduzidas o suficiente para que o valor de Q seja igual a K sp.
Use os produtos de solubilidade na Tabela E3 para determinar se o CaHPO 4 precipitará de uma solução com [Ca 2 +] = 0,0001 M e\(\ce{[HPO4^2- ]}\) = 0,001 M.
- Resposta
-
Sem precipitação de CaHPO 4; Q = 1 × 10 —7, que é menor que K sp
O cloreto de prata precipita quando volumes iguais de uma solução 2,0 × 10 —4 - M de AgNO 3 e uma solução 2,0 × 10 —4 - M de NaCl são misturados?
(Nota: A solução também contém Na + e\(\ce{NO3-}\) íons, mas quando se refere às regras de solubilidade, pode-se ver que o nitrato de sódio é muito solúvel e não pode formar um precipitado.)
Solução
A equação para o equilíbrio entre cloreto de prata sólido, íon prata e íon cloreto é:
O produto de solubilidade é 1,8 × 10 —10 (Tabela E3).
O AgCl precipitará se o quociente de reação calculado a partir das concentrações na mistura de AgNO 3 e NaCl for maior que K sp. O volume dobra quando misturamos volumes iguais de soluções de AgNO 3 e NaCl, então cada concentração é reduzida à metade de seu valor inicial. Consequentemente, imediatamente após a mistura, [Ag +] e [Cl —] são ambos iguais a:
O quociente de reação, Q, é momentaneamente maior que K sp para AgCl, então uma solução supersaturada é formada:
Como as soluções supersaturadas são instáveis, o AgCl precipitará da mistura até que a solução retorne ao equilíbrio, com Q igual a K sp.
O KClO 4 precipitará quando 20 mL de uma solução 0,050- M de K + forem adicionados a 80 mL de uma solução de 0,50- M de\(\ce{ClO4-}\)? (Lembre-se de calcular a nova concentração de cada íon após misturar as soluções antes de inserir a expressão do quociente de reação.)
- Resposta
-
Não, Q = 4,0 × 10 —3, que é menor que K sp = 1,07 × 10 —2
Nos dois exemplos anteriores, vimos que Mg (OH) 2 ou AgCl precipitam quando Q é maior que K sp. Em geral, quando uma solução de um sal solúvel do íon M m+ é misturada com uma solução de um sal solúvel do íon X n—, o sólido M p X q precipita se o valor de Q para a mistura de M m+ e X n— é maior que K sp para M p X q. Assim, se soubermos a concentração de um dos íons de um sólido iônico levemente solúvel e o valor do produto de solubilidade do sólido, podemos calcular a concentração que o outro íon deve exceder para que a precipitação comece. Para simplificar o cálculo, assumiremos que a precipitação começa quando o quociente de reação se torna igual à constante do produto de solubilidade.
O sangue não coagulará se os íons de cálcio forem removidos do plasma. Alguns tubos de coleta de sangue contêm sais do íon oxalato\(\ce{C2O4^2-}\),, para esse fim (Figura\(\PageIndex{4}\)). Em concentrações suficientemente altas, os íons cálcio e oxalato formam um sólido, CaC 2 O 4 • H 2 O (que também contém água ligada ao sólido). A concentração de Ca 2 + em uma amostra de soro sanguíneo é 2,2 × 10 —3 M. Qual concentração de\(\ce{C2O4^2-}\) íon deve ser estabelecida antes que CaC 2 O 4 •H 2 O comece a precipitar?
Solução
A expressão de equilíbrio é:
\[\ce{CaC2O4}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{C2O4^2-}(aq) \nonumber \]
Para esta reação (Tabela E3):
\[K_\ce{sp}=\ce{[Ca^2+][C2O4^2- ]}=1.96×10^{−8} \nonumber \]
CaC 2 O 4 não aparece nesta expressão porque é um sólido. A água não aparece porque é o solvente.
O CaC 2 O 4 sólido não começa a se formar até que Q seja igual a K sp. Como conhecemos K sp e [Ca 2 +], podemos resolver a concentração\(\ce{C2O4^2-}\) necessária para produzir o primeiro traço de sólido:
É necessária uma concentração de\(\ce{[C2O4^2- ]}\) = 8,9 × 10 —6 M para iniciar a precipitação de CaC 2 O 4 nessas condições.
Se uma solução contém 0,0020 mol de\(\ce{CrO4^2-}\) por litro, qual concentração de íon Ag + deve ser alcançada adicionando AgNO 3 sólido antes que o Ag 2 CrO 4 comece a precipitar? Negligencie qualquer aumento no volume ao adicionar o nitrato de prata sólido.
- Resposta
-
4,5 × 10 —9 M
Às vezes, é útil saber a concentração de um íon que permanece em solução após a precipitação. Também podemos usar o produto de solubilidade para esse cálculo: se soubermos o valor de K sp e a concentração de um íon em solução, podemos calcular a concentração do segundo íon restante na solução. O cálculo é do mesmo tipo do exemplo\(\PageIndex{8}\) — cálculo da concentração de uma espécie em uma mistura de equilíbrio a partir das concentrações da outra espécie e da constante de equilíbrio. No entanto, as concentrações são diferentes; estamos calculando as concentrações após a conclusão da precipitação, e não no início da precipitação.
Roupas lavadas em água com uma concentração de manganês [Mn 2 + (aq)] superior a 0,1 mg/L (1,8 × 10 —6 M) podem ser manchadas pelo manganês após a oxidação, mas a quantidade de Mn 2 + na água pode ser reduzida adicionando um base. Se uma pessoa que lava roupa deseja adicionar um tampão para manter o pH alto o suficiente para precipitar o manganês como o hidróxido, Mn (OH) 2, qual pH é necessário para manter [Mn 2 +] igual a 1,8 × 10 —6 M?
Solução
A dissolução de Mn (OH) 2 é descrita pela equação:
\[\ce{Mn(OH)2}(s) \rightleftharpoons \ce{Mn^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=2×10^{−13} \nonumber \]
Precisamos calcular a concentração de OH — quando a concentração de Mn 2 + é 1,8 × 10 —6 M. A partir disso, calculamos o pH. Em equilíbrio:
ou
\[ (1.8×10^{−6})\ce{[OH- ]^2}=2×10^{−13} \nonumber \]
então
Agora calculamos o pH a partir do pOH:
Se a pessoa que lava a roupa adicionar uma base, como o silicato de sódio (Na 4 SiO 4) em alguns detergentes, à água de lavagem até que o pH seja elevado para 10,52, o íon manganês será reduzido para uma concentração de 1,8 × 10 —6 M; nessa concentração ou menos, o íon não manchará as roupas.
O primeiro passo na preparação do magnésio metálico é a precipitação do Mg (OH) 2 da água do mar pela adição de Ca (OH) 2. A concentração de Mg 2 + (aq) na água do mar é de 5,37 × 10 —2 M. Calcule o pH no qual [Mg 2 +] é diminuído para 1,0 × 10 —5 M pela adição de Ca (OH) 2.
- Resposta
-
10,97
Devido à sua sensibilidade à luz, misturas de halogenetos de prata são usadas em fibras ópticas para lasers médicos, em lentes de óculos fotocrômicas (lentes de vidro que escurecem automaticamente quando expostas à luz solar) e, antes do advento da fotografia digital, em filmes fotográficos. Embora AgCl (K sp = 1,6 × 10 —10), AgBr (K sp = 5,0 × 10 —13) e AgI (K sp = 1,5 × 10 —16) sejam bastante insolúveis, não podemos preparar uma mistura sólida homogênea deles adicionando Ag + para uma solução de Cl —, Br — e I —; essencialmente, todo o AgI precipitará antes que qualquer um dos outros haletos sólidos se forme devido ao seu menor valor para K sp. No entanto, podemos preparar uma mistura homogênea dos sólidos adicionando lentamente uma solução de Cl —, Br — e I — a uma solução de Ag +.
Quando dois ânions formam compostos levemente solúveis com o mesmo cátion, ou quando dois cátions formam compostos levemente solúveis com o mesmo ânion, o composto menos solúvel (geralmente, o composto com o menor K sp) geralmente precipita primeiro quando adicionamos um agente precipitante a um solução contendo ambos os ânions (ou ambos os cátions). Quando os valores de K sp dos dois compostos diferem em duas ordens de magnitude ou mais (por exemplo, 10 —2 versus 10 —4), quase todo o composto menos solúvel precipita antes de qualquer um dos mais solúveis. Este é um exemplo de precipitação seletiva, em que um reagente é adicionado a uma solução de íons dissolvidos, fazendo com que um dos íons se precipite antes do resto.
O papel da precipitação no tratamento de águas residuais
Os equilíbrios de solubilidade são ferramentas úteis no tratamento de águas residuais realizado em instalações que podem tratar a água municipal em sua cidade ou vila (Figura\(\PageIndex{5}\)). Especificamente, a precipitação seletiva é usada para remover contaminantes das águas residuais antes que elas sejam liberadas de volta aos corpos d'água naturais. Por exemplo,\(\ce{(PO4^2- )}\) os íons fosfato geralmente estão presentes na água descarregada das instalações de fabricação. Uma abundância de fosfato faz com que o excesso de algas cresça, o que afeta a quantidade de oxigênio disponível para a vida marinha, além de tornar a água imprópria para consumo humano.

Uma forma comum de remover os fosfatos da água é pela adição de hidróxido de cálcio, conhecido como cal, Ca (OH) 2. A cal é convertida em carbonato de cálcio, uma base forte, na água. À medida que a água se torna mais básica, os íons de cálcio reagem com os íons fosfato para produzir hidroxilapatita, Ca 5 (PO4) 3 (OH), que então precipita da solução:
\[\ce{5Ca^2+ + 3PO4^3- + OH- \rightleftharpoons Ca10(PO4)6⋅(OH)2}(s) \nonumber \]
O precipitado é então removido por filtração e a água é trazida de volta a um pH neutro pela adição de CO 2 em um processo de recarbonatação. Outros produtos químicos também podem ser usados para a remoção de fosfatos por precipitação, incluindo cloreto de ferro (III) e sulfato de alumínio.
A precipitação seletiva também pode ser usada em análises qualitativas. Neste método, os reagentes são adicionados a uma mistura química desconhecida para induzir a precipitação. Certos reagentes fazem com que íons específicos se precipitem; portanto, a adição do reagente pode ser usada para determinar se o íon está presente na solução.
Uma solução contém 0,0010 mol de KI e 0,10 mol de KCl por litro. AgNO 3 é gradualmente adicionado a esta solução. O que forma primeiro, AgI sólido ou AgCl sólido?
Solução
Os dois equilíbrios envolvidos são:
Se a solução contivesse concentrações aproximadamente iguais de Cl — e I —, então o sal de prata com o menor K sp (AgI) precipitaria primeiro. As concentrações não são iguais, no entanto, devemos encontrar o [Ag +] no qual o AgCl começa a precipitar e o [Ag +] no qual o AgI começa a precipitar. O sal que se forma na parte inferior [Ag +] precipita primeiro.
Para AgI: AgI precipita quando Q é igual a K sp para AgI (1,5 × 10 —16). Quando [I —] = 0,0010 M:
O AgI começa a precipitar quando [Ag +] é 1,5 × 10 —13 M.
Para AgCl: AgCl precipita quando Q é igual a K sp para AgCl (1,6 × 10 —10). Quando [Cl —] = 0,10 M:
O AgCl começa a precipitar quando [Ag +] é 1,6 × 10 —9 M.
O AgI começa a precipitar em um valor menor de [Ag +] do que o AgCl, então o AgI começa a precipitar primeiro.
Se a solução de nitrato de prata for adicionada a uma solução que é 0,050 M nos íons Cl - e Br -, em que [Ag +] a precipitação começaria e qual seria a fórmula do precipitado?
- Resposta
-
[Ag +] = 1,0 × 10 —11 M; AgBr precipita primeiro
Efeito de íon comum
Como vimos quando discutimos soluções tampão, a concentração de íons hidrônio de uma solução aquosa de ácido acético diminui quando o eletrólito forte acetato de sódio, NaCH 3 CO 2, é adicionado. Podemos explicar esse efeito usando o princípio de Le Chatelier. A adição de íons acetato faz com que o equilíbrio se desloque para a esquerda, diminuindo a concentração de\(\ce{H3O+}\) para compensar o aumento da concentração de íons acetato. Isso aumenta a concentração de CH 3 CO 2 H:
\ [\ ce {CH3CO2H + H2O\ arpões direitos-esquerdos H3O+ + CH3CO2-}\)]
Como o acetato de sódio e o ácido acético têm o íon acetato em comum, a influência no equilíbrio é chamada de efeito de íon comum. O efeito do íon comum também pode ter um efeito direto nos equilíbrios de solubilidade. Suponha que estejamos observando a reação em que o iodeto de prata é dissolvido:
\[\ce{AgI}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{I-}(aq) \nonumber \]
Se adicionássemos iodeto de potássio (KI) a essa solução, estaríamos adicionando uma substância que compartilha um íon comum com o iodeto de prata. O princípio de Le Chatelier nos diz que quando uma mudança é feita em um sistema em equilíbrio, a reação mudará para neutralizar essa mudança. Neste exemplo, haveria um excesso de íons de iodeto, então a reação mudaria para a esquerda, fazendo com que mais iodeto de prata precipitasse da solução.
Calcule a solubilidade molar do sulfeto de cádmio (CDs) em uma solução 0,010- M de brometo de cádmio (CdBr 2). O K sp dos CDs é 1,0 × 10 —28.
Solução
A primeira coisa que você deve observar é que o sulfeto de cádmio é dissolvido em uma solução que contém íons cádmio. Precisamos usar uma tabela ICE para configurar esse problema e incluir a concentração de CdBr 2 como contribuinte dos íons cádmio:
\[\ce{CdS}(s) \rightleftharpoons \ce{Cd^2+}(aq)+\ce{S^2-}(aq) \nonumber \]
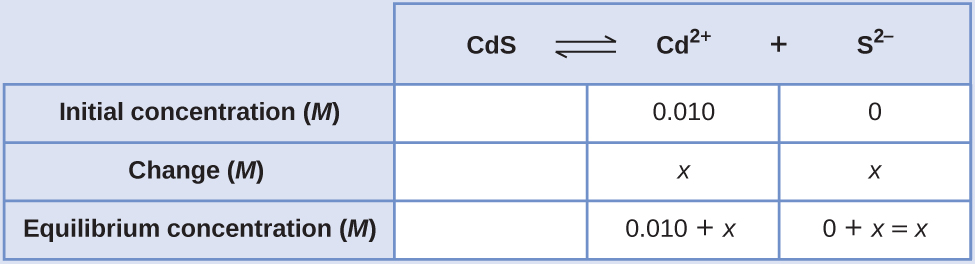
\( (0.010+x)(x)=1.0×10^{−28}\)\(x^2+0.010x−1.0×10^{−28}=0\)
Podemos resolver essa equação usando a fórmula quadrática, mas também podemos fazer uma suposição para tornar esse cálculo muito mais simples. Como o valor de K sp é tão pequeno em comparação com a concentração de cádmio, podemos supor que a mudança entre a concentração inicial e a concentração de equilíbrio é insignificante, de modo que 0,010 + x ~ 0,010. Voltando à nossa expressão K sp, agora obteríamos:
Portanto, a solubilidade molar dos CDs nesta solução é 1,0 × 10 —26 M.
Calcule a solubilidade molar do hidróxido de alumínio, Al (OH) 3, em uma solução de 0,015- M de nitrato de alumínio, Al (NO 3) 3. O K sp de Al (OH) 3 é 2 × 10 —32.
- Resposta
-
4 × 10 —11
Resumo
A constante de equilíbrio para um equilíbrio envolvendo a precipitação ou dissolução de um sólido iônico levemente solúvel é chamada de produto de solubilidade, K sp, do sólido. Quando temos um equilíbrio heterogêneo envolvendo o sólido levemente solúvel M p X q e seus íons M m+ e X n—:
\[\ce{M}_p\ce{X}_q(s) \rightleftharpoons p\mathrm{M^{m+}}(aq)+q\mathrm{X^{n−}}(aq) \nonumber \]
Escrevemos a expressão do produto de solubilidade como:
\[K_\ce{sp}=\mathrm{[M^{m+}]}^p\mathrm{[X^{n−}]}^q \nonumber \]
O produto de solubilidade de um eletrólito levemente solúvel pode ser calculado a partir de sua solubilidade; inversamente, sua solubilidade pode ser calculada a partir de seu K sp, desde que a única reação significativa que ocorre quando o sólido se dissolve seja a formação de seus íons. Um eletrólito levemente solúvel começa a precipitar quando a magnitude do quociente da reação de dissolução excede a magnitude do produto de solubilidade. A precipitação continua até que o quociente de reação seja igual ao produto de solubilidade. Um reagente pode ser adicionado a uma solução de íons para permitir que um íon precipite seletivamente da solução. O efeito iônico comum também pode desempenhar um papel nas reações de precipitação. Na presença de um íon em comum com um dos íons da solução, o princípio de Le Chatelier se aplica e mais precipitado sai da solução para reduzir a solubilidade molar.
Glossário
- efeito iônico comum
- efeito no equilíbrio quando uma substância com um íon em comum com a espécie dissolvida é adicionada à solução; causa uma diminuição na solubilidade de uma espécie iônica ou uma diminuição na ionização de um ácido ou base fraco
- solubilidade molar
- solubilidade de um composto expressa em unidades de moles por litro (mol/L)
- precipitação seletiva
- processo no qual os íons são separados usando diferenças em sua solubilidade com um determinado reagente precipitante
- produto de solubilidade (K sp)
- constante de equilíbrio para a dissolução de um eletrólito ligeiramente solúvel


