10.3: Transições de fase
- Page ID
- 195157
- Defina transições de fase e temperaturas de transição de fase
- Explicar a relação entre temperaturas de transição de fase e forças de atração intermoleculares
- Descreva os processos representados pelas curvas típicas de aquecimento e resfriamento e calcule os fluxos de calor e as mudanças de entalpia que acompanham esses processos
Testemunhamos e utilizamos mudanças de estado físico, ou transições de fase, de várias maneiras. Como um exemplo de importância global, considere a evaporação, condensação, congelamento e derretimento da água. Essas mudanças de estado são aspectos essenciais do ciclo da água na Terra, bem como muitos outros fenômenos naturais e processos tecnológicos de importância central para nossas vidas. Neste módulo, os aspectos essenciais das transições de fase são explorados.
Vaporização e condensação
Quando um líquido se vaporiza em um recipiente fechado, as moléculas de gás não conseguem escapar. À medida que essas moléculas da fase gasosa se movem aleatoriamente, elas ocasionalmente colidem com a superfície da fase condensada e, em alguns casos, essas colisões resultarão na reentrada das moléculas na fase condensada. A mudança da fase gasosa para o líquido é chamada de condensação. Quando a taxa de condensação se torna igual à taxa de vaporização, nem a quantidade de líquido nem a quantidade de vapor no recipiente mudam. Diz-se então que o vapor no recipiente está em equilíbrio com o líquido. Lembre-se de que essa não é uma situação estática, pois as moléculas são trocadas continuamente entre as fases condensada e gasosa. Esse é um exemplo de equilíbrio dinâmico, o status de um sistema no qual processos recíprocos (por exemplo, vaporização e condensação) ocorrem em taxas iguais. A pressão exercida pelo vapor em equilíbrio com um líquido em um recipiente fechado a uma determinada temperatura é chamada de pressão de vapor do líquido (ou pressão de vapor de equilíbrio). A área da superfície do líquido em contato com o vapor e o tamanho do vaso não afetam a pressão do vapor, embora afetem o tempo necessário para que o equilíbrio seja alcançado. Podemos medir a pressão de vapor de um líquido colocando uma amostra em um recipiente fechado, como o ilustrado na Figura\(\PageIndex{1}\), e usando um manômetro para medir o aumento da pressão devido ao vapor em equilíbrio com a fase condensada.
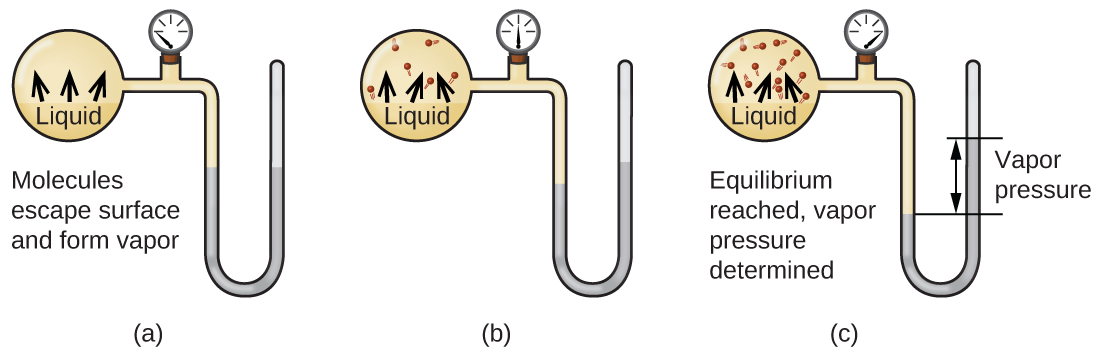
As identidades químicas das moléculas em um líquido determinam os tipos (e forças) de atrações intermoleculares possíveis; consequentemente, diferentes substâncias exibirão diferentes pressões de vapor de equilíbrio. Forças atrativas intermoleculares relativamente fortes servirão para impedir a vaporização, bem como favorecer a “recaptura” de moléculas em fase gasosa quando elas colidem com a superfície do líquido, resultando em uma pressão de vapor relativamente baixa. As atrações intermoleculares fracas apresentam menos barreira à vaporização e uma probabilidade reduzida de recaptura de gás, produzindo pressões de vapor relativamente altas. O exemplo a seguir ilustra essa dependência da pressão de vapor nas forças de atração intermoleculares.
Dadas as fórmulas estruturais mostradas para esses quatro compostos, explique suas pressões relativas de vapor em termos de tipos e extensões de IMFs:
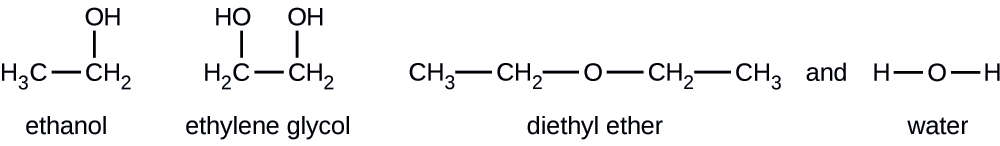
Solução
O éter dietílico tem um dipolo muito pequeno e a maioria de suas atrações intermoleculares são as forças de Londres. Embora essa molécula seja a maior das quatro consideradas, seus FMI são os mais fracos e, como resultado, suas moléculas escapam mais facilmente do líquido. Ele também tem a maior pressão de vapor. Devido ao seu tamanho menor, o etanol apresenta forças de dispersão mais fracas do que o éter dietílico. No entanto, o etanol é capaz de se ligar ao hidrogênio e, portanto, exibe FMI gerais mais fortes, o que significa que menos moléculas escapam do líquido a qualquer temperatura e, portanto, o etanol tem uma pressão de vapor menor do que o éter dietílico. A água é muito menor do que qualquer uma das substâncias anteriores e exibe forças de dispersão mais fracas, mas sua extensa ligação de hidrogênio fornece atrações intermoleculares mais fortes, menos moléculas escapando do líquido e uma pressão de vapor menor do que a do éter dietílico ou do etanol. O etilenoglicol tem dois grupos −OH, então, como a água, ele exibe uma extensa ligação de hidrogênio. É muito maior do que a água e, portanto, experimenta forças maiores de Londres. Seus FMI gerais são as maiores dessas quatro substâncias, o que significa que sua taxa de vaporização será a mais lenta e, consequentemente, sua pressão de vapor a mais baixa.


