6.1: A massa da fórmula e o conceito de toupeira
- Page ID
- 195313
- Calcule massas de fórmula para compostos covalentes e iônicos
- Defina a quantidade unidade-mol e a quantidade relacionada (número de Avogadro).
- Explique a relação entre massa, moles e número de átomos ou moléculas e realize cálculos derivando essas quantidades umas das outras
Podemos argumentar que a ciência química moderna começou quando os cientistas começaram a explorar os aspectos quantitativos e qualitativos da química. Por exemplo, a teoria atômica de Dalton foi uma tentativa de explicar os resultados das medições que lhe permitiram calcular as massas relativas dos elementos combinados em vários compostos. Entender a relação entre as massas dos átomos e as fórmulas químicas dos compostos nos permite descrever quantitativamente a composição das substâncias.
Massa da fórmula
Em um capítulo anterior, descrevemos o desenvolvimento da unidade de massa atômica, o conceito de massas atômicas médias e o uso de fórmulas químicas para representar a composição elementar das substâncias. Essas ideias podem ser estendidas para calcular a massa da fórmula de uma substância somando as massas atômicas médias de todos os átomos representados na fórmula da substância.
Massa da fórmula para substâncias covalentes
Para substâncias covalentes, a fórmula representa os números e tipos de átomos que compõem uma única molécula da substância; portanto, a massa da fórmula pode ser corretamente chamada de massa molecular. Considere o clorofórmio (CHCl 3), um composto covalente antes usado como anestésico cirúrgico e agora usado principalmente na produção de tetrafluoretileno, o alicerce do polímero “antiaderente”, o Teflon. A fórmula molecular do clorofórmio indica que uma única molécula contém um átomo de carbono, um átomo de hidrogênio e três átomos de cloro. A massa molecular média de uma molécula de clorofórmio é, portanto, igual à soma das massas atômicas médias desses átomos. A figura\(\PageIndex{1}\) descreve os cálculos usados para derivar a massa molecular do clorofórmio, que é 119,37 amu.
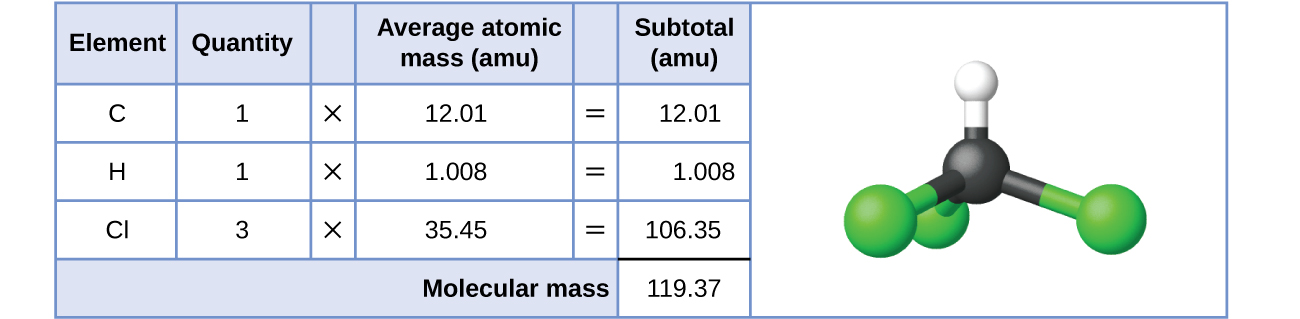
Da mesma forma, a massa molecular de uma molécula de aspirina, C 9 H 8 O 4, é a soma das massas atômicas de nove átomos de carbono, oito átomos de hidrogênio e quatro átomos de oxigênio, o que equivale a 180,15 amu (Figura\(\PageIndex{2}\)).
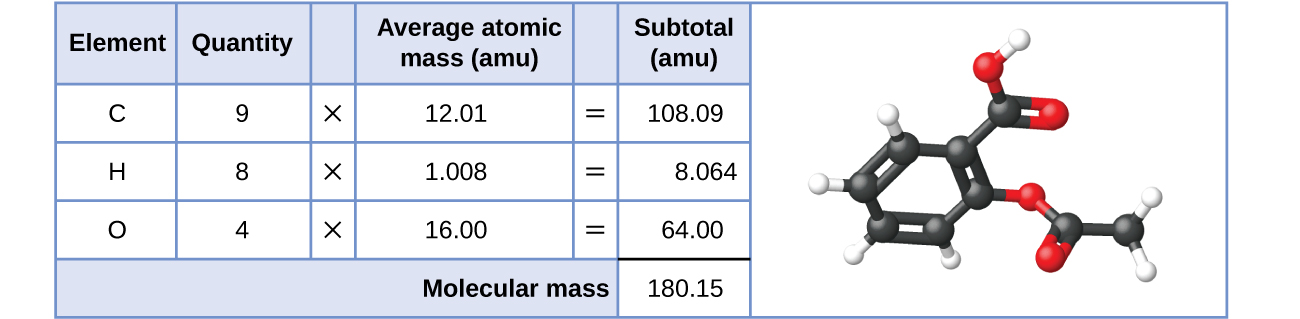
 Figura
Figura

