5.E: Teorias avançadas da ligação covalente (exercícios)
- Page ID
- 194960
8.1: Teoria do vínculo de valência
Exercícios do
- Explique como as ligações σ e π são semelhantes e como são diferentes.
- Desenhe uma curva que descreva a energia de um sistema com átomos de H e Cl em distâncias variadas. Em seguida, encontre a energia mínima dessa curva de duas maneiras.
- Use a energia de ligação encontrada na Tabela 8.2.1 para calcular a energia para uma única ligação de HCl (Dica: Quantas ligações existem em um mol?)
- Use a entalpia da reação e as energias de ligação para\(H_2\) e\(Cl_2\) para resolver a energia de um mol de ligações HCl. \[H_{2(g)}+Cl_{2(g)} \rightleftharpoons 2HCl_{(g)} \;\;\; ΔH^∘_{rxn}=−184.7\; kJ/mol\]
- Explique por que as ligações ocorrem em distâncias médias específicas de ligação, em vez de os átomos se aproximarem infinitamente próximos.
- Use a teoria da ligação de valência para explicar a ligação em F 2, HF e ClBr. Esboce a sobreposição dos orbitais atômicos envolvidos nas ligações.
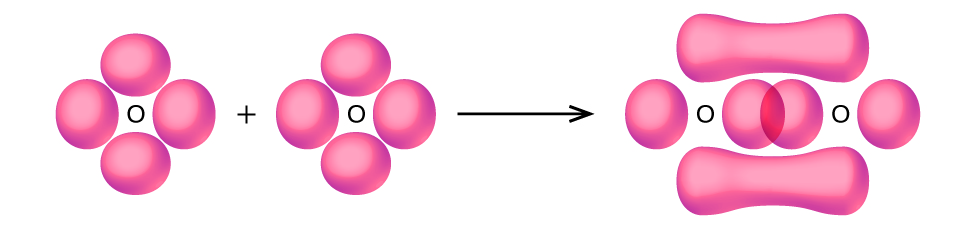
- Use a teoria da ligação de valência para explicar a ligação em O 2. Esboce a sobreposição dos orbitais atômicos envolvidos nas ligações em O 2.
- Quantas ligações σ e π estão presentes na molécula HCN?
- Um amigo diz que N 2 tem três ligações π devido à sobreposição dos três orbitais p em cada átomo de N. Você concorda?
- Desenhe as estruturas de Lewis para CO 2 e CO e preveja o número de ligações σ e π para cada molécula.
- CO 2
- CO
Soluções
1. Semelhanças: Ambos os tipos de ligações resultam da sobreposição de orbitais atômicos em átomos adjacentes e contêm no máximo dois elétrons. Diferenças: as ligações σ são mais fortes e resultam da sobreposição de ponta a ponta e todas as ligações simples são ligações σ; as ligações π entre os mesmos dois átomos são mais fracas porque resultam da sobreposição lado a lado, e várias ligações contêm uma ou mais ligações π (além de uma ligação σ).
2
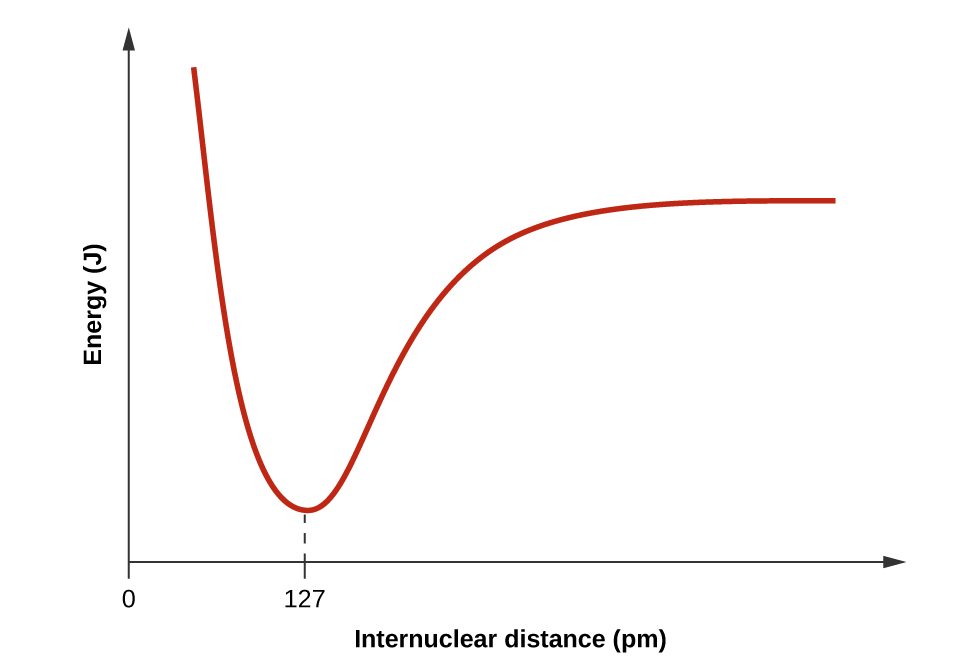
Quando H e Cl estão separados (o eixo x), a energia está em um valor específico. À medida que se aproximam, diminui para o mínimo às 127 horas (a distância da ligação) e, em seguida, aumenta acentuadamente à medida que você se aproxima.
- (a) H — Cl431 kJ/mol 427 kjmol × MOL 6,022 × 1023 ligações × 1000 kJ = 7,09 × 10−19
- (b) Conhecemos a lei de Hess relacionada às energias de ligação: ΔH°=ΔHBDE (quebrado) −ΔHBDE (formado) Recebemos a entalpia da reação
\[−184.7 kJ/mol=(ΔH∘BDE(H–H)+ΔH∘BDE(Cl–Cl))−(2ΔH∘BDE(H–Cl))\]
\[H–H is 436 kJ/mol and Cl–Cl is 243\]
\[–184.7 kJ/mol = (436 + 243) – 2x = 679 – 2x\]
\[2x = 863.7 kJ/mol\]
\[x = 432\; kJ/mol\]
Isso está muito próximo do valor da parte (a).
3. A distância média específica de ligação é a distância com a menor energia. Em distâncias menores que a distância de ligação, as cargas positivas nos dois núcleos se repelem e a energia geral aumenta.
4. A ligação única presente em cada molécula resulta da sobreposição dos orbitais relevantes: orbitais F 2 p em F 2, orbitais H 1 s e F 2 p em HF e orbital Cl 3 p e orbital Br 4 p em ClBr.
5. Ligação: Uma ligação σ e uma ligação π. Os orbitais s estão preenchidos e não se sobrepõem. Os orbitais p se sobrepõem ao longo do eixo para formar uma ligação σ e lado a lado para formar a ligação π.
6. \(\ce{H–C≡N}\)tem dois σ (H—C e C—N) e dois π (fazendo a ligação tripla CN).
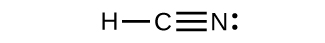
7. Não, dois dos orbitais p (um em cada N) serão orientados de ponta a ponta e formarão uma ligação σ.
 " height="174" width="442" src="https://chem.libretexts.org/@api/dek...ewStru_img.jpg">
" height="174" width="442" src="https://chem.libretexts.org/@api/dek...ewStru_img.jpg">
8. (a) 2 σ 2 π;
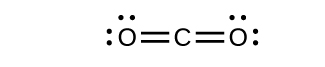
(b) 1 σ 2 π;
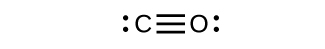
8.2: Orbitais atômicos híbridos
Exercícios de fim de capítulo de química
Por que o conceito de hibridização é exigido na teoria da ligação de valência?
A hibridização é introduzida para explicar a geometria dos orbitais de ligação na teoria da ligação de valência.
Dê a forma que descreve cada conjunto orbital híbrido:
(a) sp 2
(b) sp 3 d
(c) sp
(d) sp 3 x 2
Explique por que um átomo de carbono não pode formar cinco ligações usando orbitais híbridos sp 3 d.
Não há orbitais d na camada de valência do carbono.
Qual é a hibridização do átomo central em cada um dos seguintes?
(a) BeH 2
(b) SF 6
(c)\(\ce{PO4^3-}\)
(d) PCl 5
Uma molécula com a fórmula AB 3 pode ter uma das quatro formas diferentes. Dê a forma e a hibridização do átomo central A para cada um.
plano trigonal, sp 2; piramidal trigonal (um par solitário em A) sp 3; em forma de T (dois pares solitários em A sp 3 d, ou (três pares solitários em A) sp 3 d 2
A metionina, CH 3 SCH 2 CH 2 CH (NH 2) CO 2 H, é um aminoácido encontrado nas proteínas. Desenhe uma estrutura de Lewis desse composto. Qual é o tipo de hibridização de cada carbono, oxigênio, nitrogênio e enxofre?

O ácido sulfúrico é fabricado por uma série de reações representadas pelas seguintes equações:
\(\ce{S8}(s)+\ce{8O2}(g)⟶\ce{8SO2}(g)\)
\(\ce{2SO2}(g)+\ce{O2}(g)⟶\ce{2SO3}(g)\)
\(\ce{SO3}(g)+\ce{H2O}(l)⟶\ce{H2SO4}(l)\)
Draw a Lewis structure, predict the molecular geometry by VSEPR, and determine the hybridization of sulfur for the following:
(a) circular S8 molecule
(b) SO2 molecule
(c) SO3 molecule
(d) H2SO4 molecule (the hydrogen atoms are bonded to oxygen atoms)
(a) Each S has a bent (109°) geometry, sp3

(b) Curvado (120°), sp 2

(c) Plano trigonal, sp 2

(d) Tetraédrico, sp 3

Dois produtos químicos industriais importantes, eteno, C 2 H 4 e propeno, C 3 H 6, são produzidos pelo processo de craqueamento a vapor (ou térmico):
\(\ce{2C3H8}(g)⟶\ce{C2H4}(g)+\ce{C3H6}(g)+\ce{CH4}(g)+\ce{H2}(g)\)For each of the four carbon compounds, do the following:
(a) Draw a Lewis structure.
(b) Predict the geometry about the carbon atom.
(c) Determine the hybridization of each type of carbon atom.
For many years after they were discovered, it was believed that the noble gases could not form compounds. Now we know that belief to be incorrect. A mixture of xenon and fluorine gases, confined in a quartz bulb and placed on a windowsill, is found to slowly produce a white solid. Analysis of the compound indicates that it contains 77.55% Xe and 22.45% F by mass.
(a) What is the formula of the compound?
(b) Write a Lewis structure for the compound.
(c) Predict the shape of the molecules of the compound.
(d) What hybridization is consistent with the shape you predicted?
(a) XeF2
(b)

(c) linear (d) sp 3 d
Considere o ácido nitroso, HNO 2 (HONO).
(a) Escreva uma estrutura de Lewis.
(b) Quais são o par de elétrons e as geometrias moleculares dos átomos internos de oxigênio e nitrogênio na molécula de HNO 2?
(c) Qual é a hibridização nos átomos internos de oxigênio e nitrogênio no HNO 2?
As partidas Strike-Anywhere contêm uma camada de KClO 3 e uma camada de P 4 S 3. O calor produzido pelo atrito de bater no fósforo faz com que esses dois compostos reajam vigorosamente, o que incendeia a haste de madeira do fósforo. O KClo 3 contém o\(\ce{ClO3-}\) íon. P 4 S 3 é uma molécula incomum com a estrutura esquelética.

(a) Escreva estruturas de Lewis para P 4 S 3 e o\(\ce{ClO3-}\) ion.
(b) Describe the geometry about the P atoms, the S atom, and the Cl atom in these species.
(c) Assign a hybridization to the P atoms, the S atom, and the Cl atom in these species.
(d) Determine the oxidation states and formal charge of the atoms in P4S3 and the \(\ce{ClO3-}\) ion.
(a)

(b) Átomos de P, trigonais piramidais; átomos S, dobrados, com dois pares solitários; átomos de Cl, piramidais trigonais; (c) A hibridização sobre P, S e Cl é, em todos os casos, sp 3; (d) Estados de oxidação P +1, S\(−1\dfrac{1}{3}\), Cl +5, O —2. Cobranças formais: P 0; S 0; Cl +2: O —1
Identifique a hibridização de cada átomo de carbono na seguinte molécula. (A disposição dos átomos é dada; você precisa determinar quantas ligações conectam cada par de átomos.)

Escreva estruturas de Lewis para NF 3 e PF 5. Com base em orbitais híbridos, explique o fato de que NF 3, PF 3 e PF 5 são moléculas estáveis, mas NF 5 não existe.

O fósforo e o nitrogênio podem formar híbridos sp 3 para formar três ligações e manter um par solitário em PF 3 e NF 3, respectivamente. No entanto, o nitrogênio não tem orbitais de valência d, portanto, não pode formar um conjunto de orbitais híbridos sp 3 d para ligar cinco átomos de flúor em NF 5. O fósforo tem orbitais d e pode ligar cinco átomos de flúor com orbitais híbridos sp 3 d em PF 5.
Além do NF 3, dois outros derivados do fluoro do nitrogênio são conhecidos: N 2 F 4 e N 2 F 2. Quais formas você prevê para essas duas moléculas? Qual é a hibridização do nitrogênio em cada molécula?
8.3: Vários títulos
Exercícios de fim de capítulo de química
A energia de ligação de uma ligação única C—C é em média de 347 kJ mol −1; a de uma ligação tripla CC tem uma média de 839 kJ mol −1. Explique por que a ligação tripla não é três vezes mais forte que uma ligação única.
Uma ligação tripla consiste em uma ligação σ e duas ligações π. Uma ligação σ é mais forte do que uma ligação π devido à maior sobreposição.
Para o íon carbonato,\(\ce{CO3^2-}\), draw all of the resonance structures. Identify which orbitals overlap to create each bond.
A useful solvent that will dissolve salts as well as organic compounds is the compound acetonitrile, H3CCN. It is present in paint strippers.
(a) Write the Lewis structure for acetonitrile, and indicate the direction of the dipole moment in the molecule.
(b) Identify the hybrid orbitals used by the carbon atoms in the molecule to form σ bonds.
(c) Describe the atomic orbitals that form the π bonds in the molecule. Note that it is not necessary to hybridize the nitrogen atom.
(a)

(b) O átomo de carbono terminal usa orbitais híbridos sp 3, enquanto o átomo de carbono central é hibridizado sp. (c) Cada uma das duas ligações π é formada pela sobreposição de um orbital de 2 p em carbono e um orbital de nitrogênio 2 p.
Para o aleno da molécula\(\mathrm{H_2C=C=CH_2}\), dê a hibridização de cada átomo de carbono. Os átomos de hidrogênio estarão no mesmo plano ou em planos perpendiculares?
Identifique a hibridização do átomo central em cada uma das seguintes moléculas e íons que contêm várias ligações:
(a) ClNO (N é o átomo central)
(b) CS 2
(c) Cl 2 CO (C é o átomo central)
(d) Cl 2 SO (S é o átomo central)
(e) SO 2 F 2 (S é o átomo central)
(f) XeO 2 F 2 (Xe é o átomo central)
(g)\(\ce{ClOF2+}\) (Cl é o átomo central)
(a) sp 2; (b) sp; (c) sp 2; (d) sp 3; (e) sp 3; (f) sp 3 d; (g) sp 3
Descreva a geometria molecular e a hibridização dos átomos de N, P ou S em cada um dos seguintes compostos.
(a) H 3 PO 4, ácido fosfórico, usado em refrigerantes de cola
(b) NH 4 NO 3, nitrato de amônio, um fertilizante e explosivo
(c) S 2 Cl 2, dicloreto de disenxofre, usado na vulcanização da borracha
(d) K 4 [O 3 POPO 3], pirofosfato de potássio, um ingrediente em alguns cremes dentais
Para cada uma das seguintes moléculas, indique a hibridação solicitada e se os elétrons serão ou não deslocalizados:
(a) hibridização O central de ozônio (O 3)
(b) hibridização C central de dióxido de carbono (CO 2)
(c) hibridização central de N de dióxido de nitrogênio (NO 2)
(d) hibridização central de P de íon fosfato\(\ce{PO4^3-}\)
(a) sp 2, deslocalizado; (b) sp, localizado; (c) sp 2, deslocalizado; (d) sp 3, deslocalizado
Para cada uma das estruturas a seguir, determine a hibridação solicitada e se os elétrons serão deslocalizados:
(a) Hibridização de cada carbono

(b) Hibridização de enxofre

(c) Todos os átomos

Desenhe o diagrama orbital do carbono em CO 2 mostrando quantos elétrons de átomo de carbono existem em cada orbital.

Cada um dos quatro elétrons está em um orbital separado e se sobrepõe a um elétron em um átomo de oxigênio.
8.4: Teoria Molecular do Orbital
Exercícios de fim de capítulo de química
Esboce a distribuição da densidade eletrônica nos orbitais moleculares de ligação e antiligação formados a partir de dois orbitais s e de dois orbitais p.
Como os itens a seguir são semelhantes e como eles diferem?
(a) σ orbitais moleculares e orbitais moleculares π
(b) para um orbital atômico e para um orbital molecular
(c) orbitais de ligação e orbitais antiligação
(a) Semelhanças: Ambos são orbitais de ligação que podem conter no máximo dois elétrons. Diferenças: os orbitais σ são combinações de ponta a ponta de orbitais atômicos, enquanto os orbitais π são formados pela sobreposição lado a lado de orbitais. (b) Semelhanças: Ambas são construções de mecânica quântica que representam a probabilidade de encontrar o elétron sobre o átomo ou a molécula. Diferenças: para um orbital atômico descreve o comportamento de apenas um elétron por vez com base no átomo. Para uma molécula, representa uma combinação matemática de orbitais atômicos. (c) Semelhanças: Ambos são orbitais que podem conter dois elétrons. Diferenças: A ligação de orbitais resulta na manutenção de dois ou mais átomos juntos. Os orbitais antiaderentes têm o efeito de desestabilizar qualquer ligação que tenha ocorrido.
Se os orbitais moleculares forem criados pela combinação de cinco orbitais atômicos do átomo A e cinco orbitais atômicos do átomo B combinados, quantos orbitais moleculares resultarão?
Uma molécula com um número ímpar de elétrons pode ser diamagnética? Explique por que ou por que não.
Um número ímpar de elétrons nunca pode ser emparelhado, independentemente da disposição dos orbitais moleculares. Sempre será paramagnético.
Uma molécula com um número par de elétrons pode ser paramagnética? Explique por que ou por que não.
Por que os orbitais moleculares de ligação têm menos energia do que os orbitais atômicos originais?
Os orbitais de ligação têm densidade eletrônica próxima a mais de um núcleo. A interação entre a ligação de núcleos com carga positiva e elétrons carregados negativamente estabiliza o sistema.
Calcule a ordem de ligação de um íon com esta configuração:
Explain why an electron in the bonding molecular orbital in the H2 molecule has a lower energy than an electron in the 1s atomic orbital of either of the separated hydrogen atoms.
The pairing of the two bonding electrons lowers the energy of the system relative to the energy of the nonbonded electrons.
Predict the valence electron molecular orbital configurations for the following, and state whether they will be stable or unstable ions.
(a) \(\ce{Na2^2+}\)
(b) \(\ce{Mg2^2+}\)
(c) \(\ce{Al2^2+}\)
(d) \(\ce{Si2^2+}\)
(e) \(\ce{P2^2+}\)
(f) \(\ce{S2^2+}\)
(g) \(\ce{F2^2+}\)
(h) \(\ce{Ar2^2+}\)
Determine the bond order of each member of the following groups, and determine which member of each group is predicted by the molecular orbital model to have the strongest bond.
(a) H2, \(\ce{H2+}\), \(\ce{H2-}\)
(b) O2, \(\ce{O2^2+}\), \(\ce{O2^2-}\)
(c) Li2, \(\ce{Be2+}\), Be2
(d) F2, \(\ce{F2+}\), \(\ce{F2-}\)
(e) N2, \(\ce{N2+}\), \(\ce{N2-}\)
(a) H2 bond order = 1, \(\ce{H2+}\) bond order = 0.5, \(\ce{H2-}\) bond order = 0.5, strongest bond is H2; (b) O2 bond order = 2, \(\ce{O2^2+}\) bond order = 3; \(\ce{O2^2-}\) bond order = 1, strongest bond is \(\ce{O2^2+}\); (c) Li2 bond order = 1, \(\ce{Be2+}\) bond order = 0.5, Be2 bond order = 0, strongest bond is \(\ce{Li2}\);(d) F2 bond order = 1, \(\ce{F2+}\) bond order = 1.5, \(\ce{F2-}\) bond order = 0.5, strongest bond is \(\ce{F2+}\); (e) N2 bond order = 3, \(\ce{N2+}\) bond order = 2.5, \(\ce{N2-}\) bond order = 2.5, strongest bond is N2
For the first ionization energy for an N2 molecule, what molecular orbital is the electron removed from?
Compare the atomic and molecular orbital diagrams to identify the member of each of the following pairs that has the highest first ionization energy (the most tightly bound electron) in the gas phase:
(a) H and H2
(b) N and N2
(c) O and O2
(d) C and C2
(e) B and B2
(a) H2; (b) N2; (c) O; (d) C2; (e) B2
Which of the period 2 homonuclear diatomic molecules are predicted to be paramagnetic?
A friend tells you that the 2s orbital for fluorine starts off at a much lower energy than the 2s orbital for lithium, so the resulting σ2s molecular orbital in F2 is more stable than in Li2. Do you agree?
Yes, fluorine is a smaller atom than Li, so atoms in the 2s orbital are closer to the nucleus and more stable.
True or false: Boron contains 2s22p1 valence electrons, so only one p orbital is needed to form molecular orbitals.
What charge would be needed on F2 to generate an ion with a bond order of 2?
2+
Predict whether the MO diagram for S2 would show s-p mixing or not.
Explain why \(\ce{N2^2+}\) is diamagnetic, while \(\ce{O2^4+}\), which has the same number of valence electrons, is paramagnetic.
N2 has s-p mixing, so the π orbitals are the last filled in \(\ce{N2^2+}\). O2 does not have s-p mixing, so the σp orbital fills before the π orbitals.
Using the MO diagrams, predict the bond order for the stronger bond in each pair:
(a) B2 or \(\ce{B2+}\)
(b) F2 or \(\ce{F2+}\)
(c) O2 or \(\ce{O2^2+}\)
(d) \(\ce{C2+}\) or \(\ce{C2-}\)


