6.5: Enzimas
- Page ID
- 182113
Habilidades para desenvolver
- Descreva o papel das enzimas nas vias metabólicas
- Explicar como as enzimas funcionam como catalisadores moleculares
- Discuta a regulação de enzimas por vários fatores
Uma substância que ajuda a ocorrer uma reação química é um catalisador, e as moléculas especiais que catalisam as reações bioquímicas são chamadas de enzimas. Quase todas as enzimas são proteínas, compostas por cadeias de aminoácidos, e realizam a tarefa crítica de diminuir as energias de ativação das reações químicas dentro da célula. As enzimas fazem isso ligando-se às moléculas reagentes e mantendo-as de forma a fazer com que os processos químicos de quebra e formação de ligações ocorram mais facilmente. É importante lembrar que as enzimas não alteram o ΔG de uma reação. Em outras palavras, eles não mudam se uma reação é exergônica (espontânea) ou endergônica. Isso ocorre porque eles não alteram a energia livre dos reagentes ou produtos. Eles reduzem apenas a energia de ativação necessária para atingir o estado de transição (Figura\(\PageIndex{1}\)).
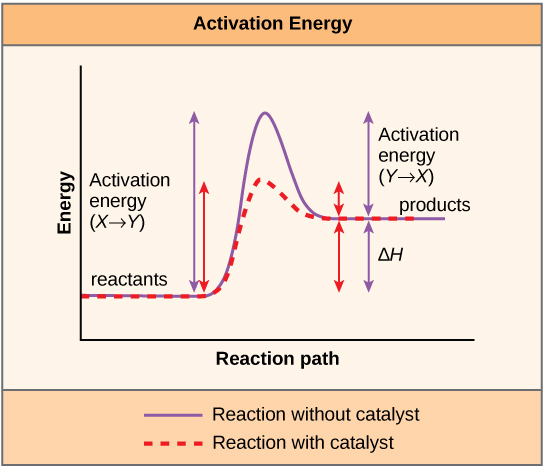
Especificidade do sítio ativo da enzima e do substrato
Os reagentes químicos aos quais uma enzima se liga são os substratos da enzima. Pode haver um ou mais substratos, dependendo da reação química específica. Em algumas reações, um substrato de reagente único é dividido em vários produtos. Em outros, dois substratos podem se unir para criar uma molécula maior. Dois reagentes também podem entrar em uma reação, ambos serem modificados e deixar a reação como dois produtos. A localização dentro da enzima onde o substrato se liga é chamada de sítio ativo da enzima. O site ativo é onde a “ação” acontece, por assim dizer. Como as enzimas são proteínas, há uma combinação única de resíduos de aminoácidos (também chamados de cadeias laterais ou grupos R) dentro do sítio ativo. Cada resíduo é caracterizado por propriedades diferentes. Os resíduos podem ser grandes ou pequenos, fracamente ácidos ou básicos, hidrofílicos ou hidrofóbicos, carregados positivamente ou negativamente ou neutros. A combinação única de resíduos de aminoácidos, suas posições, sequências, estruturas e propriedades, cria um ambiente químico muito específico dentro do sítio ativo. Esse ambiente específico é adequado para se ligar, ainda que brevemente, a um substrato químico específico (ou substratos). Devido a essa combinação semelhante a um quebra-cabeça entre uma enzima e seus substratos (que se adapta para encontrar o melhor ajuste entre o estado de transição e o sítio ativo), as enzimas são conhecidas por sua especificidade. O “melhor ajuste” resulta da forma e da atração do grupo funcional de aminoácidos pelo substrato. Existe uma enzima específica para cada substrato e, portanto, para cada reação química; no entanto, também há flexibilidade.
O fato de os locais ativos serem perfeitamente adequados para fornecer condições ambientais específicas também significa que eles estão sujeitos às influências do ambiente local. É verdade que o aumento da temperatura ambiental geralmente aumenta as taxas de reação, catalisadas por enzimas ou não. No entanto, aumentar ou diminuir a temperatura fora de uma faixa ideal pode afetar as ligações químicas dentro do local ativo, de forma que elas sejam menos adequadas para ligar substratos. As altas temperaturas acabarão por causar a desnaturalização de enzimas, como outras moléculas biológicas, um processo que altera as propriedades naturais de uma substância. Da mesma forma, o pH do ambiente local também pode afetar a função enzimática. Os resíduos de aminoácidos no local ativo têm suas próprias propriedades ácidas ou básicas que são ideais para a catálise. Esses resíduos são sensíveis a mudanças no pH que podem prejudicar a forma como as moléculas do substrato se ligam. As enzimas são adequadas para funcionar melhor dentro de uma determinada faixa de pH e, como acontece com a temperatura, valores extremos de pH (ácidos ou básicos) do ambiente podem causar a desnaturação das enzimas.
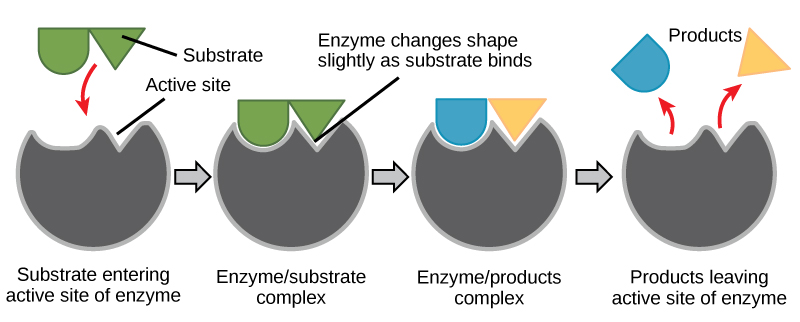
Ajuste induzido e função enzimática
Por muitos anos, os cientistas pensaram que a ligação enzima-substrato ocorria de uma forma simples, “chave e chave”. Esse modelo afirmou que a enzima e o substrato se encaixam perfeitamente em uma etapa instantânea. No entanto, a pesquisa atual apóia uma visão mais refinada chamada ajuste induzido (Figura\(\PageIndex{2}\)). O modelo de ajuste induzido expande o modelo lock-and-key ao descrever uma interação mais dinâmica entre enzima e substrato. À medida que a enzima e o substrato se unem, sua interação causa uma leve mudança na estrutura da enzima que confirma um arranjo de ligação ideal entre a enzima e o estado de transição do substrato. Essa ligação ideal maximiza a capacidade da enzima de catalisar sua reação.
Quando uma enzima se liga ao seu substrato, um complexo enzima-substrato é formado. Esse complexo reduz a energia de ativação da reação e promove sua rápida progressão de várias maneiras. Em um nível básico, as enzimas promovem reações químicas que envolvem mais de um substrato, reunindo os substratos em uma orientação ideal. A região apropriada (átomos e ligações) de uma molécula é justaposta à região apropriada da outra molécula com a qual ela deve reagir. Outra forma pela qual as enzimas promovem a reação de seus substratos é criando um ambiente ideal dentro do local ativo para que a reação ocorra. Certas reações químicas podem ocorrer melhor em um ambiente levemente ácido ou não polar. As propriedades químicas que emergem do arranjo específico de resíduos de aminoácidos em um local ativo criam o ambiente perfeito para a reação dos substratos específicos de uma enzima.
Você aprendeu que a energia de ativação necessária para muitas reações inclui a energia envolvida na manipulação ou contorção leve das ligações químicas para que elas possam se romper facilmente e permitir que outras se reformem. A ação enzimática pode auxiliar nesse processo. O complexo enzima-substrato pode diminuir a energia de ativação contorcendo as moléculas do substrato de forma a facilitar a quebra de ligações, ajudando a alcançar o estado de transição. Finalmente, as enzimas também podem diminuir as energias de ativação participando da própria reação química. Os resíduos de aminoácidos podem fornecer certos íons ou grupos químicos que realmente formam ligações covalentes com moléculas de substrato como uma etapa necessária do processo de reação. Nesses casos, é importante lembrar que a enzima sempre retornará ao seu estado original após a conclusão da reação. Uma das propriedades marcantes das enzimas é que elas permanecem, em última análise, inalteradas pelas reações que catalisam. Depois que uma enzima termina de catalisar uma reação, ela libera seu (s) produto (s).
Controle do metabolismo por meio da regulação enzimática
Parece ideal ter um cenário em que todas as enzimas codificadas no genoma de um organismo existissem em abundância e funcionassem de forma ideal em todas as condições celulares, em todas as células, em todos os momentos. Na realidade, isso está longe de ser o caso. Vários mecanismos garantem que isso não aconteça. As necessidades e condições celulares variam de célula para célula e mudam dentro de cada célula ao longo do tempo. As enzimas necessárias e as demandas energéticas das células do estômago são diferentes das células de armazenamento de gordura, células da pele, células sanguíneas e células nervosas. Além disso, uma célula digestiva trabalha muito mais para processar e decompor os nutrientes durante o tempo que segue de perto uma refeição, em comparação com muitas horas após uma refeição. Como essas demandas e condições celulares variam, o mesmo acontece com as quantidades e a funcionalidade de diferentes enzimas.
Como as taxas de reações bioquímicas são controladas pela energia de ativação e as enzimas diminuem e determinam as energias de ativação das reações químicas, as quantidades relativas e o funcionamento da variedade de enzimas dentro de uma célula determinam quais reações ocorrerão e em quais taxas. Essa determinação é rigidamente controlada. Em certos ambientes celulares, a atividade enzimática é parcialmente controlada por fatores ambientais, como pH e temperatura. Existem outros mecanismos pelos quais as células controlam a atividade das enzimas e determinam as taxas nas quais várias reações bioquímicas ocorrerão.
Regulação de enzimas por moléculas
As enzimas podem ser reguladas de forma a promover ou reduzir sua atividade. Existem muitos tipos diferentes de moléculas que inibem ou promovem a função enzimática, e existem vários mecanismos para fazer isso. Em alguns casos de inibição enzimática, por exemplo, uma molécula inibidora é semelhante o suficiente a um substrato para se ligar ao sítio ativo e simplesmente impedir a ligação do substrato. Quando isso acontece, a enzima é inibida por meio de inibição competitiva, porque uma molécula inibidora compete com o substrato pela ligação ao sítio ativo (Figura\(\PageIndex{3}\)). Por outro lado, na inibição não competitiva, uma molécula inibidora se liga à enzima em um local diferente de um sítio alostérico e ainda consegue bloquear a ligação do substrato ao sítio ativo.
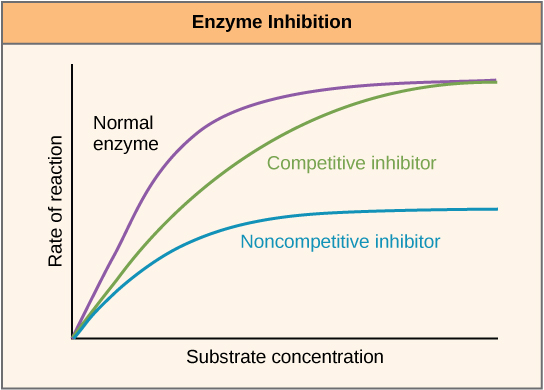
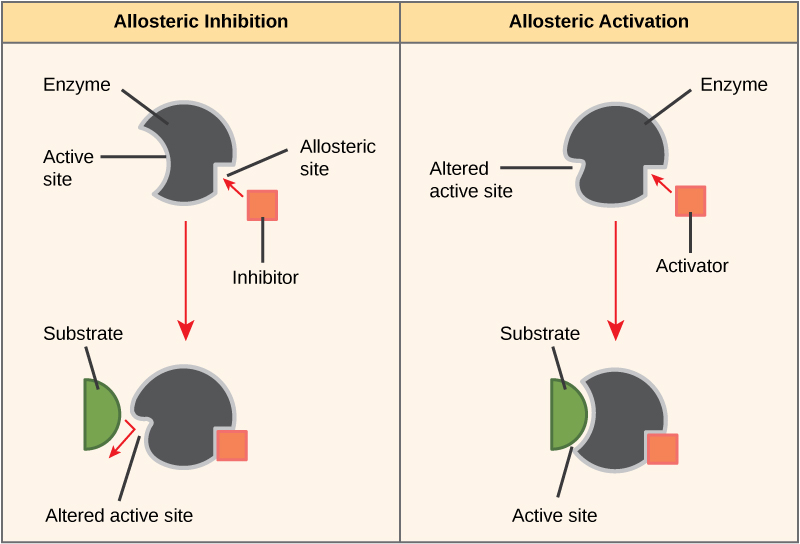
Algumas moléculas inibidoras se ligam às enzimas em um local onde sua ligação induz uma mudança conformacional que reduz a afinidade da enzima por seu substrato. Esse tipo de inibição é chamado de inibição alostérica (Figura\(\PageIndex{4}\)). A maioria das enzimas reguladas alostericamente é composta por mais de um polipeptídeo, o que significa que elas têm mais de uma subunidade proteica. Quando um inibidor alostérico se liga a uma enzima, todos os sítios ativos nas subunidades proteicas são ligeiramente alterados, de modo a ligarem seus substratos com menos eficiência. Existem ativadores alostéricos e inibidores. Os ativadores alostéricos se ligam a locais em uma enzima distantes do sítio ativo, induzindo uma mudança conformacional que aumenta a afinidade do (s) sítio (s) ativo (s) da enzima por seu (s) substrato (s).
Conexão diária: descoberta de medicamentos procurando inibidores de enzimas-chave em vias específicas

As enzimas são componentes essenciais das vias metabólicas. Entender como as enzimas funcionam e como elas podem ser reguladas é um princípio fundamental por trás do desenvolvimento de muitos dos medicamentos farmacêuticos (Figura\(\PageIndex{5}\)) no mercado atualmente. Biólogos que trabalham nesse campo colaboram com outros cientistas, geralmente químicos, para projetar medicamentos.
Considere as estatinas, por exemplo, que é o nome dado à classe de medicamentos que reduz os níveis de colesterol. Esses compostos são essencialmente inibidores da enzima HMG-CoA redutase. A HMG-CoA redutase é a enzima que sintetiza o colesterol a partir dos lipídios no corpo. Ao inibir essa enzima, os níveis de colesterol sintetizados no corpo podem ser reduzidos. Da mesma forma, o acetaminofeno, comercializado popularmente sob a marca Tylenol, é um inibidor da enzima ciclooxigenase. Embora seja eficaz no alívio da febre e da inflamação (dor), seu mecanismo de ação ainda não está completamente esclarecido.
Como os medicamentos são desenvolvidos? Um dos primeiros desafios no desenvolvimento de medicamentos é identificar a molécula específica que o medicamento deve atingir. No caso das estatinas, a HMG-CoA redutase é o medicamento alvo. Os alvos de medicamentos são identificados por meio de pesquisas meticulosas em laboratório. Identificar o alvo por si só não é suficiente; os cientistas também precisam saber como o alvo age dentro da célula e quais reações dão errado no caso de doenças. Depois que o alvo e o caminho são identificados, o processo real de design do medicamento começa. Durante esse estágio, químicos e biólogos trabalham juntos para projetar e sintetizar moléculas que podem bloquear ou ativar uma reação específica. No entanto, isso é apenas o começo: se e quando um protótipo de medicamento for bem-sucedido no desempenho de sua função, ele deverá passar por muitos testes, desde experimentos in vitro até ensaios clínicos, antes de obter a aprovação do FDA para estar no mercado.
Muitas enzimas não funcionam de forma ideal, ou mesmo de todo, a menos que estejam ligadas a outras moléculas auxiliares não proteicas específicas, seja temporariamente por meio de ligações iônicas ou de hidrogênio ou permanentemente por meio de ligações covalentes mais fortes. Dois tipos de moléculas auxiliares são cofatores e coenzimas. A ligação a essas moléculas promove a conformação e a função ideais de suas respectivas enzimas. Os cofatores são íons inorgânicos, como ferro (Fe++) e magnésio (Mg++). Um exemplo de uma enzima que requer um íon metálico como cofator é a enzima que constrói moléculas de DNA, a DNA polimerase, que requer um íon zinco ligado (Zn++) para funcionar. As coenzimas são moléculas auxiliares orgânicas, com uma estrutura atômica básica composta por carbono e hidrogênio, que são necessárias para a ação enzimática. As fontes mais comuns de coenzimas são as vitaminas dietéticas (Figura\(\PageIndex{6}\)). Algumas vitaminas são precursoras das coenzimas e outras agem diretamente como coenzimas. A vitamina C é uma coenzima para várias enzimas que participam da construção do importante componente do tecido conjuntivo, o colágeno. Um passo importante na quebra da glicose para produzir energia é a catálise por um complexo multienzimático chamado piruvato desidrogenase. A piruvato desidrogenase é um complexo de várias enzimas que, na verdade, requer um cofator (um íon magnésio) e cinco coenzimas orgânicas diferentes para catalisar sua reação química específica. Portanto, a função enzimática é, em parte, regulada por uma abundância de vários cofatores e coenzimas, que são fornecidos principalmente pelas dietas da maioria dos organismos.
Compartimentalização de enzimas
Nas células eucarióticas, moléculas como as enzimas geralmente são compartimentadas em diferentes organelas. Isso permite mais um nível de regulação da atividade enzimática. As enzimas necessárias apenas para determinados processos celulares podem ser alojadas separadamente junto com seus substratos, permitindo reações químicas mais eficientes. Exemplos desse tipo de regulação enzimática com base na localização e proximidade incluem as enzimas envolvidas nos últimos estágios da respiração celular, que ocorrem exclusivamente nas mitocôndrias, e as enzimas envolvidas na digestão de detritos celulares e materiais estranhos, localizados nos lisossomos.
Inibição de feedback nas vias metabólicas
As moléculas podem regular a função enzimática de várias maneiras. Uma grande questão permanece, no entanto: o que são essas moléculas e de onde elas vêm? Alguns são cofatores e coenzimas, íons e moléculas orgânicas, como você aprendeu. Quais outras moléculas na célula fornecem regulação enzimática, como modulação alostérica e inibição competitiva e não competitiva? A resposta é que uma grande variedade de moléculas pode desempenhar essas funções. Algumas dessas moléculas incluem drogas farmacêuticas e não farmacêuticas, toxinas e venenos do meio ambiente. Talvez as fontes mais relevantes de moléculas reguladoras de enzimas, com relação ao metabolismo celular, sejam os produtos das próprias reações metabólicas celulares. Da maneira mais eficiente e elegante, as células evoluíram para usar os produtos de suas próprias reações para inibição de feedback da atividade enzimática. A inibição do feedback envolve o uso de um produto de reação para regular sua própria produção adicional (Figura\(\PageIndex{7}\)). A célula responde à abundância de produtos específicos diminuindo a produção durante reações anabólicas ou catabólicas. Esses produtos de reação podem inibir as enzimas que catalisaram sua produção por meio dos mecanismos descritos acima.
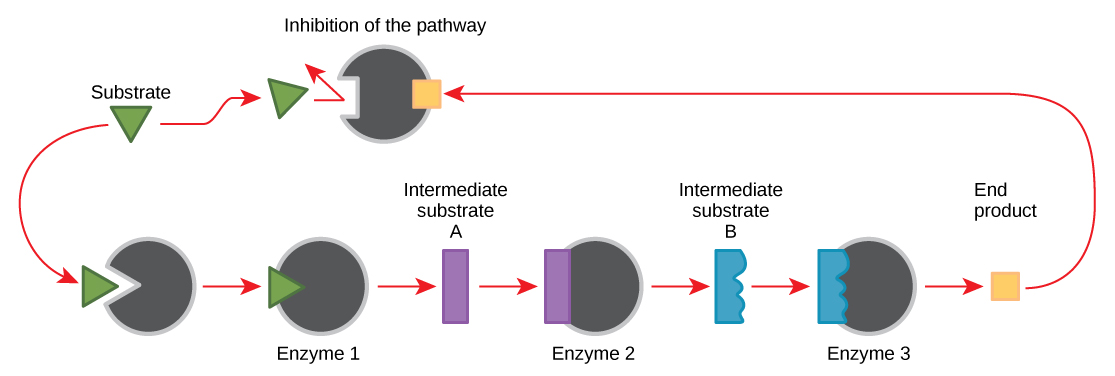
A produção de aminoácidos e nucleotídeos é controlada por meio da inibição de feedback. Além disso, o ATP é um regulador alostérico de algumas das enzimas envolvidas na decomposição catabólica do açúcar, o processo que produz o ATP. Dessa forma, quando o ATP é abundante, a célula pode impedir sua produção posterior. Lembre-se de que o ATP é uma molécula instável que pode se dissociar espontaneamente em ADP. Se muito ATP estivesse presente em uma célula, grande parte seria desperdiçada. Por outro lado, o ADP serve como um regulador alostérico positivo (um ativador alostérico) para algumas das mesmas enzimas que são inibidas pelo ATP. Assim, quando os níveis relativos de ADP são altos em comparação com o ATP, a célula é acionada para produzir mais ATP por meio do catabolismo do açúcar.
Resumo
As enzimas são catalisadores químicos que aceleram as reações químicas em temperaturas fisiológicas, diminuindo sua energia de ativação. As enzimas geralmente são proteínas que consistem em uma ou mais cadeias polipeptídicas. As enzimas têm um sítio ativo que fornece um ambiente químico único, composto por certos grupos de aminoácidos R (resíduos). Esse ambiente único é perfeitamente adequado para converter reagentes químicos específicos dessa enzima, chamados substratos, em intermediários instáveis chamados estados de transição. Acredita-se que enzimas e substratos se liguem com um ajuste induzido, o que significa que as enzimas passam por pequenos ajustes conformacionais após o contato com o substrato, levando a uma ligação completa e ideal. As enzimas se ligam aos substratos e catalisam as reações de quatro maneiras diferentes: unindo substratos em uma orientação ideal, comprometendo as estruturas de ligação dos substratos para que as ligações possam ser quebradas com mais facilidade, fornecendo condições ambientais ideais para que uma reação ocorra ou participando diretamente sua reação química formando ligações covalentes transitórias com os substratos.
A ação da enzima deve ser regulada para que, em uma determinada célula em um determinado momento, as reações desejadas sejam catalisadas e as reações indesejadas não. As enzimas são reguladas pelas condições celulares, como temperatura e pH. Eles também são regulados por sua localização dentro de uma célula, às vezes sendo compartimentados para que só possam catalisar reações sob certas circunstâncias. A inibição e ativação de enzimas por meio de outras moléculas são outras formas importantes pelas quais as enzimas são reguladas. Os inibidores podem agir de forma competitiva, não competitiva ou alostericamente; os inibidores não competitivos geralmente são alostéricos. Os ativadores também podem melhorar a função das enzimas alostericamente. O método mais comum pelo qual as células regulam as enzimas nas vias metabólicas é por meio da inibição do feedback. Durante a inibição do feedback, os produtos de uma via metabólica servem como inibidores (geralmente alostéricos) de uma ou mais das enzimas (geralmente a primeira enzima comprometida da via) envolvidas na via que as produz.
Glossário
- site ativo
- região específica da enzima à qual o substrato se liga
- inibição alostérica
- inibição por um evento de ligação em um local diferente do sítio ativo, o que induz uma mudança conformacional e reduz a afinidade da enzima por seu substrato
- coenzima
- pequena molécula orgânica, como uma vitamina ou seu derivado, necessária para aumentar a atividade de uma enzima
- cofator
- íons inorgânicos, como íons de ferro e magnésio, necessários para a regulação ideal da atividade enzimática
- inibição competitiva
- tipo de inibição em que o inibidor compete com a molécula do substrato ligando-se ao sítio ativo da enzima
- desnaturar
- processo que altera as propriedades naturais de uma substância
- inibição de feedback
- efeito de um produto de uma sequência de reação para diminuir sua produção adicional inibindo a atividade da primeira enzima na via que a produz
- ajuste induzido
- ajuste dinâmico entre a enzima e seu substrato, no qual ambos os componentes modificam suas estruturas para permitir uma ligação ideal
- substrato
- molécula na qual a enzima atua


