6.3: As leis da termodinâmica
- Page ID
- 182143
Habilidades para desenvolver
- Discuta o conceito de entropia
- Explique a primeira e a segunda leis da termodinâmica
A termodinâmica se refere ao estudo da energia e da transferência de energia envolvendo matéria física. A matéria e seu ambiente relevantes para um caso específico de transferência de energia são classificados como um sistema, e tudo fora desse sistema é chamado de ambiente. Por exemplo, ao aquecer uma panela com água no fogão, o sistema inclui o fogão, a panela e a água. A energia é transferida dentro do sistema (entre o fogão, a panela e a água). Existem dois tipos de sistemas: abertos e fechados. Um sistema aberto é aquele em que a energia pode ser transferida entre o sistema e seus arredores. O sistema do fogão está aberto porque o calor pode ser perdido no ar. Um sistema fechado é aquele que não consegue transferir energia para o ambiente.
Organismos biológicos são sistemas abertos. A energia é trocada entre eles e seus arredores, pois eles consomem moléculas que armazenam energia e liberam energia para o meio ambiente fazendo o trabalho. Como todas as coisas no mundo físico, a energia está sujeita às leis da física. As leis da termodinâmica governam a transferência de energia dentro e entre todos os sistemas do universo.
A Primeira Lei da Termodinâmica
A primeira lei da termodinâmica trata da quantidade total de energia no universo. Ele afirma que essa quantidade total de energia é constante. Em outras palavras, sempre houve, e sempre haverá, exatamente a mesma quantidade de energia no universo. A energia existe em muitas formas diferentes. De acordo com a primeira lei da termodinâmica, a energia pode ser transferida de um lugar para outro ou transformada em formas diferentes, mas não pode ser criada ou destruída. As transferências e transformações de energia ocorrem ao nosso redor o tempo todo. As lâmpadas transformam energia elétrica em energia luminosa. Os fogões a gás transformam a energia química do gás natural em energia térmica. As plantas realizam uma das transformações energéticas mais biologicamente úteis na Terra: a de converter a energia da luz solar na energia química armazenada nas moléculas orgânicas (Figura 2.3.b.1). Alguns exemplos de transformações de energia são mostrados na Figura\(\PageIndex{1}\).
O desafio para todos os organismos vivos é obter energia do ambiente em formas que eles possam transferir ou transformar em energia utilizável para trabalhar. As células vivas evoluíram para enfrentar muito bem esse desafio. A energia química armazenada em moléculas orgânicas, como açúcares e gorduras, é transformada por meio de uma série de reações químicas celulares em energia dentro das moléculas de ATP. A energia nas moléculas de ATP é facilmente acessível para fazer o trabalho. Exemplos dos tipos de trabalho que as células precisam fazer incluem construir moléculas complexas, transportar materiais, impulsionar o movimento de batimento dos cílios ou flagelos, contrair fibras musculares para criar movimento e reprodução.

A Segunda Lei da Termodinâmica
As principais tarefas de uma célula viva de obter, transformar e usar energia para trabalhar podem parecer simples. No entanto, a segunda lei da termodinâmica explica por que essas tarefas são mais difíceis do que parecem. Nenhuma das transferências de energia que discutimos, junto com todas as transferências e transformações de energia no universo, é completamente eficiente. Em cada transferência de energia, uma certa quantidade de energia é perdida de uma forma inutilizável. Na maioria dos casos, essa forma é energia térmica. Termodinamicamente, a energia térmica é definida como a energia transferida de um sistema para outro que não está funcionando. Por exemplo, quando um avião voa pelo ar, parte da energia do avião voador é perdida como energia térmica devido ao atrito com o ar circundante. Esse atrito realmente aquece o ar aumentando temporariamente a velocidade das moléculas de ar. Da mesma forma, parte da energia é perdida como energia térmica durante as reações metabólicas celulares. Isso é bom para criaturas de sangue quente como nós, porque a energia térmica ajuda a manter a temperatura corporal. Estritamente falando, nenhuma transferência de energia é totalmente eficiente, porque parte da energia é perdida de forma inutilizável.
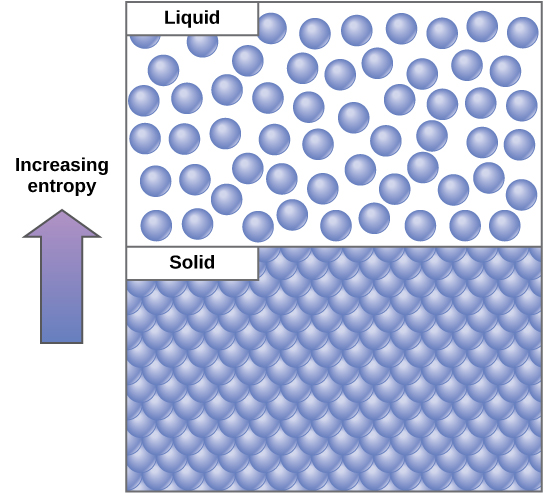
Um conceito importante em sistemas físicos é o de ordem e desordem (também conhecido como aleatoriedade). Quanto mais energia é perdida por um sistema em seu entorno, menos ordenado e mais aleatório é o sistema. Os cientistas se referem à medida da aleatoriedade ou desordem dentro de um sistema como entropia. Alta entropia significa alta desordem e baixa energia (Figura\(\PageIndex{2}\)). Para entender melhor a entropia, pense no quarto de um estudante. Se nenhuma energia ou trabalho fosse investido nela, a sala rapidamente ficaria bagunçada. Ela existiria em um estado muito desordenado, de alta entropia. A energia deve ser colocada no sistema, na forma de o aluno trabalhar e guardar tudo, a fim de trazer a sala de volta ao estado de limpeza e ordem. Esse estado é de baixa entropia. Da mesma forma, um carro ou casa deve ser constantemente mantido com o trabalho para mantê-lo em um estado ordenado. Sozinha, a entropia da casa ou do carro aumenta gradualmente com a ferrugem e a degradação. Moléculas e reações químicas também têm quantidades variáveis de entropia. Por exemplo, à medida que as reações químicas atingem um estado de equilíbrio, a entropia aumenta e, à medida que as moléculas em alta concentração em um local se difundem e se espalham, a entropia também aumenta.
Conexão científica: transferência de energia e a entropia resultante
Configure um experimento simples para entender como a energia é transferida e como resulta uma mudança na entropia.
- Pegue um bloco de gelo. Isso é água na forma sólida, por isso tem uma alta ordem estrutural. Isso significa que as moléculas não podem se mover muito e estão em uma posição fixa. A temperatura do gelo é de 0°C. Como resultado, a entropia do sistema é baixa.
- Deixe o gelo derreter em temperatura ambiente. Qual é o estado das moléculas na água líquida agora? Como ocorreu a transferência de energia? A entropia do sistema é maior ou menor? Por quê?
- Aqueça a água até o ponto de ebulição. O que acontece com a entropia do sistema quando a água é aquecida?
Todos os sistemas físicos podem ser pensados desta forma: os seres vivos são altamente ordenados, exigindo uma entrada constante de energia para serem mantidos em um estado de baixa entropia. À medida que os sistemas vivos absorvem moléculas que armazenam energia e as transformam por meio de reações químicas, eles perdem uma certa quantidade de energia utilizável no processo, porque nenhuma reação é totalmente eficiente. Eles também produzem resíduos e subprodutos que não são fontes de energia úteis. Esse processo aumenta a entropia dos arredores do sistema. Como todas as transferências de energia resultam na perda de alguma energia utilizável, a segunda lei da termodinâmica afirma que toda transferência ou transformação de energia aumenta a entropia do universo. Embora os seres vivos sejam altamente ordenados e mantenham um estado de baixa entropia, a entropia total do universo está aumentando constantemente devido à perda de energia utilizável a cada transferência de energia que ocorre. Essencialmente, os seres vivos estão em uma batalha contínua e árdua contra esse aumento constante na entropia universal.
Resumo
Ao estudar energia, os cientistas usam o termo “sistema” para se referir à matéria e seu ambiente envolvidos nas transferências de energia. Tudo fora do sistema é chamado de ambiente. Células únicas são sistemas biológicos. Os sistemas podem ser considerados como tendo uma certa quantidade de pedidos. É preciso energia para tornar um sistema mais organizado. Quanto mais ordenado for um sistema, menor será sua entropia. A entropia é uma medida da desordem de um sistema. À medida que um sistema se torna mais desordenado, menor a energia e maior a entropia.
Uma série de leis, chamadas leis da termodinâmica, descrevem as propriedades e os processos de transferência de energia. A primeira lei afirma que a quantidade total de energia no universo é constante. Isso significa que a energia não pode ser criada ou destruída, apenas transferida ou transformada. A segunda lei da termodinâmica afirma que toda transferência de energia envolve alguma perda de energia em uma forma inutilizável, como energia térmica, resultando em um sistema mais desordenado. Em outras palavras, nenhuma transferência de energia é completamente eficiente e tende à desordem.
Glossário
- entropia (S)
- medida de aleatoriedade ou desordem dentro de um sistema
- calor
- energia transferida de um sistema para outro que não funciona (energia do movimento de moléculas ou partículas)
- termodinâmica
- estudo da energia e transferência de energia envolvendo matéria física


