3.A: A Primeira Lei da Termodinâmica (Resposta)
- Page ID
- 184520
Verifique sua compreensão
3.1. \(\displaystyle p_2(V_2−V_1)\)
3.2. Linha 1,\(\displaystyle ΔE_{int}=40J\);
linha 2\(\displaystyle W=50J\) e\(\displaystyle ΔE_{int}=40J\);
linha 3,\(\displaystyle Q=80J\) e\(\displaystyle ΔE_{int}=40J\); e
linha 4\(\displaystyle Q=0\) e\(\displaystyle ΔE_{int}=40J\)
3.3. Para que o processo seja representado pela curva\(\displaystyle p=nRT/V\) no gráfico de pV para a avaliação do trabalho.
3.4. \(\displaystyle 1.26×10-^3J\).
Perguntas conceituais
1. a. SE; b. ES; c. ES
3. Parte da energia é usada para transformar a fase do líquido em gás.
5. Sim, desde que o trabalho realizado seja igual ao calor adicionado, não haverá mudança na energia interna e, portanto, nenhuma mudança na temperatura. Quando a água congela ou quando o gelo derrete ao remover ou adicionar calor, respectivamente, a temperatura permanece constante.
7. Se mais trabalho for feito no sistema do que o calor adicionado, a energia interna do sistema realmente diminuirá.
9. O sistema deve estar em contato com uma fonte de calor que permita que o calor flua para o sistema.
11. Os processos isotérmicos devem ser lentos para garantir que, à medida que o calor é transferido, a temperatura não mude. Mesmo para processos isobáricos e isocóricos, o sistema deve estar em equilíbrio térmico com mudanças lentas das variáveis termodinâmicas.
13. Normalmente\(\displaystyle C_p\) é maior do que\(\displaystyle C_V\) porque quando a expansão ocorre sob pressão constante, ela funciona nos arredores. Portanto, o calor pode entrar em energia interna e funcionar. Sob volume constante, todo o calor entra em energia interna. Neste exemplo, a água se contrai durante o aquecimento, portanto, se adicionarmos calor a pressão constante, o trabalho é feito na água pelo ambiente e, portanto,\(\displaystyle C_p\) é menor que\(\displaystyle C_V\).
15. Não, é sempre maior que 1.
17. Um processo adiabático tem uma mudança de temperatura, mas não há fluxo de calor. O processo isotérmico não tem mudança de temperatura, mas tem fluxo de calor.
Problemas
19. \(\displaystyle p(V−b)=−c_T\)é a escala de temperatura desejada e reflete o gás ideal se estiver sob volume constante.
21. \(\displaystyle V−bpT+cT^2=0\)
23. 74 K
25. 1,4 vezes
27. PvLN (4)
29. a. 160 J; b. —160 J
31. \(\displaystyle W=900J\)
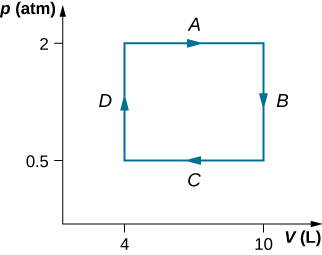
33. \(\displaystyle 3.53×10^4J\)
35. a. 1:1;
b. 10:1
37. a. 600 J;
b. 0;
c. 500 J;
d. 200 J;
e. 800 J;
f. 500 J
39. 580 J
41. a. 600 J;
b. 600 J;
c. 800 J
43. a. 0;
b. 160 J;
c. —160 J
45. a. 150 J;
b. 700 J
47. Nenhum trabalho é feito e eles atingem a mesma temperatura comum.
49. 54.500 J
51. uma\(\displaystyle (p_1+3V^2_1)(V_2−V_1)−3V_1(V^2_2−V^2_1)+(V^3_2−V^3_1)\);.
b.\(\displaystyle \frac{3}{2}(p_2V_2−p_1V_1)\);
c. a soma das partes (a) e (b); d.\(\displaystyle T_1=\frac{p_1V_1}{nR}\) e\(\displaystyle T_2=\frac{p_2V_2}{nR}\)
53. uma.
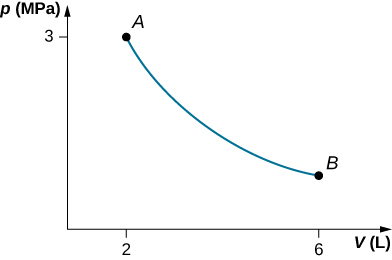
b.\(\displaystyle W=4.39kJ,ΔE_{int}=−4.39kJ\)
55. a. 1660 J;
b. −2730 J;
c. Não depende do processo.
57. a. 700 J;
b. 500 J
59. a. −3 400 J;
b. 3400 J entra no gás
61. 100 J
63. a. 370 J;
b. 100 J;
c. 500 J
65. 850 J
67. pressão diminuída em 0,31 vezes a pressão original
69. \(\displaystyle γ=0.713\)
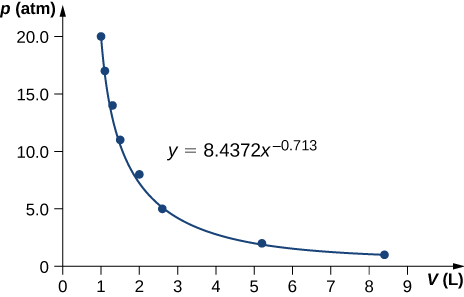
71. 84 KG
73. Uma expansão adiabática tem menos trabalho realizado e nenhum fluxo de calor, portanto, uma energia interna menor em comparação com uma expansão isotérmica que tem fluxo de calor e trabalho realizado. A temperatura diminui durante a expansão adiabática.
75. A isotérmica tem uma pressão final maior e não depende do tipo de gás.
77.
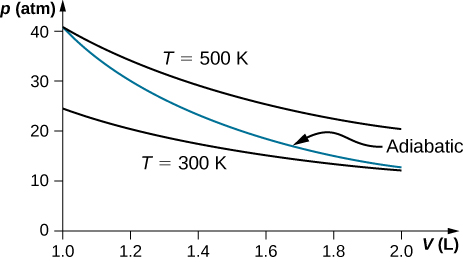
Problemas adicionais
79. uma.\(\displaystyle W_{AB}=0,W_{BC}=2026J,W_{AD}=810.4J,W_{DC}=0;\)
b.\(\displaystyle ΔE_{AB}=3600J,ΔE_{BC}=374J\);
c.\(\displaystyle ΔE_{AC}=3974J\);
d.\(\displaystyle Q_{ADC}=4784J\);.
e. Não, porque foi adicionado calor para ambas as partes AD e DC. Não há informações suficientes para descobrir quanto custa cada segmento do caminho.
81. 300 J
83. a. 59,5 J;
b. 170 N
85. \(\displaystyle 2.4×10^3J\)
87. a. 15.000 J;
b. 10.000 J;
c. 25.000 J
89. 78 J
91. Um cilindro contendo três moles de gás nitrogênio é aquecido a uma pressão constante de 2 atm. a. −1220 J; b. +1220 J
93. a. 7,6 L, 61,6 K;
b. 81,3 K;
c.\(\displaystyle 3.63L⋅atm=367J\);
d. −367 J
Problemas de desafio
95. a. 1700 J; b. 1200 J; c. 2400 J
97. a. 2,2 mol;
b.\(\displaystyle V_A=6.7×10^{−2}m^3, V_B=3.3×10^{−2}m^3\);
c.\(\displaystyle T_A=2400K,T_B=397K\); d. 26.000 J


