31.3: Subestrutura do Núcleo
- Page ID
- 194589
Objetivos de
Ao final desta seção, você poderá:
- Defina e discuta o núcleo em um átomo.
- Defina o número atômico.
- Defina e discuta isótopos.
- Calcule a densidade do núcleo.
- Explique a força nuclear.
O que há dentro do núcleo? Por que alguns núcleos são estáveis enquanto outros decaem? (Figura\(\PageIndex{1}\)) Por que existem diferentes tipos de decaimento (\(\alpha\),\(\beta\) e\(\gamma\))? Por que as energias de decaimento nuclear são tão grandes? Buscar questões naturais como essas levou a descobertas muito mais fundamentais do que você imagina.

Já identificamos os prótons como as partículas que carregam carga positiva nos núcleos. No entanto, na verdade, existem dois tipos de partículas nos núcleos - o próton e o nêutron, chamados coletivamente de nucleons, os constituintes dos núcleos. Como o próprio nome indica, o nêutron é uma partícula neutra (\(q = 0\)) que tem quase a mesma massa e rotação intrínseca do próton. A tabela\(\PageIndex{1}\) compara as massas de prótons, nêutrons e elétrons. Observe a proximidade das massas de prótons e nêutrons, mas o nêutron fica um pouco mais massivo quando você olha além do terceiro dígito. Ambos os nucleons são muito mais massivos do que um elétron. De fato,\(m_p = 1836 \, m_e\) (conforme observado em Aplicações Médicas da Física Nuclear\(m_n = 1839 \, m_e\) e.
| Partícula | Símbolo | kg | u | \(MeVc^2\) |
|---|---|---|---|---|
| Próton | p | \(1.67262 \times 10^{-27}\) | 1.007276 | \ (MeVC^2\) ">938,27 |
| Nêutron | n | \(1.67493 \times 10^{-27}\) | 1,008665 | \ (MeVC^2\) ">939,57 |
| Elétron | e | \(9.1094 \times 10^{-31}\) | 0,005 4858 | \ (MeVc^2\) ">0,51 |
A tabela\(\PageIndex{1}\) também fornece massas em termos de unidades de massa que são mais convenientes do que quilogramas na escala atômica e nuclear. A primeira delas é a unidade de massa atômica unificada (u), definida como
\[1 \, u = 1.6605 \times 10^{-27} \, kg\]
Esta unidade é definida para que um\(^{12}C\) átomo de carbono neutro tenha uma massa de exatamente 12 u. As massas também são expressas em unidades de\(MeV/c^2\). Essas unidades são muito convenientes quando se considera a conversão de massa em energia (e vice-versa), como é tão proeminente nos processos nucleares. Usando unidades\(E = mc^3\) de\(m\) in,\(MeV/c^2\) descobrimos que\(c^2\) cancelam e\(E\) saem convenientemente no MeV. Por exemplo, se a massa restante de um próton for totalmente convertida em energia, então
\[E = mc^2 = (938.27 \, MeV/c^2)c^2 = 938.27 \, MeV.\]
É útil observar que 1 u de massa convertida em energia produz 931,5 MeV, ou
\[1 \, u = 031.5 \, MeV/c^2.\]
Todas as propriedades de um núcleo são determinadas pelo número de prótons e nêutrons que ele possui. Uma combinação específica de prótons e nêutrons é chamada de nuclídeo e é um núcleo único. A seguinte notação é usada para representar um nuclídeo específico:
\[_Z^AX_N,\]
onde os símbolos\(A, \, X, \, Z\) e\(N\) são definidos da seguinte forma: O número de prótons em um núcleo é o número atômico\(Z\), conforme definido em Aplicações Médicas da Física Nuclear. X é o símbolo do elemento, como Ca para cálcio. No entanto, uma vez\(Z\) conhecido, o elemento é conhecido; portanto,\(Z\) e\(X\) são redundantes. Por exemplo,\(Z = 20\) é sempre cálcio, e o cálcio sempre foi\(Z = 20\). \(N\)é o número de nêutrons em um núcleo. Na notação de um nuclídeo, o subscrito geralmente\(N\) é omitido. O símbolo\(A\) é definido como o número de nucleons ou o número total de prótons e nêutrons,
\[A = N + Z,\]
onde também\(A\) é chamado de número de massa. Esse nome\(A\) é lógico; a massa de um átomo é quase igual à massa de seu núcleo, já que os elétrons têm tão pouca massa. A massa do núcleo acaba sendo quase igual à soma das massas dos prótons e nêutrons nele, o que é proporcional\(A\) a. Nesse contexto, é particularmente conveniente expressar massas em unidades de u. Tanto prótons quanto nêutrons têm massas próximas a 1 u e, portanto, a massa de um átomo está próxima de\(A\) u. Por exemplo, em um núcleo de oxigênio com oito prótons e oito nêutrons\(A = 16\), e sua massa é 16 u. Como observado, o unidade de massa atômica unificada é definida de forma que um átomo de carbono neutro (na verdade, um\(^{12}C\) átomo) tenha uma massa de exatamente 12 u. O carbono foi escolhido como padrão, em parte devido à sua importância na química orgânica (ver Apêndice A).
Vejamos alguns exemplos de nuclídeos expressos na\(_A^ZX_N\) notação. O núcleo do átomo mais simples, hidrogênio, é um único próton, ou\(_1^1H_2\) (o zero para nenhum nêutron é frequentemente omitido). Para verificar esse símbolo, consulte a tabela periódica — você vê que o número atômico\(Z\) de hidrogênio é 1. Como você percebe que não há nêutrons, o número da massa também\(A\) é 1. Suponha que você seja informado de que o núcleo ou\(\alpha\) partícula de hélio tem dois prótons e dois nêutrons. Você pode então ver que está escrito\(_2^4He_2\). Existe uma forma escassa de hidrogênio encontrada na natureza chamada deutério; seu núcleo tem um próton e um nêutron e, portanto, o dobro da massa do hidrogênio comum. O símbolo do deutério é, portanto,\(_1^2H_1\) (às vezes\(D\) é usado, como para a água deuterada\(D_2O\)). Uma forma ainda mais rara - e radioativa - de hidrogênio é chamada de trítio, pois tem um único próton e dois nêutrons, e está escrito\(_1^3H_2\). Essas três variedades de hidrogênio têm química quase idêntica, mas os núcleos diferem muito em massa, estabilidade e outras características. Núcleos (como os de hidrogênio) com\(N\) s iguais\(Z\) e diferentes são definidos como isótopos do mesmo elemento.
Há alguma redundância nos símbolos\(A, \, X, \, Z,\)\(N\) e. Se o elemento\(X\) for conhecido, então\(Z\) pode ser encontrado em uma tabela periódica e é sempre o mesmo para um determinado elemento. Se ambos\(A\) e\(X\) forem conhecidos, então também\(N\) podem ser determinados (primeiro encontre\(Z\); depois,\(N = A - Z\)). Assim, a notação mais simples para nuclídeos é
\[^AX,\]
o que é suficiente e é mais comumente usado. Por exemplo, nesta notação mais simples, os três isótopos de hidrogênio são\(^1H, \, ^2H\) e\(^3H\) enquanto a\(\alpha\) partícula -é\(^4He\). Lemos isso de trás para frente, dizendo hélio-4 para\(^4He\), ou urânio-238 para\(^{238}U\). Então, se precisarmos saber, podemos determinar isso\(Z = 92\) para o urânio a partir da tabela periódica e, portanto,\(N = 238 - 92 = 146\).\(^{238}U\)
Uma variedade de experimentos indica que um núcleo se comporta como uma bola de nucleons bem compactada, conforme ilustrado na Figura. Esses núcleons têm grandes energias cinéticas e, portanto, se movem rapidamente em contato muito próximo. Os nucleons podem ser separados por uma grande força, como em uma colisão com outro núcleo, mas resistem fortemente a serem empurrados para mais perto. A evidência mais convincente de que os nucleons estão bem compactados em um núcleo é que o raio de um núcleo,\(r\) é encontrado para ser dado aproximadamente por
\[r = r_0A^{1/3},\]onde\(r_0 = 1.2 \, fm\) e\(A\) é o número de massa do núcleo. Observe isso\(r^3 \propto A\). Como muitos núcleos são esféricos e o volume de uma esfera é\(V = (4/3)\pi r^3\), vemos que\(V \propto A\), ou seja, o volume de um núcleo é proporcional ao número de nucleons nele. Isso é o que aconteceria se você empacotasse os nucleons tão próximos que não houvesse espaço vazio entre eles.

Os nucleons são mantidos juntos pelas forças nucleares e resistem a serem separados e empurrados um para dentro do outro. O volume do núcleo é a soma dos volumes dos nucleons nele, aqui mostrados em cores diferentes para representar prótons e nêutrons.
Exemplo\(\PageIndex{1}\): How Small and Dense Is a Nucleus?
- Encontre o raio de um núcleo de ferro-56.
- Encontre sua densidade aproximada em\(kg/m^3\), aproximando\(^{56}Fe\) a massa de 56 u.
Estratégia e conceito
- Encontrar o raio de\(^{56}Fe\) é uma aplicação direta de\(r = r_0A^{1/3}\), dado\(A = 56\).
- Para encontrar a densidade aproximada, assumimos que o núcleo é esférico (este na verdade é), calculamos seu volume usando o raio encontrado na parte (a) e, em seguida, calculamos sua densidade a partir de\(\rho = m/V\). Finalmente, precisaremos converter a densidade de unidades de\(u/fm^3\) para\(kg/m^3\)
Solução
(a) O raio de um núcleo é dado por\[r = r_0A^{1/3}.\nonumber\]
Substituindo os valores\(r_0\) e os\(A\) rendimentos
\[r = (1.2 \, fm)(56)^{1/3} = (1.2 \, fm)(3.83) = 4.6 \, fm.\nonumber\]
(b) A densidade é definida como sendo\(\rho = m/V\), que para uma esfera de raio\(r\) é
\[\rho = \dfrac{m}{V} = \dfrac{m}{(4/3)\pi r^3}. \nonumber\]
Convertendo em unidades de\(kg/m^3\), encontramos
\[ \begin{align*} \rho &= (0.138 \, u/fm^3)(1.66 \times 10^{-27} \, kg/u)\left(\dfrac{1 \, fm}{10^{-15} \, m}\right) \\[5pt] &= 2.3 \times 10^{17} \, kg/m^3. \end{align*} \]
Discussão
- O raio desse núcleo de tamanho médio é de aproximadamente 4,6 fm e, portanto, seu diâmetro é de cerca de 10 fm, ou\(10^{-14} \, m\). Em nossa discussão sobre a descoberta do núcleo por Rutherford, notamos que ele tem cerca\(10^{-15} \, m\) de diâmetro (que é para núcleos mais leves), consistente com esse resultado em uma ordem de magnitude. O núcleo tem um diâmetro muito menor do que o átomo típico, que tem um diâmetro da ordem de\(10^{-10} \, m\).
- A densidade encontrada aqui é tão grande que causa descrença. É consistente com discussões anteriores que tivemos sobre o núcleo ser muito pequeno e conter quase toda a massa do átomo. As densidades nucleares, como as encontradas aqui, são cerca de\(2 \times 10^{14}\) vezes maiores que as da água, que tem uma densidade de “apenas”\(10^3 \, kg/m^3\). Um metro cúbico de matéria nuclear, como o encontrado em uma estrela de nêutrons, tem a mesma massa de um cubo de água de 61 km de lado.
Forças nucleares e estabilidade
Quais forças mantêm um núcleo unido? O núcleo é muito pequeno e seus prótons, sendo positivos, exercem tremendas forças repulsivas uns sobre os outros. (A força de Coulomb aumenta à medida que as cargas se aproximam, pois é proporcional a\(1/r^2\), mesmo nas pequenas distâncias encontradas nos núcleos.) A resposta é que duas forças até então desconhecidas mantêm o núcleo unido e o transformam em uma bola compacta de nucleons. Essas forças são chamadas de forças nucleares fracas e fortes. As forças nucleares têm um alcance tão curto que caem para zero quando os nucleons são separados por apenas alguns fm. No entanto, como a cola, eles são fortemente atraídos quando os nucleons se aproximam um do outro. A força nuclear forte é cerca de 100 vezes mais atraente do que a repulsiva força EM, mantendo facilmente os nucleons juntos. As forças nucleares se tornam extremamente repulsivas se os nucleons se aproximam demais, fazendo com que os nucleons resistam fortemente a serem empurrados um para dentro do outro, algo como rolamentos de esferas.
O fato de as forças nucleares serem muito fortes é responsável pelas energias muito grandes emitidas na decadência nuclear. Durante a decadência, as forças funcionam e, como o trabalho é força vezes a distância (\(W = Fd \, cos \, \theta\)), uma força grande pode resultar em uma grande energia emitida. Na verdade, sabemos que existem duas forças nucleares distintas por causa dos diferentes tipos de decaimento nuclear: a força nuclear forte é responsável pela decomposição, enquanto a força nuclear fraca é responsável pela\(\beta\) decomposição.
Os muitos núcleos estáveis e instáveis que exploramos, e as centenas que não discutimos, podem ser organizados em uma tabela chamada gráfico dos nuclídeos, cuja versão simplificada é mostrada na Figura\(\PageIndex{3}\). Os nuclídeos estão localizados em um gráfico de\(N\) versus\(Z\). O exame de um gráfico detalhado dos nuclídeos revela padrões nas características dos núcleos, como estabilidade, abundância e tipos de decaimento, análogos, mas mais complexos do que a sistemática na tabela periódica dos elementos.
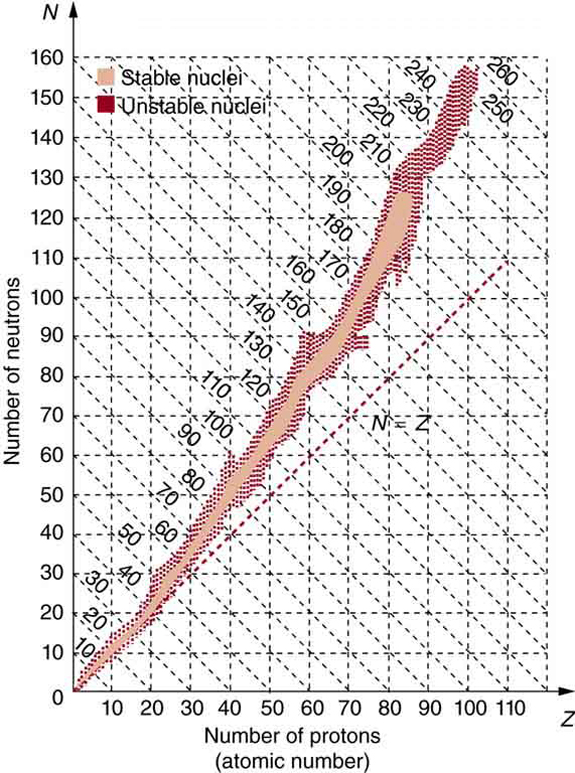
Em princípio, um núcleo pode ter qualquer combinação de prótons e nêutrons, mas a Figura\(\PageIndex{3}\) mostra um padrão definido para aqueles que são estáveis. Para núcleos de baixa massa, há uma forte tendência de\(N\) e\(Z\) para serem quase iguais. Isso significa que a força nuclear é mais atraente quando\(N = Z\). Um exame mais detalhado revela maior estabilidade quando\(N\) e\(Z\) são números pares — as forças nucleares são mais atraentes quando nêutrons e prótons estão em pares. Para massas cada vez maiores, há progressivamente mais nêutrons do que prótons em núcleos estáveis. Isso se deve à crescente repulsão entre prótons. Como as forças nucleares são de curto alcance e a força de Coulomb é de longo alcance, um excesso de nêutrons mantém os prótons um pouco mais afastados, reduzindo a repulsão de Coulomb. Os modos de decaimento de nuclídeos fora da região de estabilidade produzem consistentemente nuclídeos mais próximos da região de estabilidade. Existem núcleos mais estáveis com certos números de prótons e nêutrons, chamados números mágicos. Os números mágicos indicam uma estrutura de concha para o núcleo na qual as conchas fechadas são mais estáveis. A teoria da concha nuclear tem sido muito bem-sucedida em explicar os níveis de energia nuclear, a decadência nuclear e a maior estabilidade dos núcleos com camadas fechadas. Produzimos elementos transurânicos cada vez mais pesados desde o início da década de 1940 e agora produzimos o elemento com\(Z = 118\). Existem previsões teóricas de uma ilha de relativa estabilidade para núcleos com tão altos\(Z\) s.

Resumo
- Duas partículas, ambas chamadas de nucleons, são encontradas dentro dos núcleos. Os dois tipos de nucleons são prótons e nêutrons; eles são muito semelhantes, exceto que o próton tem carga positiva enquanto o nêutron é neutro. Algumas de suas características são dadas na Tabela\(\PageIndex{3}\) e comparadas com as do elétron. Uma unidade de massa conveniente para processos atômicos e nucleares é a unidade unificada de massa atômica (u), definida como\[1 \, u = 1.6605 \times 10^{-27} \, kg = 931.46 \, MeV/c^2.\]
- Um nuclídeo é uma combinação específica de prótons e nêutrons, denotada por\[_Z^AX_N \, or \, simply \, ^AX,\]
- \(Z\)é o número de prótons ou número atômico, X é o símbolo do elemento,\(N\), é o número de nêutrons e\(A\) é o número de massa ou o número total de prótons e nêutrons,\[A = N + Z.\]
- Nuclídeos com o mesmo\(Z\), mas diferentes,\(N\) são isótopos do mesmo elemento.
- O raio de um núcleo,\(r\), é aproximadamente\[r = r_0A^{1/3},\] onde\(r_0 = 1.2 \, fm\). Os volumes nucleares são proporcionais\(A\) a. Existem duas forças nucleares, a fraca e a forte. A sistemática da estabilidade nuclear vista no gráfico dos nuclídeos indica que há fechamentos de conchas nos núcleos para valores\(N\) iguais\(Z\) e iguais aos números mágicos, que correspondem a núcleos altamente estáveis.
Glossário
- massa atômica
- a massa total dos prótons, nêutrons e elétrons em um único átomo
- número atômico
- número de prótons em um núcleo
- gráfico dos nuclídeos
- uma tabela com núcleos estáveis e instáveis
- isótopos
- núcleos com os mesmos\(Z\) e diferentes\(N\) s
- números mágicos
- um número que indica uma estrutura de concha para o núcleo na qual as conchas fechadas são mais estáveis
- número de massa
- número de nucleons em um núcleo
- nêutron
- uma partícula neutra encontrada em um núcleo
- nucleons
- as partículas encontradas dentro dos núcleos
- núcleo
- uma região que consiste em prótons e nêutrons no centro de um átomo
- nuclídeo
- um tipo de átomo cujo núcleo tem números específicos de prótons e nêutrons
- prótons
- os nucleons carregados positivamente encontrados em um núcleo
- raio de um núcleo
- o raio de um núcleo é\(r = r_0 A^{1/3}\)


