14.3: Criação seletiva e engenharia genética
- Page ID
- 172543
O desenvolvimento de uma nova variedade de cultivo é um exemplo de biotecnologia agrícola, uma variedade de ferramentas que incluem técnicas tradicionais de criação e métodos laboratoriais mais modernos. Os métodos tradicionais datam de milhares de anos, enquanto a biotecnologia usa as ferramentas da engenharia genética desenvolvidas nas últimas décadas.
Reprodução seletiva (seleção artificial)
Quase todas as frutas e vegetais encontrados no mercado local não ocorreriam naturalmente. Na verdade, eles existem apenas por causa da intervenção humana que começou há milhares de anos. Os humanos criaram a grande maioria das espécies cultivadas usando práticas tradicionais de reprodução em plantas silvestres que ocorrem naturalmente. Essas práticas dependem da reprodução seletiva (seleção artificial), reprodução facilitada pelo homem de indivíduos com características desejáveis. Por exemplo, variedades de alto rendimento foram produzidas por meio de reprodução seletiva. As práticas tradicionais de reprodução, embora de baixa tecnologia e simples de realizar, têm o resultado prático de modificar a informação genética de um organismo, produzindo assim novas características.
A reprodução seletiva é limitada, no entanto, pelo ciclo de vida da planta e pelas variantes genéticas que estão naturalmente presentes. Por exemplo, mesmo a variedade de milho com floração mais rápida tem um tempo de geração de 60 dias (o tempo necessário para uma semente germinar, produzir uma planta madura, ser polinizada e, finalmente, produzir mais sementes) em condições perfeitas. Cada geração oferece a oportunidade de criar plantas individuais seletivamente e gerar sementes um pouco mais próximas do resultado desejado (por exemplo, produzir grãos maiores e mais suculentos). Além disso, se nenhum indivíduo possuir variantes genéticas que resultam em grãos maiores e mais suculentos, não é possível selecionar artificialmente essa característica. Finalmente, a criação tradicional mistura todos os genes entre os dois indivíduos que estão sendo criados, o que pode chegar a dezenas de milhares (o milho, por exemplo, tem 32.000 genes). Ao misturar um número tão grande de genes, os resultados podem ser imprevisíveis.
Um exemplo interessante é o milho (milho). Biólogos descobriram que o milho foi desenvolvido a partir de uma planta selvagem chamada teosinto. Por meio de práticas tradicionais de reprodução, os humanos que viviam há milhares de anos no que hoje é o sul do México começaram a selecionar características desejáveis até conseguirem transformar a planta no que hoje é conhecido como milho (figura\(\PageIndex{a}\)). Ao fazer isso, eles alteraram permanentemente (e sem saber) suas instruções genéticas.
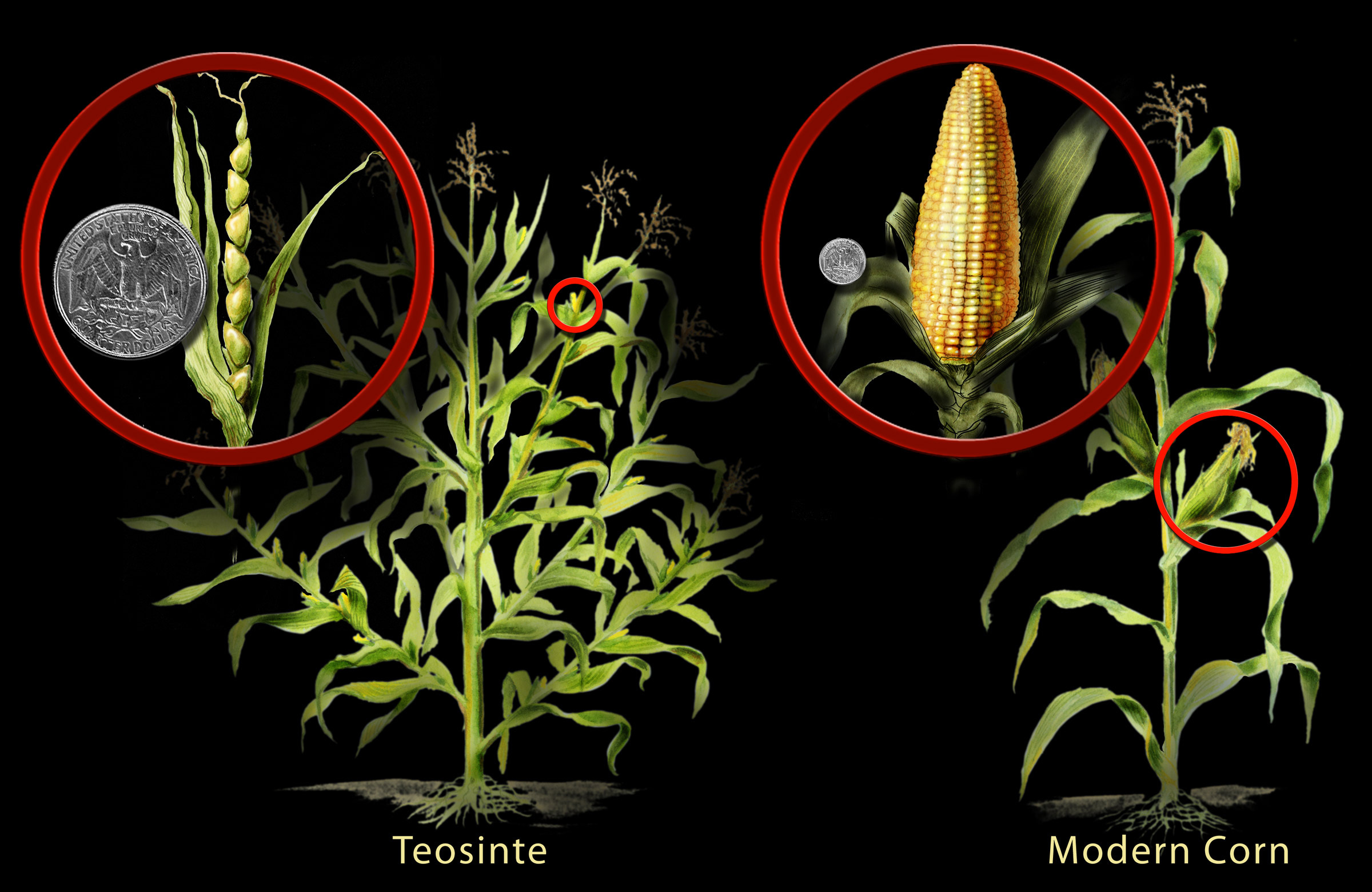
Essa história de modificação genética é comum a quase todas as espécies cultivadas. Por exemplo, repolho, brócolis, couve de Bruxelas, couve-flor e couve foram todos desenvolvidos a partir de uma única espécie de planta de mostarda selvagem (figura\(\PageIndex{b}\)). A erva-moura selvagem foi a fonte de tomate, berinjela, tabaco e batata, esta última desenvolvida por humanos de 7.000 a 10.000 anos atrás na América do Sul.

Engenharia Genética
A engenharia genética é o processo de alterar diretamente o DNA de um organismo para produzir as safras desejadas mais rapidamente do que a reprodução seletiva. Como os genes podem ser obtidos de outras espécies ou até mesmo sintetizados em laboratório, os cientistas não estão limitados pela variação genética existente dentro de uma espécie cultivada (ou espécies estreitamente relacionadas com as quais eles podem ser cruzados). Isso amplia as possíveis características que podem ser adicionadas às plantações. A engenharia genética moderna é mais precisa do que a criação seletiva, no sentido de que os biólogos podem modificar apenas um único gene. Além disso, a engenharia genética pode introduzir um gene entre duas espécies distantes, como inserir um gene bacteriano em uma planta (figura\(\PageIndex{c}\)).
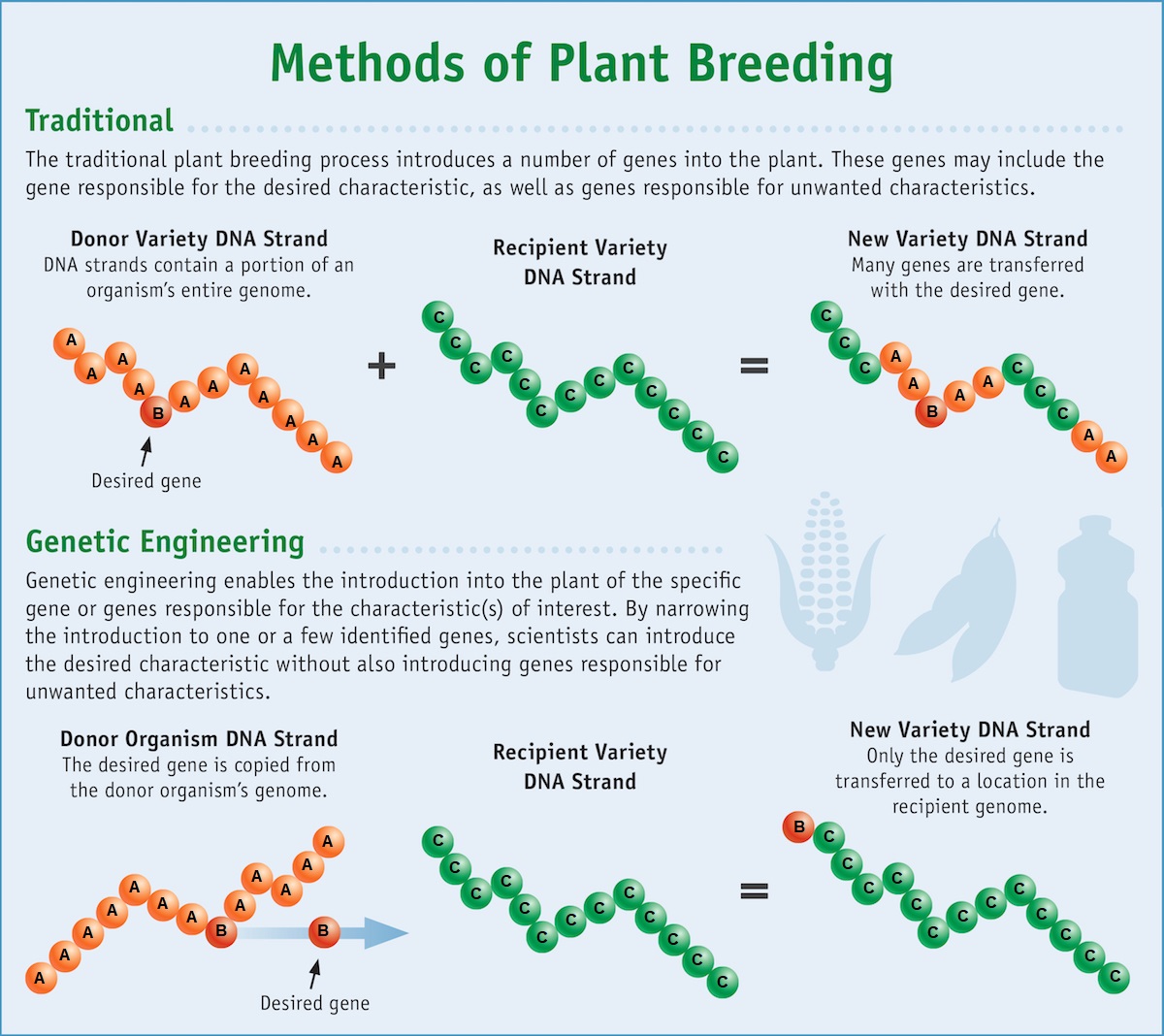
Organismos geneticamente modificados (OGMs) são aqueles que tiveram seu DNA alterado por meio da engenharia genética. Às vezes, as culturas geneticamente modificadas são chamadas de culturas geneticamente modificadas (GE). Organismos transgênicos são um tipo de organismo geneticamente modificado que contém genes de uma espécie diferente. Como eles contêm combinações únicas de genes e não estão restritos ao laboratório, as plantas transgênicas e outros OGM são monitorados de perto por agências governamentais para garantir que sejam adequadas para consumo humano e não coloquem em risco outras formas de vida vegetal e animal. Como esses genes estranhos (transgenes) podem se espalhar para outras espécies no ambiente, particularmente no pólen e nas sementes das plantas, testes extensivos são necessários para garantir a estabilidade ecológica.
Como modificar geneticamente as células vegetais
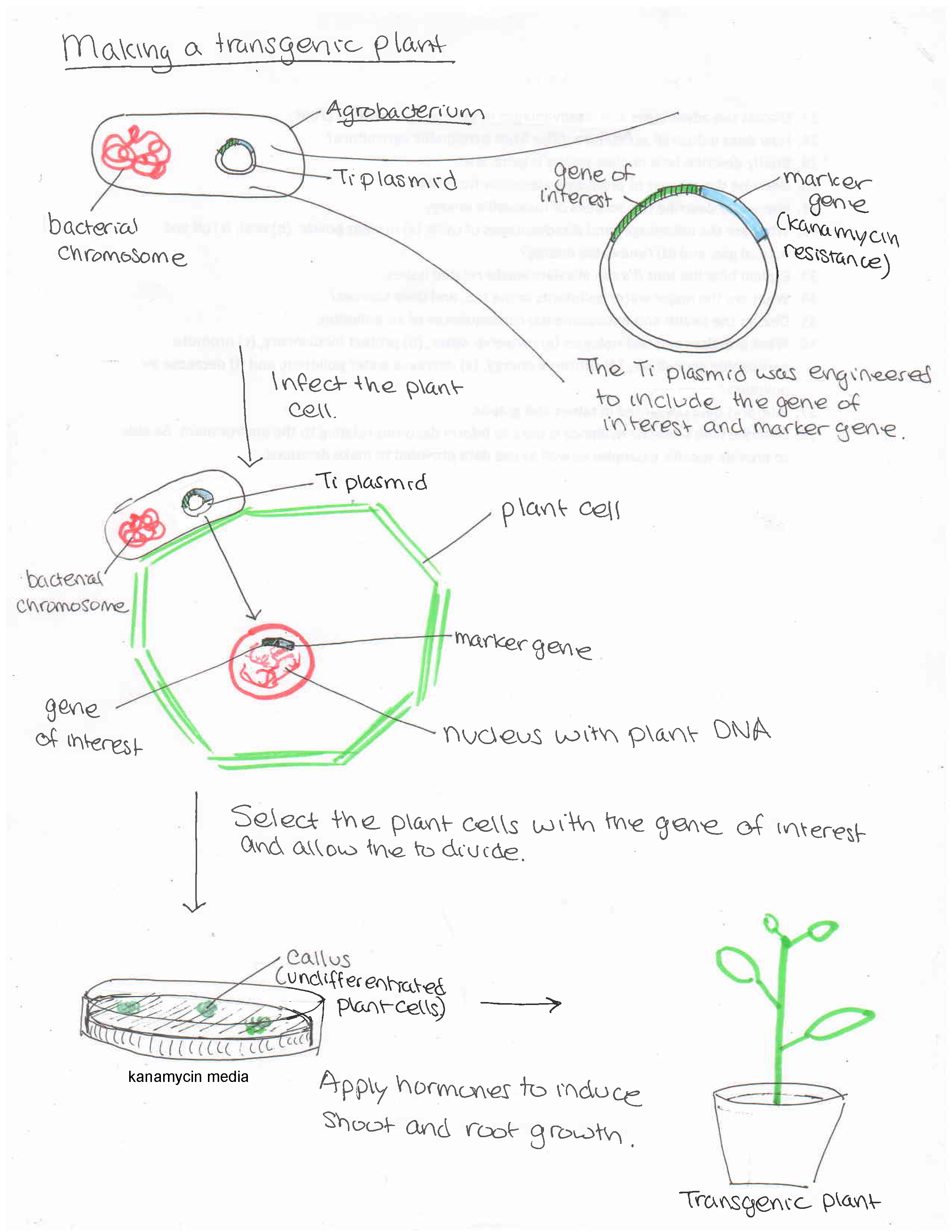
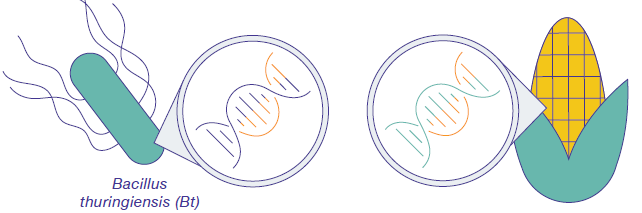
O DNA pode ser inserido nas células vegetais por meio de várias técnicas. Por exemplo, uma arma genética impulsiona DNA ligado a partículas de ouro para as células vegetais. (O DNA tem uma carga negativa e se apega ao ouro carregado positivamente.) Uma abordagem mais tradicional emprega o patógeno vegetal Agrobacterium tumefaciens (figura\(\PageIndex{d}\)). Normalmente, essa bactéria causa a doença da vesícula coronária nas plantas ao inserir um pedaço circular de DNA, chamado plasmídeo de Ti, nas células vegetais. Esse DNA se incorpora aos cromossomos vegetais, dando-lhes genes para produzir a vesícula (figura\(\PageIndex{e}\)), que fornece um lar para o patógeno bacteriano.
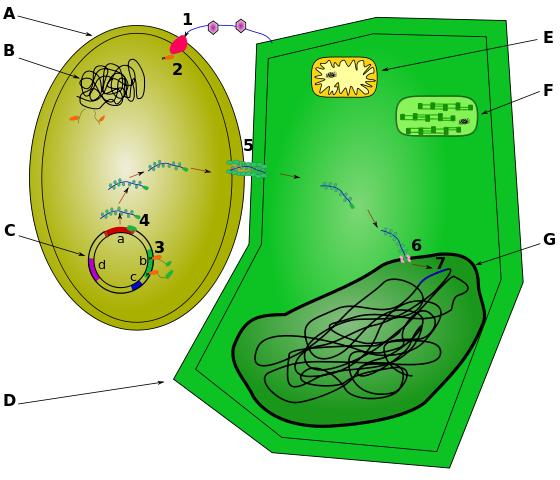

Os cientistas alteram o processo pelo qual o Agrobacterium infecta e altera geneticamente as células vegetais para produzir plantas geneticamente modificadas com características benéficas para a agricultura, da seguinte forma (figura\(\PageIndex{f}\)):
- O T-DNA, que codifica a galha da coroa, é removido do plasmídeo de Ti, e genes para as características desejadas são adicionados.
- O plasmídeo modificado é então adicionado novamente ao Agrobacterium.
- O Agrobacterium infecta células vegetais indiferenciadas (células-tronco que podem se desenvolver em qualquer parte da planta; figura\(\PageIndex{g}\)).
- As células vegetais modificadas recebem hormônios para produzir toda a planta.

Exemplos de culturas geneticamente modificadas
Muitas culturas geneticamente modificadas foram aprovadas nos EUA e produzem nossos alimentos. O primeiro organismo geneticamente modificado aprovado pela Food and Drug Administration (FDA) dos EUA em 1994 foi o tomate Flavr Savr™, que tem uma vida útil mais longa (apodrecimento retardado) porque um gene responsável pela quebra das células é inibido. Os tomates Flavr Savr são geneticamente modificados (porque seu DNA foi alterado), mas não transgênicos (porque não contêm genes de outra espécie). O tomate Flavr Savr não conseguiu se manter no mercado devido a problemas de manutenção e transporte da safra. O arroz dourado produz β-caroteno, um precursor da vitamina A (figura\(\PageIndex{h}\); o β-caroteno também está em altas concentrações em cenouras, batatas-doces e melão, dando-lhes sua cor laranja). O milho, o algodão e a soja Roundup Ready® são resistentes a esse herbicida comum, facilitando a pulverização uniforme em um campo para matar as ervas daninhas sem prejudicar as plantações (figura\(\PageIndex{i}\)).


As safras também foram projetadas para produzir inseticidas. O Bacillus thuringiensis (Bt) é uma bactéria que produz cristais proteicos que são tóxicos para muitas espécies de insetos que se alimentam de plantas. Os insetos que ingeriram a toxina Bt param de se alimentar das plantas em poucas horas. Depois que a toxina é ativada no intestino dos insetos, a morte ocorre em alguns dias. O gene para produzir a toxina Bt foi adicionado a muitas culturas, incluindo milho (figura\(\PageIndex{j}\)), batata e algodão, fornecendo às plantas uma defesa contra insetos.
Alimentos geneticamente modificados são difundidos nos Estados Unidos. Por exemplo, 94% das safras de soja foram geneticamente modificadas para resistência a herbicidas em 2020. Da mesma forma, 8% das safras de algodão e 10% das culturas de milho foram modificadas para resistência a herbicidas, além dos 83% das safras de algodão e 79% de milho que foram geneticamente modificadas de várias maneiras.
Animais geneticamente modificados também entraram recentemente no mercado. O salmão AquaAdvantage® foi modificado para crescer mais rapidamente e foi aprovado em novembro de 2015. No entanto, em março de 2021, eles ainda não foram vendidos devido a contestações legais. Em 2020, o FDA aprovou porcos GalSafe™ para produção de medicamentos e alimentos. Esses porcos não têm uma molécula na parte externa de suas células que causa alergias em algumas pessoas.
Vantagens das culturas geneticamente modificadas
Os avanços na biotecnologia podem fornecer aos consumidores alimentos que são enriquecidos nutricionalmente, mais duradouros ou que contêm níveis mais baixos de certas toxinas naturais presentes em algumas plantas alimentícias. Por exemplo, pesquisadores estão usando a biotecnologia para tentar reduzir as gorduras saturadas nos óleos de cozinha e reduzir os alérgenos nos alimentos. Ainda não se sabe se esses benefícios alcançarão as pessoas que mais precisam deles. Embora o cultivo do arroz dourado possa resolver a deficiência de vitamina A em milhões de pessoas, ele não tem sido historicamente acessível a essas pessoas porque é patenteado e caro. Da mesma forma, sementes geneticamente modificadas poderiam aumentar a renda dos agricultores pobres se estivessem disponíveis a baixo ou nenhum custo, mas esse nem sempre é o caso.
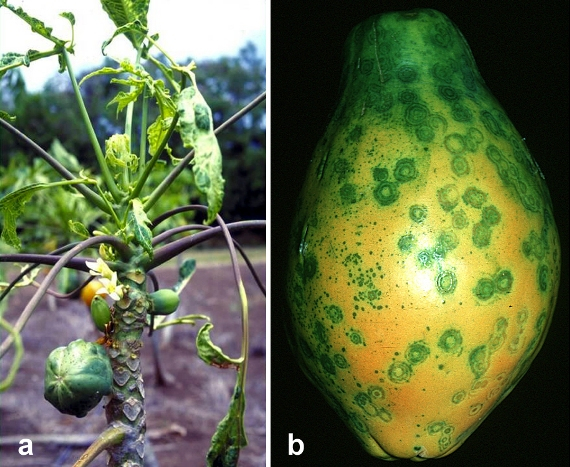
Os mamões Rainbow e SunUp são uma história de sucesso de como as plantações geneticamente modificadas podem beneficiar os pequenos agricultores e a economia em geral. No início da década de 1990, uma doença emergente estava destruindo a produção de mamão no Havaí e ameaçando dizimar a indústria de 11 milhões de dólares (número\(\PageIndex{k}\)). Felizmente, um homem chamado Dennis Gonsalves (figura\(\PageIndex{l}\)), que foi criado em uma plantação de açúcar e depois se tornou fisiologista vegetal na Universidade Cornell, desenvolveria plantas de mamão geneticamente modificadas para resistir ao vírus mortal. No final da década, a indústria havaiana de mamão e os meios de subsistência de muitos agricultores foram salvos graças à distribuição gratuita das sementes do Dr. Gonsalves.

O efeito das culturas geneticamente modificadas no meio ambiente depende da modificação genética específica e das práticas agrícolas que ela promove. Por exemplo, as plantações de Bt produzem seus próprios inseticidas, de forma que a aplicação externa desses produtos químicos é desnecessária, reduzindo os impactos negativos da agricultura industrial. Pesquisas em andamento estão explorando se as plantações podem ser projetadas para fixar nitrogênio na atmosfera (como fazem algumas bactérias) em vez de depender de amônio, nitritos e nitratos no solo. Se essas culturas fossem projetadas com sucesso, elas poderiam reduzir a aplicação de fertilizantes sintéticos e minimizar o escoamento de nutrientes que leva à eutrofização.
As culturas geneticamente modificadas podem ter o potencial de conservar os recursos naturais, permitir que os animais usem com mais eficácia os nutrientes presentes na ração e ajudar a atender às crescentes demandas mundiais de alimentos e terras. Na prática, no entanto, países que usam culturas geneticamente modificadas em comparação com aqueles que não apenas desfrutam de um ligeiro (ou inexistente) aumento na produção.
Desvantagens das culturas geneticamente modificadas
Preocupações sociais
Os direitos de propriedade intelectual são um dos fatores importantes no debate atual sobre culturas geneticamente modificadas. As culturas geneticamente modificadas podem ser patenteadas pelos agronegócios, o que pode levá-los a controlar e potencialmente explorar os mercados agrícolas. Alguns acusam empresas, como a Monsanto, de supostamente controlarem a produção e o preço das sementes, em detrimento dos agricultores (figura\(\PageIndex{m}\)).
Preocupações ambientais
As culturas geneticamente modificadas apresentam várias preocupações ambientais. A monocultura agrícola já reduz a biodiversidade, e o cultivo de culturas geneticamente modificadas, para as quais plantas individuais são geneticamente bastante semelhantes, agrava isso. O uso das safras Roundup Ready ® naturalmente incentiva o uso generalizado de herbicidas, o que pode matar involuntariamente as plantas nativas próximas. Essa prática também aumentaria os resíduos de herbicidas nos produtos. Embora as culturas Bt sejam benéficas no sentido de que não requerem aplicação externa de inseticida, a toxina Bt é disseminada em seu pólen. Um estudo inicial descobriu que o pólen de milho Bt pode ser prejudicial às lagartas monarcas (figura\(\PageIndex{n}\)), mas apenas em concentrações que raramente são alcançadas na natureza. Estudos de acompanhamento descobriram que a maior parte do milho Bt cultivado não prejudicou os monarcas; no entanto, a única cepa de milho Bt foi consequentemente removida do mercado.

Por meio do cruzamento ou hibridização, as culturas geneticamente modificadas podem compartilhar seus transgenes com parentes selvagens. Isso pode afetar a genética desses parentes selvagens e ter consequências imprevistas em suas populações e até mesmo ter implicações para o ecossistema maior. Por exemplo, se um gene projetado para conferir resistência a herbicidas passasse de uma cultura geneticamente modificada para um parente selvagem, ele poderia transformar a espécie selvagem em uma supererva daninha — uma espécie que não poderia ser controlada por herbicida. Seu crescimento desenfreado poderia então deslocar outras espécies selvagens e a vida selvagem que delas depende, causando danos ecológicos.
Os genes fugitivos não só poderiam alterar as espécies de ervas daninhas, mas também poderiam entrar em populações de espécies nativas. Isso poderia tornar algumas espécies nativas melhores competidoras do que eram anteriormente, interrompendo a dinâmica do ecossistema. (Eles poderiam potencialmente superar outras espécies nativas com as quais, de outra forma, coexistiriam.)
Embora haja evidências de transferência genética entre plantações geneticamente modificadas e parentes selvagens, ainda não há evidências de danos ecológicos causados por essa transferência. Claramente, o monitoramento contínuo, especialmente para culturas recém-desenvolvidas, é necessário.
A fuga de animais geneticamente modificados também tem potencial para perturbar os ecossistemas. Por exemplo, se o salmão AquaAdvantage escapasse para o ecossistema natural, como os peixes cultivados costumam fazer, eles poderiam superar o salmão nativo, incluindo espécies ameaçadas de extinção. Sua modificação genética, que facilita o crescimento rápido, pode resultar em uma vantagem competitiva.
Problemas com a saúde
Além dos riscos ambientais, algumas pessoas estão preocupadas com os riscos potenciais à saúde das culturas geneticamente modificadas porque sentem que a modificação genética altera as propriedades intrínsecas, ou a essência, de um organismo. Conforme discutido acima, no entanto, sabe-se que tanto as práticas tradicionais de criação quanto a engenharia genética moderna produzem mudanças genéticas permanentes. Além disso, a reprodução seletiva, na verdade, tem um impacto maior e mais imprevisível na genética de uma espécie devido à sua natureza comparativamente bruta.
Para resolver essas preocupações (e outras), as Academias Nacionais de Ciências, Engenharia e Medicina dos EUA (NASEM) publicaram um relatório abrangente de 500 páginas em 2016 que resumiu o conhecimento científico atual sobre culturas geneticamente modificadas. O relatório, intitulado Cultivos Geneticamente Modificados: Experiências e Perspectivas, analisou mais de 900 artigos de pesquisa, além de comentários públicos e depoimentos de especialistas. O GE Crop Report da NASEM não encontrou “nenhuma evidência comprovada de uma diferença nos riscos à saúde humana entre as atuais culturas geneticamente modificadas (GE) disponíveis comercialmente e as culturas criadas convencionalmente, nem encontrou evidências conclusivas de causa e efeito de problemas ambientais das culturas transgênicas”. Além disso, a Organização das Nações Unidas para Alimentação e Agricultura concluiu que os riscos para a saúde humana e animal decorrentes do uso de OGM são insignificantes. O consenso científico sobre as culturas geneticamente modificadas é bastante claro: elas são seguras para consumo humano.
O potencial de as culturas geneticamente modificadas serem alergênicas é um dos potenciais efeitos adversos à saúde e deve continuar sendo estudado, especialmente porque algumas evidências científicas indicam que animais alimentados com plantações geneticamente modificadas foram prejudicados. O GE Crop Report da NASEM concluiu que, ao desenvolver novas safras, é o produto que deve ser estudado quanto a possíveis riscos à saúde e ao meio ambiente, não o processo que atingiu esse produto. O que isso significa é que, como as práticas tradicionais de criação e a engenharia genética moderna produzem novas características por meio da modificação genética, ambas apresentam riscos potenciais. Assim, para a segurança do meio ambiente e da saúde humana, ambos devem ser adequadamente estudados.
As culturas geneticamente modificadas são a solução de que precisamos?
Recursos significativos, tanto financeiros quanto intelectuais, foram alocados para responder à pergunta: as culturas geneticamente modificadas são seguras para consumo humano? Depois de muitas centenas de estudos científicos, a resposta é sim. Mas uma questão importante ainda permanece: eles são necessários? Certamente, como em casos como o mamão do Havaí, que estava ameaçado de erradicação devido a uma doença agressiva, a engenharia genética era uma solução rápida e eficaz que teria sido extremamente difícil, se não impossível, de resolver usando práticas tradicionais de reprodução.
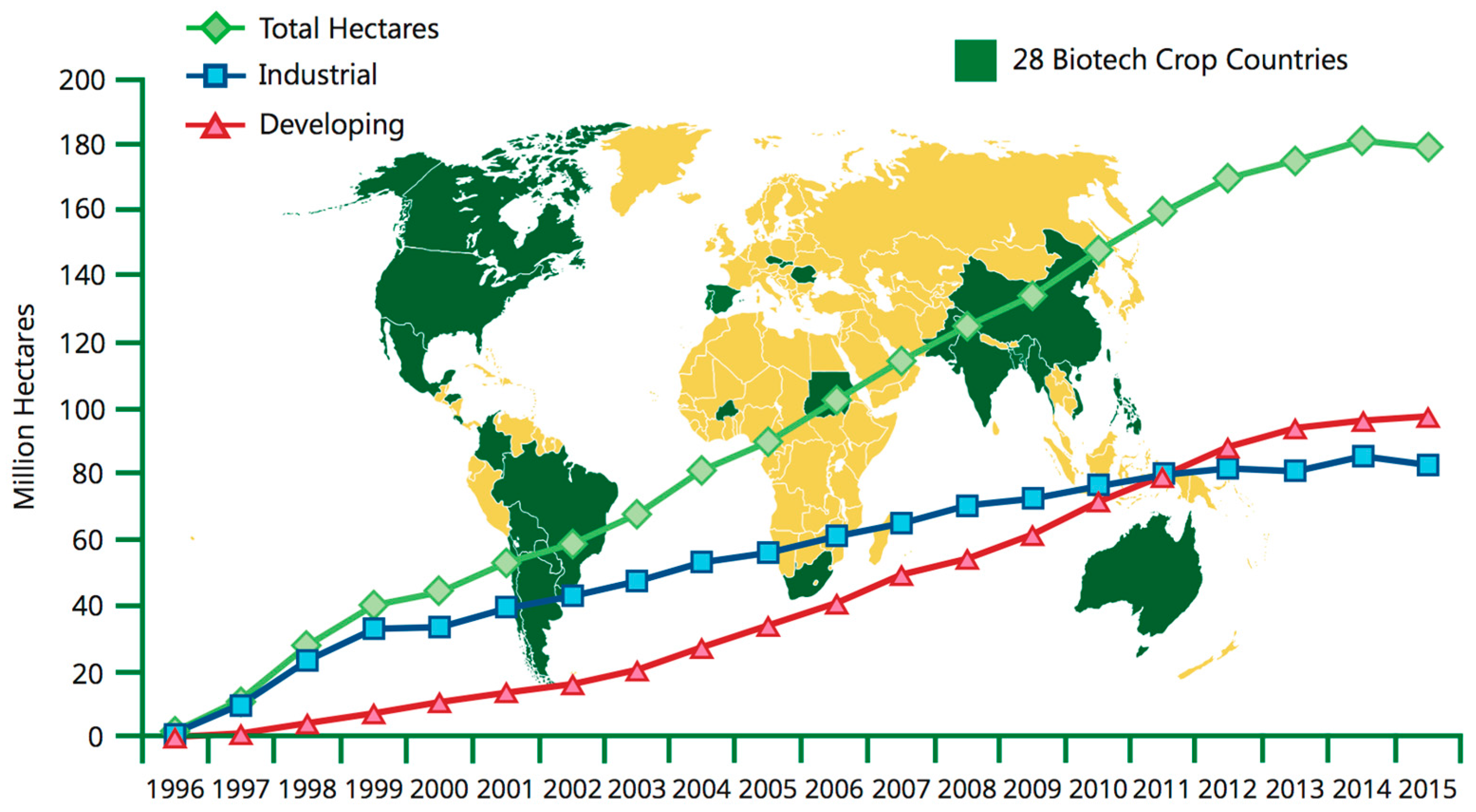
No entanto, em muitos casos, as promessas iniciais das culturas geneticamente modificadas - de que melhorariam a qualidade nutricional dos alimentos, confeririam resistência a doenças e proporcionariam avanços incomparáveis na produtividade das safras - falharam em grande parte. O relatório de safra GE da NASEM afirma que, embora as culturas geneticamente modificadas tenham resultado na redução da perda agrícola por pragas, no uso reduzido de pesticidas e na redução das taxas de lesões causadas por inseticidas para os trabalhadores agrícolas, elas não aumentaram a taxa na qual os rendimentos das safras estão avançando quando comparados aos não transgênicos colheitas. Além disso, embora existam algumas exceções notáveis, como arroz dourado ou mamão resistente a vírus, muito poucas culturas geneticamente modificadas foram produzidas para aumentar a capacidade nutricional ou prevenir doenças de plantas que podem devastar a renda do agricultor e reduzir a segurança alimentar. A grande maioria das culturas geneticamente modificadas é desenvolvida com apenas dois propósitos: introduzir resistência a herbicidas ou resistência a pragas. As culturas geneticamente modificadas estão concentradas nos países desenvolvidos e sua disponibilidade nos países em desenvolvimento, onde talvez sejam mais necessárias, é limitada (figura\(\PageIndex{o}\)).
Leitura suplementar sugerida
NASEM. 2016. Cultivos geneticamente modificados: experiências e perspectivas.
Atribuições
Modificado por Melissa Ha a partir das seguintes fontes:
- Biotecnologia e Engenharia Genética de Biologia Ambiental por Matthew R. Fisher (licenciado sob CC-BY)
- Biotecnologia em Medicina e Agricultura a partir de Conceitos em Biologia da OpenStax (licenciado sob CC-BY)


