8.6 : Spectres atomiques et rayons X
- Page ID
- 189782
À la fin de cette section, vous serez en mesure de :
- Décrire l'absorption et l'émission de rayonnement en termes de niveaux d'énergie atomique et de différences d'énergie
- Utilisez les nombres quantiques pour estimer l'énergie, la fréquence et la longueur d'onde des photons produits par les transitions atomiques dans des atomes à plusieurs électrons
- Expliquer les concepts de rayonnement dans le contexte de la fluorescence atomique et des rayons X
L'étude des spectres atomiques fournit la plupart de nos connaissances sur les atomes. Dans la science moderne, les spectres atomiques sont utilisés pour identifier des espèces d'atomes dans divers objets, des galaxies lointaines aux échantillons de sang prélevés sur les lieux d'un crime.
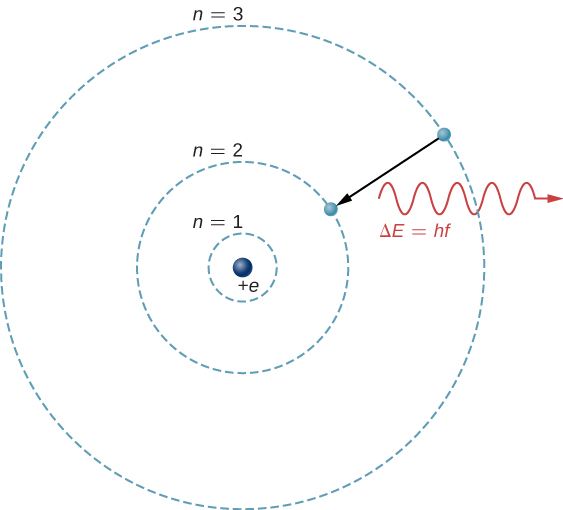
La base théorique de la spectroscopie atomique est la transition des électrons entre les niveaux d'énergie des atomes. Par exemple, si un électron d'un atome d'hydrogène effectue une transition entre la\(n = 3\) coque et la\(n = 2\) coque, l'atome émet un photon d'une longueur d'onde
\[\lambda = \frac{c}{f} = \frac{h \cdot c}{h \cdot f} = \frac{hc}{E_3 - E_2}, \nonumber \]
où\(\Delta E = E_3 - E_2\) est l'énergie emportée par le photon et\(hc = 1240 \, eV \cdot nm\). Une fois que ce rayonnement a traversé un spectromètre, il apparaît sous la forme d'une raie spectrale nette sur un écran. Le modèle de Bohr de ce processus est illustré à la figure\(\PageIndex{1}\). Si l'électron absorbe ensuite un photon avec de l'énergie\(\Delta E\), l'électron retourne dans la\(n = 3\) coque (nous avons examiné le modèle de Bohr précédemment).
Pour comprendre les transitions atomiques dans les atomes multi-électrons, il est nécessaire de prendre en compte de nombreux effets, notamment la répulsion de Coulomb entre électrons et les interactions magnétiques internes (couplages spin-orbite et spin-spin). Heureusement, de nombreuses propriétés de ces systèmes peuvent être comprises en négligeant les interactions entre les électrons et en représentant chaque électron par sa propre fonction d'onde à particule unique\(ψ_{nlm}\).
Les transitions atomiques doivent respecter les règles de sélection. Ces règles découlent des principes de la mécanique quantique et de la symétrie. Les règles de sélection classent les transitions comme autorisées ou interdites. (Des transitions interdites se produisent, mais la probabilité d'une transition interdite typique est très faible.) Pour un atome de type hydrogène, les transitions atomiques impliquant des interactions électromagnétiques (émission et absorption de photons) obéissent à la règle de sélection suivante :
\[\Delta l = \pm 1, \label{select1} \]
où\(l\) est associé à l'amplitude du moment cinétique orbital,
\[L = \sqrt{l(l + 1)}\hbar. \nonumber \]
Pour les atomes à électrons multiples, des règles similaires s'appliquent. Pour illustrer cette règle, considérez les transitions atomiques observées dans l'hydrogène (H), le sodium (Na) et le mercure (Hg) (Figure\(\PageIndex{2}\)). Les lignes horizontales de ce diagramme correspondent aux niveaux d'énergie atomique, et les transitions autorisées par cette règle de sélection sont indiquées par des lignes tracées entre ces niveaux. Les énergies de ces états sont de l'ordre de quelques électronvolts, et les photons émis lors des transitions se situent dans le domaine visible. Techniquement, les transitions atomiques peuvent enfreindre la règle de sélection, mais de telles transitions sont rares.
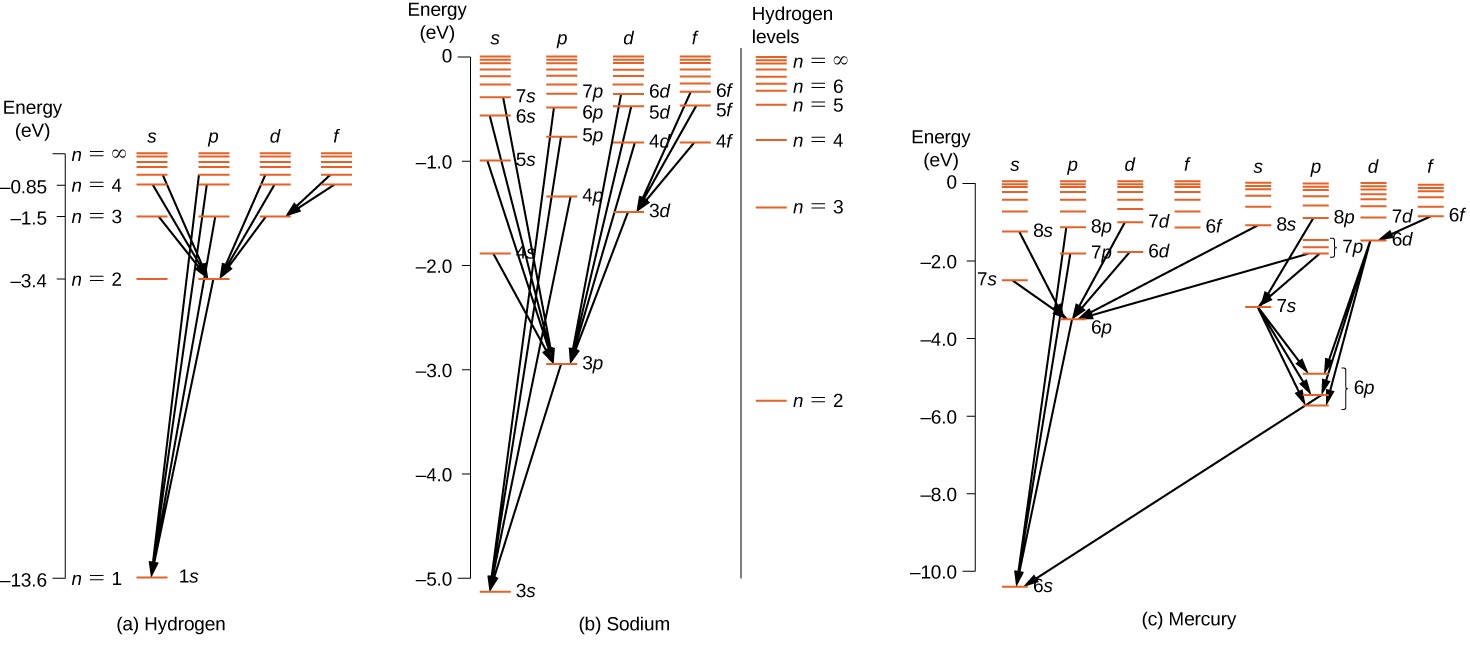
L'atome d'hydrogène possède le diagramme de niveau d'énergie le plus simple. Si l'on néglige le spin des électrons, tous les états ayant la même valeur de n ont la même énergie totale. Cependant, le couplage spin-orbite divise les\(n = 2\) états en deux états de moment cinétique (s et p) d'énergies légèrement différentes. (Ces niveaux ne sont pas déplacés verticalement, car le partage de l'énergie est trop faible pour apparaître sur ce diagramme.) De même, le couplage spin-orbite divise les\(n = 3\) états en trois états de moment cinétique (s, p et d).
Le diagramme des niveaux d'énergie de l'hydrogène est similaire à celui du sodium, car les deux atomes ont un électron dans l'enveloppe extérieure. L'électron de valence du sodium se déplace dans le champ électrique d'un noyau protégé par des électrons dans les couches internes. Il n'est donc pas soumis à un simple potentiel de Coulomb 1/ r et son énergie totale dépend à la fois de n et de l. Il est intéressant de noter que le mercure possède deux diagrammes de niveaux d'énergie distincts ; ces diagrammes correspondent à deux états de spin nets de ses électrons 6 s (valence).
Le spectre du sodium est analysé à l'aide d'un spectromètre. Deux raies rapprochées de longueurs d'onde de 589,00 nm et 589,59 nm sont observées.
- Si le doublet correspond à l'électron excité (valence) qui passe d'un état excité à l'état 3 s, quel était le moment cinétique original de l'électron ?
- Quelle est la différence énergétique entre ces deux états excités ?
Stratégie
Le sodium et l'hydrogène appartiennent à la même colonne ou au même groupe chimique du tableau périodique, de sorte que le sodium est « semblable à l'hydrogène ». L'électron le plus externe du sodium se trouve dans la sous-couche 3 s (\(l=0\)) et peut être excité à des niveaux d'énergie plus élevés. Comme pour l'hydrogène, les transitions ultérieures vers des niveaux d'énergie plus faibles doivent respecter la règle de sélection (Équation \ ref {select1}) :
\[\Delta l = \pm 1 \nonumber \]
Nous devons d'abord déterminer le nombre quantique de l'état initial qui satisfait à la règle de sélection. Ensuite, nous pouvons utiliser ce nombre pour déterminer l'amplitude du moment cinétique orbital de l'état initial.
Solution
- Les transitions autorisées doivent respecter la règle de sélection. Si le nombre quantique de l'état initial est\(l = 0\), la transition est interdite car\(\Delta l = 0\). Si le nombre quantique de l'état initial est\(l = 2,3,4,...\) la transition est interdite car\(\Delta l > 1\). Par conséquent, le quantum de l'état initial doit être\(l=1\). Le moment cinétique orbital de l'état initial est\[L = \sqrt{l(l + 1)}\hbar = 1.41 \hbar. \nonumber \]
- Comme l'état final des deux transitions est le même (3 s), la différence d'énergie des photons est égale à la différence d'énergie des deux états excités. En utilisant l'équation\[\Delta e = hf = h\left(\frac{c}{\lambda}\right), \nonumber \] que nous avons\[\begin{align*} E &= hc\left(\frac{1}{\lambda_1} - \frac{1}{\lambda_2}\right) \\[4pt] &=(4.14 \times 10^{-15} eVs)(3.00 \times 10^8 m/s) \times \left(\frac{1}{589.00 \times 10^{-9} m} - \frac{1}{589.59 \times 10^{-9} m}\right) \\[4pt] &= 2.11 \times 10^{-3} eV. \end{align*} \nonumber \]
L'importance
Pour comprendre la difficulté de mesurer cette différence d'énergie, nous comparons cette différence à l'énergie moyenne des deux photons émis lors de la transition. Étant donné une longueur d'onde moyenne de 589,30 nm, l'énergie moyenne des photons est
\[E = \frac{hc}{\lambda} = \frac{(4.14 \times 10^{-15} eVs) (3.00 \times 10^8 m/s)}{589.30 \times 10^{-9} m} = 2.11 \, eV. \nonumber \]
La différence d'énergie\(\Delta E\) est d'environ 0,1 % (1 partie sur 1000) de cette énergie moyenne. Cependant, un spectromètre sensible peut mesurer la différence.
Fluorescence atomique
La fluorescence se produit lorsqu'un électron d'un atome est excité à plusieurs niveaux au-dessus de l'état fondamental par absorption d'un photon ultraviolet (UV) de haute énergie. Une fois excité, l'électron « se désexcite » de deux manières. L'électron peut retomber à l'état fondamental, en émettant un photon de la même énergie que celle qui l'a excité, ou il peut retomber en une série de petites étapes, émettant plusieurs photons de faible énergie. Certains de ces photons peuvent se trouver dans le domaine visible. Les colorants fluorescents présents dans les vêtements peuvent rendre les couleurs plus vives au soleil en convertissant les rayons UV en lumière visible. Les lampes fluorescentes sont plus efficaces pour convertir l'énergie électrique en lumière visible que les filaments à incandescence (environ quatre fois plus efficaces). La figure\(\PageIndex{3}\) montre un scorpion éclairé par une lampe UV. Les protéines situées près de la surface de la peau émettent une lumière bleue caractéristique.

Radiographies
L'étude des transitions de l'énergie atomique nous permet de comprendre les rayons X et la technologie des rayons X. Comme tous les rayonnements électromagnétiques, les rayons X sont composés de photons. Les photons X sont produits lorsque les électrons des couches les plus externes d'un atome tombent vers les couches internes. (Les atomes d'hydrogène n'émettent pas de rayons X, car les niveaux d'énergie des électrons sont trop rapprochés pour permettre l'émission de rayonnements à haute fréquence.) Les transitions de ce type sont normalement interdites car les états inférieurs sont déjà remplis. Cependant, si une enveloppe intérieure présente une lacune (un électron interne est absent, peut-être parce qu'il a été renversé par un électron à haute vitesse), un électron provenant de l'une des coques extérieures peut perdre de l'énergie pour combler le vide. L'écart énergétique pour une telle transition est relativement important, de sorte que la longueur d'onde du photon de rayons X émis est relativement courte.
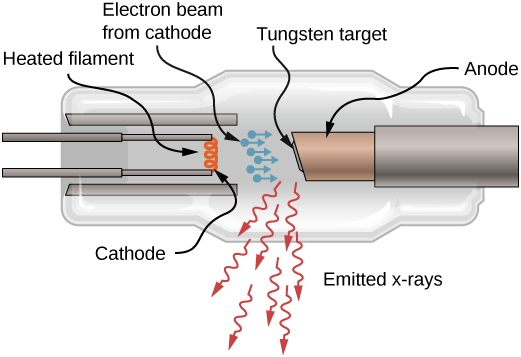
Les rayons X peuvent également être produits en bombardant une cible métallique avec des électrons de haute énergie, comme le montre la figure\(\PageIndex{4}\). Sur la figure, les électrons sont extraits d'un filament et accélérés par un champ électrique jusqu'à une cible en tungstène. Selon la théorie classique de l'électromagnétisme, toute particule chargée qui accélère émet un rayonnement. Ainsi, lorsque l'électron frappe la cible en tungstène et ralentit soudainement, l'électron émet un rayonnement de freinage (on utilise souvent le terme allemand : Bremsstrahlung). Le rayonnement de freinage fait référence au rayonnement produit par toute particule chargée ralentie par un milieu. Dans ce cas, le rayonnement de freinage contient une gamme continue de fréquences, car les électrons entrent en collision avec les atomes cibles de manières légèrement différentes.
Le rayonnement de freinage n'est pas le seul type de rayonnement produit lors de cette interaction. Dans certains cas, un électron entre en collision avec un autre électron de la couche interne d'un atome cible et fait sortir l'électron de la manière d'un atome ou d'une boule de billard. L'état vide est rempli lorsqu'un électron d'une couche supérieure tombe dans cet état (baisse du niveau d'énergie) et émet un photon de rayons X.
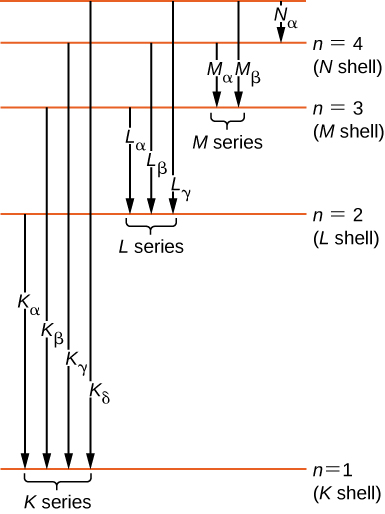
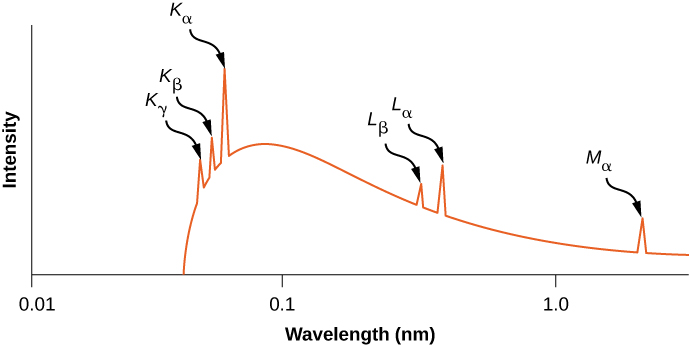
Historiquement, les raies spectrales des rayons X étaient marquées par des lettres (K, L, M, N,...). Ces lettres correspondent aux couches atomiques (\(n = 1,2,3,4,...\)). Les rayons X produits par une transition entre n'importe quelle couche supérieure et la couche K (\(n = 1\)) sont marqués comme des rayons X. Les rayons X produits dans une transition à partir de la coque L (\(n = 2\)) sont appelés\(K_{\alpha}\) rayons X ; les rayons X produits dans une transition à partir de la coque M (\(n = 3\)) sont appelés\(K_{\beta}\) rayons X ; les rayons X produits dans une transition à partir de la coque N (\(n = 4\)) sont appelés \(K_{\gamma}\)Radiographies ; et ainsi de suite. Les transitions des coques supérieures vers les coques L et M sont étiquetées de la même manière. Ces transitions sont représentées par un diagramme des niveaux d'énergie sur la figure\(\PageIndex{5}\).
La distribution des longueurs d'onde des rayons X produites en frappant un métal avec un faisceau d'électrons est donnée dans la figure\(\PageIndex{6}\). Les transitions des rayons X dans le métal cible apparaissent sous forme de pics au-dessus de la courbe de rayonnement de freinage. Les fréquences des photons correspondant aux pointes de la distribution des rayons X sont appelées fréquences caractéristiques, car elles peuvent être utilisées pour identifier le métal cible. La longueur d'onde de coupure nette (juste en dessous du\(K_{\gamma}\) pic) correspond à un électron qui perd toute son énergie au profit d'un seul photon. Le rayonnement de longueurs d'onde plus courtes est interdit pour des raisons de conservation de l'énergie.
Estimez l'énergie et la fréquence caractéristiques des\(K_{\alpha}\) rayons X pour l'aluminium (\(Z = 13\)).
Stratégie
Un\(K_{\alpha}\) rayon X est produit par la transition d'un électron dans la couche L (\(n=2\)) vers la couche K (\(n = 1\)). Un électron de la couche L « voit » une charge efficace\(Z = 13 - 1 = 12\), car un électron de la couche K protège la charge nucléaire. (Rappelons que deux électrons ne se trouvent pas dans la couche K parce que l'autre état électronique est vacant.) La fréquence du photon émis peut être estimée à partir de la différence d'énergie entre les couches L et K.
Solution
La différence d'énergie entre les couches L et K d'un atome d'hydrogène est de 10,2 eV. En supposant que les autres électrons de la couche L ou des couches de haute énergie ne protègent pas la charge nucléaire, la différence d'énergie entre les couches L et K dans un atome avec\(Z = 13\) est d'environ
\[\begin{align*} E_{L \rightarrow K} &\approx (Z - 1)^2 (10.2 \, eV) \\[4pt] &\approx (13 - 1)^2(10.2 \, eV) \\[4pt] &\approx 1.47 \times 10^3 eV. \end{align*} \nonumber \]
Sur la base de la relation\(f = (\Delta E_{L \rightarrow K})/h\), la fréquence des rayons X est
\[f = \frac{1.47 \times 10^3 eV}{4.14 \times 10^{-15} eV \cdot s} = 3.55 \times 10^{17} Hz. \nonumber \]
L'importance
La longueur d'onde du rayon X typique est de 0,1 à 10 nm. Dans ce cas, la longueur d'onde est :
\[\lambda = \frac{c}{f} = \frac{3.0 \times 10^8 m/s}{3.55 \times 10^{17} Hz} = 8.5 \times 10^{-10} = 0.85 \, nm. \nonumber \]
Ainsi, la transition L → K dans l'aluminium produit un rayonnement X.
La production de rayons X constitue un test important de la mécanique quantique. Selon le modèle de Bohr, l'énergie d'un\(K_{\alpha}\) rayon X dépend de la charge nucléaire ou du numéro atomique, Z. Si Z est grand, les forces de Coulomb dans l'atome sont importantes, les différences d'énergie (\(\Delta E\)) sont importantes et, par conséquent, l'énergie des photons rayonnés est importante. Pour illustrer, considérez un seul électron dans un atome à plusieurs électrons. En négligeant les interactions entre les électrons, les niveaux d'énergie autorisés sont
\[E_n = -\frac{Z^2(13.6 \, eV)}{n^2}, \nonumber \]
où n = 1, 2,... et Z est le numéro atomique du noyau. Cependant, un électron de la couche L (\(n = 2\)) « voit » une charge\(Z - 1\), car un électron de la couche K protège la charge nucléaire. (Rappelez-vous qu'il n'y a qu'un seul électron dans la couche K parce que l'autre électron a été « désactivé ».) Par conséquent, les énergies approximatives de l'électron dans les couches L et K sont
\[E_L \approx - \frac{(Z - 1)^2(13.6 \, eV)}{2^2} \nonumber \]
\[E_K \approx - \frac{(Z - 1)^2(13.6 \, eV)}{1^2}. \nonumber \]
L'énergie emportée par un photon lors d'une transition de la couche L à la couche K est donc
\[ \begin{align*} \Delta E_{L \rightarrow K} &= (Z - 1)^2 (13.6 \, eV)\left(\frac{1}{1^2} - \frac{1}{2^2} \right) \\[4pt] &= (Z - 1)^2 (10.2 \, eV), \end{align*} \nonumber \]
où Z est le numéro atomique. En général, l'énergie des photons X pour une transition d'une enveloppe extérieure à la couche K est
\[E_{L\rightarrow K} = hf = constant \times (Z - 1)^2, \nonumber \]
ou
\[(Z - 1) = constant \sqrt{f}, \nonumber \]
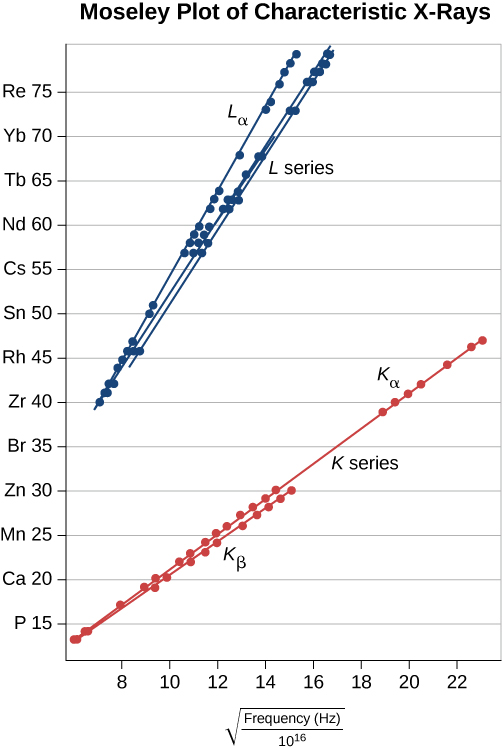
où\(f\) est la fréquence d'une\(K_{\alpha}\) radiographie. Cette équation est la loi de Moseley. Pour des valeurs élevées de\(Z\), nous avons environ
\[Z \approx constant \sqrt{f}. \nonumber \]
Cette prédiction peut être vérifiée\(f\) en mesurant diverses cibles métalliques. Ce modèle est pris en charge si un diagramme de Z par rapport aux\(\sqrt{f}\) données (appelé diagramme de Moseley) est linéaire. La comparaison des prévisions du modèle et des résultats expérimentaux, pour les séries K et L, est présentée à la figure\(\PageIndex{7}\). Les données soutiennent le modèle selon lequel les rayons X sont produits lorsqu'un électron de l'enveloppe externe perd de l'énergie pour combler un vide dans une coque interne.
Les rayons X sont produits en bombardant une cible métallique avec des électrons de haute énergie. Si la cible est remplacée par une autre dont le numéro atomique est deux fois supérieur, qu'advient-il de la fréquence des rayons X ?
- Réponse
-
quadruples de fréquence
Calculez l'énergie approximative d'un\(K_{\alpha}\) rayon X émis par une anode en tungstène dans un tube à rayons X.
Stratégie
Deux électrons occupent une couche K pleine. Une lacune dans cette couche laisserait un électron, de sorte que la charge effective d'un électron dans la couche L serait Z − 1 plutôt que Z. Pour le tungstène, Z=74, donc la charge effective est de 73. Ce nombre peut être utilisé pour calculer la différence de niveau d'énergie entre les couches L et K et, par conséquent, l'énergie emportée par un photon dans la transition L→K.
Solution
Le Z effectif est de 73, donc l'énergie des\(K_{\alpha}\) rayons X est donnée par
\[E_{K_{\alpha}} = \Delta E = E_i - E_f = E_2 - E_1, \nonumber \]
où
\[E_1 = - \frac{Z^2}{1^2}E_0 = - \frac{73^2}{1}(13.6 \, eV) = - 72.5 \, keV \nonumber \]
et
\[E_2 = - \frac{Z^2}{2^2}E_0 = - \frac{73^2}{4}(13.6 \, eV) = -18.1 \, keV. \nonumber \]
Ainsi,
\[E_{K_{\alpha}} = - 18.1 \, keV - (- 72.5 \, keV) = 54.4 \, keV. \nonumber \]
L'importance
Cette grande énergie photonique est typique des rayons X. Les énergies des rayons X augmentent progressivement pour les éléments plus lourds car leur énergie augmente approximativement au fur et à mesure\(Z^2\). Une tension d'accélération de plus de 50 000 volts est nécessaire pour « neutraliser » un électron interne d'un atome de tungstène.
Technologie à rayons X
Les rayons X ont de nombreuses applications, notamment pour le diagnostic médical (Figure\(\PageIndex{8}\)), l'inspection des bagages dans les aéroports (Figure\(\PageIndex{9}\)) et même la détection de fissures dans des composants essentiels de l'avion. Les images radiographiques les plus courantes sont dues aux ombres. Comme les photons X ont une énergie élevée, ils pénètrent dans des matériaux opaques à la lumière visible. Plus un photon à rayons X possède d'énergie, plus il pénètre de matière. La profondeur de pénétration est liée à la densité du matériau, ainsi qu'à l'énergie du photon. Plus le matériau est dense, moins les photons de rayons X passent à travers et plus l'ombre est foncée. Les rayons X sont efficaces pour identifier les fractures osseuses et les tumeurs ; toutefois, une surexposition aux rayons X peut endommager les cellules des organismes biologiques.

Une radiographie standard fournit une vue bidimensionnelle de l'objet. Cependant, dans les applications médicales, ce point de vue ne fournit pas souvent suffisamment d'informations pour tirer des conclusions fermes. Par exemple, sur une radiographie bidimensionnelle du corps, les os peuvent facilement cacher des tissus mous ou des organes. Le scanner CAT (tomographie axiale assistée par ordinateur) résout ce problème en collectant de nombreuses images radiographiques en « tranches » dans tout le corps. Un traitement informatique complexe de l'absorption relative des rayons X, dans différentes directions, peut produire une image radiographique tridimensionnelle très détaillée du corps.
Les rayons X peuvent également être utilisés pour sonder les structures des atomes et des molécules. Considérez les rayons X incidents à la surface d'un solide cristallin. Certains photons de rayons X sont réfléchis à la surface, tandis que d'autres sont réfléchis sur le « plan » des atomes situés juste sous la surface. L'interférence entre ces photons, pour différents angles d'incidence, produit une belle image sur un écran (Figure\(\PageIndex{10}\)). L'interaction des rayons X avec un solide est appelée diffraction des rayons X. L'exemple le plus connu utilisant la diffraction des rayons X est la découverte de la structure en double hélice de l'ADN.



