17.1 : Isotopes radioactifs
- Page ID
- 167803
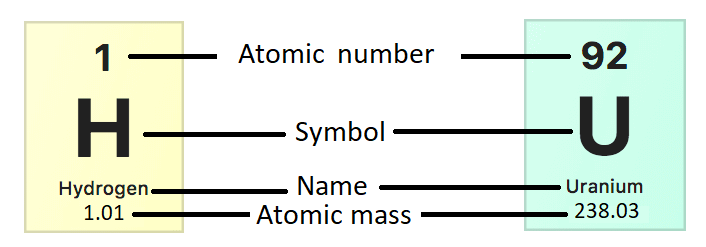
Rappelons qu'un atome est le plus petit composant d'un élément qui conserve toutes les propriétés chimiques de cet élément (voir Matière). Comme indiqué précédemment, les atomes contiennent des neutrons non chargés et des protons chargés positivement dans le noyau. Des électrons chargés négativement entourent le noyau. La masse atomique d'un atome est déterminée par le nombre de protons et de neutrons car la masse des électrons est négligeable. Chaque proton ou neutron pèse 1 unité de masse atomique (UMA). Les valeurs de masse atomique affichées dans le tableau périodique des éléments ne sont pas des nombres entiers car elles représentent la masse atomique moyenne des atomes de cet élément (figure\(\PageIndex{a}\)). Les atomes d'un même élément n'ont pas nécessairement la même masse car ils peuvent avoir un nombre de neutrons différent.
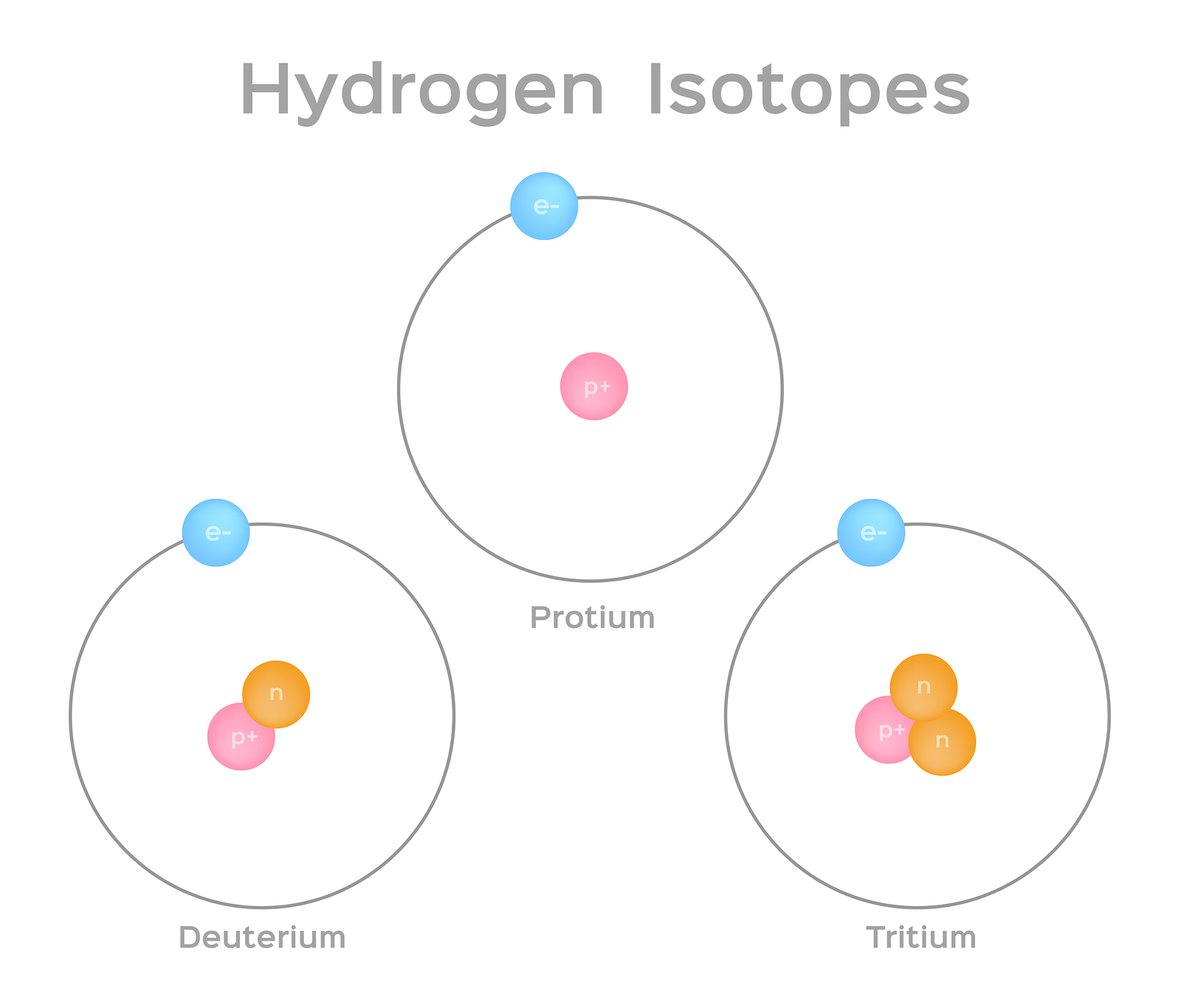
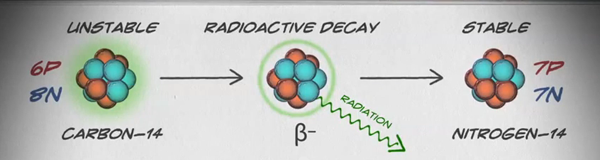
Les isotopes sont des formes différentes d'un même élément qui contiennent le même nombre de protons, mais un nombre différent de neutrons. Certains éléments, tels que le carbone, le potassium et l'uranium, contiennent des isotopes naturels. Le carbone 12, l'isotope le plus courant du carbone, contient six protons et six neutrons. Il a donc un nombre de masse de 12 (six protons et six neutrons) et un numéro atomique de 6 (ce qui en fait du carbone). Le carbone 14 contient six protons et huit neutrons. Il a donc un nombre de masse de 14 (six protons et huit neutrons) et un numéro atomique de 6, ce qui signifie qu'il s'agit toujours de l'élément carbone. Ces deux formes alternatives de carbone sont des isotopes. Certains isotopes sont instables et émettent des radiations sous forme de particules et d'énergie pour former des éléments plus stables. Certaines formes de rayonnement sont dangereuses. Ils sont appelés isotopes radioactifs ou radio-isotopes (figure\(\PageIndex{b}\)). Au cours de la désintégration radioactive, un type d'atome peut se transformer en un autre type d'atome de cette manière (figure\(\PageIndex{c}\)).
Demi-vie
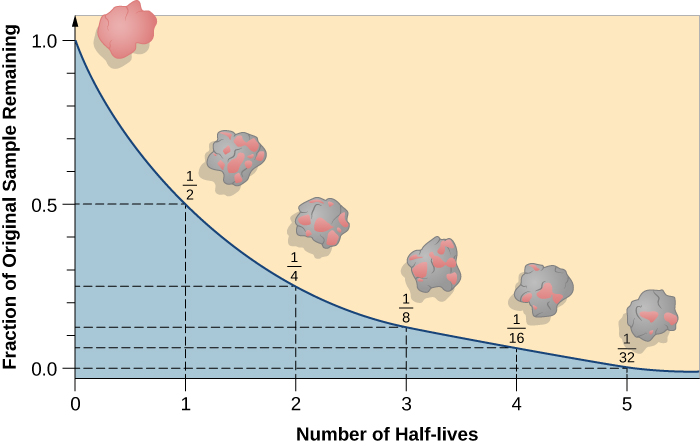
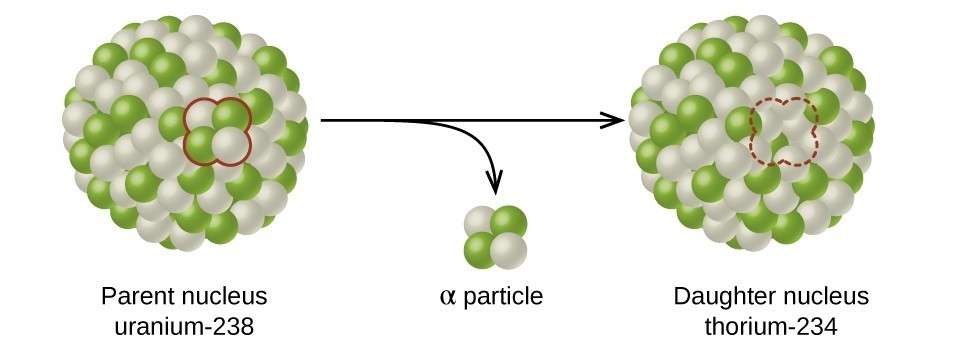
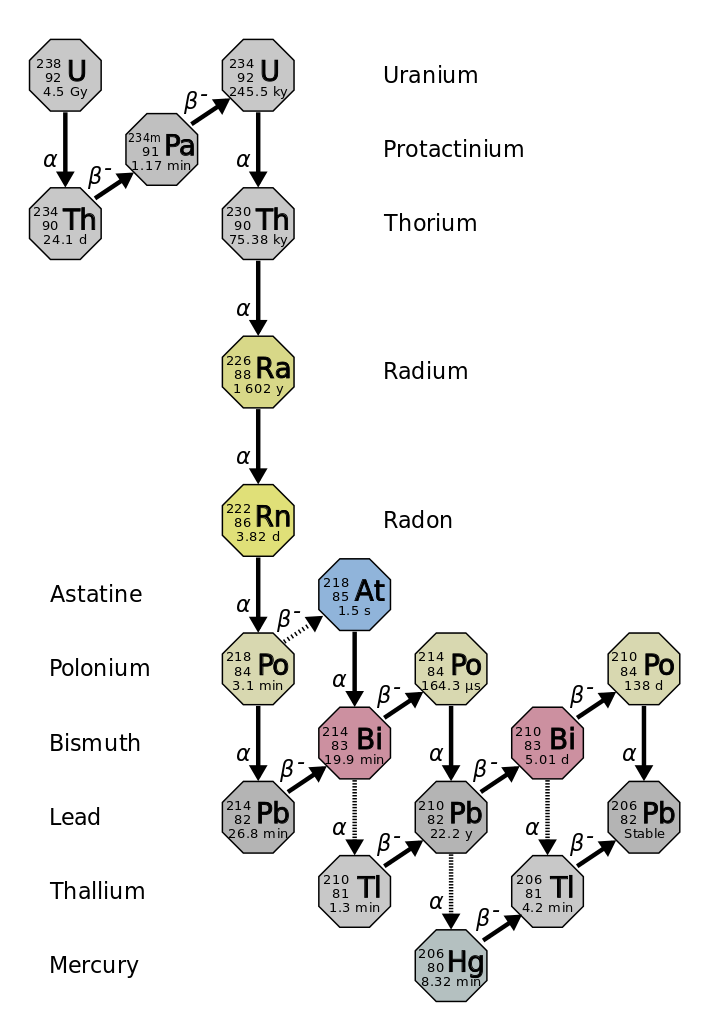
La demi-vie est le temps nécessaire à la désintégration de la moitié de l'isotope radioactif d'origine (figure\(\PageIndex{d}\)). Par exemple, la demi-vie de l'uranium 238 est d'environ 4,5 milliards d'années. Après 4,5 milliards d'années, il ne restera que la moitié (50 %) de la quantité initiale d'uranium 238. Le reste se sera désintégré en thorium-234 (qui est également radioactif et se désintègre rapidement en une série d'isotopes radioactifs, jusqu'à ce qu'il devienne finalement du plomb-206, qui est stable ; figure\(\PageIndex{e-f}\)). Après deux demi-vies (9 milliards d'années), seule la moitié des 50 % resteraient (25 % de la durée initiale). Après trois demi-vies, il ne resterait que 12,5 % de l'uranium 238 d'origine.
L'évolution en action : Datation au carbone
Le carbone 14 (14 C) est un radio-isotope naturel créé dans l'atmosphère par les rayons cosmiques. Il s'agit d'un processus continu, donc plus de 14 C est toujours créé. Au fur et à mesure qu'un organisme vivant se développe, le niveau relatif de 14 C dans son corps est égal à la concentration de 14 C dans l'atmosphère. Lorsqu'un organisme meurt, il n'ingère plus de 14 C, donc le ratio diminue. Le 14 C se désintègre en 14 N par un processus appelé désintégration bêta ; il dégage de l'énergie au cours de ce processus lent (figure\(\PageIndex{c}\)). Après environ 5 730 ans, seule la moitié de la concentration initiale de 14 C aura été convertie en 14 N. Le temps qu'il faut à la moitié de la concentration initiale d'un isotope pour se désintégrer et prendre sa forme la plus stable est appelé demi-vie.
Comme la demi-vie du 14° C est longue, il est utilisé pour vieillir des objets autrefois vivants, tels que des fossiles. En utilisant le rapport entre la concentration de 14 C trouvée dans un objet et la quantité de 14 C détectée dans l'atmosphère, la quantité d'isotope qui ne s'est pas encore désintégrée peut être déterminée. Sur la base de cette quantité, l'âge du fossile peut être calculé à environ 50 000 ans (figure\(\PageIndex{g}\) ci-dessous). Les isotopes ayant des demi-vies plus longues, tels que le potassium 40, sont utilisés pour calculer l'âge des fossiles plus anciens. Grâce à la datation au carbone, les scientifiques peuvent reconstituer l'écologie et la biogéographie des organismes vivant au cours des 50 000 dernières années.
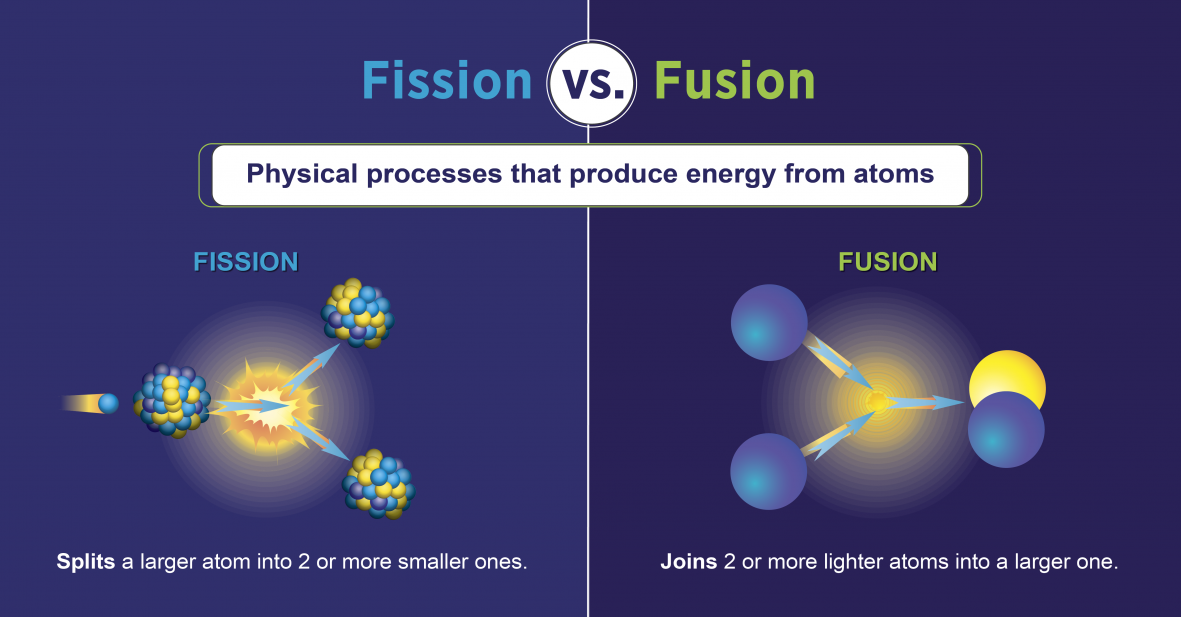
Réactions de fission nucléaire
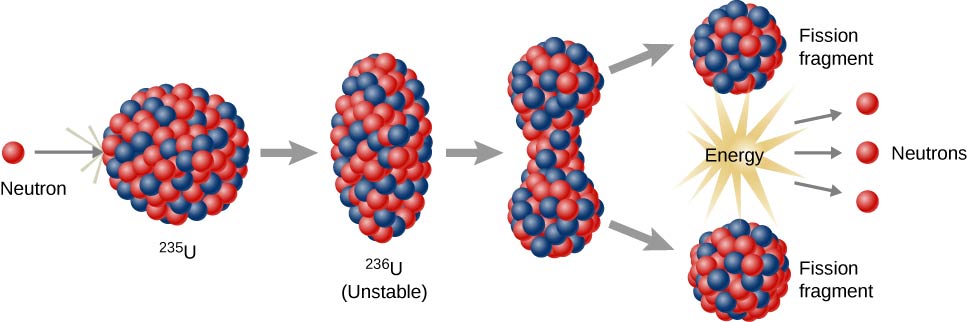
Les réactions de fission nucléaire sont celles qui impliquent la division du noyau d'un atome (figure\(\PageIndex{h}\)). Ils peuvent être induits en projetant des éléments radioactifs avec des neutrons. Comme pour la désintégration radioactive naturelle, les réactions de fission nucléaire induites libèrent de l'énergie. L'énergie thermique dégagée lors de la fission nucléaire peut être utilisée pour produire de l'électricité. C'est la base de l'énergie nucléaire. Actuellement, l'uranium 235 (235 U ; un isotope de l'uranium d'une masse atomique de 235) est actuellement utilisé comme combustible pour les réactions de fission nucléaire (figure\(\PageIndex{h}\)).