14.3 : Élevage sélectif et génie génétique
- Page ID
- 167704
Le développement d'une nouvelle variété végétale est un exemple de biotechnologie agricole, une gamme d'outils qui inclut à la fois des techniques de sélection traditionnelles et des méthodes de laboratoire plus modernes. Les méthodes traditionnelles remontent à des milliers d'années, tandis que la biotechnologie utilise les outils du génie génétique développés au cours des dernières décennies.
Élevage sélectif (sélection artificielle)
Presque tous les fruits et légumes que vous trouverez sur votre marché local ne sont pas d'origine naturelle. En fait, ils n'existent que grâce à une intervention humaine qui a débuté il y a des milliers d'années. Les humains ont créé la grande majorité des espèces cultivées en utilisant des pratiques de sélection traditionnelles sur des plantes sauvages naturelles. Ces pratiques reposent sur l'élevage sélectif (sélection artificielle), la reproduction facilitée par l'homme d'individus présentant des caractéristiques souhaitables. Par exemple, des variétés à haut rendement ont été produites par sélection sélective. Les pratiques de sélection traditionnelles, bien que peu techniques et simples à mettre en œuvre, ont pour résultat pratique de modifier les informations génétiques d'un organisme, produisant ainsi de nouveaux caractères.
La sélection sélective est toutefois limitée par le cycle de vie de la plante et les variants génétiques naturellement présents. Par exemple, même la variété de maïs qui fleurit le plus rapidement a une durée de génération de 60 jours (le temps nécessaire pour qu'une graine germe, produise une plante mature, soit pollinisée et, en fin de compte, produise plus de graines) dans des conditions idéales. Chaque génération offre la possibilité de sélectionner des plantes individuelles et de générer des graines légèrement plus proches du résultat souhaité (par exemple, produire des grains plus gros et plus juteux). De plus, si aucun individu ne possède de variants génétiques qui produisent des grains plus gros et plus juteux, il n'est pas possible de sélectionner artificiellement ce trait. Enfin, la sélection traditionnelle mélange tous les gènes des deux individus élevés, qui peuvent atteindre des dizaines de milliers (le maïs, par exemple, possède 32 000 gènes). Lorsque vous mélangez un si grand nombre de gènes, les résultats peuvent être imprévisibles.
Le maïs en est un exemple intéressant. Des biologistes ont découvert que le maïs a été développé à partir d'une plante sauvage appelée téosinte. Grâce à des pratiques de sélection traditionnelles, les humains vivant il y a des milliers d'années dans ce qui est aujourd'hui le sud du Mexique ont commencé à sélectionner les caractères souhaitables jusqu'à ce qu'ils soient en mesure de transformer la plante en ce que l'on appelle aujourd'hui le maïs (figure\(\PageIndex{a}\)). Ce faisant, ils ont modifié ses instructions génétiques de façon permanente (et sans le savoir).
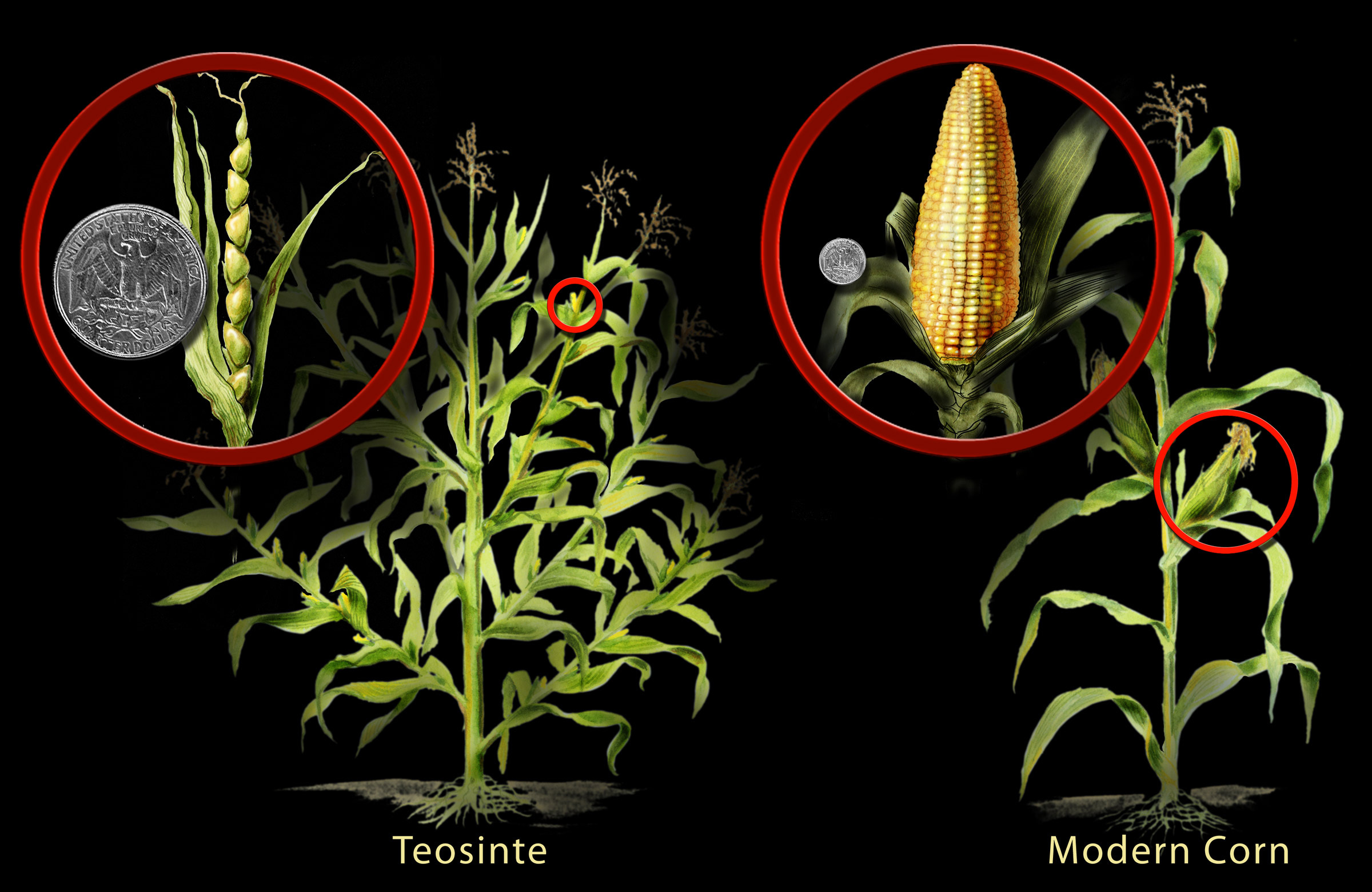
Cette histoire de modification génétique est commune à presque toutes les espèces cultivées. Par exemple, le chou, le brocoli, les choux de Bruxelles, le chou-fleur et le chou frisé ont tous été développés à partir d'une seule espèce de moutarde sauvage (figure\(\PageIndex{b}\)). La morelle sauvage était à l'origine des tomates, des aubergines, du tabac et des pommes de terre, ces dernières ayant été développées par les humains il y a 7 000 à 10 000 ans en Amérique du Sud.

Génie génétique
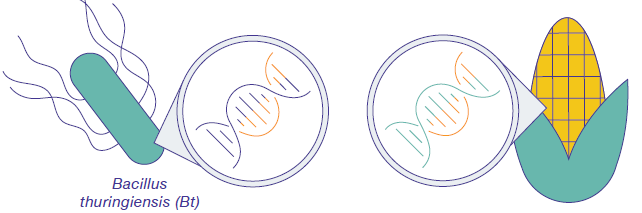
Le génie génétique est le processus qui consiste à modifier directement l'ADN d'un organisme afin de produire les cultures souhaitées plus rapidement que la sélection sélective. Comme les gènes peuvent être obtenus à partir d'autres espèces ou même synthétisés en laboratoire, les scientifiques ne sont pas limités par la variation génétique existante au sein d'une espèce cultivée (ou d'espèces étroitement apparentées avec lesquelles ils peuvent être croisés). Cela élargit les caractéristiques qui peuvent être ajoutées aux cultures. Le génie génétique moderne est plus précis que la sélection sélective en ce sens que les biologistes ne peuvent modifier qu'un seul gène. De plus, le génie génétique peut introduire un gène entre deux espèces apparentées, par exemple en insérant un gène bactérien dans une plante (figure\(\PageIndex{c}\)).
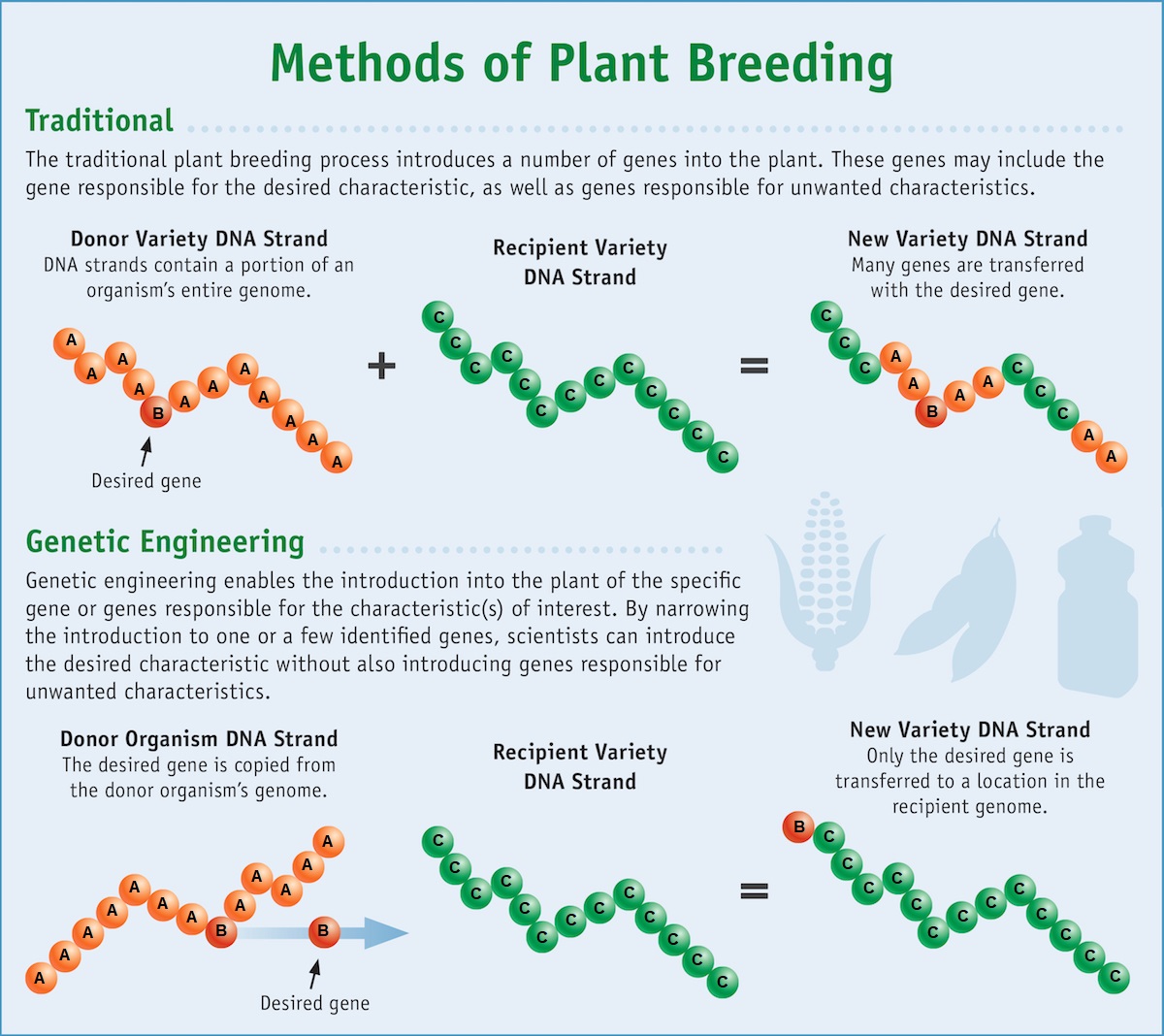
Les organismes génétiquement modifiés (OGM) sont ceux dont l'ADN a été modifié par génie génétique. Les cultures génétiquement modifiées sont parfois appelées cultures génétiquement modifiées (GM). Les organismes transgéniques sont un type d'organisme génétiquement modifié qui contient des gènes d'une espèce différente. Comme ils contiennent des combinaisons uniques de gènes et qu'ils ne sont pas limités au laboratoire, les plantes transgéniques et autres OGM sont étroitement surveillés par les agences gouvernementales afin de s'assurer qu'ils sont propres à la consommation humaine et ne mettent pas en danger d'autres formes de vie végétale et animale. Comme ces gènes étrangers (transgènes) peuvent se propager à d'autres espèces présentes dans l'environnement, en particulier dans le pollen et les graines des plantes, des tests approfondis sont nécessaires pour garantir la stabilité écologique.
Comment modifier génétiquement les cellules végétales
L'ADN peut être inséré dans les cellules végétales par diverses techniques. Par exemple, un pistolet à gènes propulse l'ADN lié à des particules d'or dans des cellules végétales. (L'ADN est chargé négativement et s'accroche à l'or chargé positivement.) Une approche plus traditionnelle utilise le pathogène végétal Agrobacterium tumefaciens (figure\(\PageIndex{d}\)). Habituellement, cette bactérie provoque la maladie de la galle du collet chez les plantes en insérant un fragment circulaire d'ADN, appelé plasmide Ti, dans les cellules végétales. Cet ADN s'intègre aux chromosomes des plantes, leur donnant les gènes nécessaires à la production de la galle (figure\(\PageIndex{e}\)), qui abrite le pathogène bactérien.
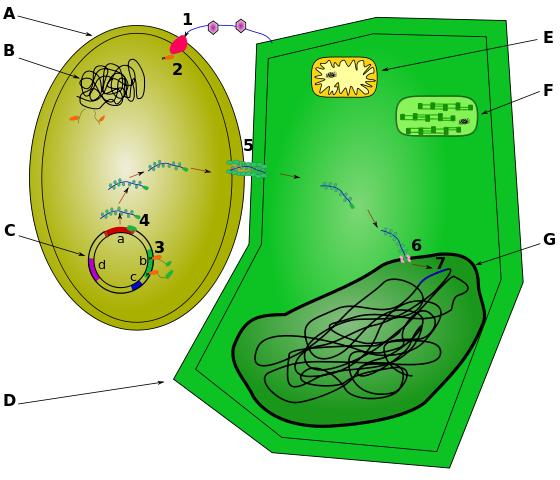

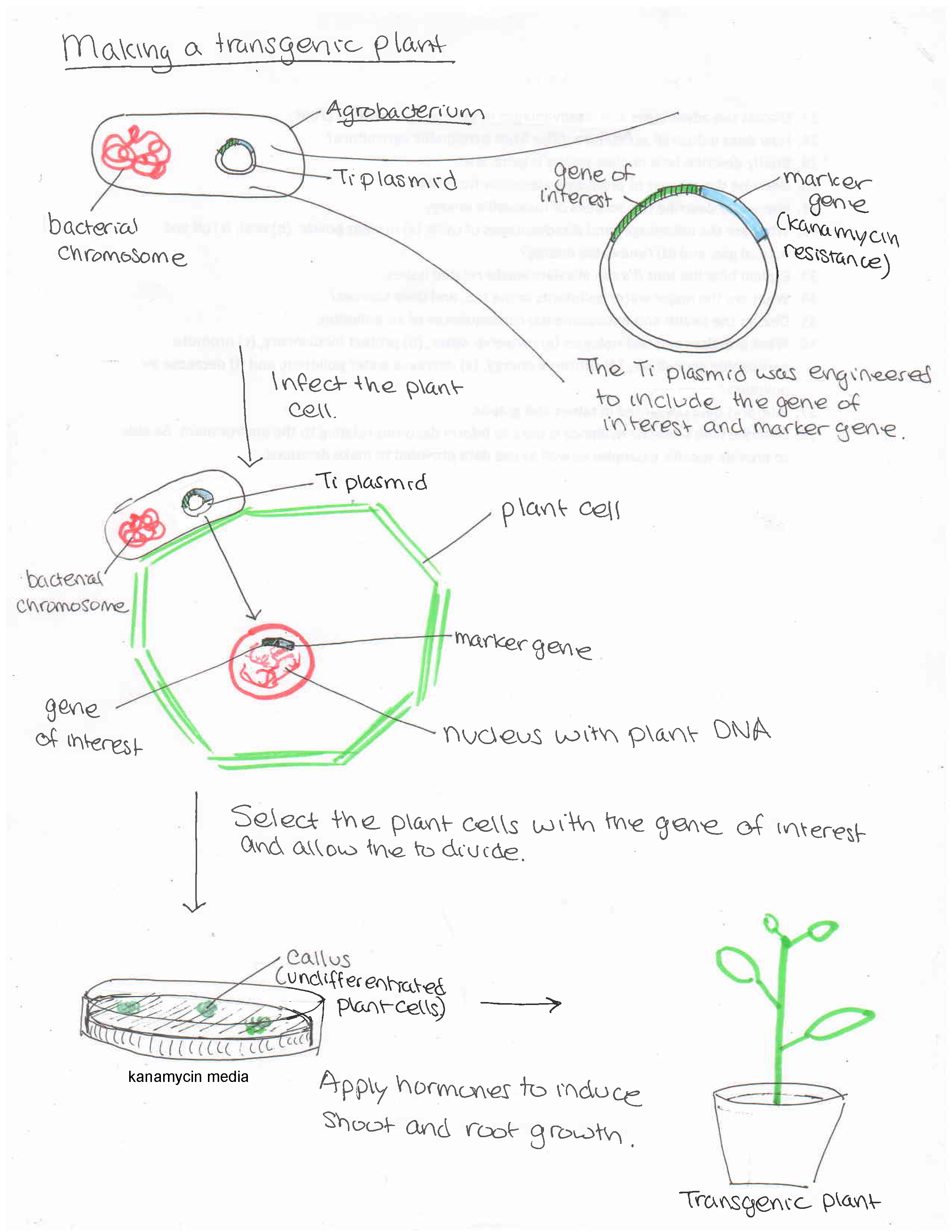
Les scientifiques modifient le processus par lequel Agrobacterium infecte et modifie génétiquement les cellules végétales pour produire des plantes génétiquement modifiées présentant des caractéristiques bénéfiques pour l'agriculture comme suit (figure\(\PageIndex{f}\)) :
- L'ADN-T, qui code pour la galle coronaire, est retiré du plasmide Ti et les gènes des caractères souhaités sont ajoutés.
- Le plasmide modifié est ensuite ajouté à Agrobacterium.
- L'agrobactérie infecte les cellules végétales indifférenciées (cellules souches qui peuvent se développer dans n'importe quelle partie de la plante ; figure\(\PageIndex{g}\)).
- Les cellules végétales modifiées reçoivent des hormones pour produire la plante entière.

Exemples de cultures génétiquement modifiées
De nombreuses cultures génétiquement modifiées ont été approuvées aux États-Unis et produisent nos aliments. Le premier organisme génétiquement modifié approuvé par la Food and Drug Administration (FDA) des États-Unis en 1994 était la tomate Flavr Savr™, dont la durée de conservation est plus longue (pourriture différée) car un gène responsable de la dégradation des cellules est inhibé. Les tomates Flavr Savr sont génétiquement modifiées (parce que leur ADN a été altéré) mais non transgéniques (car elles ne contiennent pas de gènes d'une autre espèce). La tomate Flavr Savr n'a pas réussi à se maintenir sur le marché en raison de problèmes de conservation et d'expédition de la récolte. Le riz doré produit du β-carotène, un précurseur de la vitamine A (figure\(\PageIndex{h}\) ; le β-carotène est également présent en forte concentration dans les carottes, les patates douces et le cantaloup, ce qui leur donne leur couleur orange.) Le maïs, le coton et le soja Roundup Ready® sont résistants à cet herbicide courant, ce qui permet de le pulvériser uniformément dans un champ pour tuer les mauvaises herbes sans endommager les cultures (figure\(\PageIndex{i}\)).


Les cultures ont également été conçues pour produire des insecticides. Bacillus thuringiensis (Bt) est une bactérie qui produit des cristaux de protéines toxiques pour de nombreuses espèces d'insectes qui se nourrissent de plantes. Les insectes qui ont mangé de la toxine Bt cessent de se nourrir des plantes en quelques heures. Une fois la toxine activée dans les intestins des insectes, la mort survient en quelques jours. Le gène responsable de la production de la toxine Bt a été ajouté à de nombreuses cultures, notamment le maïs (figure\(\PageIndex{j}\)), les pommes de terre et le coton, fournissant ainsi aux plantes une défense contre les insectes.
Les aliments génétiquement modifiés sont très répandus aux États-Unis. Par exemple, 94 % des cultures de soja ont été génétiquement modifiées pour résister aux herbicides en 2020. De même, 8 % des cultures de coton et 10 % des cultures de maïs ont été modifiées pour leur résistance aux herbicides, en plus des 83 % des cultures de coton et de 79 % des cultures de maïs qui ont été génétiquement modifiées de multiples manières.
Des animaux génétiquement modifiés ont également récemment fait leur entrée sur le marché. Les saumons AquaAdvantage® ont été modifiés pour croître plus rapidement et ont été approuvés en novembre 2015. Cependant, en mars 2021, ils n'avaient toujours pas été vendus en raison de contestations judiciaires. En 2020, la FDA a approuvé les porcs GalSafe™ pour la production de médicaments et d'aliments. Ces porcs n'ont pas de molécule à l'extérieur de leurs cellules qui provoque des allergies chez certaines personnes.
Avantages des cultures génétiquement modifiées
Les progrès de la biotechnologie peuvent fournir aux consommateurs des aliments enrichis sur le plan nutritionnel, qui durent plus longtemps ou qui contiennent des niveaux plus faibles de certaines toxines naturelles présentes dans certaines plantes alimentaires. Par exemple, des chercheurs ont recours à la biotechnologie pour tenter de réduire les graisses saturées dans les huiles de cuisson et de réduire les allergènes dans les aliments. Reste à savoir si ces avantages profiteront aux personnes qui en ont le plus besoin. Bien que la culture du riz doré puisse remédier à la carence en vitamine A chez des millions de personnes, ce riz n'a toujours pas été accessible à ces personnes car il est breveté et coûteux. De même, les semences génétiquement modifiées pourraient augmenter les revenus des agriculteurs pauvres si elles étaient disponibles à faible coût ou gratuitement, mais ce n'est pas toujours le cas.
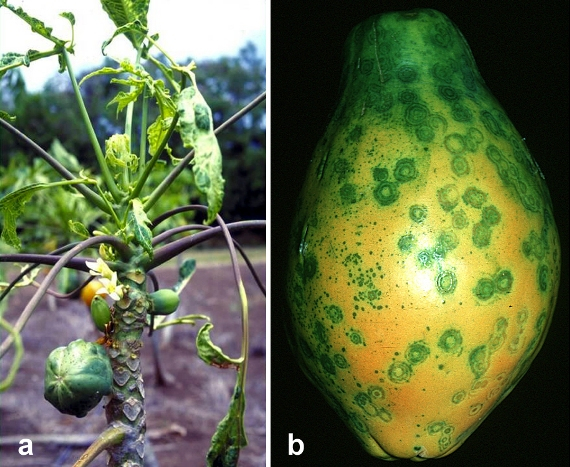
Les papayes Rainbow et SunUp illustrent bien les avantages que peuvent apporter les cultures génétiquement modifiées aux petits agriculteurs et à l'économie en général. Au début des années 1990, une maladie émergente détruisait la production de papaye d'Hawaï et menaçait de décimer l'industrie de 11 millions de dollars (figure\(\PageIndex{k}\)). Heureusement, un homme du nom de Dennis Gonsalves (figure\(\PageIndex{l}\)), qui a grandi dans une plantation de canne à sucre puis est devenu physiologiste des plantes à l'université Cornell, a développé des plants de papaye génétiquement modifiés pour résister au virus mortel. À la fin de la décennie, l'industrie de la papaye hawaïenne et les moyens de subsistance de nombreux agriculteurs ont été sauvés grâce à la distribution gratuite des graines du Dr Gonsalves.

L'effet des cultures génétiquement modifiées sur l'environnement dépend de la modification génétique spécifique et des pratiques agricoles qu'elle promeut. Par exemple, les cultures Bt produisent leurs propres insecticides, de sorte que l'application externe de ces produits chimiques n'est pas nécessaire, ce qui réduit les impacts négatifs de l'agriculture industrielle. Les recherches en cours visent à déterminer si les cultures peuvent être modifiées de manière à fixer l'azote dans l'atmosphère (comme le font certaines bactéries) plutôt que de dépendre de l'ammonium, des nitrites et des nitrates présents dans le sol. Si ces cultures étaient conçues avec succès, elles pourraient réduire l'application d'engrais synthétiques et minimiser le ruissellement des nutriments qui entraîne l'eutrophisation.
Les cultures génétiquement modifiées peuvent avoir le potentiel de conserver les ressources naturelles, de permettre aux animaux d'utiliser plus efficacement les nutriments présents dans les aliments pour animaux et de contribuer à répondre à la demande mondiale croissante en nourriture et en terres. Dans la pratique, cependant, les pays qui utilisent des cultures génétiquement modifiées sont comparés à ceux qui ne bénéficient pas seulement d'une légère augmentation (voire inexistante) de leur rendement.
Inconvénients des cultures génétiquement modifiées
Préoccupations sociales
Les droits de propriété intellectuelle sont l'un des facteurs importants du débat actuel sur les cultures génétiquement modifiées. Les cultures génétiquement modifiées peuvent être brevetées par les entreprises agroalimentaires, ce qui peut les amener à contrôler et potentiellement exploiter les marchés agricoles. Certains accusent des entreprises, comme Monsanto, de contrôler prétendument la production et les prix des semences, au détriment des agriculteurs (figure\(\PageIndex{m}\)).
Préoccupations environnementales
Les cultures génétiquement modifiées présentent plusieurs préoccupations environnementales. La monoculture réduit déjà la biodiversité, et la culture de cultures génétiquement modifiées, pour lesquelles les plantes individuelles sont très similaires sur le plan génétique, ne fait qu'exacerber cette situation. L'utilisation des cultures Roundup Ready ® encourage naturellement l'utilisation généralisée d'herbicides, qui pourraient tuer involontairement les plantes indigènes voisines. Cette pratique augmenterait également les résidus d'herbicides sur les fruits et légumes. Les cultures Bt sont bénéfiques en ce sens qu'elles ne nécessitent pas d'application externe d'insecticide, mais la toxine Bt se répand dans leur pollen. Une première étude a révélé que le pollen de maïs Bt peut être nocif pour les chenilles monarques (figure\(\PageIndex{n}\)), mais uniquement à des concentrations rarement atteintes dans la nature. Des études de suivi ont révélé que la majeure partie du maïs Bt cultivé ne nuisait pas aux monarques ; toutefois, la seule souche de maïs Bt a été retirée du marché.

Par le biais de croisements ou d'hybridations, les cultures génétiquement modifiées peuvent partager leurs transgènes avec des espèces sauvages apparentées. Cela pourrait affecter la génétique de ces espèces sauvages apparentées et avoir des conséquences imprévues sur leurs populations et pourrait même avoir des implications pour l'ensemble de l'écosystème. Par exemple, si un gène modifié pour conférer une résistance aux herbicides devait passer d'une culture génétiquement modifiée à un parent sauvage, cela pourrait transformer l'espèce sauvage en une super mauvaise herbe, une espèce qui ne pourrait pas être contrôlée par un herbicide. Sa croissance effrénée pourrait alors déplacer d'autres espèces sauvages et la faune qui en dépendent, entraînant ainsi des dommages écologiques.
Non seulement les gènes échappés peuvent modifier les espèces de mauvaises herbes, mais ils peuvent également pénétrer dans les populations d'espèces indigènes. Cela pourrait faire de certaines espèces indigènes de meilleurs compétiteurs qu'elles ne l'étaient auparavant, perturbant ainsi la dynamique des écosystèmes. (Ils pourraient potentiellement concurrencer d'autres espèces indigènes avec lesquelles ils coexisteraient autrement.)
Bien qu'il existe des preuves d'un transfert génétique entre des plantes génétiquement modifiées et des espèces sauvages apparentées, il n'existe pas encore de preuves de dommages écologiques liés à ce transfert. De toute évidence, une surveillance continue, en particulier pour les nouvelles cultures, est justifiée.
La fuite d'animaux génétiquement modifiés est également susceptible de perturber les écosystèmes. Par exemple, si le saumon AquaAdvantage devait s'échapper dans un écosystème naturel, comme le font souvent les poissons d'élevage, il pourrait surpasser le saumon indigène, y compris les espèces menacées. Leur modification génétique, qui facilite une croissance rapide, pourrait se traduire par un avantage concurrentiel.
Préoccupations de santé
Outre les risques environnementaux, certaines personnes s'inquiètent des risques potentiels pour la santé des cultures génétiquement modifiées, car elles estiment que la modification génétique altère les propriétés intrinsèques, ou l'essence, d'un organisme. Comme nous l'avons vu plus haut, on sait toutefois que les pratiques de sélection traditionnelles et le génie génétique moderne produisent des changements génétiques permanents. De plus, l'élevage sélectif a en fait un impact plus important et plus imprévisible sur la génétique d'une espèce en raison de sa nature relativement rudimentaire.
Pour répondre à ces préoccupations (et à d'autres), les Académies nationales des sciences, de l'ingénierie et de la médecine des États-Unis (NASEM) ont publié en 2016 un rapport complet de 500 pages résumant les connaissances scientifiques actuelles concernant les cultures génétiquement modifiées. Le rapport, intitulé Genetically Engineered Crops : Experiences and Prospects, a passé en revue plus de 900 articles de recherche, en plus des commentaires publics et des témoignages d'experts. Le rapport sur les cultures génétiquement modifiées du NASEM n'a trouvé « aucune preuve étayée d'une différence en matière de risques pour la santé humaine entre les cultures génétiquement modifiées (GE) actuellement disponibles dans le commerce et les cultures cultivées de manière conventionnelle, pas plus qu'il n'a trouvé de preuves concluantes de cause à effet de problèmes environnementaux liés aux cultures GM ». En outre, l'Organisation des Nations unies pour l'alimentation et l'agriculture a conclu que les risques pour la santé humaine et animale liés à l'utilisation d'OGM sont négligeables. Le consensus scientifique sur les cultures génétiquement modifiées est très clair : elles ne présentent aucun danger pour la consommation humaine.
Le potentiel allergène des cultures génétiquement modifiées est l'un des effets nocifs potentiels sur la santé, et il convient de continuer à l'étudier, en particulier parce que certaines preuves scientifiques indiquent que les animaux nourris avec des cultures génétiquement modifiées ont subi des dommages. Le rapport sur les cultures GM du NASEM a conclu que, lors du développement de nouvelles cultures, c'est le produit qui doit être étudié pour déterminer les risques potentiels pour la santé et l'environnement, et non le processus qui a permis d'obtenir ce produit. Cela signifie que, dans la mesure où les pratiques de sélection traditionnelles et le génie génétique moderne produisent de nouveaux caractères par le biais de modifications génétiques, elles présentent toutes deux des risques potentiels. Ainsi, pour la sécurité de l'environnement et de la santé humaine, les deux devraient être étudiées de manière adéquate.
Les cultures génétiquement modifiées sont-elles la solution dont nous avons besoin ?
D'importantes ressources, à la fois financières et intellectuelles, ont été allouées pour répondre à la question suivante : les cultures génétiquement modifiées sont-elles sûres pour la consommation humaine ? Après plusieurs centaines d'études scientifiques, la réponse est oui. Mais une question importante demeure : sont-elles nécessaires ? Assurément, comme dans des cas tels que la papaye d'Hawaï, qui était menacée d'éradication en raison d'une maladie agressive, le génie génétique était une solution rapide et efficace qui aurait été extrêmement difficile, voire impossible, à résoudre en utilisant les pratiques de sélection traditionnelles.
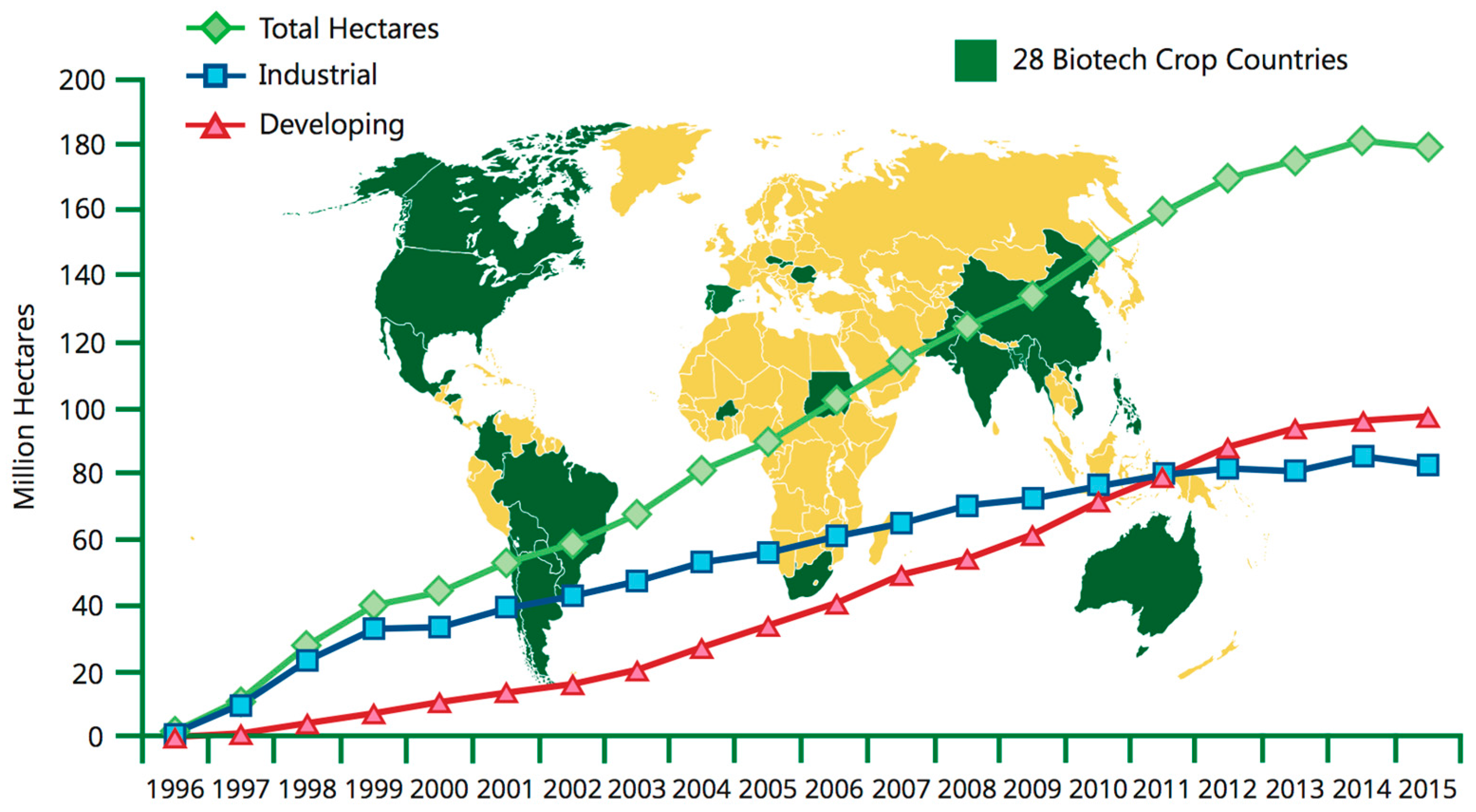
Cependant, dans de nombreux cas, les premières promesses des cultures génétiquement modifiées, à savoir qu'elles amélioreraient la qualité nutritionnelle des aliments, conféreraient une résistance aux maladies et amélioreraient sans précédent les rendements des cultures, n'ont en grande partie pas porté leurs fruits. Le rapport sur les cultures génétiquement modifiées de la NASEM indique que si les cultures génétiquement modifiées ont permis de réduire les pertes agricoles causées par les ravageurs, de réduire l'utilisation de pesticides et de réduire les taux de blessures causées par les insecticides pour les travailleurs agricoles, elles n'ont pas augmenté le rythme auquel les rendements des cultures augmentent par rapport aux cultures non GM cultures. En outre, bien qu'il existe quelques exceptions notables, comme le riz doré ou les papayes résistantes aux virus, très peu de cultures génétiquement modifiées ont été produites pour augmenter la capacité nutritionnelle ou pour prévenir les maladies des plantes qui peuvent dévaster les revenus des agriculteurs et réduire la sécurité alimentaire. La grande majorité des cultures génétiquement modifiées ne sont développées que pour deux raisons : introduire une résistance aux herbicides ou une résistance aux ravageurs. Les cultures génétiquement modifiées sont concentrées dans les pays développés et leur disponibilité dans les pays en développement, où elles sont peut-être les plus nécessaires, est limitée (figure\(\PageIndex{o}\)).
Lectures supplémentaires suggérées
NASEM. 2016. Cultures génétiquement modifiées : expériences et perspectives.
Atmissions
Modifié par Melissa Ha à partir des sources suivantes :
- Biotechnologie et génie génétique à partir de la biologie environnementale par Matthew R. Fisher (sous licence CC-BY)
- Biotechnologie en médecine et en agriculture à partir de Concepts in Biology par OpenStax (sous licence CC-BY)


