7.2 : Matière
- Page ID
- 167424
La matière est la « matière » que l'on trouve dans les écosystèmes. Techniquement, la matière est définie comme tout ce qui occupe l'espace ou possède une masse. La masse est la résistance à l'accélération. En termes plus simples, la masse est similaire au poids, mais le poids tient compte de l'accélération due à la gravité. La matière se déplace entre les composants biotiques et abiotiques de l'écosystème par le biais de cycles biogéochimiques. Pour bien comprendre ces cycles, il faut avoir une connaissance approfondie des particules qui composent la matière, les atomes.
Atomes et molécules
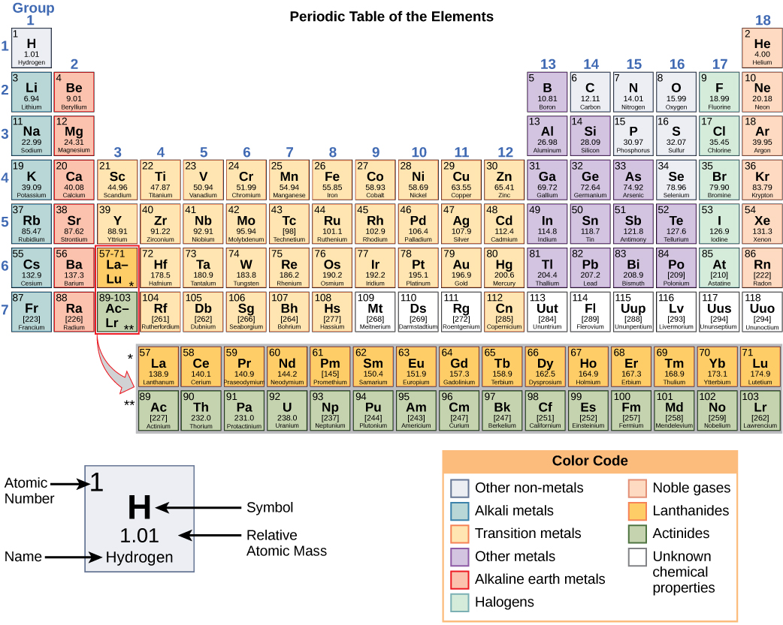
Les éléments sont des substances qui ne peuvent pas être décomposées ou transformées chimiquement en d'autres substances (figure\(\PageIndex{a}\)). Au total, 118 éléments ont été définis ; toutefois, seuls 92 sont présents à l'état naturel et moins de 30 se trouvent dans les organismes. Les 26 éléments restants sont instables et n'existent donc pas depuis très longtemps ou sont théoriques et n'ont pas encore été détectés. Chaque élément est désigné par son symbole chimique (tel que H, N, O, C et Na) et possède des propriétés uniques. Ces propriétés uniques permettent aux éléments de se combiner et de se lier les uns aux autres de manière spécifique.
Un atome est le plus petit composant d'un élément qui conserve toutes les propriétés chimiques de cet élément. Par exemple, un atome d'hydrogène possède toutes les propriétés de l'élément hydrogène, par exemple, qu'il existe sous forme de gaz à température ambiante et qu'il se lie à l'oxygène pour créer une molécule d'eau. Les atomes d'hydrogène ne peuvent pas être décomposés en éléments plus petits tout en conservant les propriétés de l'hydrogène. Si un atome d'hydrogène était décomposé en particules plus petites, il n'aurait plus les propriétés de l'hydrogène. Au niveau le plus élémentaire, tous les organismes sont constitués d'une combinaison d'éléments. Ils contiennent des atomes qui se combinent pour former des molécules. Les molécules peuvent interagir pour former les cellules, les unités structurales et fonctionnelles de la vie. Dans les organismes multicellulaires, tels que les animaux, ces cellules se combinent pour former des tissus, qui constituent les organes. Ces combinaisons se poursuivent jusqu'à la formation d'organismes multicellulaires entiers.
Les atomes se combinent pour former des molécules. Les molécules sont des produits chimiques composés de deux atomes ou plus liés entre eux. Certaines molécules sont très simples, comme l'O 2, qui est composé de seulement deux atomes d'oxygène. Certaines molécules utilisées par les organismes, comme l'ADN, sont composées de plusieurs millions d'atomes. Tous les atomes contiennent des protons, des électrons et des neutrons (figure\(\PageIndex{b}\)). La seule exception est l'hydrogène (H), qui n'est généralement composé que d'un proton et d'un électron. Un proton est une particule chargée positivement qui réside dans le noyau (le cœur de l'atome) d'un atome et qui a une masse de 1 et une charge de +1. Un électron est une particule chargée négativement qui se déplace dans l'espace entourant le noyau. En d'autres termes, il se trouve à l'extérieur du noyau. Il a une masse négligeable et une charge de -1. Les neutrons, comme les protons, se trouvent dans le noyau d'un atome. Ils ont une masse de 1 et sont gratuits. Les charges positives (protons) et négatives (électrons) s'équilibrent dans un atome neutre, qui a une charge nette nulle.
Chaque élément contient un nombre différent de protons et de neutrons, ce qui lui donne son propre numéro atomique et son propre numéro de masse. Le numéro atomique d'un élément est égal au nombre de protons que cet élément contient. Le nombre de masse est le nombre de protons plus le nombre de neutrons de cet élément. Il est donc possible de déterminer le nombre de neutrons en soustrayant le numéro atomique du nombre de masse.
Liaisons chimiques
La façon dont les éléments interagissent entre eux dépend du nombre d'électrons et de la façon dont ils sont disposés. Lorsqu'un atome ne contient pas le même nombre de protons et d'électrons, on parle d'ion. Comme le nombre d'électrons n'est pas égal au nombre de protons, chaque ion possède une charge nette. Par exemple, si le sodium perd un électron, il possède désormais 11 protons et seulement 10 électrons, ce qui lui laisse une charge globale de +1. Les ions positifs se forment en perdant des électrons et sont appelés cations. Les ions négatifs se forment en gagnant des électrons et sont appelés anions. Les noms anioniques élémentaires sont modifiés pour se terminer par -ide. Par exemple, lorsque le chlore devient un ion, on parle de chlorure.
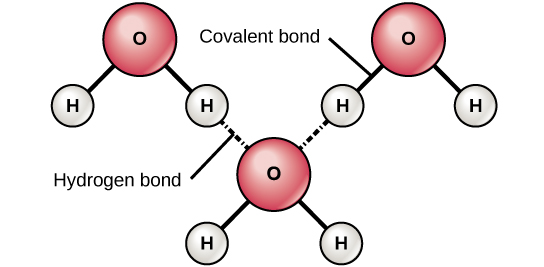
Les liaisons ioniques et covalentes sont des liaisons fortes formées entre deux atomes. Ces liaisons maintiennent les atomes ensemble dans un état relativement stable. Des liaisons ioniques se forment entre deux ions de charge opposée (un anion et un cation). Comme les charges positives et négatives s'attirent, ces ions sont maintenus ensemble, un peu comme le feraient deux aimants de charge opposée. Les liaisons covalentes se forment lorsque les électrons sont partagés entre deux atomes. Chaque atome partage l'un de ses électrons, qui tourne ensuite autour des noyaux des deux atomes, maintenant les deux atomes ensemble. Les liaisons covalentes sont la forme de liaison chimique la plus forte et la plus courante chez les organismes. Contrairement à la plupart des liaisons ioniques, les liaisons covalentes ne se dissocient pas dans l'eau. Les liaisons hydrogène se forment lorsque les molécules ont une distribution inégale d'électrons et ont donc des extrémités partiellement positives et partiellement négatives. Ils sont ainsi attirés l'un par l'autre (figure\(\PageIndex{c}\)). Techniquement, les liaisons hydrogène se produisent uniquement entre l'hydrogène et l'oxygène (O), l'azote (N) ou le fluor (F). Parfois, des liaisons hydrogène relient différentes parties ou de grosses molécules, comme c'est le cas dans l'ADN et les protéines. Les liaisons hydrogène sont plus faibles que les liaisons ioniques et covalentes et peuvent se rompre facilement. (Notez que les liaisons hydrogène font partie des forces intermoléculaires les plus fortes, mais celles qui se produisent entre les molécules.)
Macromolécules biologiques
Les organismes contiennent de grosses molécules organiques appelées macromolécules biologiques. Les molécules organiques sont celles qui contiennent du carbone lié de manière covalente à l'hydrogène. (En revanche, les molécules inorganiques sont dépourvues de carbone lié à l'hydrogène et sont souvent plus simples que les molécules organiques.) De plus, ils peuvent contenir de l'oxygène, de l'azote, du phosphore, du soufre et d'autres éléments. Il existe quatre grandes classes de macromolécules biologiques : les glucides, les lipides, les protéines et les acides nucléiques. Chacun est un élément important de la cellule et remplit un large éventail de fonctions.
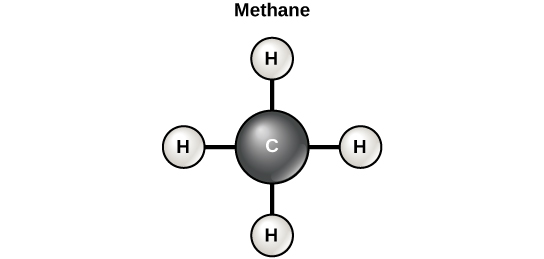
On dit souvent que la vie est « basée sur le carbone ». Cela signifie que les atomes de carbone, liés à d'autres atomes de carbone ou à d'autres éléments, constituent les composants fondamentaux de nombreuses molécules présentes uniquement dans les êtres vivants. D'autres éléments jouent un rôle important dans les molécules biologiques, mais le carbone est certainement considéré comme l'élément « de base » des molécules des êtres vivants. Ce sont les propriétés de liaison des atomes de carbone qui sont responsables de son rôle important. Le carbone peut former quatre liaisons covalentes avec d'autres atomes ou molécules. La molécule de carbone organique la plus simple est le méthane (CH 4), dans lequel quatre atomes d'hydrogène se lient à un atome de carbone (figure\(\PageIndex{d}\)).
Les glucides comprennent ce que l'on appelle communément les sucres simples, comme le glucose, et les glucides complexes tels que l'amidon. Alors que de nombreux types de glucides sont utilisés pour produire de l'énergie, certains sont utilisés pour la structure par la plupart des organismes, y compris les plantes et les animaux. Par exemple, la cellulose est un glucide complexe qui ajoute de la rigidité et de la résistance à la couche externe des cellules végétales (les parois cellulaires).
Les lipides comprennent un groupe diversifié de composés unis par une caractéristique commune : les lipides sont insolubles dans l'eau. Les lipides remplissent de nombreuses fonctions différentes dans une cellule. Les cellules stockent l'énergie pour une utilisation à long terme sous forme de lipides appelés graisses. Les lipides isolent également les plantes et les animaux de l'environnement. Par exemple, ils aident à garder les oiseaux et les mammifères aquatiques au sec en raison de leur nature hydrofuge. Les lipides sont également les éléments constitutifs de nombreuses hormones et constituent un constituant important des membranes qui entourent les cellules et forment bon nombre de leurs structures internes.
Les protéines sont l'une des molécules organiques les plus abondantes des systèmes vivants et possèdent la gamme de fonctions la plus diversifiée de toutes les macromolécules. Ce sont tous des polymères d'acides aminés. Les fonctions des protéines sont très diverses car il existe 20 acides aminés différents chimiquement distincts qui forment de longues chaînes, et les acides aminés peuvent être dans n'importe quel ordre. Les protéines peuvent jouer un rôle dans des réactions chimiques facilitées dans les organismes, telles que la photosynthèse, la transmission de messages sous forme d'hormones, la contraction des muscles, etc.
Les acides nucléiques sont de très grosses molécules qui jouent un rôle important dans la continuité de la vie. Ils contiennent le schéma génétique d'une cellule et donc les instructions relatives à sa fonctionnalité. Les deux principaux types d'acides nucléiques sont l'acide désoxyribonucléique (ADN) et l'acide ribonucléique (ARN). L'ADN est le matériel génétique présent dans tous les organismes, des bactéries unicellulaires aux mammifères multicellulaires. L'autre type d'acide nucléique, l'ARN, est principalement impliqué dans la synthèse des protéines. L'ADN et l'ARN sont constitués de petits éléments constitutifs appelés nucléotides. L'ADN a une belle structure à double hélice (Figure\(\PageIndex{e}\)).


