4.E : La deuxième loi de la thermodynamique (exercice)
- Page ID
- 191120
Questions conceptuelles
4.2 Processus réversibles et irréver
1. Donnez l'exemple d'un processus qui se produit dans la nature et qui est aussi presque réversible que possible.
4.3 Moteurs thermiques
2. Expliquez en termes pratiques pourquoi l'efficacité est définie comme\(\displaystyle W/Q_h\).
4.4 Réfrigérateurs et thermopompes
3. Si la porte du réfrigérateur reste ouverte, qu'arrive-t-il à la température de la cuisine ?
4. Est-il possible que le rendement d'un moteur réversible soit supérieur à 1,0 ? Est-il possible que le coefficient de performance d'un réfrigérateur réversible soit inférieur à 1,0 ?
4.5 Exposés de la deuxième loi de la thermodynamique
5. Dans le texte, nous avons montré que si la déclaration de Clausius est fausse, la déclaration de Kelvin doit également l'être. Montrez maintenant l'inverse, de telle sorte que si l'énoncé de Kelvin est faux, il s'ensuit que l'énoncé de Clausius est faux.
6. Pourquoi ne pas faire fonctionner des paquebots en extrayant la chaleur de l'océan ou des avions en extrayant la chaleur de l'atmosphère ?
7. Discutez des avantages et des inconvénients pratiques des pompes à chaleur et du chauffage électrique.
8. La production d'énergie d'une pompe à chaleur est supérieure à l'énergie utilisée pour faire fonctionner la pompe. Pourquoi cette affirmation ne viole-t-elle pas la première loi de la thermodynamique ?
9. Sur la base d'arguments liés à la température, spéculez sur les raisons pour lesquelles les centrales nucléaires sont moins efficaces que les centrales à combustibles fossiles.
10. Un gaz idéal passe d'un état\(\displaystyle (p_i,V_i)\) à l'autre\(\displaystyle (p_f,V_f)\) lorsqu'on le laisse se dilater librement. Est-il possible de représenter le processus réel sur un diagramme pV ? Expliquez.
4.6 Le cycle de Carnot
11. Pour augmenter l'efficacité d'un moteur Carnot, faut-il augmenter ou abaisser la température du réservoir chaud ? Qu'en est-il du réservoir de froid ?
12. Comment pourriez-vous concevoir un moteur Carnot à 100 % d'efficacité ?
13. Quels types de processus se produisent dans un cycle de Carnot ?
4.7 Entropie
14. L'entropie augmente-t-elle pour un moteur Carnot à chaque cycle ?
15. Est-il possible qu'un système subisse un changement d'entropie s'il n'absorbe ni n'émet de chaleur lors d'une transition réversible ? Que se passe-t-il si le processus est irréversible ?
4.8 Entropie à l'échelle microscopique
16. Les changements d'entropie des systèmes dans les processus suivants sont-ils positifs ou négatifs ?
a) de la vapeur d'eau qui se condense sur une surface froide ;
b) du gaz contenu dans un contenant qui fuit dans l'atmosphère environnante ;
c) un glaçon qui fond dans un verre d'eau tiède ;
d) l'eau tiède de la partie c) ;
e) un véritable moteur thermique effectuant un cycle ; f) des aliments refroidis dans un réfrigérateur.
17. Discutez des changements d'entropie dans les systèmes de la question 21.10 en termes de trouble.
Des problèmes
4.2 Processus réversibles et irréver
18. Un réservoir contient 111,0 g de chlore gazeux (\(\displaystyle Cl_2\)), à une température de 82,0 °C et à une pression absolue\(\displaystyle 5.70×10^5Pa\). La température de l'air à l'extérieur du réservoir est de 20,0 °C. La masse molaire de\(\displaystyle Cl_2\) est de 70,9 g/mol.
a) Quel est le volume du réservoir ?
(b) Quelle est l'énergie interne du gaz ?
c) Quel est le travail effectué par le gaz si la température et la pression à l'intérieur du réservoir chutent à 31,0 °C et\(\displaystyle 3.80×10^5Pa\), respectivement, en raison d'une fuite ?
19. Une mole de gaz monatomique idéal à 0 °C et à 1,00 atm est chauffée pour se dilater de façon isobare et tripler son volume. Quelle quantité de chaleur est transférée pendant le processus ?
20. Une mole d'un gaz idéal à une pression de 4,00 atm et à une température de 298 K se dilate de manière isotherme pour doubler son volume. Quel est le travail effectué par le gaz ?
21. Après une expansion libre visant à quadrupler son volume, une mole de gaz diatomique idéal est comprimée à nouveau à son volume initial de façon adiabatique, puis refroidie à sa température initiale. Quelle est la chaleur minimale retirée du gaz lors de l'étape finale de son rétablissement ?
4.3 Moteurs thermiques
22. On constate qu'un moteur a un rendement de 0,40. S'il effectue 200 J de travail par cycle, quelles sont les quantités correspondantes de chaleur absorbée et évacuée ?
23. En effectuant 100,0 J de travail, un moteur dégage 50,0 J de chaleur. Quelle est l'efficacité du moteur ?
24. Un moteur d'une efficacité de 0,30 absorbe 500 J de chaleur par cycle.
a) Quelle quantité de travail effectue-t-il par cycle ?
(b) Quelle quantité de chaleur dégage-t-elle par cycle ?
25. On constate qu'un moteur décharge 100,0 J tout en absorbant 125,0 J à chaque cycle de fonctionnement.
a) Quel est le rendement du moteur ?
(b) Quelle quantité de travail effectue-t-il par cycle ?
26. La température du réservoir froid du moteur est de 300 K. Il a un rendement de 0,30 et absorbe 500 J de chaleur par cycle.
a) Quelle quantité de travail effectue-t-il par cycle ?
(b) Quelle quantité de chaleur dégage-t-elle par cycle ?
27. Un moteur absorbe trois fois plus de chaleur qu'il n'en rejette. Le travail effectué par le moteur par cycle est de 50 J. Calculer
a) le rendement du moteur,
(b) la chaleur absorbée par cycle, et
c) la chaleur évacuée par cycle.
28. Une centrale au charbon consomme 100 000 kg de charbon par heure et produit 500 MW d'énergie. Si la chaleur de combustion du charbon est de 30 MJ/kg, quel est le rendement de la centrale ?
4.4 Réfrigérateurs et thermopompes
29. Un réfrigérateur a un coefficient de performance de 3,0.
a) S'il nécessite 200 J de travail par cycle, quelle quantité de chaleur par cycle évacue-t-il le réservoir de froid ?
(b) Quelle quantité de chaleur par cycle est rejetée dans le réservoir d'eau chaude ?
30. Au cours d'un cycle, un réfrigérateur retire 500 J d'un réservoir froid et en évacue 800 J dans son réservoir chaud.
a) Quel est son coefficient de performance ?
(b) Quelle est la quantité de travail requise par cycle pour fonctionner ?
31. Si un réfrigérateur rejette 80 J de chaleur par cycle et que son coefficient de performance est de 6,0, quels sont
a) la quantité de chaleur qu'il retire par cycle d'un réservoir froid et
b) la quantité de travail par cycle requise pour son fonctionnement ?
32. Un réfrigérateur a un coefficient de performance de 3,0.
a) S'il nécessite 200 J de travail par cycle, quelle quantité de chaleur par cycle évacue-t-il le réservoir de froid ?
(b) Quelle quantité de chaleur par cycle est rejetée dans le réservoir d'eau chaude ?
4.6 Le cycle de Carnot
33. La température des réservoirs froid et chaud entre lesquels fonctionne un réfrigérateur Carnot est de −73 °C et 270 °C, respectivement. Quel est son coefficient de performance ?
34. Supposons qu'un réfrigérateur Carnot fonctionne entre\(\displaystyle T_c\) et\(\displaystyle T_h\). Calculez la quantité de travail requise pour extraire 1,0 J de chaleur du réservoir froid si :
(a)\(\displaystyle T_c=7°, T_h=27°C;\)
b)\(\displaystyle T_c=−73°C, T_h=27°C\) ;
(c)\(\displaystyle T_c=−173°C, T_h=27°C\) ; et
(d)\(\displaystyle T_c=−273°C, T_h=27°C\).
35. Un moteur Carnot fonctionne entre des réservoirs entre 600 et 300 K. Si le moteur absorbe 100 J par cycle au niveau du réservoir chaud, quel est son rendement par cycle ?
36. Un moteur de 500 W fait fonctionner un réfrigérateur Carnot entre −5 °C et 30 °C.
a) Quelle est la quantité de chaleur extraite par seconde de l'intérieur du réfrigérateur ?
(b) Quelle quantité de chaleur est évacuée vers l'air extérieur par seconde ?
37. Esquissez un cycle de Carnot sur un diagramme température-volume.
38. Une pompe à chaleur Carnot fonctionne entre 0 °C et 20 °C. Quelle quantité de chaleur est évacuée à l'intérieur d'une maison pour chaque 1,0 J de travail effectué par la pompe ?
39. Un moteur fonctionnant entre des réservoirs de chaleur à 20 °C et 200 °C extrait 1 000 J par cycle du réservoir chaud.
a) Quel est le maximum de travail possible que le moteur peut effectuer par cycle ?
b) Pour ce travail maximal, quelle quantité de chaleur est évacuée vers le réservoir de froid par cycle ?
40. Supposons qu'un moteur Carnot puisse fonctionner entre deux réservoirs en tant que moteur thermique ou réfrigérateur. Comment le coefficient de performance du réfrigérateur est-il lié à l'efficacité du moteur thermique ?
41. Un moteur Carnot est utilisé pour mesurer la température d'un réservoir de chaleur. Le moteur fonctionne entre le réservoir de chaleur et un réservoir constitué d'eau à son point triple.
a) Si 400 J par cycle sont retirés du réservoir de chaleur alors que 200 J par cycle sont déposés dans le réservoir à trois points, quelle est la température du réservoir de chaleur ?
b) Si 400 J par cycle sont retirés du réservoir à trois points tandis que 200 J par cycle sont déposés dans le réservoir de chaleur, quelle est la température du réservoir de chaleur ?
42. Quel est le travail minimum requis pour un réfrigérateur s'il doit extraire 50 J par cycle de l'intérieur d'un congélateur à −10 °C et évacuer la chaleur vers l'air à 25 °C ?
4.7 Entropie
43. Deux cents joules de chaleur sont retirés d'un réservoir de chaleur à une température de 200 K. Quel est le changement d'entropie du réservoir ?
44. Lors d'une expansion isotherme réversible à 27 °C, un gaz idéal fait 20 J de travail. Qu'est-ce que le changement d'entropie du gaz ?
45. Un gaz idéal à 300 K est comprimé de manière isotherme jusqu'à un cinquième de son volume initial. Déterminez le changement d'entropie par mole de gaz.
46. Quel est le changement d'entropie de 10 g de vapeur à 100 °C lorsqu'elle se condense en eau à la même température ?
47. Une tige métallique est utilisée pour conduire la chaleur entre deux réservoirs à des températures\(\displaystyle T_h\) et\(\displaystyle T_c\), respectivement. Lorsqu'une quantité de chaleur Q circule à travers la tige du réservoir chaud au réservoir froid, quel est le changement d'entropie net du barreau, du réservoir chaud, du réservoir froid et de l'univers ?
48. Pour le cycle de Carnot de la Figure 4.12, quel est le changement d'entropie du réservoir chaud, du réservoir froid et de l'univers ?
49. Un morceau de plomb de 5,0 kg à une température de 600 °C est placé dans un lac dont la température est de 15 °C. Déterminez le changement d'entropie de (a) la pièce principale, (b) du lac et (c) de l'univers.
50. Une mole d'un gaz idéal double son volume lors d'une expansion isotherme réversible.
a) Quelle est la modification de l'entropie du gaz ?
(b) Si 1 500 J de chaleur sont ajoutés au cours de ce processus, quelle est la température du gaz ?
51. Une mole d'un gaz monatomique idéal est confinée dans un contenant rigide. Lorsque de la chaleur est ajoutée de manière réversible au gaz, sa température passe de\(\displaystyle T_1\) à\(\displaystyle T_2\).
a) Quelle quantité de chaleur est ajoutée ?
(b) Quelle est la modification de l'entropie du gaz ?
52. a) Une roche de 5,0 kg à une température de 20 °C est déposée dans un lac peu profond également à 20 °C à une hauteur de\(\displaystyle 1.0×10^3m\). Quelle est la modification de l'entropie de l'univers qui en résulte ?
(b) Si la température de la roche est de 100 °C à 100 °C au moment de sa chute, quel est le changement d'entropie de l'univers ? Supposons que la friction de l'air soit négligeable (ce n'est pas une bonne hypothèse) et que C=860J/kg⋅K est la chaleur spécifique de la roche.
4.8 Entropie à l'échelle microscopique
53. Une barre de cuivre d'une section transversale\(\displaystyle 5.0cm^2\) et d'une longueur de 5,0 m conduit la chaleur d'un réservoir de chaleur à 373 K à un réservoir de chaleur à 273 K. Quel est le taux de variation dans le temps de l'entropie de l'univers pour ce processus ?
54. Cinquante grammes d'eau à 20 °C sont chauffés jusqu'à ce qu'elle devienne vapeur à 100 °C. Calculez la variation de l'entropie de l'eau dans ce processus.
55. Cinquante grammes d'eau à 0 °C sont transformés en vapeur à 100 °C. Quel est le changement de l'entropie de l'eau dans ce processus ?
56. Dans un processus isochore, de la chaleur est ajoutée à 10 moles de gaz idéal monoatomique dont la température augmente de 273 à 373 K. Quel est le changement d'entropie du gaz ?
57. Deux cents grammes d'eau à 0°C sont mis en contact avec un réservoir de chaleur à 80°C. Une fois l'équilibre thermique atteint, quelle est la température de l'eau ? Du réservoir ? Quelle quantité de chaleur a été transférée au cours du processus ? Qu'est-ce que le changement d'entropie de l'eau ? Du réservoir ? Qu'est-ce que le changement d'entropie de l'univers ?
58. Supposons que la température de l'eau dans le problème précédent soit augmentée en l'amenant d'abord à l'équilibre thermique avec un réservoir à une température de 40 °C, puis avec un réservoir à 80 °C. Calculez les variations d'entropie de (a) chaque réservoir, (b) de l'eau et (c) de l'univers.
59. Deux cents grammes d'eau à 0 °C sont mis en contact en équilibre thermique successivement avec des réservoirs à 20 °C, 40 °C, 60 °C et 80 °C.
a) Quel est le changement d'entropie de l'eau ?
(b) Du réservoir ?
(c) Qu'est-ce que le changement d'entropie de l'univers ?
60. a) Dix grammes de\(\displaystyle H_2O\) départ sous forme de glace à 0 °C. La glace absorbe la chaleur de l'air (juste au-dessus de 0 °C) jusqu'à ce qu'elle fonde entièrement. Calculez le changement d'entropie de\(\displaystyle H_2O\), de l'air et de l'univers.
(b) Supposons que l'air de la partie (a) soit à 20 °C plutôt qu'à 0 °C et que la glace absorbe la chaleur jusqu'à devenir de l'eau à 20 °C. Calculez le changement d'entropie de\(\displaystyle H_2O\), de l'air et de l'univers.
(c) L'un ou l'autre de ces processus est-il réversible ?
61. Le cycle de Carnot est représenté par le diagramme température-entropie ci-dessous.
a) Quelle quantité de chaleur est absorbée par cycle dans le réservoir à haute température ?
b) Quelle quantité de chaleur est évacuée par cycle dans le réservoir à basse température ?
(c) Quel est le volume de travail effectué par le moteur par cycle ? (d) Quelle est l'efficacité du
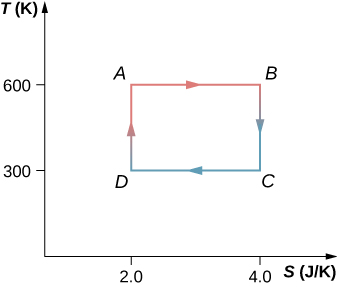
62. Un moteur Carnot fonctionnant entre des réservoirs de chaleur à 500 et 300 K absorbe 1 500 J par cycle au niveau du réservoir à haute température.
(a) Représenter le cycle du moteur sur un diagramme température-entropie.
(b) Quelle quantité de travail par cycle est effectuée par le moteur ?
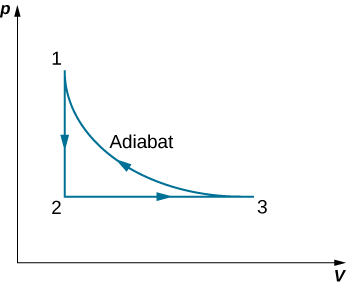
63. Un gaz idéal monoatomique (n moles) passe par un processus cyclique illustré ci-dessous. Déterminez la variation de l'entropie du gaz à chaque étape et la variation totale de l'entropie sur l'ensemble du cycle.
64. Un moteur Carnot a un rendement de 0,60. Lorsque la température de son réservoir froid change, l'efficacité chute à 0,55. Si initialement\(\displaystyle T_c=27°C\), déterminez
a) la valeur constante de\(\displaystyle T_h\) et
(b) la valeur finale de\(\displaystyle T_c\).
65. Un moteur Carnot effectue 100 J de travail tout en dégageant 200 J de chaleur à chaque cycle. Une fois la température du réservoir chaud uniquement réglée, on constate que le moteur effectue maintenant 130 J de travail tout en rejetant la même quantité de chaleur.
a) Quels sont les rendements initial et final du moteur ?
(b) Quelle est la variation fractionnée de la température du réservoir chaud ?
66. Un réfrigérateur Carnot évacue la chaleur dans l'air, qui se trouve à une température de 25 °C. Quelle est la quantité d'énergie consommée par le réfrigérateur s'il gèle 1,5 g d'eau par seconde ? Supposons que l'eau soit à 0 °C.
Problèmes supplémentaires
67. Une pompe à chaleur de 300 W fonctionne entre le sol, dont la température est de 0 °C, et l'intérieur d'une maison à 22 °C. Quelle est la quantité maximale de chaleur par heure que la pompe à chaleur peut fournir à la maison ?
68. Un ingénieur doit concevoir un réfrigérateur qui effectue 300 J de travail par cycle afin d'extraire 2 100 J de chaleur par cycle d'un congélateur dont la température est de −10 °C. Quelle est la température maximale de l'air pour laquelle cette condition peut être remplie ? Est-ce une condition raisonnable à imposer au dessin ?
69. Un moteur Carnot utilise 1,5 mol d'azote comme substance active, ce qui est considéré comme un gaz diatomique idéal avec γ = 7,5 aux températures de fonctionnement du moteur. Le cycle de Carnot passe dans le cycle ABCDA, AB étant une expansion isotherme. Le volume aux points A et C du cycle est de 0\(\displaystyle 5.0×10^{−3}m^3\) et 0,15 L, respectivement. Le moteur fonctionne entre deux bains thermaux de température 500 K et 300 K.
(a) Trouvez les valeurs du volume en B et D.
(b) Quelle quantité de chaleur est absorbée par le gaz contenu dans l'expansion isotherme AB ?
(c) Quelle quantité de travail est réalisée par le gaz contenu dans l'expansion isotherme AB ?
d) Quelle est la quantité de chaleur dégagée par le gaz contenu dans l'expansion disotherme ?
e) Quel est le travail effectué par le gaz contenu dans la compression isotherme du CD ?
(f) Quel est le travail effectué par le gaz dans l'expansion adiabatique de la Colombie-Britannique ?
(g) Quel est le travail effectué par le gaz contenu dans la compression adiabatique DA ?
(h) Déterminer la valeur de l'efficacité du moteur en fonction de la puissance réseau et de l'apport de chaleur. Comparez cette valeur à l'efficacité d'un moteur Carnot basée sur les températures des deux bains.
70. Un bloc de bois de 5,0 kg démarre à une vitesse initiale de 8,0 m/s et glisse sur le sol jusqu'à ce que la friction l'arrête. Estimez le changement d'entropie de l'univers qui en résulte. Supposons que tout reste à une température ambiante de 20 °C.
71. Un système constitué de 20,0 moles d'un gaz idéal monoatomique est refroidi à pression constante d'un volume de 50,0 L à 10,0 L. La température initiale était de 300 K. Quel est le changement d'entropie du gaz ?
72. Un bécher en verre d'une masse de 400 g contient 500 g d'eau à 27 °C. Le bécher est chauffé de manière réversible afin que la température du bécher et de l'eau augmente progressivement jusqu'à 57 °C. Trouvez ensemble le changement d'entropie du bécher et de l'eau.
73. Un moteur Carnot fonctionne entre 550 °C et 20 °C dans des bains et produit 300 kJ d'énergie à chaque cycle. Trouvez-vous la variation de l'entropie du (a) bain chaud et (b) bain froid, à chaque cycle de Carnot ?
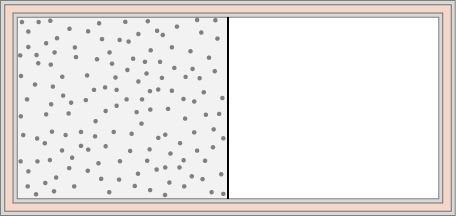
74. Un gaz idéal à la température T est stocké dans la moitié gauche d'un récipient isolant de volume V à l'aide d'une cloison de volume négligeable (voir ci-dessous). Quel est le changement d'entropie par mole de gaz dans chacun des cas suivants ?
a) La cloison est soudainement retirée et le gaz remplit rapidement tout le récipient.
b) Un minuscule trou est percé dans la cloison et, après une longue période, le gaz atteint un état d'équilibre tel qu'il n'y a pas de débit net à travers le trou.
(c) La cloison est déplacée très lentement et adiabatiquement jusqu'à la paroi droite afin que le gaz remplisse enfin la totalité du récipient.
75. Un morceau d'aluminium de 0,50 kg à 250 °C est jeté dans 1,0 kg d'eau à 20 °C. Une fois l'équilibre atteint, quel est le changement d'entropie net du système ?
76. Supposons que 20 g de glace à 0 °C soient ajoutés à 300 g d'eau à 60 °C. Quel est le changement total de l'entropie du mélange une fois qu'il a atteint l'équilibre thermique ?
77. Un moteur thermique fonctionne entre deux températures de telle sorte que la substance active du moteur absorbe 5 000 J de chaleur provenant du bain à haute température et évacue 3 000 J dans le bain à basse température. Le reste de l'énergie est converti en énergie mécanique de la turbine. Trouvez
a) la quantité de travail produite par le moteur et
b) le rendement du moteur.
78. Un moteur thermique produit 4 MJ d'énergie électrique lorsqu'il fonctionne entre deux bains thermaux de températures différentes. La substance active du moteur décharge 5 MJ de chaleur vers le bain froid. Quelle est l'efficacité du moteur ?
79. Une centrale au charbon consomme 100 000 kg de charbon par heure et produit 500 MW d'énergie. Si la chaleur de combustion du charbon est de 30 MJ/kg, quel est le rendement de la centrale ?
80. Un moteur Carnot fonctionne selon un cycle de Carnot entre une source de chaleur à 550 °C (550 °C) et un dissipateur thermique à 20 °C (-20 °C). Déterminez l'efficacité du moteur Carnot.
81. Un moteur Carnot fonctionnant entre deux bains de chaleur de 600 K et 273 K complète chaque cycle en 5 secondes. À chaque cycle, le moteur absorbe 10 kJ de chaleur. Trouvez la puissance du moteur.
82. Un cycle Carnot fonctionnant entre 100 °C et 30 °C est utilisé pour faire fonctionner un réfrigérateur entre −10 °C et 30 °C. Quelle quantité d'énergie le moteur Carnot doit-il produire par seconde pour que le réfrigérateur puisse rejeter 10 J d'énergie par seconde ?
Problèmes liés au défi
83. (a) Une quantité infinitésimale de chaleur est ajoutée de manière réversible à un système. En combinant les première et deuxième lois, montrez que\(\displaystyle dU=TdS−dW\). (b) Lorsque de la chaleur est ajoutée à un gaz idéal, sa température et son volume changent de\(\displaystyle T_1\) et\(\displaystyle V_1\) vers\(\displaystyle T_2\) et\(\displaystyle V_2\). Montrez que le changement d'entropie de n moles du gaz est donné par\(\displaystyle ΔS=nC_v\ln\frac{T_2}{T_1}+nR\ln\frac{V_2}{V_1}\).
84. En utilisant le résultat du problème précédent, montrez que pour un gaz idéal soumis à un processus adiabatique,\(\displaystyle TV^{γ−1}\) il est constant.
85. À l'aide des deux problèmes précédents, montrez que ΔS entre les états 1 et 2 de n moles est donné par un gaz idéal\(\displaystyle ΔS=nC_p\ln\frac{T_2}{T_1}−nRln\frac{p_2}{p_1}\).
86. Un cylindre contient 500 g d'hélium à 120 atm et à 20 °C. La vanne fuit et tout le gaz s'échappe lentement de manière isotherme dans l'atmosphère. Utilisez les résultats du problème précédent pour déterminer le changement d'entropie de l'univers qui en résulte.
87. Un gaz idéal diatomique est amené d'un état d'équilibre initial à\(\displaystyle p_1=0.50atm\) et\(\displaystyle T_1=300K\) à un stade final avec\(\displaystyle p_2=0.20atm\) et\(\displaystyle T_1=500K\). Utilisez les résultats du problème précédent pour déterminer le changement d'entropie par mole de gaz.
88. Le moteur à combustion interne à essence fonctionne selon un cycle composé de six parties. Quatre de ces pièces impliquent, entre autres, des frottements, des échanges thermiques par des différences de température finies et des accélérations du piston ; elles sont irréversibles. Néanmoins, il est représenté par le cycle Otto réversible idéal, illustré ci-dessous. La substance active du cycle est supposée être l'air. Les six étapes du cycle Otto sont les suivantes :
i. Accident isobarique (OA). Un mélange d'essence et d'air est aspiré dans la chambre de combustion à la pression\(\displaystyle p_0\) atmosphérique lorsque le piston se dilate, augmentant le volume du cylindre de zéro à\(\displaystyle V_A\).
ii. Course de compression adiabatique (AB). La température du mélange augmente lorsque le piston le comprime adiabatiquement d'un volume\(\displaystyle V_A\) à\(\displaystyle V_B\).
iii. Allumage à volume constant (BC). Le mélange est allumé par une étincelle. La combustion est si rapide qu'il n'y a pratiquement aucun mouvement du piston. Au cours de ce processus, la chaleur ajoutée\(\displaystyle Q_1\) fait augmenter la pression de\(\displaystyle p_B\) 0\(\displaystyle p_C\) à Pbtopc à volume constant\(\displaystyle V_B(=V_C)\).
iv. Expansion adiabatique (CD). Le mélange chauffé d'essence et d'air se dilate contre le piston, augmentant le volume de\(\displaystyle V_C\) à\(\displaystyle V_D\). C'est ce que l'on appelle la course mécanique, car c'est la partie du cycle qui fournit la plus grande partie de la puissance au vilebrequin.
v. Échappement à volume constant (DA). Lorsque la soupape d'échappement s'ouvre, certains produits de combustion s'échappent. Il n'y a pratiquement aucun mouvement du piston pendant cette partie du cycle, de sorte que le volume reste constant à\(\displaystyle V_A(=V_D)\). La majeure partie de l'énergie disponible y est perdue, comme le représente l'échappement de chaleur\(\displaystyle Q_2\).
vi. Compression isobare (AO). La soupape d'échappement reste ouverte et la compression de 0\(\displaystyle V_A\) à zéro chasse les produits de combustion restants.
(a) En utilisant (i)\(\displaystyle e=W/Q_1\) ; (ii)\(\displaystyle W=Q_1−Q_2\) ; et (iii)\(\displaystyle Q_1=nC_v(T_C−T_B), Q_2=nC_v(T_D−T_A)\), montrez que\(\displaystyle e=1−\frac{T_D−T_A}{T_C−T_B}\). (b) Utilisez le fait que les étapes (ii) et (iv) sont adiabatiques pour montrer que\(\displaystyle e=1−\frac{1}{r^{γ−1}}\), où\(\displaystyle r=V_A/V_B\). La quantité r est appelée taux de compression du moteur. (c) Dans la pratique, r est maintenu à une valeur inférieure à environ 7. Pour des valeurs plus élevées, le mélange essence-air est comprimé à des températures si élevées qu'il explose avant que l'étincelle finement programmée ne soit émise. Ce préallumage provoque un cliquetis du moteur et une perte de puissance. Montrez que pour r = 6 et γ = 1,4 (la valeur pour l'air), e = 0,51, soit une efficacité de 51 %. En raison des nombreux processus irréversibles, un véritable moteur à combustion interne a un rendement bien inférieur à cette valeur idéale. Le rendement typique d'un moteur réglé est d'environ 25 % à 30 %.
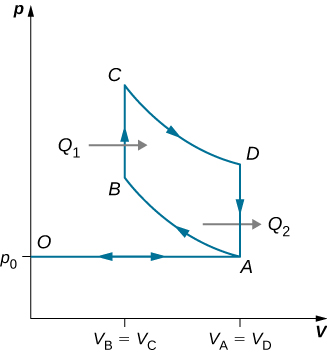
89. Un cycle diesel idéal est illustré ci-dessous. Ce cycle se compose de cinq temps. Dans ce cas, seul de l'air est aspiré dans la chambre pendant la course d'admission OA. L'air est ensuite comprimé adiabatiquement de l'état A à l'état B, en élevant sa température suffisamment haut pour que lorsque du carburant est ajouté pendant la course mécanique BC, il s'enflamme. Une fois l'allumage terminé en C, il y a une autre course de puissance adiabatique CD. Enfin, il y a un échappement à volume constant lorsque la pression chute de\(\displaystyle p_D\) à\(\displaystyle p_A\), suivi d'un nouvel échappement lorsque le piston comprime le volume de la chambre à zéro. (a) Utilisez\(\displaystyle W=Q_1−Q_2, Q_1=nC_p(T_C−T_B),\) et\(\displaystyle Q_2=nC_v(T_D−T_A)\) pour le montrer\(\displaystyle e=\frac{W}{Q_1}=1−\frac{T_D−T_A}{γ(T_C−T_B)}\). (b) Utilisez le fait que A→B et C→D sont adiabatiques pour montrer que\(\displaystyle e=1−\frac{1}{γ}\frac{(\frac{V_C}{V_D})^γ−(\frac{V_B}{V_A})^γ}{(\frac{V_C}{V_D})−(\frac{V_B}{V_A})}\) (c) Comme il n'y a pas de préallumage (rappelez-vous que la chambre ne contient pas de carburant pendant la compression), le taux de compression peut être supérieur à celui d'un moteur à essence. Typiquement,\(\displaystyle V_A/V_B=15\) et\(\displaystyle V_D/V_C=5\). Pour ces valeurs et γ = 1,4, montrez que ε=0,56, soit une efficacité de 56 %. Les moteurs diesel fonctionnent effectivement avec un rendement d'environ 30 % à 35 %, contre 25 % à 30 % pour les moteurs à essence.
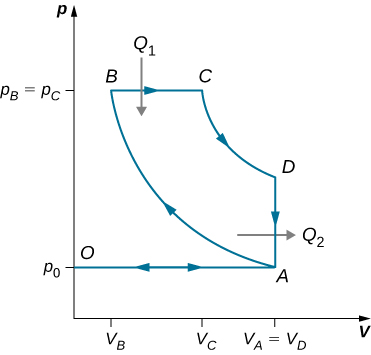
91. Dérivez une formule pour le coefficient de performance d'un réfrigérateur en utilisant un gaz idéal comme substance active fonctionnant dans le cycle indiqué ci-dessous en termes de propriétés des trois états étiquetés 1, 2 et 3.

92. Deux moles d'azote gazeux, avec γ = 7/5 pour les gaz diatomiques idéaux, occupent un volume de\(\displaystyle 10^{−2}m^3\) dans une bouteille isolée à une température de 300 K. Le gaz est comprimé adiabatiquement et de manière réversible jusqu'à un volume de 5 L. Le piston du cylindre est bloqué à sa place, et l'isolation autour du le cylindre est retiré. Le cylindre thermoconducteur est ensuite placé dans un bain de 300 K. La chaleur du gaz comprimé quitte le gaz et la température du gaz redevient 300 K. Le gaz est ensuite lentement détendu à la température fixe de 300 K jusqu'à ce que le volume du gaz atteigne\(\displaystyle 10^{−2}m^3\), réalisant ainsi un cycle complet pour le gaz. Pour l'ensemble du cycle, calculez (a) le travail effectué par le gaz, (b) la chaleur entrant ou sortant du gaz, (c) la variation de l'énergie interne du gaz et (d) la variation de l'entropie du gaz.
93. Un réfrigérateur Carnot, fonctionnant entre 0 °C et 30 °C, est utilisé pour refroidir un seau d'eau contenant\(\displaystyle 10^{−2}m^3\) de l'eau entre 30 °C et 5 °C en 2 heures. Déterminez la quantité totale de travail nécessaire.


