3.5 : Processus thermodynamiques
- Page ID
- 190969
À la fin de cette section, vous serez en mesure de :
- Définition d'un processus thermodynamique
- Distinguer les processus quasi-statiques des processus non quasi-statiques
- Calculez des grandeurs physiques, telles que la chaleur transférée, le travail effectué et le changement d'énergie interne pour les processus thermodynamiques isothermes, adiabatiques et cycliques
Pour résoudre des problèmes de mécanique, nous isolons le corps considéré, analysons les forces externes qui agissent sur lui, puis utilisons les lois de Newton pour prédire son comportement. En thermodynamique, nous adoptons une approche similaire. Nous commençons par identifier la partie de l'univers que nous souhaitons étudier ; elle est également connue sous le nom de notre système. (Au début de ce chapitre, nous avons défini un système comme tout système dont les propriétés nous intéressent ; il peut s'agir d'un seul atome ou de la Terre entière.) Une fois notre système sélectionné, nous déterminons comment l'environnement, ou l'environnement, interagit avec le système. Enfin, une fois l'interaction comprise, nous étudions le comportement thermique du système à l'aide des lois de la thermodynamique.
Le comportement thermique d'un système est décrit en termes de variables thermodynamiques. Pour un gaz idéal, ces variables sont la pression, le volume, la température et le nombre de molécules ou de moles du gaz. Les différents types de systèmes sont généralement caractérisés par différents ensembles de variables. Par exemple, les variables thermodynamiques d'un élastique étiré sont la tension, la longueur, la température et la masse.
L'état d'un système peut changer en raison de son interaction avec l'environnement. La modification d'un système peut être rapide ou lente, grande ou petite. La manière dont l'état d'un système peut passer d'un état initial à un état final est appelée processus thermodynamique. À des fins d'analyse en thermodynamique, il est utile de diviser les processus en quasi-statiques ou non quasi-statiques, comme nous l'expliquons maintenant.
Processus quasi-statiques et non quasi-statiques
Un processus quasi-statique fait référence à un processus idéalisé ou imaginaire dans lequel le changement d'état se fait infiniment lentement, de sorte qu'à chaque instant, on peut supposer que le système est en équilibre thermodynamique avec lui-même et avec l'environnement. Par exemple, imaginez que vous chauffez 1 kg d'eau d'une température\(20^oC\)\(21^oC\) à une pression constante d'une atmosphère. Pour chauffer l'eau très lentement, on peut imaginer de placer le récipient contenant de l'eau dans un grand bain qui peut être chauffé lentement de telle sorte que la température du bain puisse monter infiniment lentement de\(20^oC\) à\(21^oC\). Si nous mettons 1 kg d'eau\(20^oC\) directement dans un bain,\(21^oC\) la température de l'eau augmentera rapidement pour atteindre de\(21^oC\) manière non quasi-statique.
Les processus quasi-statiques sont effectués suffisamment lentement pour que le système reste à l'équilibre thermodynamique à chaque instant, malgré le fait que le système change au fil du temps. L'équilibre thermodynamique du système est nécessaire pour que le système possède des valeurs bien définies de propriétés macroscopiques telles que la température et la pression du système à chaque instant du processus. Par conséquent, les processus quasi-statiques peuvent être présentés sous la forme de chemins bien définis dans l'espace d'états du système.
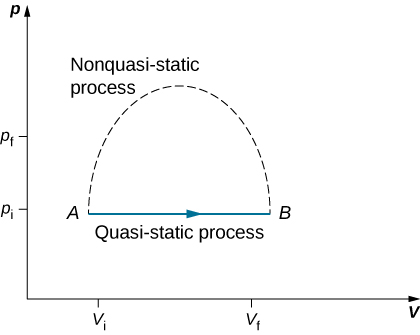
Étant donné que les processus quasi-statiques ne peuvent pas être complètement réalisés pour un changement fini du système, tous les processus de la nature sont non quasi-statiques. Des exemples de processus quasi-statiques et non quasi-statiques sont présentés dans la figure\(\PageIndex{1}\). Malgré le fait que tous les changements finis doivent se produire de manière essentiellement non quasi-statique à un moment donné du changement, nous pouvons imaginer exécuter une infinité de processus quasi-statiques correspondant à chaque processus quasi-statique. Comme les processus quasi-statiques peuvent être analysés de manière analytique, nous étudions principalement les processus quasi-statiques dans ce livre. Nous avons déjà vu que dans un processus quasi-statique, le travail d'un gaz est donné par le PdV.
Procédés isothermes
Un processus isotherme est un changement de l'état du système à température constante. Ce processus est réalisé en maintenant l'équilibre thermique du système avec un grand bain de chaleur pendant le processus. Rappelons qu'un bain de chaleur est un système « infiniment » idéalisé dont la température ne change pas. En pratique, la température d'un bain fini est contrôlée en ajoutant ou en retirant une quantité limitée d'énergie, selon le cas.
Pour illustrer un processus isotherme, imaginez une bouteille de gaz à piston mobile immergée dans un grand réservoir d'eau dont la température est maintenue constante. Comme le piston est librement mobile, la pression intérieure\(P_{in}\) est équilibrée par la pression extérieure\(P_{out}\) par certains poids sur le piston, comme sur la figure\(\PageIndex{2}\).
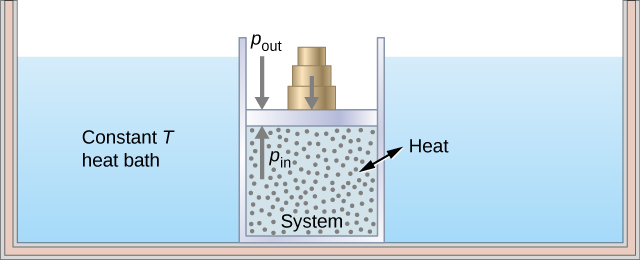
Lorsque les poids sur le piston sont retirés, un déséquilibre des forces s'exerçant sur le piston se développe. La force nette non nulle exercée sur le piston provoquerait une accélération du piston, ce qui entraînerait une augmentation de volume. La détente du gaz refroidit le gaz à une température plus basse, ce qui permet à la chaleur d'entrer dans le système depuis le bain de chaleur jusqu'à ce que la température du gaz soit ramenée à la température du bain de chaleur. Si les poids sont retirés par étapes infinitésimales, la pression dans le système diminue lentement et infiniment. De cette façon, un processus isotherme peut être réalisé de manière quasi statique. Une ligne isotherme sur un diagramme (p, V) est représentée par une ligne courbe allant du point de départ A au point d'arrivée B, comme le montre la figure\(\PageIndex{3}\). Pour un gaz idéal, un processus isotherme est hyperbolique, car pour un gaz idéal à température constante,\(p \propto \frac{1}{V}\).
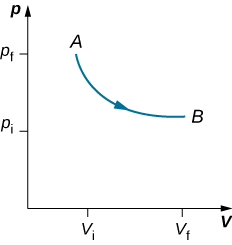
Un processus isotherme étudié dans ce chapitre est réalisé de manière quasi statique, car pour être isotherme tout au long du changement de volume, vous devez pouvoir indiquer la température du système à chaque étape, ce qui n'est possible que si le système est en équilibre thermique en continu. Le système doit sortir de l'équilibre pour que l'état change, mais pour les processus quasi-statiques, nous imaginons que le processus se déroule par étapes infinitésimales de telle sorte que ces écarts par rapport à l'équilibre puissent être aussi brèves et minimes que nous le souhaitons.
Les autres processus quasi-statiques présentant un intérêt pour les gaz sont les processus isobariques et isochoriques. Un processus isobare est un processus dans lequel la pression du système ne change pas, alors qu'un processus isochore est un processus dans lequel le volume du système ne change pas.
Processus adiabatiques
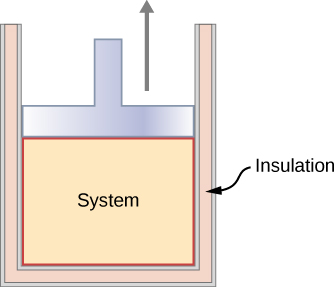
Dans le cadre d'un processus adiabatique, le système est isolé de son environnement de telle sorte que, même si l'état du système change, aucune chaleur n'est autorisée à entrer ou à sortir du système, comme le montre la figure\(\PageIndex{3}\). Un processus adiabatique peut être conduit de manière quasi-statique ou non quasi-statique. Lorsqu'un système se développe adiabatiquement, il doit agir contre le monde extérieur et, par conséquent, son énergie diminue, ce qui se traduit par une baisse de la température du système. Une expansion adiabatique entraîne un abaissement de la température, et une compression adiabatique entraîne une augmentation de la température. Nous discutons à nouveau de l'expansion adiabatique dans la section sur les processus adiabatiques pour un gaz idéal.
Processus cycliques
Nous disons qu'un système passe par un processus cyclique si l'état du système à la fin est le même que celui du début. Par conséquent, les propriétés d'état telles que la température, la pression, le volume et l'énergie interne du système ne changent pas au cours d'un cycle complet :\[\Delta E_{int} = 0.\]
Lorsque la première loi de la thermodynamique est appliquée à un processus cyclique, nous obtenons une relation simple entre la chaleur qui pénètre dans le système et le travail effectué par le système au cours du cycle :
\[Q = W \, (cyclic \, process).\]
Les processus thermodynamiques se distinguent également selon qu'ils sont réversibles ou non. Un processus réversible est un processus qui peut être amené à suivre sa trajectoire par des changements différentiels dans l'environnement. Un tel processus doit donc également être quasi-statique. Il convient toutefois de noter qu'un processus quasi-statique n'est pas nécessairement réversible, car des forces dissipatives peuvent être impliquées. Par exemple, si des frottements se produisaient entre le piston et les parois du cylindre contenant le gaz, l'énergie perdue à cause du frottement nous empêcherait de reproduire les états d'origine du système.
Nous avons examiné plusieurs processus thermodynamiques :
- Un processus isotherme, pendant lequel la température du système reste constante
- Processus adiabatique, au cours duquel aucune chaleur n'est transférée vers ou depuis le système
- Un processus isobare, au cours duquel la pression du système ne change pas
- Un processus isochore, au cours duquel le volume du système ne change pas
De nombreux autres processus se produisent également qui ne rentrent dans aucune de ces quatre catégories.
Consultez ce site pour configurer votre propre processus dans un schéma pV. Déterminez si vous pouvez calculer les valeurs prédites par la simulation pour la chaleur, le travail et les variations de l'énergie interne.


