24.3 : Infections bactériennes du tractus gastro-intestinal
- Page ID
- 188011
Objectifs d'apprentissage
- Identifiez les bactéries les plus courantes qui peuvent provoquer des infections du tractus gastro-intestinal
- Comparez les principales caractéristiques de maladies bactériennes spécifiques affectant le tractus gastro-intestinal
Un large éventail de maladies gastro-intestinales sont causées par la contamination bactérienne des aliments. Rappelons que les maladies d'origine alimentaire peuvent résulter d'une infection ou d'une intoxication. Dans les deux cas, les toxines bactériennes sont généralement responsables de l'apparition des signes et des symptômes de la maladie. La différence réside dans l'endroit où les toxines sont produites. Lors d'une infection, l'agent microbien est ingéré, colonise l'intestin, puis produit des toxines qui endommagent les cellules hôtes. Lors d'une intoxication, les bactéries produisent des toxines dans les aliments avant qu'ils ne soient ingérés. Dans les deux cas, les toxines endommagent les cellules qui tapissent le tractus gastro-intestinal, généralement le côlon. Cela entraîne les signes et symptômes courants de diarrhée ou de selles liquides et de crampes abdominales, ou de dysenterie plus grave. Les symptômes des maladies d'origine alimentaire incluent également souvent des nausées et des vomissements, qui sont des mécanismes que l'organisme utilise pour expulser les substances toxiques.
La plupart des maladies gastro-intestinales d'origine bactérienne sont de courte durée et disparaissent spontanément ; toutefois, la perte de liquide due à une maladie diarrhéique grave peut entraîner une déshydratation qui peut, dans certains cas, être fatale en l'absence de traitement approprié. La réhydratation orale à l'aide de solutions électrolytiques est un aspect essentiel du traitement de la plupart des patients atteints de maladies gastro-intestinales, en particulier chez les enfants et les nourrissons.
Intoxication alimentaire staphylococcique
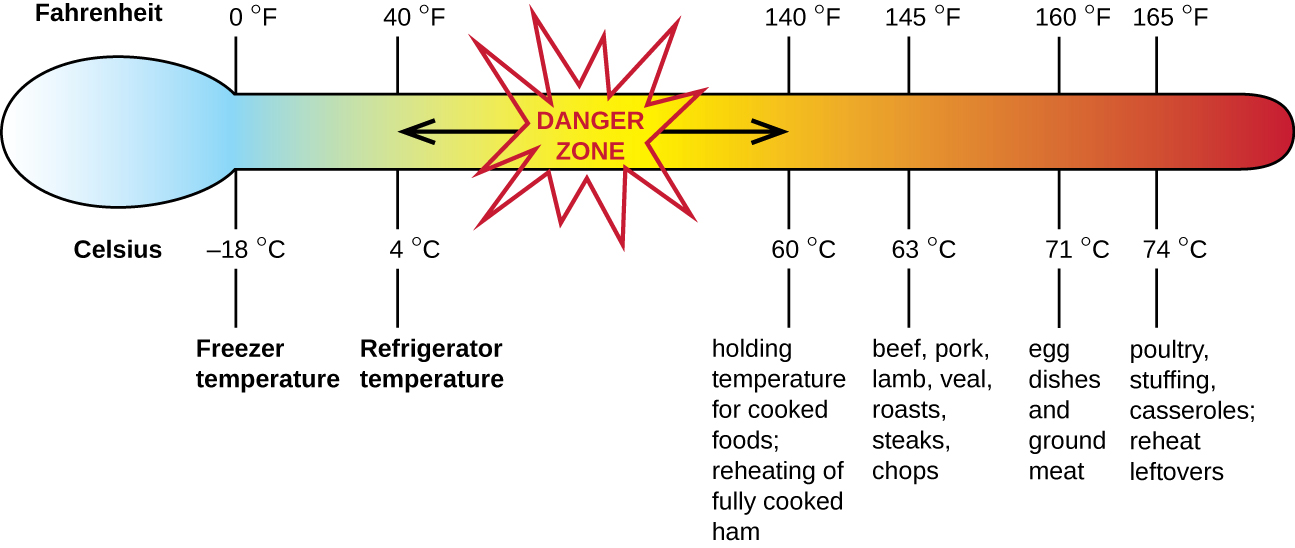
L'intoxication alimentaire staphylococcique est une forme d'intoxication alimentaire. Lorsque le Staphylococcus aureus se développe dans les aliments, il peut produire des entérotoxines qui, lorsqu'elles sont ingérées, peuvent provoquer des symptômes tels que nausées, diarrhée, crampes et vomissements en une à six heures. Dans certains cas graves, elle peut provoquer des maux de tête, une déshydratation et des modifications de la pression artérielle et du rythme cardiaque. Les signes et symptômes disparaissent en 24 à 48 heures. S. aureus est souvent associé à une variété d'aliments crus ou insuffisamment cuits et cuits, notamment de la viande (par exemple, de la viande en conserve, du jambon et des saucisses) et des produits laitiers (par exemple, des fromages, du lait et du beurre). On le trouve également couramment sur les mains et peut être transmis aux aliments préparés par une mauvaise hygiène, notamment en se lavant les mains et en utilisant des surfaces de préparation des aliments contaminées, telles que des planches à découper. Le plus grand risque concerne les aliments laissés à une température inférieure à 60 °C (140 °F), ce qui permet à la bactérie de se développer. Les aliments cuits doivent généralement être réchauffés à au moins 60 °C (140 °F) pour des raisons de sécurité et la plupart des viandes crues doivent être cuites à des températures internes encore plus élevées (Figure\(\PageIndex{1}\)).
Au moins 21 entérotoxines staphylococciques et toxines de type entérotoxine staphylococcique peuvent provoquer une intoxication alimentaire. Les entérotoxines sont des protéines résistantes aux faibles pH, ce qui leur permet de traverser l'estomac. Elles sont stables à la chaleur et ne sont pas détruites par ébullition à 100 °C. Même si la bactérie elle-même peut être tuée, les entérotoxines peuvent à elles seules provoquer des vomissements et des diarrhées, bien que les mécanismes ne soient pas entièrement compris. Au moins certains des symptômes peuvent être causés par l'entérotoxine agissant comme un superantigène et provoquant une forte réponse immunitaire en activant la prolifération des lymphocytes T.
L'apparition rapide de signes et de symptômes permet de diagnostiquer cette maladie d'origine alimentaire. Comme la bactérie n'a pas besoin d'être présente pour que la toxine provoque des symptômes, le diagnostic est confirmé en identifiant la toxine dans un échantillon alimentaire ou dans des échantillons biologiques (matières fécales ou vomissements) prélevés sur le patient. Des techniques sérologiques, y compris l'ELISA, peuvent également être utilisées pour identifier la toxine dans les échantillons alimentaires.
La maladie se résorbe généralement assez rapidement, en 24 heures, sans traitement. Dans certains cas, un traitement de soutien en milieu hospitalier peut être nécessaire.
Exercice\(\PageIndex{1}\)
Comment S. aureus peut-il provoquer une intoxication alimentaire ?
Shigellose (dysenterie bacillaire)
Lorsqu'une maladie gastro-intestinale est associée à la bactérie gram-négative Shigella en forme de bâtonnet, on parle de dysenterie bacillaire, ou shigellose. Les infections peuvent être causées par S. dysenteriae, S. flexneri, S. boydii et/ou S. sonnei qui colonisent le tube digestif. La shigellose peut se transmettre de la main à la bouche ou par des aliments ou de l'eau contaminés. Le plus souvent, elle se transmet par voie fécale-orale.
La bactérie Shigella envahit les cellules épithéliales intestinales. Lorsqu'ils sont introduits dans un phagosome, ils peuvent s'échapper et vivre dans le cytoplasme de la cellule ou se déplacer vers des cellules adjacentes. À mesure que les organismes se multiplient, l'épithélium et les structures contenant des cellules M des plaques de Peyer dans l'intestin peuvent s'ulcérer et provoquer une perte de liquide. Des crampes d'estomac, de la fièvre et une diarrhée aqueuse pouvant également contenir du pus, du mucus et/ou du sang apparaissent souvent. Les cas plus graves peuvent entraîner une ulcération de la muqueuse, une déshydratation et des saignements rectaux. De plus, les patients peuvent développer ultérieurement un syndrome hémolytique et urémique (SHU), une affection grave caractérisée par l'accumulation de cellules sanguines endommagées dans les reins et pouvant provoquer une insuffisance rénale, ou une arthrite réactive, une affection caractérisée par l'apparition d'une arthrite dans de multiples articulations à la suite d'une infection. Les patients peuvent également développer un syndrome du côlon irritable (SCI) chronique après infection.
S. dysenteriae de type 1 est capable de produire de la toxine Shiga, qui cible les cellules endothéliales des petits vaisseaux sanguins du petit et du gros intestin en se liant à un glycosphingolipide. Une fois à l'intérieur des cellules endothéliales, la toxine cible la grande sous-unité ribosomale, affectant ainsi la synthèse des protéines de ces cellules. Des hémorragies et des lésions du côlon peuvent en résulter. La toxine peut cibler le glomérule du rein, les vaisseaux sanguins où commence la filtration du sang dans les reins, provoquant ainsi le SHU.
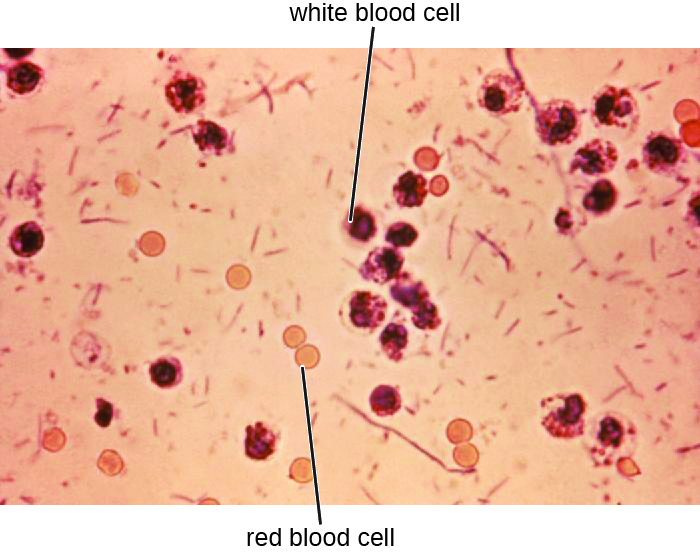
Les échantillons de selles, qui doivent être traités rapidement, sont analysés à l'aide de techniques sérologiques ou moléculaires. Une méthode courante consiste à effectuer des immunoessais pour S. dysenteriae. (Parmi les autres méthodes qui peuvent être utilisées pour identifier Shigella, citons les bandelettes de test API, les systèmes Enterotube ou les tests PCR. La présence de globules blancs et de sang dans les échantillons fécaux survient chez environ 70 % des patients 1 (Figure\(\PageIndex{2}\)). Les cas graves peuvent nécessiter des antibiotiques tels que la ciprofloxacine et l'azithromycine, mais ceux-ci doivent être prescrits avec soin car la résistance est de plus en plus courante.
Exercice\(\PageIndex{2}\)
Comparez et comparez les infections et les intoxications à Shigella.
Salmonellose
La gastro-entérite à Salmonella, également appelée salmonellose, est causée par la bactérie gram-négative Salmonella en forme de bâtonnet. Deux espèces, S. enterica et S. bongori, provoquent des maladies chez l'homme, mais S. enterica est la plus courante. Les sérotypes les plus courants de S. enterica sont Enteritidis et Typhi. Nous aborderons séparément la fièvre typhoïde causée par les sérotypes Typhi et Paratyphi A. Nous nous concentrerons ici sur la salmonellose causée par d'autres sérotypes.
La salmonelle fait partie du microbiote intestinal normal de nombreuses personnes. Cependant, la salmonellose est causée par des agents exogènes et l'infection peut survenir en fonction du sérotype, de la taille de l'inoculum et de l'état de santé général de l'hôte. L'infection est causée par l'ingestion d'aliments contaminés, la manipulation de coquilles d'œufs ou l'exposition à certains animaux. La salmonelle fait partie du microbiote de la volaille, de sorte que l'exposition à des œufs crus et à de la volaille crue peut augmenter le risque d'infection. Le lavage des mains et la cuisson minutieuse des aliments réduisent considérablement le risque de transmission. La bactérie Salmonella peut survivre au gel pendant de longues périodes mais ne peut pas survivre à des températures élevées.
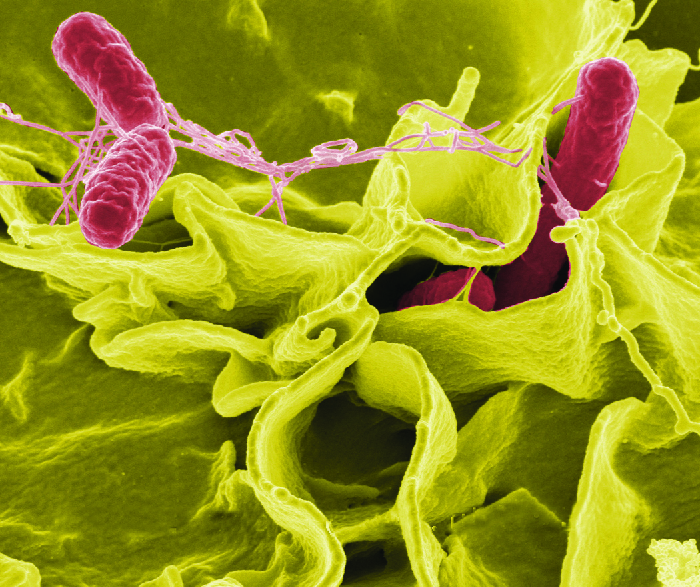
Une fois ingérées, les bactéries se multiplient dans les intestins et pénètrent dans les cellules de la muqueuse épithéliale via les cellules M où elles continuent à se développer (Figure\(\PageIndex{3}\)). Ils déclenchent des processus inflammatoires et l'hypersécrétion de liquides. Une fois à l'intérieur du corps, ils peuvent persister à l'intérieur des phagosomes des macrophages. La salmonelle peut traverser la membrane cellulaire épithéliale et pénétrer dans la circulation sanguine et le système lymphatique. Certaines souches de Salmonella produisent également une entérotoxine qui peut provoquer une intoxication.
Les personnes infectées développent de la fièvre, des nausées, des crampes abdominales, des vomissements, des maux de tête et de la diarrhée Ces signes et symptômes durent généralement de quelques jours à une semaine. Selon les Centers for Disease Control and Prevention (CDC), il y a 1 000 000 de cas par an, avec 380 décès par an. 2 Cependant, comme la maladie est généralement spontanément résolutive, de nombreux cas ne sont pas signalés aux médecins et l'incidence globale peut être sous-estimée. Le diagnostic implique une culture suivie d'un sérotypage et d'une prise d'empreintes génétiques si nécessaire. Les résultats positifs sont communiqués au CDC. Lorsqu'un sérotype inhabituel est détecté, des échantillons sont envoyés au CDC pour une analyse plus approfondie. Le sérotypage est important pour déterminer le traitement. La thérapie de réhydratation orale est couramment utilisée. Les antibiotiques ne sont recommandés que dans les cas graves. Lorsque des antibiotiques sont nécessaires, comme chez les patients immunodéprimés, les fluoroquinolones, les céphalosporines de troisième génération et l'ampicilline sont recommandés. La résistance aux antibiotiques est très préoccupante.
Fièvre typhoïde
Certains sérotypes de S. enterica, principalement le sérotype Typhi (S. typhi) mais aussi le Paratyphi, provoquent une forme plus grave de salmonellose appelée fièvre typhoïde. Cette maladie grave, dont le taux de mortalité non traitée est de 10 %, provoque une forte fièvre, des courbatures, des maux de tête, des nausées, une léthargie et éventuellement une éruption cutanée.
Certaines personnes sont porteuses de S. typhi sans présenter de signes ni de symptômes (porteuses asymptomatiques) et les excrétent continuellement dans leurs matières fécales. Ces porteurs sont souvent porteurs de bactéries dans la vésicule biliaire ou l'épithélium intestinal. Les personnes consommant des aliments ou de l'eau contaminés par ces matières fécales peuvent être infectées
S. typhi pénètre dans la muqueuse intestinale, se développe dans les macrophages et est transporté dans tout l'organisme, notamment vers le foie et la vésicule biliaire. Finalement, les macrophages se lysent, libérant S. typhi dans la circulation sanguine et le système lymphatique. La mortalité peut résulter d'une ulcération et d'une perforation de l'intestin. Un large éventail de complications, telles que la pneumonie et la jaunisse, peuvent survenir en cas de maladie disséminée.
S. typhi possède des îlots de pathogénicité (SPIs) pour Salmonella qui contiennent les gènes de bon nombre de leurs facteurs de virulence. Deux exemples de toxines typhoïdes importantes sont l'antigène Vi, qui code pour la production de capsules, et la toxine chimérique A2B5, qui est à l'origine de nombreux signes et symptômes de la phase aiguë de la fièvre typhoïde.
L'examen clinique et la culture sont utilisés pour établir le diagnostic. La bactérie peut être cultivée à partir de matières fécales, d'urine, de sang ou de moelle osseuse. La sérologie, y compris l'ELISA, est utilisée pour identifier les souches les plus pathogènes, mais une confirmation par des tests ADN ou une culture est nécessaire. Un test PCR peut également être utilisé, mais il n'est pas largement disponible.
Le traitement antibiotique recommandé comprend des fluoroquinolones, de la ceftriaxone et de l'azithromycine. Les individus doivent faire très attention à ne pas infecter d'autres personnes pendant le traitement. La fièvre typhoïde peut être évitée grâce à la vaccination des personnes qui voyagent dans des régions du monde où elle est courante.
Exercice\(\PageIndex{3}\)
Pourquoi le sérotypage est-il particulièrement important pour les infections à Salmonella et la fièvre typhoïde ?
Mary Mallon était une immigrante irlandaise qui a travaillé comme cuisinière à New York au début du XXe siècle. Pendant sept ans, de 1900 à 1907, Mallon a travaillé pour différents ménages, propageant sans le savoir la maladie aux personnes qui vivaient dans chacun d'eux. En 1906, une famille a engagé George Soper, un expert des épidémies de fièvre typhoïde, pour déterminer la cause des maladies dans leur foyer. Finalement, Soper a retrouvé Mallon et a directement lié 22 cas de fièvre typhoïde à elle. Il a découvert que Mallon était porteuse de la typhoïde mais qu'elle était elle-même immunisée contre cette maladie. Bien que des porteurs actifs aient déjà été reconnus, c'était la première fois qu'un porteur asymptomatique de l'infection était identifié.
Comme elle n'avait jamais été malade elle-même, Mallon avait du mal à croire qu'elle pouvait être à l'origine de la maladie. Elle a fui Soper et les autorités parce qu'elle ne voulait pas être mise en quarantaine ou forcée de renoncer à son métier, qui était relativement bien rémunéré pour une personne ayant ses antécédents. Cependant, Mallon a finalement été arrêtée et gardée dans un centre d'isolement dans le Bronx, où elle est restée jusqu'en 1910, date à laquelle le département de santé de New York l'a libérée à la condition qu'elle ne travaille plus jamais avec de la nourriture. Malheureusement, Mallon n'a pas obtempéré et elle a rapidement recommencé à travailler comme cuisinière. Après l'apparition de nouveaux cas qui ont entraîné la mort de deux personnes, les autorités l'ont retrouvée et l'ont mise en isolement, où elle est restée 23 ans de plus, jusqu'à sa mort en 1938. Les épidémiologistes ont pu retracer 51 cas de fièvre typhoïde et trois décès directement à Mallon, dont on se souvient de façon peu flatteuse sous le nom de « Typhoid Mary ».
L'affaire Typhoid Mary a des corrélations directes dans le secteur des soins de santé. Prenons l'exemple de Kaci Hickox, une infirmière américaine qui a soigné des patients atteints d'Ebola en Afrique de l'Ouest pendant l'épidémie de 2014. Après son retour aux États-Unis, Hickox a été mise en quarantaine contre son gré pendant trois jours et on a découvert plus tard qu'elle n'était pas atteinte du virus Ebola. Hickox s'est opposé avec véhémence à la quarantaine. Dans un éditorial publié dans le journal britannique The Guardian, 3 Hickox a fait valoir que la mise en quarantaine des agents de santé asymptomatiques qui n'avaient pas été testés positifs pour une maladie empêcherait non seulement ces personnes d'exercer leur profession, mais découragerait d'autres personnes de se porter volontaires pour travailler dans des zones touchées par des maladies où le personnel de santé est désespérément nécessaire.
Quelle est la responsabilité d'une personne comme Mary Mallon de modifier son comportement pour protéger les autres ? Que se passe-t-il lorsqu'une personne pense qu'elle ne représente pas un risque alors que d'autres pensent qu'elle l'est ? Comment réagiriez-vous si vous vous retrouviez dans la peau de Mallon et que vous étiez placé en quarantaine que vous ne croyiez pas nécessaire, au détriment de votre liberté et peut-être de votre carrière ? Cela aurait-il de l'importance que vous soyez définitivement infecté ou non ?
Infections à E. coli
Le bâtonnet Gram négatif Escherichia coli est un membre courant du microbiote normal du côlon. Bien que la grande majorité des souches d'E. coli soient des bactéries commensales utiles, certaines peuvent être pathogènes et provoquer de dangereuses maladies diarrhéiques. Les souches pathogènes possèdent des facteurs de virulence supplémentaires tels que les fimbriae de type 1 qui favorisent la colonisation du côlon ou peuvent produire des toxines (voir Facteurs de virulence des agents pathogènes bactériens et viraux). Ces facteurs de virulence sont acquis par transfert horizontal de gènes.
Une maladie extra-intestinale peut survenir si la bactérie se propage à partir du tractus gastro-intestinal. Bien que ces bactéries puissent se transmettre d'une personne à une autre, elles sont souvent contractées par des aliments ou de l'eau contaminés. Il existe six groupes pathogènes reconnus d'E. coli, mais nous nous concentrerons ici sur les quatre qui sont le plus souvent transmis par les aliments et l'eau.
La bactérie E. coli entérotoxinogène (ETEC), également connue sous le nom de diarrhée du voyageur, provoque des maladies diarrhéiques et est courante dans les pays moins développés. Au Mexique, l'infection par ETEC s'appelle Montezuma's Revenge. À la suite de l'ingestion d'aliments ou d'eau contaminés, les personnes infectées développent une diarrhée aqueuse, des crampes abdominales, un malaise (sensation de malaise) et une faible fièvre. L'ETEC produit une entérotoxine thermostable similaire à la toxine cholérique, ainsi que des adhésines appelées facteurs de colonisation qui aident les bactéries à se fixer à la paroi intestinale. Certaines souches d'ETEC produisent également des toxines thermolabiles. La maladie est généralement relativement bénigne et disparaît spontanément. Le diagnostic implique la culture et la PCR. Si nécessaire, un traitement antibiotique à base de fluoroquinolones, de doxycycline, de rifaximine et de triméthoprime-sulfaméthoxazole (TMP/SMZ) peut raccourcir la durée de l'infection. Cependant, la résistance aux antibiotiques constitue un problème.
La bactérie E. coli entéroinvasive (EIEC) est très similaire à la shigellose, notamment en ce qui concerne la pathogenèse de l'invasion intracellulaire du tissu épithélial intestinal. Cette bactérie est porteuse d'un grand plasmide qui intervient dans la pénétration des cellules épithéliales. La maladie est généralement spontanément résolutive et présente des symptômes tels que diarrhée aqueuse, frissons, crampes, malaise, fièvre et dysenterie. La culture et les tests PCR peuvent être utilisés pour le diagnostic. Le traitement antibiotique n'étant pas recommandé, un traitement de soutien est utilisé si nécessaire.
La bactérie E. coli entéropathogène (EPEC) peut provoquer une diarrhée potentiellement mortelle, en particulier chez les nourrissons et dans les pays moins développés. La fièvre, les vomissements et la diarrhée peuvent entraîner une déshydratation sévère. Ces E. coli injectent une protéine (Tir) qui se fixe à la surface des cellules épithéliales intestinales et déclenche le réarrangement de l'actine de la cellule hôte des microvillosités vers les socles. Le Tir est également le récepteur de l'intimine, une protéine de surface produite par l'EPEC, permettant ainsi à E. coli de « reposer » sur le piédestal. Les gènes nécessaires à cette formation du socle sont codés sur l'îlot de pathogénicité du locus d'effacement des entérocytes (LEE). Comme pour l'ETEC, le diagnostic implique la culture et la PCR. Le traitement est similaire à celui de l'ETEC.
Les souches les plus dangereuses sont les E. coli entérohémorragiques (EHEC), qui sont les souches susceptibles de provoquer des épidémies. En particulier, la souche O157:H7 a été responsable de plusieurs foyers récents. Rappelons que le O et le H font référence à des antigènes de surface qui contribuent à la pathogénicité et déclenchent une réponse immunitaire de l'hôte (« O » fait référence à la chaîne du côté O du lipopolysaccharide et le « H » fait référence aux flagelles). Semblable à l'EPEC, l'EHEC forme également des socles. L'EHEC produit également une toxine de type Shiga. Comme le génome de cette bactérie a été séquencé, on sait que les gènes de la toxine Shiga ont très probablement été acquis par transduction (transfert horizontal de gènes). Les gènes de la toxine Shiga proviennent de Shigella dysenteriae. Prophage à partir d'un bactériophage qui a déjà infecté Shigella et s'est intégré au chromosome d'E. coli. La toxine de type Shiga est souvent appelée vérotoxine.
L'EHEC peut provoquer des maladies relativement bénignes à potentiellement mortelles. Les symptômes incluent une diarrhée sanglante accompagnée de crampes sévères, mais pas de fièvre. Bien qu'elle soit souvent spontanément résolutive, elle peut entraîner une colite hémorragique et des saignements abondants. L'une des complications possibles est le SHU. Le diagnostic implique une culture, souvent à l'aide de MacConkey avec de la gélose au sorbitol pour différencier E. coli O157:H7, qui ne fermente pas le sorbitol, d'autres souches moins virulentes d'E. coli capables de fermenter le sorbitol.
Le typage sérologique ou les tests PCR peuvent également être utilisés, ainsi que des tests génétiques pour la toxine Shiga. Pour distinguer l'EPEC de l'EHEC, étant donné que ces deux substances forment des socles sur les cellules épithéliales intestinales, il est nécessaire de tester les gènes codant à la fois pour la toxine de type Shiga et pour le LEE. L'EPEC et l'EHEC sont tous deux porteurs du LEE, mais l'EPEC ne possède pas le gène de la toxine Shiga. L'antibiothérapie n'est pas recommandée et peut aggraver le SHU en raison des toxines libérées lorsque la bactérie est tuée. Des traitements de soutien doivent donc être utilisés. \(\PageIndex{1}\)Le tableau résume les caractéristiques des quatre groupes pathogènes les plus courants.
| Groupe | Facteurs et gènes de virulence | Signes et symptômes | Tests diagnostiques | Traitement |
|---|---|---|---|---|
| E. coli entérotoxinogène (ETEC) | Entérotoxine thermostable similaire à la toxine cholérique | Diarrhée aqueuse relativement légère | Culture, PCR | Régulnérabilité spontanée ; au besoin, fluoroquinolones, doxycycline, rifaximine, TMP/SMZ ; la résistance aux antibiotiques est un problème |
| E. coli entéroinvasif (EIEC) | Gènes Inv (plasmides invasifs) | Diarrhée aqueuse relativement légère ; dysenterie ou colite inflammatoire peuvent survenir | Culture, PCR ; dépistage du gène inv ; essais supplémentaires pour distinguer la Shigella | Traitement de soutien uniquement ; antibiotiques non recommandés |
| E. coli entéropathogène (EPEC) | Île de pathogénicité du locus d'effacement des entérocytes (LEE) | Fièvre sévère, vomissements, diarrhée non sanglante, déshydratation ; potentiellement fatale | Culture, PCR ; détection du LEE dépourvu de gènes de toxine de type Shiga | Régulnérabilité spontanée ; au besoin, fluoroquinolones, doxycycline, rifaximine (TMP/SMZ) ; la résistance aux antibiotiques est un problème |
| E. coli entérohémorragique (EHEC) | Vérotoxine | Peut être légère ou très grave ; diarrhée sanglante ; peut provoquer un SHU | Culture ; plaque sur gélose MacConkey avec de la gélose au sorbitol car elle ne fermente pas le sorbitol ; détection par PCR du LEE contenant des gènes de toxine de type Shiga | Les antibiotiques ne sont pas recommandés en raison du risque de SHU |
Exercice\(\PageIndex{4}\)
Comparez et comparez les facteurs de virulence ainsi que les signes et symptômes des infections avec les quatre principaux groupes d'E. coli.
Choléra et autres vibrions
Maladie gastro-intestinale Le choléra est une infection grave souvent associée à de mauvaises conditions sanitaires, en particulier à la suite de catastrophes naturelles, car elle se propage par l'eau contaminée et les aliments qui n'ont pas été chauffés à des températures suffisamment élevées pour tuer la bactérie. Elle est causée par le sérotype O1 de Vibrio cholerae, une bactérie flagellée gram-négative en forme de tige incurvée (vibrio). Selon les CDC, le choléra cause environ 3 à 5 millions de cas et 100 000 décès par an. 4
Comme V. cholerae est tué par l'acide gastrique, des doses relativement importantes sont nécessaires pour que quelques cellules microbiennes puissent survivre et atteindre les intestins et provoquer une infection. Les cellules motiles traversent la couche muqueuse des intestins, où elles se fixent aux cellules épithéliales et libèrent de l'entérotoxine cholérique. La toxine est une toxine A-B qui agit par l'intermédiaire de l'adénylate cyclase (voir Facteurs de virulence des agents pathogènes bactériens et viraux). Dans la cellule intestinale, les niveaux d'AMP cyclique (AMPc) augmentent, ce qui active un canal chlorure et entraîne la libération d'ions dans la lumière intestinale. Cette augmentation de la pression osmotique dans la lumière entraîne également la pénétration d'eau dans la lumière. Lorsque l'eau et les électrolytes quittent le corps, ils provoquent une déshydratation rapide et un déséquilibre électrolytique. La diarrhée est si abondante qu'on l'appelle souvent « selles d'eau de riz », et les patients sont placés sur des lits percés d'un trou pour surveiller la perte de liquide (Figure\(\PageIndex{4}\)).
Le choléra est diagnostiqué en prélevant un échantillon de selles et en les cultivant pour le Vibrio. Les bactéries sont positives à l'oxydase et présentent une fermentation sans lactose sur de la gélose MacConkey. Les fermenteurs de lactose à Gram négatif produiront des colonies rouges tandis que les fermenteurs non fermenteurs produiront des colonies blanches et incolores. Les bactéries à Gram positif ne se développeront pas sur MacConkey. La fermentation du lactose est couramment utilisée pour identifier les agents pathogènes car le microbiote normal fermente généralement le lactose alors que les agents pathogènes ne le font pas. V. cholerae peut également être cultivé sur de la gélose thiosulfate, citrate, sels biliaires et saccharose (TCBS), un milieu sélectif et différentiel pour les Vibrio spp., qui produisent une colonie jaune distincte.
Le choléra peut disparaître spontanément et le traitement implique une réhydratation et un réapprovisionnement en électrolytes. Bien que les antibiotiques ne soient généralement pas nécessaires, ils peuvent être utilisés pour traiter une maladie grave ou disséminée. Les tétracyclines sont recommandées, mais la doxycycline, l'érythromycine, l'orfloxacine, la ciprofloxacine et le TMP/SMZ peuvent être utilisés. Des preuves récentes suggèrent que l'azithromycine est également un bon antibiotique de première intention. Un bon assainissement, y compris un traitement approprié des eaux usées, des fournitures propres pour la cuisine et de l'eau potable purifiée, est important pour prévenir les infections (Figure\(\PageIndex{4}\))

V. cholera n'est pas la seule espèce de Vibrio susceptible de provoquer des maladies. V. parahemolyticus est associé à la consommation de fruits de mer contaminés et provoque des maladies gastro-intestinales accompagnées de signes et de symptômes tels que diarrhée aqueuse, nausées, fièvre, frissons et crampes abdominales. Les bactéries produisent une hémolysine thermostable, ce qui entraîne une dysenterie et peut-être une maladie disséminée. Elle provoque également parfois des infections des plaies. Le V. parahemolyticus est diagnostiqué à l'aide de cultures prélevées sur du sang, des selles ou une plaie. Comme pour V. cholera, le milieu sélectif (en particulier la gélose TCBS) fonctionne bien. La tétracycline et la ciprofloxacine peuvent être utilisées pour traiter les cas graves, mais les antibiotiques ne sont généralement pas nécessaires.
Vibrio vulnificus se trouve dans l'eau de mer chaude et, contrairement à V. cholerae, il n'est pas associé à de mauvaises conditions sanitaires. La bactérie se trouve dans les fruits de mer crus et son ingestion provoque des maladies gastro-intestinales. Il peut également être contracté par des personnes présentant des plaies cutanées ouvertes qui sont exposées à de l'eau contenant de fortes concentrations de l'agent pathogène. Dans certains cas, l'infection se propage à la circulation sanguine et provoque une septicémie. Une infection cutanée peut entraîner un œdème, une ecchymose (décoloration de la peau due à un saignement) et des abcès. Les patients atteints d'une maladie sous-jacente ont un taux de létalité élevé d'environ 50 %. Elle est particulièrement préoccupante pour les personnes atteintes d'une maladie chronique du foie ou qui sont immunodéficientes, car un système immunitaire sain peut souvent empêcher l'infection de se développer. On diagnostique V. vulnificus en cultivant le pathogène à partir d'échantillons de selles, de sang ou d'abcès cutanés. Les patients adultes sont traités par la doxycycline associée à une céphalosporine de troisième génération ou à des fluoroquinolones, et les enfants sont traités par TMP/SMZ.
Deux autres vibrions, Aeromonas hydrophila et Plesiomonas shigelloides, sont également associés aux environnements marins et aux fruits de mer crus ; ils peuvent également provoquer des gastro-entérites. Comme V. vulnificus, A. hydrophila est plus souvent associée à des infections des plaies, généralement celles contractées dans l'eau. Dans certains cas, elle peut également provoquer une septicémie. D'autres espèces d'Aeromonas peuvent provoquer des maladies. P. shigelloides est parfois associé à des infections systémiques plus graves s'il est ingéré dans des aliments ou de l'eau contaminés. La culture peut être utilisée pour diagnostiquer des infections à A. hydrophila et à P. shigelloides, pour lesquelles une antibiothérapie n'est généralement pas nécessaire. Si nécessaire, la tétracycline et la ciprofloxacine, entre autres antibiotiques, peuvent être utilisées pour traiter A. hydrophila, et les fluoroquinolones et le triméthoprime sont les traitements efficaces contre P. shigelloides.
Exercice\(\PageIndex{5}\)
Comment l'infection à V. cholera entraîne-t-elle une déshydratation rapide ?
Gastro-entérite à Campylobacter jejuni
Campylobacter est un genre de bactéries gram-négatives, spirales ou incurvées. Ils peuvent avoir un ou deux flagelles. La gastro-entérite à Campylobacter jejuni, une forme de campylobactériose, est une maladie répandue causée par Campylobacter jejuni. La principale voie de transmission est la volaille contaminée lors de l'abattage. La manipulation du poulet cru contamine à son tour les surfaces de cuisson, les ustensiles et d'autres aliments. Le lait non pasteurisé ou l'eau contaminée sont également des véhicules potentiels de transmission. Dans la plupart des cas, la maladie est spontanément résolutive et comprend de la fièvre, de la diarrhée, des crampes, des vomissements et parfois de la dysenterie. Des signes et symptômes plus graves, tels qu'une bactériémie, une méningite, une pancréatite, une cholécystite et une hépatite, apparaissent parfois. Elle a également été associée à des maladies auto-immunes telles que le syndrome de Guillain-Barré, une maladie neurologique qui survient après certaines infections et entraîne une paralysie temporaire. Un SHU peut également survenir après une infection. La virulence de nombreuses souches est le résultat de la production d'hémolysine et de la présence de la toxine de distension cytoléthale (CDT) de Campylobacter, une puissante désoxyribonucléase (DNase) qui endommage de manière irréversible l'ADN de la cellule hôte.
Le diagnostic implique une culture dans des conditions spéciales, telles qu'une température élevée, une faible tension en oxygène et souvent une supplémentation en agents antimicrobiens. Ces bactéries doivent être cultivées sur un milieu sélectif (tel que Campy CV, milieu sélectif au charbon ou gélose désoxycholate au charbon de céfaperazone) et incubées dans des conditions microaérophiles pendant au moins 72 heures à 42 °C. Un traitement antibiotique n'est généralement pas nécessaire, mais de l'érythromycine ou de la ciprofloxacine peuvent être utilisées.
Ulcères peptiques
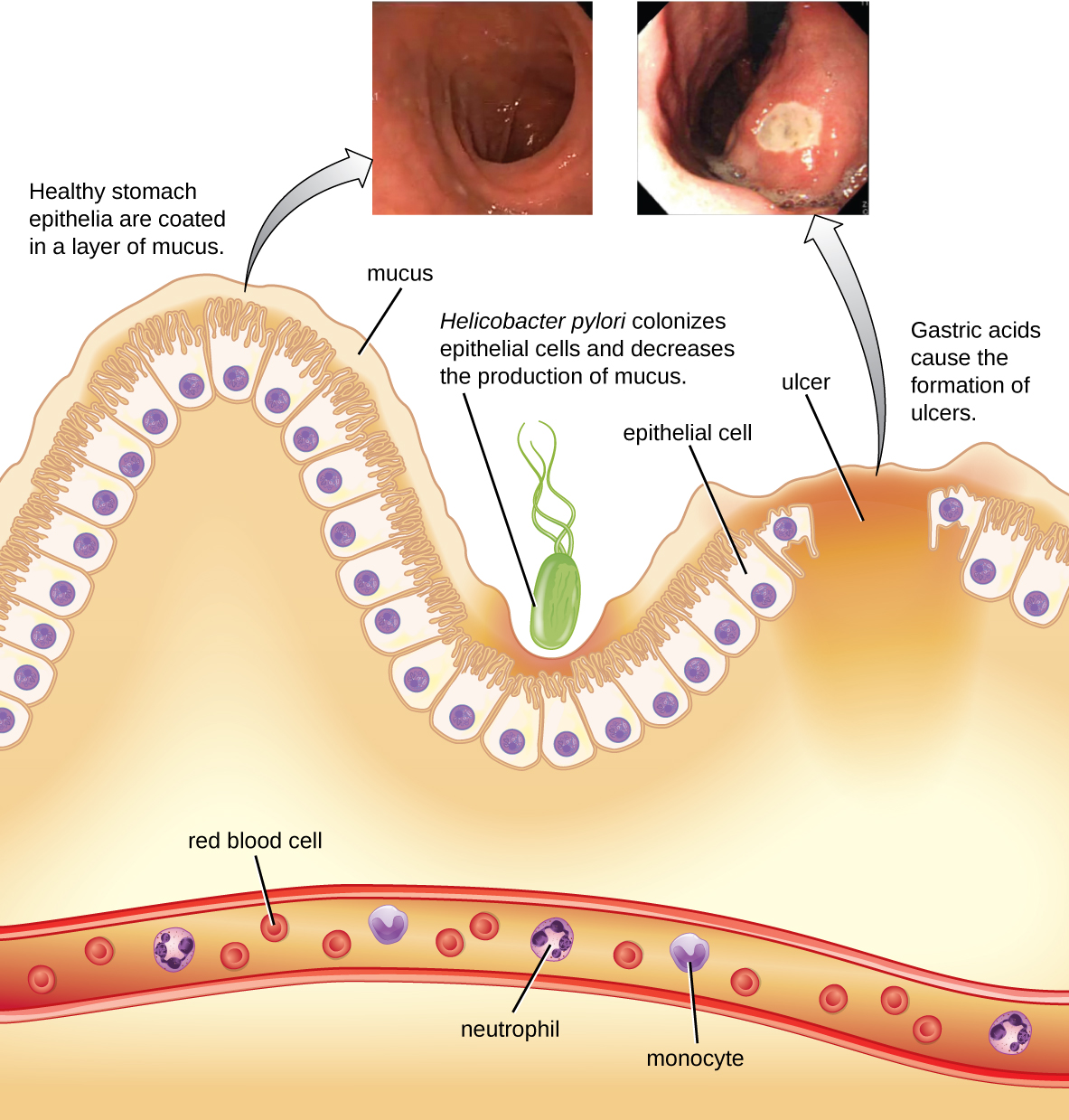
La bactérie à Gram négatif Helicobacter pylori est capable de tolérer l'environnement acide de l'estomac humain et s'est révélée être l'une des principales causes des ulcères gastro-duodénaux, qui sont des ulcères de l'estomac ou du duodénum. La bactérie est également associée à un risque accru de cancer de l'estomac (Figure\(\PageIndex{5}\)). Selon les CDC, environ les deux tiers de la population sont infectés par H. pylori, mais moins de 20 % présentent un risque de développer des ulcères ou un cancer de l'estomac. H. pylori est présent dans environ 80 % des ulcères de l'estomac et dans plus de 90 % des ulcères duodénaux. 5
H. pylori colonise les cellules épithéliales de l'estomac à l'aide de pili pour l'adhésion. Ces bactéries produisent de l'uréase, qui stimule une réponse immunitaire et crée de l'ammoniac qui neutralise les acides gastriques afin de créer un microenvironnement plus accueillant. L'infection endommage les cellules de la paroi de l'estomac, y compris celles qui produisent normalement le mucus protecteur qui sert de barrière entre les tissus et l'acide gastrique. En conséquence, une inflammation (gastrite) se produit et des ulcères peuvent se développer lentement. La formation d'ulcères peut également être causée par l'activité des toxines. Il a été rapporté que 50 % des isolats cliniques de H. pylori présentent des niveaux détectables d'activité exotoxique in vitro. 6 Cette toxine, VacA, induit la formation de vacuoles dans les cellules hôtes. VacA ne présente aucune homologie de séquence primaire avec d'autres toxines bactériennes et, dans un modèle murin, il existe une corrélation entre la présence du gène de la toxine, l'activité de la toxine et les lésions du tissu épithélial gastrique.
Les signes et symptômes incluent des nausées, un manque d'appétit, des ballonnements, des rots et une perte de poids. Les ulcères hémorragiques peuvent produire des selles foncées. Si aucun traitement n'est administré, les ulcères peuvent s'approfondir, d'autres tissus peuvent être touchés et une perforation de l'estomac peut survenir. Comme la perforation permet aux enzymes digestives et à l'acide de pénétrer dans l'organisme, il s'agit d'une affection très grave.
Pour diagnostiquer une infection à H. pylori, plusieurs méthodes sont disponibles. Lors d'un test respiratoire, le patient avale de l'urée radiomarquée. Si H. pylori est présent, la bactérie produira de l'uréase pour décomposer l'urée. Cette réaction produit du dioxyde de carbone radiomarqué qui peut être détecté dans l'haleine du patient. Des analyses sanguines peuvent également être utilisées pour détecter les anticorps dirigés contre H. pylori. Les bactéries elles-mêmes peuvent être détectées à l'aide d'un test des selles ou d'une biopsie de la paroi de l'estomac.
Des antibiotiques peuvent être utilisés pour traiter l'infection. Cependant, la Food and Drug Administration des États-Unis recommande d'utiliser une trithérapie, propre à H. pylori. Les protocoles actuels sont les suivants : 10 jours de traitement à l'oméprazole, à l'amoxicilline et à la clarithromycine (OAC) ; 14 jours de traitement au sous-salicylate de bismuth, au métronidazole et à la tétracycline (BMT) ; ou 10 ou 14 jours de traitement par le lansoprazole, l'amoxicilline et la clarithromycine (LAC). L'oméprazole, le sous-salicylate de bismuth et le lansoprazole ne sont pas des antibiotiques mais sont plutôt utilisés pour réduire les niveaux d'acide, car H. pylori préfère les environnements acides.
Bien que le traitement soit souvent utile, il existe également des risques d'éradication de H. pylori. L'infection par H. pylori peut en fait protéger contre certains cancers, tels que l'adénocarcinome œsophagien et le reflux gastro-œsophagien. 7 8
Exercice\(\PageIndex{6}\)
Comment H. pylori provoque-t-il les ulcères gastro-duodénaux ?
Gastroentérite à Clostridium perfringens
La gastro-entérite à Clostridium perfringens est une maladie d'origine alimentaire généralement bénigne associée à des viandes et à d'autres aliments insuffisamment cuits. C. perfringens est une bactérie anaérobie à Gram positif, en forme de bâtonnet, formant des endospores qui tolère les températures élevées et basses. À des températures élevées, les bactéries peuvent former des endospores qui germent rapidement dans les aliments ou dans l'intestin. Les intoxications alimentaires par des souches de type A sont courantes. Cette souche produit toujours une entérotoxine, parfois également présente dans d'autres souches, qui provoque les symptômes cliniques de crampes et de diarrhée. Une forme plus grave de la maladie, appelée cochon ou entérite nécrotique, provoque des hémorragies, des douleurs, des vomissements et des ballonnements. Une gangrène des intestins peut en résulter. Cette forme présente un taux de mortalité élevé, mais elle est rare aux États-Unis.
Le diagnostic consiste à détecter la toxine C. perfringens dans des échantillons de selles à l'aide de techniques de biologie moléculaire (détection du gène de la toxine par PCR) ou d'immunologie (ELISA). La bactérie elle-même peut également être détectée dans les aliments ou dans les échantillons de matières fécales. Le traitement comprend une thérapie de réhydratation, un remplacement électrolytique et des liquides intraveineux. Les antibiotiques ne sont pas recommandés car ils peuvent endommager l'équilibre du microbiote intestinal et la résistance aux antibiotiques suscite des inquiétudes. La maladie peut être évitée par une manipulation et une cuisson appropriées des aliments, notamment par une réfrigération rapide à des températures suffisamment basses et une cuisson des aliments à une température suffisamment élevée.
Clostridium difficile
Le Clostridium difficile est un bâtonnet à Gram positif qui peut être une bactérie commensale faisant partie du microbiote normal des personnes en bonne santé. Lorsque le microbiote normal est perturbé par l'utilisation prolongée d'antibiotiques, cela peut permettre la prolifération de cette bactérie et provoquer une diarrhée associée aux antibiotiques causée par C. difficile. La diarrhée associée aux antibiotiques peut également être considérée comme une maladie nosocomiale. Les patients les plus à risque d'infection à C. difficile sont ceux qui sont immunodéprimés, qui ont été hospitalisés pendant de longues périodes, qui sont plus âgés, qui ont récemment pris des antibiotiques, qui ont subi des interventions gastro-intestinales ou qui utilisent des inhibiteurs de la pompe à protons, qui réduisent l'acidité de l'estomac et permettre la prolifération de C. difficile. Comme cette espèce peut former des endospores, elle peut survivre pendant de longues périodes dans l'environnement dans des conditions difficiles et constitue une préoccupation majeure dans les établissements de soins de santé.
Cette bactérie produit deux toxines, la toxine A de Clostridium difficile (TcDA) et la toxine B de Clostridium difficile (TCDb). Ces toxines inactivent les petites protéines liant le GTP, ce qui entraîne la condensation de l'actine et l'arrondissement des cellules, suivis de la mort cellulaire. Les infections commencent par une nécrose focale, puis par une ulcération avec exsudat, et peuvent évoluer vers une colite pseudomembraneuse, qui implique une inflammation du côlon et le développement d'une pseudomembrane de fibrine contenant des cellules épithéliales mortes et des leucocytes (Figure\(\PageIndex{6}\)). Une diarrhée aqueuse, une déshydratation, de la fièvre, une perte d'appétit et des douleurs abdominales peuvent en résulter. Une perforation du côlon peut survenir, entraînant une septicémie, un choc et la mort. C. difficile est également associé à une entérocolite nécrosante chez les prématurés et à une entérocolite neutropénique associée à des traitements anticancéreux.
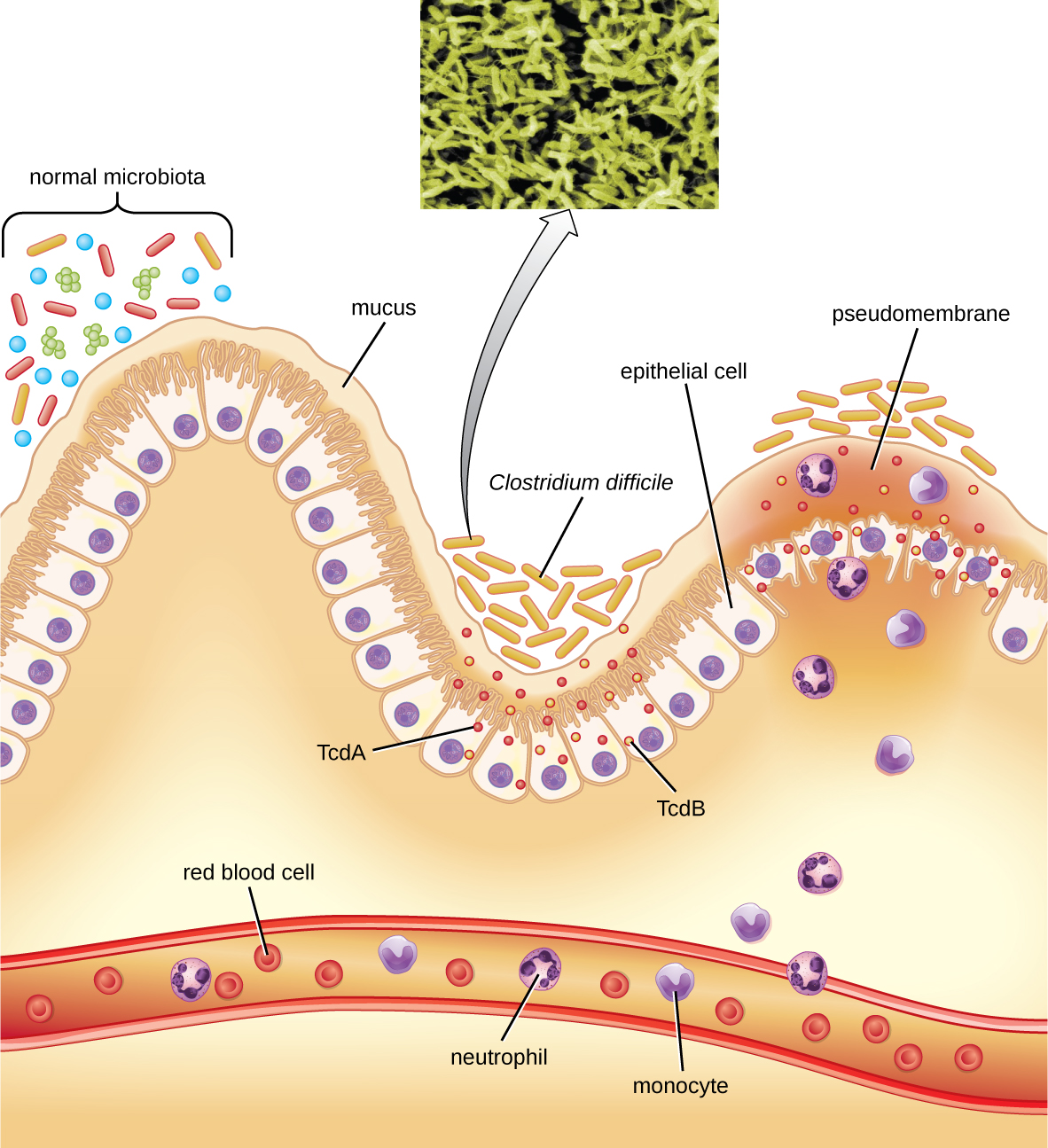
Le diagnostic est établi en tenant compte des antécédents du patient (tels que l'exposition à des antibiotiques), de la présentation clinique, de l'imagerie, de l'endoscopie, des tests de laboratoire et d'autres données disponibles. La détection de la toxine dans les échantillons de selles permet de confirmer le diagnostic. Bien que la culture soit préférée, elle est rarement pratique en pratique clinique car la bactérie est un anaérobe obligatoire. Les tests d'amplification des acides nucléiques, y compris la PCR, sont considérés comme préférables aux tests ELISA pour l'analyse moléculaire.
La première étape du traitement conventionnel consiste à arrêter l'utilisation d'antibiotiques, puis à fournir un traitement de soutien comprenant un remplacement électrolytique et des liquides. Le métronidazole est le traitement préféré si le diagnostic de C. difficile est confirmé. La vancomycine peut également être utilisée, mais elle doit être réservée aux patients pour lesquels le métronidazole s'est révélé inefficace ou qui répondent à d'autres critères (par exemple, moins de 10 ans, enceintes ou allergiques au métronidazole).
Une nouvelle approche thérapeutique, connue sous le nom de greffe fécale, met l'accent sur la restauration du microbiote intestinal afin de combattre l'infection. Dans le cadre de cette procédure, une personne en bonne santé donne un échantillon de selles, qui est mélangé à une solution saline et transplanté au receveur par coloscopie, endoscopie, sigmoïdoscopie ou lavement. Il a été rapporté que cette procédure permet de résoudre les infections à C. difficile avec plus de 90 % de succès. 9
Exercice\(\PageIndex{7}\)
Comment l'utilisation d'antibiotiques entraîne-t-elle des infections à C. difficile ?
Maladie d'origine alimentaire due à Bacillus cereus
Le Bacillus cereus, que l'on trouve couramment dans le sol, est une bactérie à Gram positif formant des endospores qui peut parfois provoquer des maladies d'origine alimentaire. Les endospores de B. cereus peuvent survivre à la cuisson et produire des entérotoxines dans les aliments après qu'ils ont été chauffés ; les maladies surviennent souvent après la consommation de riz et d'autres aliments préparés laissés trop longtemps à température ambiante. Les signes et symptômes apparaissent quelques heures après l'ingestion et incluent des nausées, des douleurs et des crampes abdominales. B. cereus produit deux toxines : l'une provoque la diarrhée et l'autre provoque des vomissements. Des signes et des symptômes plus graves peuvent parfois apparaître.
Le diagnostic peut être effectué en isolant les bactéries des échantillons de selles ou des vomissements et des aliments infectés non consommés. Le traitement implique une réhydratation et un traitement de soutien. Les antibiotiques ne sont généralement pas nécessaires, car la maladie est généralement relativement bénigne et est due à l'activité des toxines.
Maladie d'origine alimentaire due à la yersinie
Le genre Yersinia est surtout connu pour le Yersinia pestis, un bâtonnet à Gram négatif responsable de la peste. Cependant, Y. enterocolitica et Y. pseudotuberculosis peuvent provoquer une gastro-entérite. L'infection se transmet généralement par voie fécale-orale, par ingestion d'aliments ou d'eau contaminés par des matières fécales. Une intoxication peut également résulter de l'activité de son endotoxine et de ses exotoxines (entérotoxine et facteur nécrosant des cytotoxines). La maladie est normalement relativement bénigne et disparaît spontanément. Cependant, une diarrhée sévère et une dysenterie peuvent apparaître chez les nourrissons. Chez les adultes, l'infection peut se propager et entraîner des complications telles qu'une arthrite réactive, des troubles thyroïdiens, une endocardite, une glomérulonéphrite, une inflammation oculaire et/ou un érythème noueux. Une bactériémie peut apparaître dans de rares cas.
Le diagnostic se fait généralement en détectant la bactérie dans les échantillons de selles. Des échantillons peuvent également être prélevés à partir d'autres tissus ou fluides corporels. Le traitement est généralement de soutien, y compris la réhydratation, sans antibiotiques. En cas de bactériémie ou d'autres maladies systémiques, des antibiotiques tels que les fluoroquinolones, les aminoglycosides, la doxycycline et le triméthoprime-sulfaméthoxazole peuvent être utilisés. Le rétablissement peut prendre jusqu'à deux semaines.
Exercice\(\PageIndex{8}\)
Comparez et comparez les maladies d'origine alimentaire causées par B. cereus et Yersinia.
Infections bactériennes du tractus gastro-intestinal
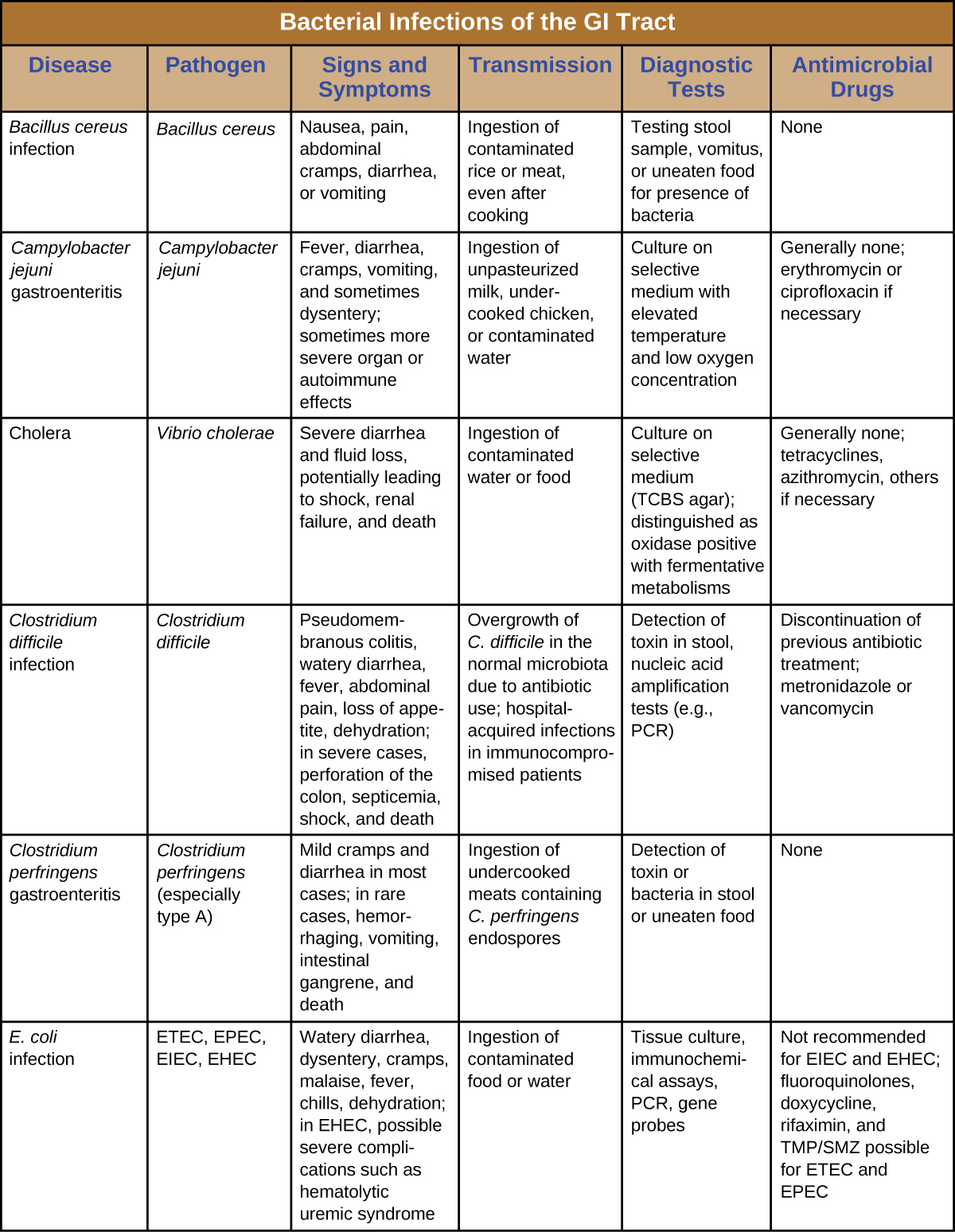
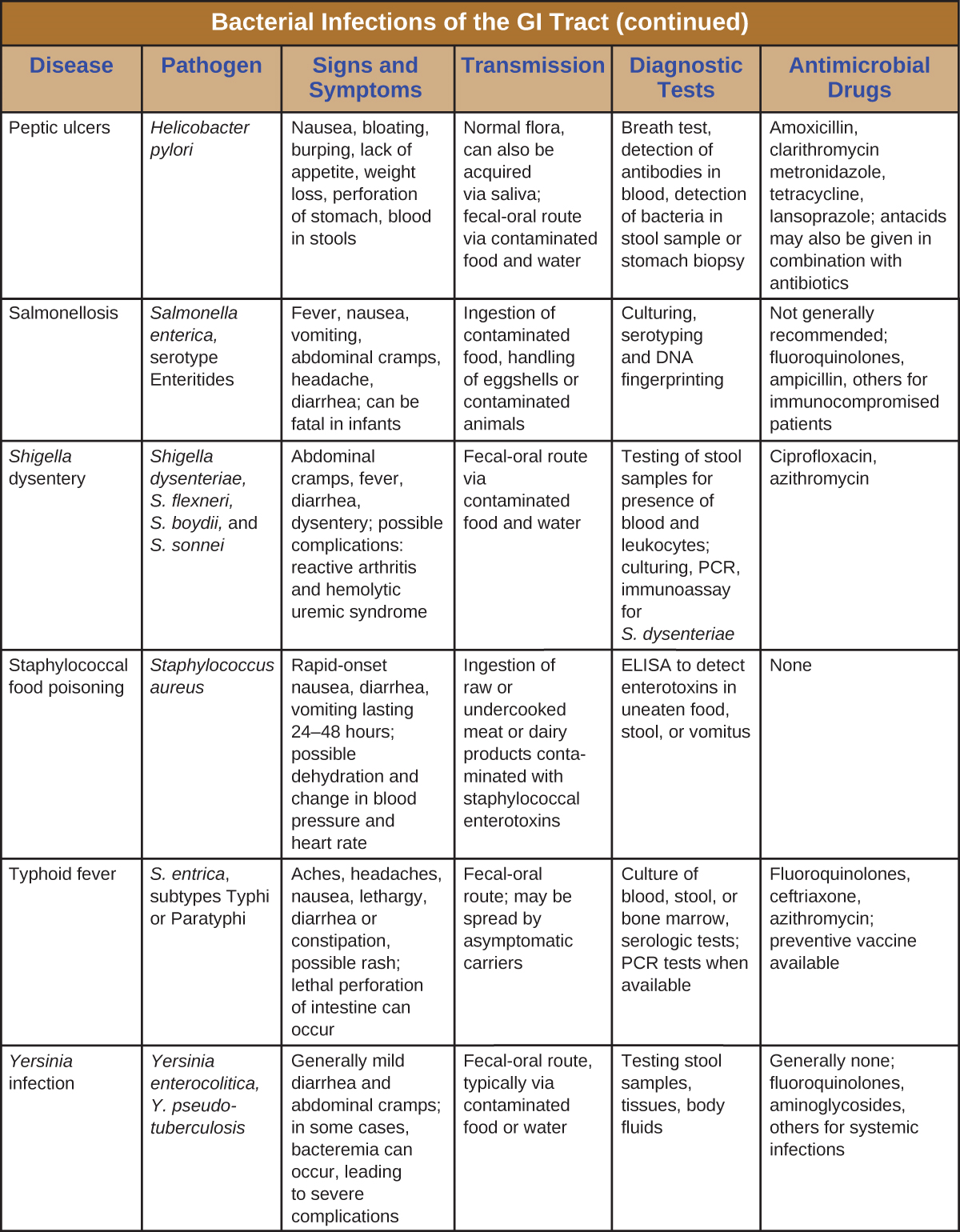
Les infections bactériennes du tractus gastro-intestinal surviennent généralement lorsque des bactéries ou des toxines bactériennes sont ingérées dans des aliments ou de l'eau contaminés. Les toxines et autres facteurs de virulence peuvent provoquer une inflammation gastro-intestinale et des symptômes généraux tels que diarrhée et vomissements. Les infections gastro-intestinales d'origine bactérienne peuvent varier considérablement en termes de sévérité et de traitement. Certains peuvent être traités avec des antibiotiques, mais dans d'autres cas, les antibiotiques peuvent être inefficaces pour combattre les toxines ou même contre-productifs s'ils compromettent le microbiote gastro-intestinal. Figure\(\PageIndex{7}\) et figure\(\PageIndex{8}\) les principales caractéristiques des infections gastro-intestinales bactériennes courantes.
Orientation clinique : partie 2
À l'hôpital, le médecin de Carli a commencé à réfléchir aux causes possibles de ses graves troubles gastro-intestinaux. L'une des possibilités était une intoxication alimentaire, mais personne d'autre dans sa famille n'était malade. Le médecin a demandé ce que Carli avait mangé la veille ; sa mère a mentionné qu'elle avait mangé des œufs au déjeuner et qu'ils étaient peut-être un peu mal cuits. Le médecin a prélevé un échantillon des selles de Carli et l'a envoyé pour des tests de laboratoire dans le cadre de son bilan de santé. Elle soupçonnait Carli d'avoir un cas de gastro-entérite bactérienne ou virale, mais elle avait besoin d'en connaître la cause afin de prescrire un traitement approprié.
En laboratoire, des techniciens ont identifié au microscope des bacilles à Gram négatif dans l'échantillon de selles de Carli. Ils ont également établi une culture pure de la bactérie et l'ont analysée pour détecter la présence d'antigènes. Ces tests ont montré que l'agent causal était la salmonelle.
Exercice\(\PageIndex{9}\)
Que doit faire le médecin maintenant pour traiter Carli ?
Concepts clés et résumé
- Les principales causes de maladies gastro-intestinales sont les bactéries Salmonella spp., Staphylococcus spp., Helicobacter pylori, Clostridium perfringens, Clostridium difficile, Bacillus cereus et Yersinia.
- C. difficile est une cause importante d'infection nosocomiale.
- Vibrio cholerae provoque le choléra, qui peut être une maladie diarrhéique grave.
- Différentes souches d'E. coli, dont l'ETEC, l'EPEC, l'EIEC et l'EHEC, provoquent différentes maladies avec des degrés de gravité variables.
- H. pylori est associé à des ulcères gastro-duodénaux.
- Les sérotypes de Salmonella enterica peuvent provoquer la fièvre typhoïde, une maladie plus grave que la salmonellose.
- La réhydratation et d'autres thérapies de soutien sont souvent utilisées comme traitements généraux.
- Une utilisation prudente des antibiotiques est nécessaire pour réduire le risque de provoquer des infections à C. difficile et lors du traitement des infections résistantes aux antibiotiques.
Notes
- 1 Jaya Sureshbabu. « Bilan de l'infection à Shigella ». Medscape. Mis à jour le 28 juin 2016. http://emedicine.medscape.com/article/968773-workup.
- 2 centres pour le contrôle et la prévention des maladies. Salmonelle. Mis à jour le 25 août 2016. https://www.cdc.gov/salmonella.
- 3 Kaci Hickox. « Arrêtez de m'appeler « infirmière Ebola ». » Le Guardian. 17 novembre 2014. www.theguardian.com/commentis... se-kaci-hickox.
- 4 centres pour le contrôle et la prévention des maladies. Infection par le choléra et le vibrio cholerae. Mis à jour le 6 novembre 2014. http://www.cdc.gov/cholera/general. Consulté le 14 septembre 2016.
- 5 centres pour le contrôle et la prévention des maladies. « Helicobacter pylori : fiche d'information à l'intention des professionnels de santé. » Mis à jour en juillet 1998. www.cdc.gov/ulcer/files/hpfacts.pdf.
- 6 T. L. Couverture. « La cytotoxine vacuolisante d'Helicobacter pylori. » Microbiologie moléculaire 20 (1996) 2 : p. 241 à 246. http://www.ncbi.nlm.nih.gov/pubmed/8733223.
- 7 Martin J. Blaser. « Microbiote en voie de disparition : Helicobacter pylori protège contre l'adénocarcinome œsophagien. » Recherche sur la prévention du cancer 1 (2008) 5 : p. 308 à 311. http://cancerpreventionresearch.aacr....full.pdf+html.
- 8 Ivan F. N. Hung et Benjamin C.Y. Wong. « Évaluation des risques et des avantages du traitement de l'infection à Helicobacter pylori. » Progrès thérapeutiques en gastroentérologie 2 (2009) 3 : pp, 141—147. doi : 10.1177/1756283X08100279.
- 9 Faith Rohlke et Neil Stollman. « Transplantation de microbiote fécal dans une infection récidivante à Clostridium difficile », Therapeutic Advances in Gastroenterology 5 (2012) 6 : 403—420. doi : 10.1177/1756283X12453637.


