18.5 : Vaccins
- Page ID
- 187709
Objectifs d'apprentissage
- Comparez les différents types d'immunité artificielle
- Différencier la variolation de la vaccination
- Décrire les différents types de vaccins et expliquer leurs avantages et inconvénients respectifs
Pour de nombreuses maladies, la prévention est la meilleure forme de traitement, et peu de stratégies de prévention sont aussi efficaces que la vaccination. La vaccination est une forme d'immunité artificielle. En stimulant artificiellement les défenses immunitaires adaptatives, un vaccin déclenche une production de cellules mémoire similaire à celle qui se produirait lors d'une réponse primaire. Ce faisant, le patient est capable de développer une forte réponse secondaire lorsqu'il est exposé à l'agent pathogène, mais sans avoir à souffrir au préalable d'une infection initiale. Dans cette section, nous explorerons différents types d'immunité artificielle ainsi que différents types de vaccins et les mécanismes par lesquels ils induisent une immunité artificielle.
Classification de l'immunité adaptative
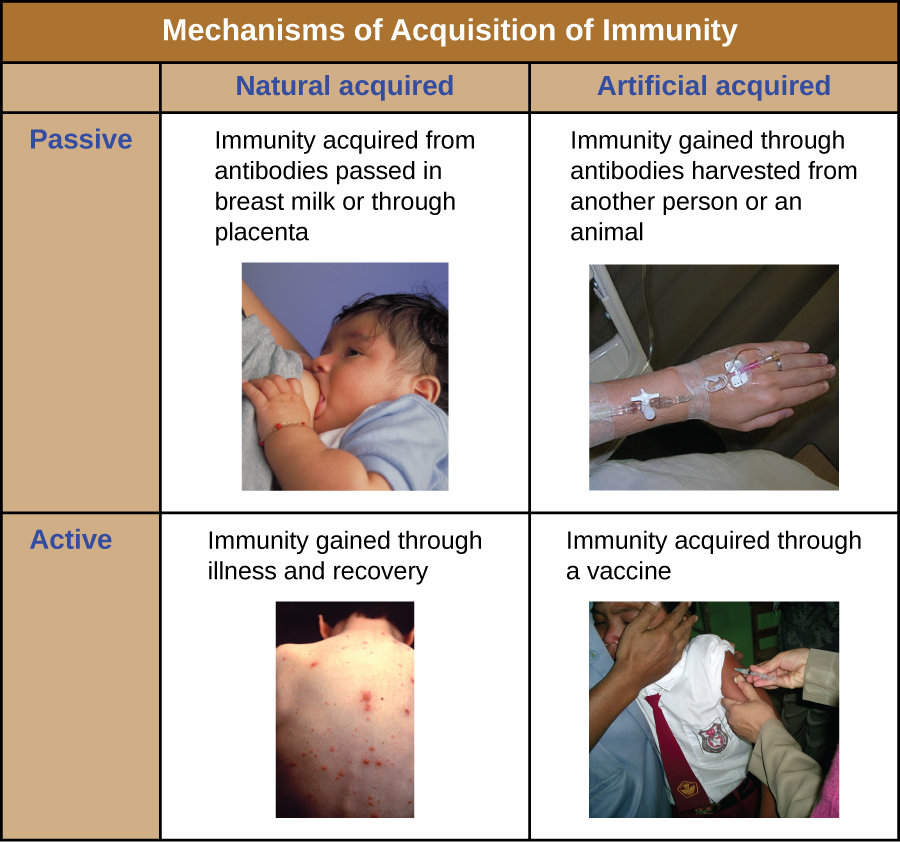
Toutes les formes d'immunité adaptative peuvent être décrites comme actives ou passives. L'immunité active fait référence à l'activation des défenses immunitaires adaptatives d'un individu, tandis que l'immunité passive fait référence au transfert de défenses immunitaires adaptatives d'un autre individu ou animal. L'immunité active et passive peut être subdivisée en fonction du fait que la protection est acquise naturellement ou artificiellement.
L'immunité active naturelle est une immunité adaptative qui se développe après une exposition naturelle à un agent pathogène (Figure\(\PageIndex{1}\)). Par exemple, l'immunité permanente qui se développe après la guérison d'une infection par la varicelle ou la rougeole (bien qu'une infection aiguë ne soit pas toujours nécessaire pour activer l'immunité adaptative). La durée pendant laquelle une personne est protégée peut varier considérablement en fonction du pathogène et des antigènes impliqués. Par exemple, l'activation de l'immunité adaptative par des structures de pointe protéique lors d'une infection virale intracellulaire peut activer l'immunité à vie, tandis que l'activation par des antigènes des capsules glucidiques lors d'une infection bactérienne extracellulaire peut activer une immunité à court terme.
L'immunité passive naturelle implique le passage naturel d'anticorps d'une mère à son enfant avant et après la naissance. Les IgG sont la seule classe d'anticorps capable de traverser le placenta entre le sang de la mère et le sang du fœtus. Le transfert placentaire d'IgG constitue une défense immunitaire passive importante pour le nourrisson, qui dure jusqu'à six mois après la naissance. Les IgA sécrétoires peuvent également être transférées de la mère au nourrisson par le lait maternel.
L'immunité passive artificielle fait référence au transfert d'anticorps produits par un donneur (humain ou animal) à un autre individu. Ce transfert d'anticorps peut être effectué à titre prophylactique (c'est-à-dire pour prévenir la maladie après exposition à un agent pathogène) ou comme stratégie de traitement d'une infection active. Par exemple, l'immunité passive artificielle est couramment utilisée pour la prophylaxie post-exposition contre la rage, l'hépatite A, l'hépatite B et la varicelle (chez les personnes à risque élevé). Les infections actives traitées par immunité passive artificielle incluent les infections par le cytomégalovirus chez les patients immunodéprimés et les infections par le virus Ebola. En 1995, huit patients atteints d'une infection active au virus Ebola en République démocratique du Congo ont reçu des transfusions sanguines de patients en convalescence. Un seul des huit patients est décédé (soit un taux de mortalité de 12,5 %), ce qui était bien inférieur au taux de mortalité attendu de 80 % dû au virus Ebola chez les patients non traités. 1 L'immunité passive artificielle est également utilisée pour le traitement de maladies causées par des toxines bactériennes, notamment le tétanos, le botulisme et la diphtérie.
L'immunité active artificielle est à la base de la vaccination. Elle implique l'activation de l'immunité adaptative par l'exposition délibérée d'un individu à des agents pathogènes affaiblis ou inactivés, ou à des préparations contenant des antigènes pathogènes clés.
Exercice\(\PageIndex{1}\)
- Quelle est la différence entre immunité active et immunité passive ?
- Quel type d'immunité est conféré par un vaccin ?
Immunité collective
Les quatre types d'immunité qui viennent d'être décrits sont le résultat du système immunitaire adaptatif d'un individu. Quelle que soit la maladie, une personne peut être considérée comme immunisée ou susceptible selon sa capacité à développer une réponse immunitaire efficace lors de l'exposition. Ainsi, toute population donnée est susceptible de compter certaines personnes immunisées et d'autres personnes sensibles. Si une population compte très peu d'individus vulnérables, même ces individus vulnérables seront protégés par un phénomène appelé immunité collective. L'immunité collective n'a rien à voir avec la capacité d'une personne à développer une réponse immunitaire efficace ; elle se produit plutôt parce qu'il y a trop peu de personnes sensibles dans une population pour que la maladie se propage efficacement.
Les programmes de vaccination créent une immunité collective en réduisant considérablement le nombre de personnes vulnérables au sein d'une population. Même si certains individus de la population ne sont pas vaccinés, tant qu'un certain pourcentage est immunisé (naturellement ou artificiellement), il est peu probable que les quelques individus sensibles soient exposés au pathogène. Toutefois, étant donné que de nouvelles personnes entrent constamment dans la population (par exemple, à la naissance ou à la suite d'une relocalisation), des programmes de vaccination sont nécessaires pour maintenir l'immunité collective.
Vaccination : obligation ou choix
De plus en plus de parents choisissent de ne pas faire vacciner leurs enfants. Ils sont surnommés « antivaxxers » et la majorité d'entre eux pensent que les vaccins sont à l'origine de l'autisme (ou d'autres maladies), un lien qui a maintenant été totalement réfuté. D'autres s'opposent aux vaccins pour des raisons religieuses ou morales (par exemple, l'argument selon lequel la vaccination Gardasil contre le VPH peut favoriser la promiscuité sexuelle), pour des raisons éthiques personnelles (par exemple, une objection de conscience à toute intervention médicale) ou pour des raisons politiques (par exemple, l'idée que les vaccinations obligatoires sont violation des libertés individuelles). 2
On pense que ce nombre croissant de personnes non vaccinées a provoqué de nouvelles épidémies de coqueluche et de rougeole. Nous nous attendons à ce que l'immunité collective protège les personnes non vaccinées dans notre population, mais l'immunité collective ne peut être maintenue que si un nombre suffisant de personnes sont vaccinées.
La vaccination est clairement bénéfique pour la santé publique. Mais du point de vue de chaque parent, la vision peut être plus obscure. Les vaccins, comme toutes les interventions médicales, comportent des risques associés, et même si les risques liés à la vaccination peuvent être extrêmement faibles par rapport aux risques d'infection, les parents peuvent ne pas toujours comprendre ou accepter le consensus de la communauté médicale. Ces parents ont-ils le droit de ne pas vacciner leurs enfants ? Devraient-ils être autorisés à mettre leurs enfants et la société dans son ensemble en danger ?
De nombreux gouvernements insistent sur la vaccination des enfants comme condition préalable à l'entrée dans l'école publique, mais il est devenu facile dans la plupart des États de se soustraire à cette obligation ou de garder les enfants en dehors du système public. Depuis les années 1970, la Virginie occidentale et le Mississippi ont mis en place des exigences strictes en matière de vaccination des enfants, sans exception, et aucun des deux États n'a enregistré de cas de rougeole depuis le début des années 1990. Les législateurs californiens ont récemment adopté une loi similaire en réponse à une épidémie de rougeole en 2015, rendant ainsi beaucoup plus difficile pour les parents de ne pas se faire vacciner si leurs enfants fréquentent les écoles publiques. Compte tenu de ce bilan et des efforts législatifs renouvelés, d'autres États devraient-ils adopter des exigences aussi strictes ?
Quel rôle les prestataires de santé devraient-ils jouer dans la promotion ou l'application de la vaccination universelle Des études ont montré que de nombreux parents peuvent changer d'avis en réponse aux informations fournies par les agents de santé, mais est-ce à ces derniers de tenter de persuader les parents de faire vacciner leurs enfants ? Certains prestataires de soins de santé sont naturellement réticents à traiter des patients non vaccinés. Ont-ils le droit de refuser de servir les patients qui refusent de se faire vacciner ? Les compagnies d'assurance ont-elles le droit de refuser la couverture aux antivaxxers ? Ce sont toutes des questions éthiques que les décideurs politiques peuvent être contraints de résoudre alors que de plus en plus de parents contournent les normes de vaccination
Variolation et vaccination
Il y a des milliers d'années, on a découvert pour la première fois que les personnes ayant survécu à une infection par la variole étaient immunisées contre les infections subséquentes. La pratique consistant à inoculer des individus pour les protéger activement de la variole semble avoir vu le jour au Xe siècle en Chine, lorsque la pratique de la variolation a été décrite (Figure\(\PageIndex{2}\)). La variolation fait référence à l'inoculation délibérée de matériel infectieux provenant de croûtes ou de pustules de victimes de la variole. Les matières infectieuses ont été injectées dans la peau ou introduites par voie nasale. L'infection qui s'est développée était généralement plus bénigne que la variole contractée naturellement, et la guérison d'une infection plus bénigne a permis de se protéger contre la maladie la plus grave.
Bien que la majorité des personnes traitées par variolation n'aient développé que des infections bénignes, la pratique n'était pas sans risques. Des infections plus graves et parfois mortelles se sont produites et, comme la variole était contagieuse, les infections résultant de la variolation pouvaient provoquer des épidémies. Malgré cela, la pratique de la variolation pour la prévention de la variole s'est étendue à d'autres régions, notamment en Inde, en Afrique et en Europe.

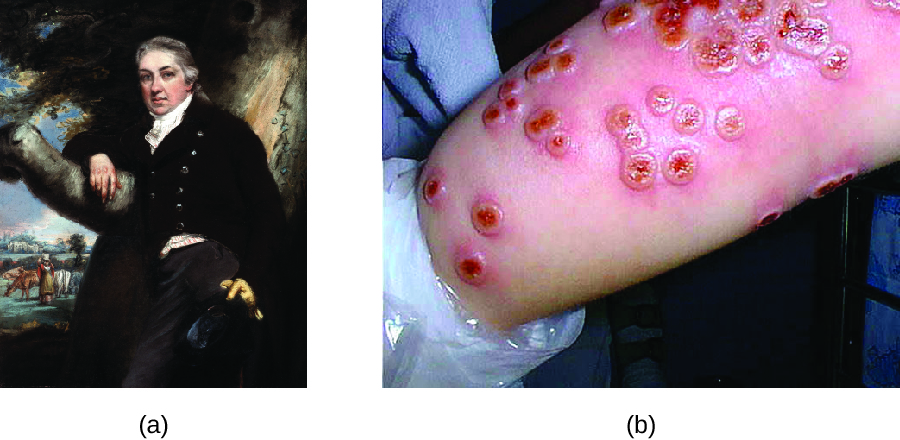
Bien que la variolation soit pratiquée depuis des siècles, le médecin anglais Edward Jenner (1749—1823) est généralement reconnu pour avoir développé le processus moderne de vaccination. Jenner a observé que les laitières qui avaient développé la vérole, une maladie similaire à la variole mais plus bénigne, étaient immunisées contre la variole plus grave. Cela a amené Jenner à émettre l'hypothèse que l'exposition à un agent pathogène moins virulent pourrait fournir une protection immunitaire contre un pathogène plus virulent, offrant ainsi une alternative plus sûre à la variolation. En 1796, Jenner a testé son hypothèse en prélevant des échantillons infectieux provenant d'une lésion active de la vache chez une laitière et en injectant le matériel à un jeune garçon (Figure\(\PageIndex{3}\)). Le garçon a développé une infection bénigne qui comprenait une légère fièvre, une gêne aux aisselles (aisselles) et une perte d'appétit. Lorsque le garçon a ensuite été infecté par des échantillons infectieux provenant de lésions causées par la variole, il n'a pas contracté la variole. 3 Cette nouvelle approche a été baptisée vaccination, nom dérivé de l'utilisation de la vérole (latin vacca qui signifie « vache ») pour se protéger contre la variole. Aujourd'hui, nous savons que le vaccin de Jenner a fonctionné parce que le virus de la variole est génétiquement et antigéniquement apparenté aux virus de la variole qui sont à l'origine de la variole. L'exposition à des antigènes de la variole a entraîné une réponse primaire et la production de cellules mémoire identiques ou apparentées à des épitopes du virus de la variole lors d'une exposition ultérieure à la variole.
Le succès de la vaccination antivariolique de Jenner a amené d'autres scientifiques à mettre au point des vaccins contre d'autres maladies. Le plus remarquable est peut-être Louis Pasteur, qui a développé des vaccins contre la rage, le choléra et l'anthrax. Au cours des 20e et 21e siècles, des vaccins efficaces ont été développés pour prévenir un large éventail de maladies causées par des virus (par exemple, la varicelle et le zona, l'hépatite, la rougeole, les oreillons, la poliomyélite et la fièvre jaune) et des bactéries (par exemple, la diphtérie, la pneumonie pneumococcique, le tétanos et la coqueluche). toux,).
Exercice\(\PageIndex{2}\)
- Quelle est la différence entre la variolation et la vaccination contre la variole ?
- Expliquez pourquoi la vaccination est moins risquée que la variolation.
Classes de vaccins
Pour qu'un vaccin puisse fournir une protection contre une maladie, il doit exposer une personne à des antigènes spécifiques à un pathogène qui stimuleront une réponse immunitaire adaptative protectrice. De par sa nature même, cela comporte certains risques. Comme tout médicament pharmaceutique, les vaccins peuvent provoquer des effets indésirables. Cependant, le vaccin idéal ne provoque aucun effet indésirable grave et ne présente aucun risque de contracter la maladie qu'il est censé prévenir. Différents types de vaccins ont été développés en tenant compte de ces objectifs. Ces différentes classes de vaccins sont décrites dans la section suivante et résumées dans le tableau\(\PageIndex{1}\).
Vaccins vivants atténués
Les vaccins vivants atténués exposent un individu à une souche affaiblie d'un agent pathogène dans le but d'établir une infection subclinique qui activera les défenses immunitaires adaptatives. Les agents pathogènes sont atténués afin de réduire leur virulence à l'aide de méthodes telles que la manipulation génétique (pour éliminer les principaux facteurs de virulence) ou la culture à long terme dans un hôte ou un environnement non naturel (pour favoriser les mutations et diminuer la virulence).
En établissant une infection active, les vaccins vivants atténués stimulent une réponse immunitaire plus complète que certains autres types de vaccins. Les vaccins vivants atténués activent l'immunité cellulaire et humorale et stimulent le développement de la mémoire pour une immunité durable. Dans certains cas, la vaccination d'un individu avec un agent pathogène vivant atténué peut même entraîner la transmission naturelle du pathogène atténué à d'autres personnes. Cela peut également amener les autres personnes à développer une infection subclinique active qui active leurs défenses immunitaires adaptatives.
Les inconvénients associés aux vaccins vivants atténués incluent les défis liés au stockage et au transport à long terme ainsi que la possibilité pour un patient de développer des signes et des symptômes de la maladie au cours de l'infection active (en particulier chez les patients immunodéprimés). Il existe également un risque que l'agent pathogène atténué revienne à sa pleine virulence. Le\(\PageIndex{1}\) tableau présente des exemples de vaccins vivants atténués.
Vaccins inactivés
Les vaccins inactivés contiennent des agents pathogènes entiers qui ont été tués ou inactivés par la chaleur, des produits chimiques ou des radiations. Pour que les vaccins inactivés soient efficaces, le processus d'inactivation ne doit pas affecter la structure des principaux antigènes du pathogène.
Comme l'agent pathogène est tué ou inactif, les vaccins inactivés ne produisent pas d'infection active et la réponse immunitaire qui en résulte est plus faible et moins complète que celle provoquée par un vaccin vivant atténué. Généralement, la réponse implique uniquement l'immunité humorale et le pathogène ne peut pas être transmis à d'autres personnes. De plus, les vaccins inactivés nécessitent généralement des doses plus élevées et de multiples doses de rappel, ce qui peut provoquer des réactions inflammatoires au site d'injection.
Malgré ces inconvénients, les vaccins inactivés présentent les avantages d'une stabilité au stockage à long terme et d'une facilité de transport. De plus, il n'y a aucun risque de provoquer des infections actives graves. Cependant, les vaccins inactivés ne sont pas dépourvus d'effets secondaires. Le\(\PageIndex{1}\) tableau présente des exemples de vaccins inactivés.
Vaccins sous-unités
Alors que les vaccins vivants atténués et inactifs exposent un individu à un agent pathogène affaibli ou mort, les vaccins sous-unitaires exposent uniquement le patient aux principaux antigènes d'un pathogène, et non à des cellules entières ou à des virus. Les vaccins sous-unitaires peuvent être produits soit en dégradant chimiquement un agent pathogène et en isolant ses principaux antigènes, soit en produisant les antigènes par génie génétique. Comme ces vaccins ne contiennent que les antigènes essentiels d'un agent pathogène, le risque d'effets secondaires est relativement faible. Le\(\PageIndex{1}\) tableau présente des exemples de vaccins sous-unitaires.
Vaccins à toxines
Comme les vaccins sous-unitaires, les vaccins à base d'anatoxine n'introduisent pas un agent pathogène complet chez le patient ; ils contiennent des toxines bactériennes inactivées, appelées toxoïdes. Les vaccins antitoxoïdes sont utilisés pour prévenir les maladies dans lesquelles les toxines bactériennes jouent un rôle important dans la pathogenèse. Ces vaccins activent l'immunité humorale qui neutralise les toxines. Le\(\PageIndex{1}\) tableau présente des exemples de vaccins anatoxiques.
Vaccins conjugués
Un vaccin conjugué est un type de vaccin sous-unitaire qui consiste en une protéine conjuguée à un polysaccharide en capsule. Des vaccins conjugués ont été développés pour améliorer l'efficacité des vaccins sous-unitaires contre les agents pathogènes qui contiennent des capsules de polysaccharides protectrices qui les aident à échapper à la phagocytose, provoquant des infections invasives pouvant entraîner une méningite et d'autres affections graves. Les vaccins sous-unitaires contre ces agents pathogènes introduisent des antigènes polysaccharidiques capsulaires indépendants du T qui entraînent la production d'anticorps capables d'opsoniser la capsule et ainsi de combattre l'infection ; toutefois, les enfants de moins de deux ans ne répondent pas efficacement à ces vaccins. Les enfants réagissent efficacement lorsqu'ils sont vaccinés avec le vaccin conjugué, dans lequel une protéine contenant des antigènes T-dépendants est conjuguée au polysaccharide en capsule. L'antigène protéine-polysaccharide conjugué stimule la production d'anticorps dirigés à la fois contre la protéine et contre le polysaccharide en capsule. Le\(\PageIndex{1}\) tableau présente des exemples de vaccins conjugués.
| Classe | Désignation | AVANTAGES | Désavantages | Exemples |
|---|---|---|---|---|
| En direct atténué | Souche affaiblie du pathogène entier | Immunité cellulaire et humorale | Difficile à stocker et à transporter | Varicelle, rougeole allemande, rougeole, oreillons, tuberculose, fièvre typhoïde, fièvre jaune |
| Immunité durable | Risque d'infection chez les patients immunodéprimés | |||
| Transmission aux contacts | Risque de réversion | |||
| Inactivé | Agent pathogène entier tué ou inactivé par la chaleur, des produits chimiques ou des radiations | Facilité de stockage et de transport | Immunité plus faible (humorale uniquement) | Choléra, hépatite A, grippe, peste, rage |
| Aucun risque d'infection active sévère | Des doses plus élevées et plus de boosters sont nécessaires | |||
| Sous-unité | Antigènes immunogènes | Diminution du risque d'effets secondaires | Longévité limitée | Anthrax, hépatite B, grippe, méningite, papillomavirus, pneumonie pneumococcique, coqueluche |
| Doses multiples requises | ||||
| Aucune protection contre les variations antigéniques | ||||
| Anatoxine | Toxine bactérienne inactivée | Immunité humorale pour neutraliser la toxine | N'empêche pas l'infection | Botulisme, diphtérie, coqueluche, tétanos |
| Conjugué | Polysaccharide en capsule conjugué à une protéine | Réponse T-dépendante à la capsule | Coûteux à produire |
Méningite (Haemophilus influenzae, Streptococcus pneumoniae, Neisseria meningitides) |
| Aucune protection contre les variations antigéniques | ||||
| Meilleure réponse chez les jeunes enfants | Peut interférer avec d'autres vaccins |
Exercice\(\PageIndex{3}\)
- Quel est le risque associé à un vaccin vivant atténué ?
- Pourquoi un vaccin conjugué est-il nécessaire dans certains cas ?
Les vaccins à ADN constituent une approche vaccinale relativement nouvelle et prometteuse. Un vaccin à ADN est produit en incorporant des gènes pour des antigènes dans un vaccin plasmidique recombinant. L'introduction du vaccin à ADN chez un patient entraîne l'absorption du plasmide recombinant par certaines cellules du patient, suivie de la transcription et de la traduction des antigènes et de la présentation de ces antigènes au MHC I pour activer l'immunité adaptative. Il en résulte une stimulation de l'immunité humorale et cellulaire sans risque de maladie active associé aux vaccins vivants atténués.
Bien que la plupart des vaccins à ADN pour les humains soient encore en cours de développement, il est probable qu'ils deviendront plus répandus dans un avenir proche, car les chercheurs travaillent à la mise au point de vaccins à ADN qui activeront l'immunité adaptative contre plusieurs agents pathogènes différents à la fois. Les vaccins à ADN de première génération testés dans les années 1990 semblaient prometteurs sur des modèles animaux mais étaient décevants lorsqu'ils étaient testés sur des sujets humains. La faible absorption cellulaire des plasmides d'ADN a été l'un des principaux problèmes affectant leur efficacité. Les essais de vaccins à ADN de deuxième génération se sont révélés plus prometteurs grâce aux nouvelles techniques visant à améliorer l'absorption cellulaire et à optimiser les antigènes. Des vaccins à ADN contre divers cancers et agents pathogènes viraux tels que le VIH, le VPH et les hépatites B et C sont actuellement en cours de développement.
Certains vaccins à ADN sont déjà utilisés. En 2005, un vaccin à ADN contre le virus du Nil occidental a été approuvé pour utilisation chez les chevaux aux États-Unis. Le Canada a également approuvé un vaccin à ADN pour protéger les poissons contre le virus de la nécrose hématopoïétique infectieuse. 4 Un vaccin à ADN contre le virus de l'encéphalite japonaise a été approuvé pour utilisation chez l'homme en 2010 en Australie.
Orientation clinique : résolution
Sur la base des symptômes d'Olivia, son médecin a posé un diagnostic préliminaire de méningite bactérienne sans attendre une identification positive à partir des échantillons de sang et de LCR envoyés au laboratoire. Olivia a été admise à l'hôpital et a reçu des antibiotiques à large spectre par voie intraveineuse et une thérapie de réhydratation. Au cours des jours qui ont suivi, son état a commencé à s'améliorer, et de nouveaux échantillons de sang et des échantillons prélevés par ponction lombaire ont révélé l'absence de microbes dans le sang et le LCR, et les taux de globules blancs sont revenus à la normale. Au cours de cette période, le laboratoire a identifié avec certitude Neisseria meningitidis, l'agent responsable de la méningite à méningocoque, dans son échantillon original de LCR.
N. meningitidis produit une capsule de polysaccharide qui sert de facteur de virulence. N. meningitidis a tendance à affecter les nourrissons après qu'ils commencent à perdre l'immunité passive naturelle fournie par les anticorps maternels. À l'âge d'un an, les anticorps IgG maternels d'Olivia auraient disparu et elle n'aurait pas développé de cellules mémoire capables de reconnaître les antigènes associés à la capsule polysaccharidique de N. meningitidis. Son système immunitaire adaptatif n'a donc pas été en mesure de produire des anticorps protecteurs pour combattre l'infection et, sans antibiotiques, elle n'aurait peut-être pas survécu. L'infection d'Olivia aurait probablement été complètement évitée si elle avait été vaccinée. Un vaccin conjugué destiné à prévenir la méningite à méningocoque est disponible et approuvé pour les nourrissons dès l'âge de deux mois. Cependant, les calendriers de vaccination actuels aux États-Unis recommandent que le vaccin soit administré entre 11 et 12 ans et qu'une dose de rappel soit administrée à 16 ans.
Dans les pays dotés de systèmes de santé publique développés, de nombreux vaccins sont administrés régulièrement aux enfants et aux adultes. Les calendriers de vaccination sont modifiés périodiquement, en fonction des nouvelles informations et des résultats de recherche recueillis par les agences de santé publique. Aux États-Unis, les CDC publient des calendriers et d'autres informations mises à jour sur les vaccins.
Concepts clés et résumé
- L'immunité adaptative peut être divisée en quatre catégories distinctes : immunité active naturelle, immunité passive naturelle, immunité passive artificielle et immunité active artificielle.
- L'immunité active artificielle est à la base de la vaccination et du développement de vaccins. Les programmes de vaccination confèrent non seulement une immunité artificielle aux individus, mais favorisent également l'immunité collective au sein des populations.
- La variolation contre la variole remonte au Xe siècle en Chine, mais la procédure était risquée car elle pouvait provoquer la maladie qu'elle était censée prévenir. La vaccination moderne a été développée par Edward Jenner, qui a développé la pratique consistant à inoculer aux patients du matériel infectieux provenant de lésions de la variole pour prévenir la variole.
- Les vaccins vivants atténués et les vaccins inactivés contiennent des agents pathogènes entiers qui sont faibles, tués ou inactivés. Les vaccins sous-unitaires, les vaccins à base d'anatoxine et les vaccins conjugués contiennent des composants acellulaires et des antigènes qui stimulent une réponse immunitaire.
Notes
- 1 K. Mupapa, M. Massamba, K. Kibadi, K. Kivula, A. Bwaka, M. Kipasa, R. Colebunders, J.J. Muyembe-Tamfum. « Traitement de la fièvre hémorragique Ebola par des transfusions sanguines de patients convalescents. » Journal des maladies infectieuses 179 Suppl. (1999) : S18—S23.
- 2 Elizabeth Yale. « Pourquoi les mouvements anti-vaccination ne peuvent jamais être apprivoisés. » Religion & Politics, 22 juillet 2014. religionandpolitics.org/2014/... Ne soyez jamais apprivoisé.
- 3 N.J. Willis. « Edward Jenner et l'éradication de la variole. » Journal médical écossais 42 (1997) : 118—121.
- 4 M. Alonso et J.C. Leong. « Vaccins à ADN homologués contre le virus de la nécrose hématopoïétique infectieuse (VNHI). » Brevets récents sur l'ADN et les séquences de gènes (abandonnés) 7 n° 1 (2013) : 62—65, issn 1872-2156/2212-3431. doi 10.2174/1872215611307010009.
- 5 S.B. Halstead et S.J. Thomas. « Nouveaux vaccins contre l'encéphalite japonaise : alternatives à la production dans le cerveau de souris ». Examen par des experts des vaccins 10 no 3 (2011) : 355—64.


