18.3 : Lymphocytes T
- Page ID
- 187697
Objectifs d'apprentissage
- Décrire le processus de maturation des lymphocytes T et de sélection thymique
- Expliquer les événements génétiques qui mènent à la diversité des récepteurs des lymphocytes T
- Comparez et opposez les différentes classes et sous-types de lymphocytes T en termes d'activation et de fonction
- Expliquer le mécanisme par lequel les superantigènes agissent sur l'activation non régulée des lymphocytes T
Comme expliqué dans Aperçu de l'immunité adaptative spécifique, les anticorps impliqués dans l'immunité humorale se lient souvent aux agents pathogènes et aux toxines avant de pouvoir se fixer aux cellules hôtes et les envahir. Ainsi, l'immunité humorale vise principalement à combattre les agents pathogènes dans les espaces extracellulaires. Cependant, les agents pathogènes qui ont déjà pénétré dans les cellules hôtes sont largement protégés contre les défenses médiées par les anticorps humoraux. L'immunité cellulaire, quant à elle, cible et élimine les agents pathogènes intracellulaires grâce à l'action des lymphocytes T, ou lymphocytes T (Figure\(\PageIndex{1}\)). Les lymphocytes T jouent également un rôle plus central dans l'orchestration de la réponse immunitaire adaptative globale (humorale et cellulaire) ainsi que des défenses cellulaires de l'immunité innée.

Production et maturation des lymphocytes T
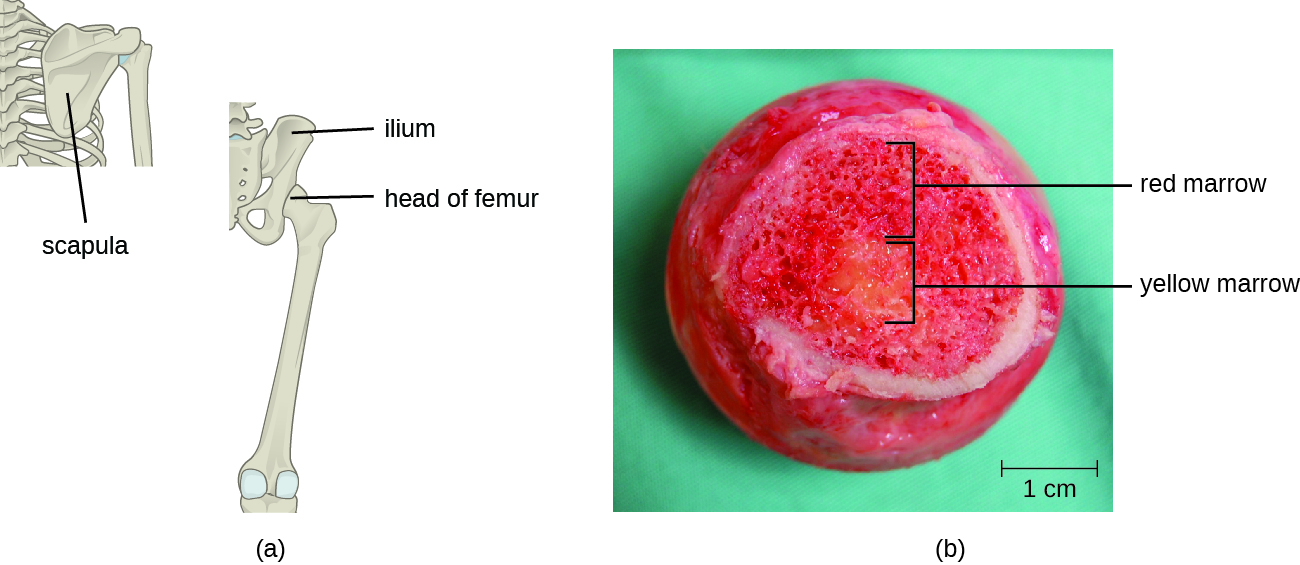
Les lymphocytes T, comme tous les autres globules blancs impliqués dans l'immunité innée et adaptative, sont formés à partir de cellules souches hématopoïétiques (CSH) multipotentes présentes dans la moelle osseuse (voir Figure 17.3.1). Cependant, contrairement aux globules blancs de l'immunité innée, les lymphocytes T éventuels se différencient d'abord en cellules souches lymphoïdes qui deviennent ensuite de petits lymphocytes immatures, parfois appelés lymphoblastes. Les premières étapes de différenciation se produisent dans la moelle rouge des os (Figure\(\PageIndex{2}\)), après quoi les lymphocytes T immatures pénètrent dans la circulation sanguine et se dirigent vers le thymus pour les dernières étapes de maturation (Figure\(\PageIndex{3}\)). Une fois dans le thymus, les lymphocytes T immatures sont appelés thymocytes.
La maturation des thymocytes dans le thymus peut être divisée en trois étapes critiques de sélection positive et négative, appelées collectivement sélection thymique. La première étape de la sélection thymique a lieu dans le cortex du thymus et implique le développement d'un récepteur fonctionnel des lymphocytes T (TCR) qui est nécessaire à l'activation par les APC. Les thymocytes présentant des TCR défectueux sont éliminés par sélection négative par induction de l'apoptose (mort cellulaire contrôlée programmée). La deuxième étape de la sélection thymique se produit également dans le cortex et implique la sélection positive de thymocytes qui interagiront de manière appropriée avec les molécules du CMH. Les thymocytes qui peuvent interagir de manière appropriée avec les molécules du CMH reçoivent une stimulation positive qui les fait avancer dans le processus de maturation, tandis que les thymocytes qui n'interagissent pas de manière appropriée ne sont pas stimulés et sont éliminés par apoptose. La troisième et dernière étape de la sélection thymique se déroule à la fois dans le cortex et la moelle et implique une sélection négative pour éliminer les thymocytes autoréactifs, ceux qui réagissent aux auto-antigènes, par apoptose. Cette dernière étape est parfois appelée tolérance centrale, car elle empêche les lymphocytes T autoréactifs d'atteindre la circulation sanguine et de provoquer potentiellement une maladie auto-immune, qui survient lorsque le système immunitaire attaque les cellules « personnelles » saines.
Malgré la tolérance centrale, certains lymphocytes T autoréactifs s'échappent généralement du thymus et pénètrent dans la circulation sanguine périphérique. Par conséquent, une deuxième ligne de défense appelée tolérance périphérique est nécessaire pour se protéger contre les maladies auto-immunes. La tolérance périphérique implique des mécanismes d'anergie et d'inhibition des lymphocytes T autoréactifs par les lymphocytes T régulateurs. L'anergie fait référence à un état de non-réponse à la stimulation antigénique. Dans le cas de lymphocytes T autoréactifs qui s'échappent du thymus, l'absence d'un signal co-stimulant essentiel à l'activation provoque une anergie et empêche l'activation auto-immune. Les lymphocytes T régulateurs participent à la tolérance périphérique en inhibant l'activation et la fonction des lymphocytes T autoréactifs et en sécrétant des cytokines anti-inflammatoires.
On ne comprend pas complètement quels événements dirigent spécifiquement la maturation des thymocytes en lymphocytes T régulateurs. Les théories actuelles suggèrent que les événements critiques peuvent se produire au cours de la troisième étape de la sélection thymique, lorsque la plupart des lymphocytes T autoréactifs sont éliminés. Les lymphocytes T régulateurs peuvent recevoir un signal unique inférieur au seuil requis pour les cibler en vue d'une sélection négative et d'une apoptose. Par conséquent, ces cellules continuent de mûrir puis de sortir du thymus, armées pour inhiber l'activation des lymphocytes T autoréactifs.
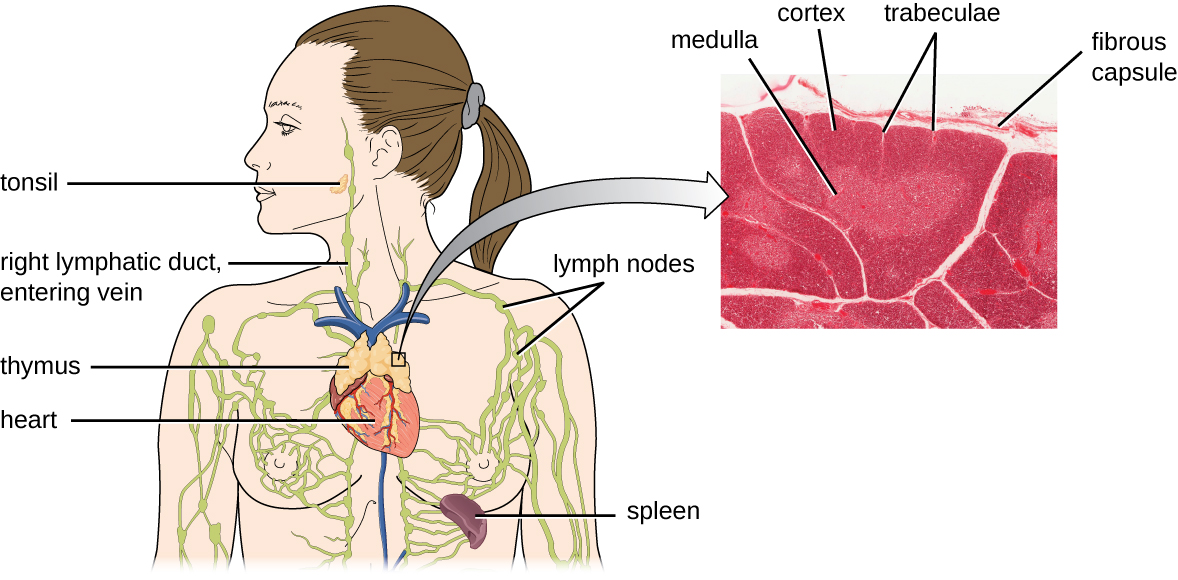
Il a été estimé que les trois étapes de la sélection thymique éliminent 98 % des thymocytes. Les 2 % restants qui sortent du thymus migrent par la circulation sanguine et le système lymphatique vers des sites d'organes/tissus lymphoïdes secondaires, tels que les ganglions lymphatiques, la rate et les amygdales (Figure\(\PageIndex{3}\)), où ils attendent d'être activés par la présentation d'antigènes spécifiques par les APC. Jusqu'à ce qu'ils soient activés, ils sont connus sous le nom de lymphocytes T matures naïfs.
Exercice\(\PageIndex{1}\)
- Quels sont les sites anatomiques impliqués dans la production et la maturation des lymphocytes T ?
- Quelles sont les trois étapes de la sélection thymique ?
- Pourquoi la tolérance centrale et la tolérance périphérique sont-elles importantes ? Que préviennent-ils ?
Classes de lymphocytes T
Les lymphocytes T peuvent être classés en trois classes distinctes : les lymphocytes T auxiliaires, les lymphocytes T régulateurs et les lymphocytes T cytotoxiques. Ces classes sont différenciées en fonction de leur expression de certaines molécules de surface, de leur mode d'activation et de leurs rôles fonctionnels dans l'immunité adaptative (Tableau\(\PageIndex{1}\)).
Tous les lymphocytes T produisent des agrégats de molécules de différenciation (CD), des glycoprotéines de surface cellulaire qui peuvent être utilisées pour identifier et distinguer les différents types de globules blancs. Bien que les lymphocytes T puissent produire diverses molécules de CD, le CD4 et le CD8 sont les deux plus importants utilisés pour la différenciation des classes. Les lymphocytes T auxiliaires et les lymphocytes T régulateurs sont caractérisés par l'expression de CD4 à leur surface, tandis que les lymphocytes T cytotoxiques sont caractérisés par l'expression de CD8.
Les classes de lymphocytes T peuvent également être distinguées par les molécules spécifiques du MHC et les APC avec lesquelles elles interagissent pour l'activation. Les lymphocytes T auxiliaires et les lymphocytes T régulateurs ne peuvent être activés que par des APC présentant des antigènes associés au MHC II. En revanche, les lymphocytes T cytotoxiques reconnaissent les antigènes présentés en association avec le MHC I, soit par les CPA, soit par des cellules nucléées infectées par un pathogène intracellulaire.
Les différentes classes de lymphocytes T jouent également des rôles fonctionnels différents dans le système immunitaire. Les lymphocytes T auxiliaires servent d'orchestrateurs centraux qui aident à activer et à diriger les fonctions de l'immunité humorale et cellulaire. De plus, les lymphocytes T auxiliaires renforcent les fonctions de destruction des agents pathogènes des macrophages et des cellules NK de l'immunité innée. En revanche, le rôle principal des lymphocytes T régulateurs est de prévenir les réponses immunitaires indésirables et potentiellement dommageables. Leur rôle dans la tolérance périphérique, par exemple, protège contre les maladies auto-immunes, comme indiqué précédemment. Enfin, les lymphocytes T cytotoxiques sont les principales cellules effectrices de l'immunité cellulaire. Ils reconnaissent et ciblent les cellules infectées par des agents pathogènes intracellulaires, détruisant ainsi les cellules infectées ainsi que les agents pathogènes qui s'y trouvent.
| Classe | Molécules de surface | Activation | Fonctions |
|---|---|---|---|
| Lymphocytes T auxiliaires | CD4 | APC présentant des antigènes associés au MHC II | Orchestrez l'immunité humorale et cellulaire |
| Impliqué dans l'activation des macrophages et des cellules NK | |||
| lymphocytes T régulateurs | CD4 | APC présentant des antigènes associés au MHC II | Impliqué dans la tolérance périphérique et la prévention des réponses auto-immunes |
| Lymphocytes T cytotoxiques | CD8 | CPA ou cellules nucléées infectées présentant des antigènes associés au MHC I | Détruire les cellules infectées par des agents pathogènes intrac |
Exercice\(\PageIndex{2}\)
- Quelles sont les fonctions uniques des trois classes de lymphocytes T ?
- Quels lymphocytes T peuvent être activés par des antigènes présentés par des cellules autres que les APC ?
Récepteurs des lymphocytes
Tant pour les lymphocytes T auxiliaires que pour les lymphocytes T cytotoxiques, l'activation est un processus complexe qui nécessite l'interaction de plusieurs molécules et l'exposition à des cytokines. Le récepteur des lymphocytes T (TCR) est impliqué dans la première étape de la reconnaissance des épitopes pathogènes au cours du processus d'activation.
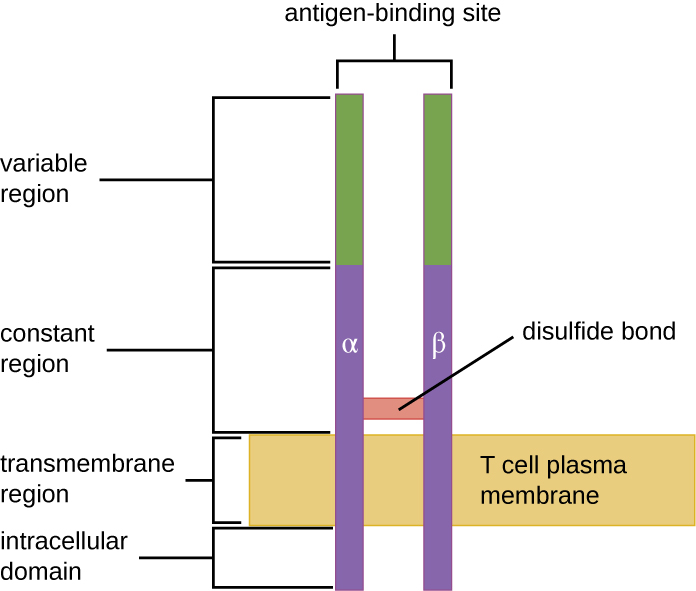
Le TCR appartient à la même famille de récepteurs que les anticorps IgD et IgM, les récepteurs antigéniques situés à la surface de la membrane des lymphocytes B, et partage donc des éléments structuraux communs. Comme les anticorps, le TCR possède une région variable et une région constante, et la région variable fournit le site de liaison à l'antigène (Figure\(\PageIndex{4}\)). Cependant, la structure du TCR est plus petite et moins complexe que celle des molécules d'immunoglobulines (Figure 18.1.4). Alors que les immunoglobulines possèdent quatre chaînes peptidiques et des structures en forme de Y, le TCR ne comprend que deux chaînes peptidiques (chaînes α et β), qui recouvrent toutes deux la membrane cytoplasmique du lymphocyte T.
Les TCR sont spécifiques à un épitope, et on estime que 25 millions de lymphocytes T dotés de TCR uniques se liant aux épitopes sont nécessaires pour protéger un individu contre un large éventail de pathogènes microbiens. Comme le génome humain ne contient qu'environ 25 000 gènes, nous savons que chaque TCR spécifique ne peut pas être codé par son propre ensemble de gènes. Cela soulève la question de savoir comment obtenir une telle population de lymphocytes T avec des millions de TCR spécifiques peut être atteinte. La réponse est un processus appelé réarrangement génétique, qui se produit dans le thymus lors de la première étape de la sélection thymique.
Les gènes qui codent pour les régions variables du TCR sont divisés en segments géniques distincts appelés segments variables (V), diversité (D) et segments jointifs (J). Les segments de gènes associés à la chaîne α du TCR sont composés de 70 segments V α différents ou plus et de 61 segments J α différents. Les segments géniques associés à la chaîne β du TCR se composent de 52 segments V β différents, de deux segments D β différents et de 13 segments J β différents. Au cours du développement du TCR fonctionnel dans le thymus, le réarrangement génétique dans un lymphocyte T réunit un segment V α et un segment J α pour coder la région variable de la chaîne α. De même, le réarrangement génétique réunit l'un des segments V β avec l'un des segments D β et l'un des segments TJ β pour coder la région variable de la chaîne β. Toutes les combinaisons possibles de réarrangements entre les différents segments de V, D et J fournissent la diversité génétique requise pour produire des millions de TCR avec des régions variables spécifiques aux épitopes uniques.
Exercice\(\PageIndex{3}\)
- Quelles sont les similitudes et les différences entre les TCR et les immunoglobulines ?
- Quel processus est utilisé pour fournir des millions de sites de reliure TCR uniques ?
Activation et différenciation des lymphocytes T auxiliaires
Les lymphocytes T auxiliaires ne peuvent être activés que par des APC présentant des épitopes étrangers traités en association avec le MHC II. La première étape du processus d'activation est la reconnaissance par TCR de l'épitope étranger spécifique présenté dans la fente de liaison à l'antigène du MHC II. La deuxième étape implique l'interaction du CD4 sur le lymphocyte T auxiliaire avec une région de la molécule MHC II distincte de la fente de liaison à l'antigène. Cette seconde interaction ancre le complexe MHC II-TCR et garantit que le lymphocyte T auxiliaire reconnaît à la fois l'épitope étranger (« non-soi ») et l'antigène « auto-» de l'APC ; les deux reconnaissances sont nécessaires à l'activation de la cellule. Dans la troisième étape, l'APC et les lymphocytes T sécrètent des cytokines qui activent le lymphocyte T auxiliaire. Le lymphocyte T auxiliaire activé prolifère ensuite, se divisant par mitose pour produire des lymphocytes T auxiliaires naïfs clonaux qui se différencient en sous-types dotés de fonctions différentes (Figure\(\PageIndex{5}\)).
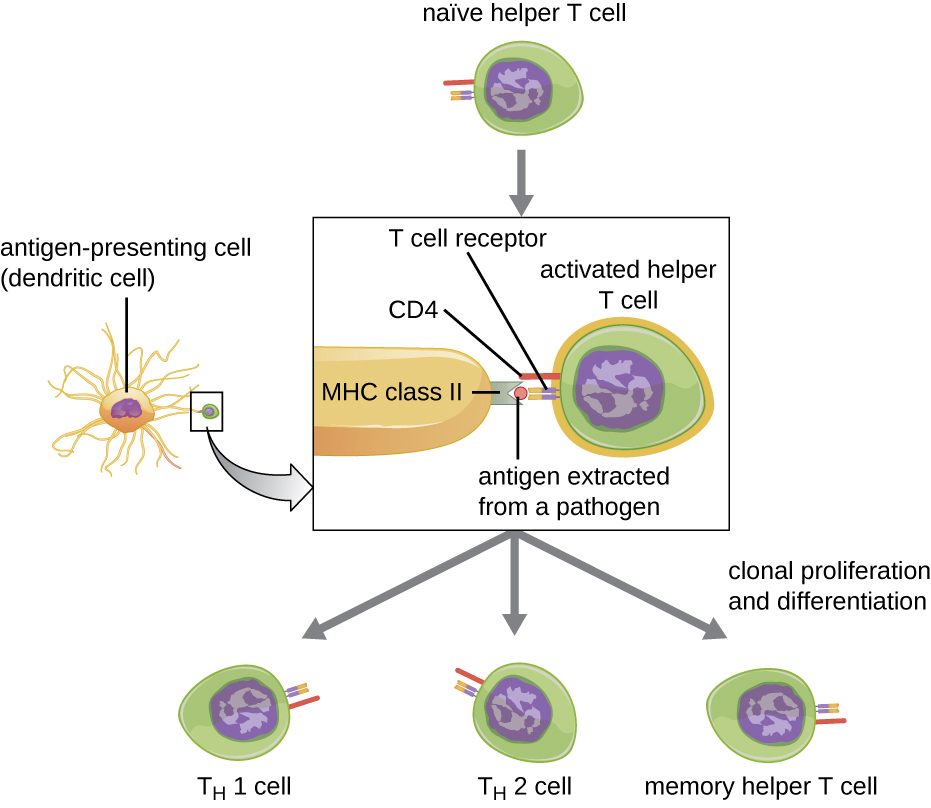
Les lymphocytes T auxiliaires activés peuvent se différencier en l'un des quatre sous-types distincts, résumés dans le tableau\(\PageIndex{2}\). Le processus de différenciation est dirigé par des cytokines sécrétées par l'APC. Selon les cytokines sécrétées par l'APC qui interagissent avec un lymphocyte T auxiliaire activé, la cellule peut se différencier en une cellule T auxiliaire 1 (T H 1), une cellule T auxiliaire 2 (T H 2) ou un lymphocyte T auxiliaire de la mémoire. Les deux types de lymphocytes T auxiliaires ont une durée de vie relativement courte, ce qui signifie qu'ils remplissent diverses fonctions de la réponse immunitaire immédiate. En revanche, les lymphocytes T auxiliaires de la mémoire ont une durée de vie relativement longue ; ils sont programmés pour « se souvenir » d'un antigène ou d'un épitope spécifique afin de produire une réponse secondaire rapide et forte aux expositions ultérieures.
Les cellules T H 1 sécrètent leurs propres cytokines qui participent à la stimulation et à l'orchestration d'autres cellules impliquées dans l'immunité adaptative et innée. Par exemple, ils stimulent les lymphocytes T cytotoxiques, améliorant ainsi leur destruction des cellules infectées et favorisant la différenciation en lymphocytes T cytotoxiques à mémoire. Les cellules T H 1 stimulent également les macrophages et les neutrophiles pour qu'ils soient plus efficaces dans leur destruction des bactéries intracellulaires. Ils peuvent également stimuler les cellules NK pour qu'elles deviennent plus efficaces pour tuer les cellules cibles.
Les lymphocytes T H 2 jouent un rôle important dans l'orchestration de la réponse immunitaire humorale grâce à leur sécrétion de cytokines qui activent les lymphocytes B et dirigent la différenciation des lymphocytes B et la production d'anticorps. Diverses cytokines produites par les cellules T H 2 orchestrent le changement de classe d'anticorps, ce qui permet aux lymphocytes B de passer de la production d'IgM, d'IgG, d'IgA et d'IgE selon les besoins pour exécuter des fonctions anticorps spécifiques et fournir des réponses immunitaires humorales spécifiques au pathogène.
Un troisième sous-type de lymphocytes T auxiliaires, appelés cellules T H 17, a été découvert grâce à des observations selon lesquelles l'immunité à certaines infections n'est pas associée aux cellules T H 1 ou T H 2. Les cellules T H 17 et les cytokines qu'elles produisent semblent être spécifiquement responsables de la défense de l'organisme contre les infections cutanéo-muqueuses chroniques. Les patients qui n'ont pas suffisamment de cellules T H 17 dans la muqueuse (par exemple, les patients atteints du VIH) peuvent être plus sensibles à la bactériémie et aux infections gastro-intestinales. 1
| Sous-type | Fonctions |
|---|---|
| Cellules T H 1 | Stimuler les lymphocytes T cytotoxiques et produire des lymphocytes T cytotoxiques à mémoire |
| Stimuler les macrophages et les neutrophiles (PMN) pour une destruction intracellulaire plus efficace des agents pathogènes | |
| Stimulez les cellules NK pour tuer plus efficacement | |
| Cellules T H 2 | Stimuler l'activation et la différenciation des lymphocytes B en plasmocytes et en lymphocytes B mémoire |
| Changement direct de classe d'anticorps dans les lymphocytes B | |
| Cellules T H 17 | Stimule l'immunité contre des infections spécifiques telles que les infections cutanéo-muqueuses chroniques |
| Cellules T auxiliaires de mémoire | « Se souvenir » d'un agent pathogène spécifique et déclencher une réponse secondaire forte et rapide lors de la réexposition |
Activation et différenciation des lymphocytes T cytotoxiques
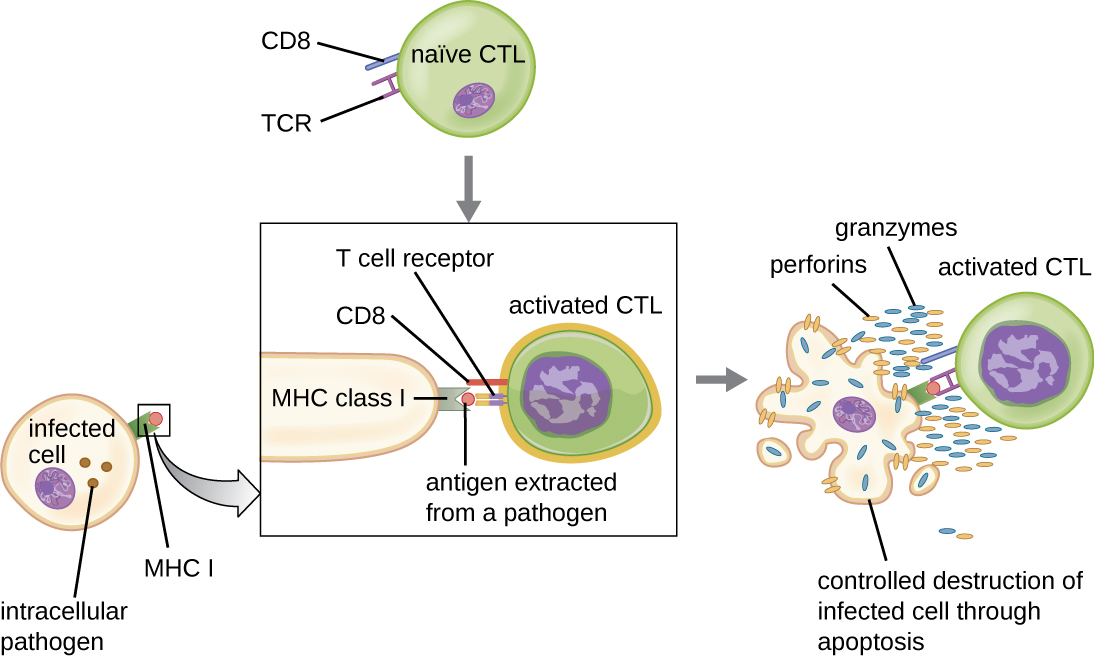
Les lymphocytes T cytotoxiques (également appelés lymphocytes T cytotoxiques, ou CTL) sont activés par les CPA selon un processus en trois étapes similaire à celui des lymphocytes T auxiliaires. La principale différence est que l'activation des lymphocytes T cytotoxiques implique la reconnaissance d'un antigène présenté par le MHC I (par opposition au MHC II) et l'interaction du CD8 (par opposition au CD4) avec le complexe récepteur. Après la co-reconnaissance réussie d'un épitope étranger et d'un auto-antigène, la production de cytokines par l'APC et le lymphocyte T cytotoxique active la prolifération et la différenciation clonales. Les lymphocytes T cytotoxiques activés peuvent se différencier en lymphocytes T cytotoxiques effecteurs qui ciblent les agents pathogènes en vue de leur destruction ou en cellules mémoire prêtes à réagir à des expositions ultérieures.
Comme indiqué, la prolifération et la différenciation des lymphocytes T cytotoxiques sont également stimulées par les cytokines sécrétées par les cellules T H 1 activées par le même épitope étranger. La co-stimulation qui provient de ces cellules T H 1 est assurée par des cytokines sécrétées. Bien qu'il soit possible que l'activation des lymphocytes T cytotoxiques se produise sans stimulation par les lymphocytes T H 1, l'activation n'est pas aussi efficace ou durable.
Une fois activés, les lymphocytes T cytotoxiques servent de cellules effectrices de l'immunité cellulaire, reconnaissant et détruisant les cellules infectées par des agents pathogènes intracellulaires par un mécanisme très similaire à celui des cellules NK. Cependant, alors que les cellules NK reconnaissent les signaux non spécifiques de stress ou d'anomalie cellulaire, les lymphocytes T cytotoxiques reconnaissent les cellules infectées grâce à la présentation antigénique d'épitopes spécifiques du pathogène associés au CMH I. Une fois qu'une cellule infectée est reconnue, le TCR du lymphocyte T cytotoxique se lie à l'épitope et libère perforines et granzymes qui détruisent la cellule infectée (Figure\(\PageIndex{6}\)). La perforine est une protéine qui crée des pores dans la cellule cible, et les granzymes sont des protéases qui pénètrent dans les pores et induisent l'apoptose. Ce mécanisme de mort cellulaire programmée est un moyen contrôlé et efficace de détruire et d'éliminer les cellules infectées sans libérer les agents pathogènes qui s'y trouvent pour infecter les cellules voisines, comme cela pourrait se produire si les cellules infectées étaient simplement lysées.
Dans cette vidéo, vous pouvez voir un lymphocyte T cytotoxique induisant l'apoptose dans une cellule cible.
Exercice\(\PageIndex{4}\)
- Comparez et comparez l'activation des lymphocytes T auxiliaires et des lymphocytes T cytotoxiques.
- Quelles sont les différentes fonctions des sous-types de lymphocytes T auxiliaires ?
- Quel est le mécanisme de destruction des cellules infectées par le CTL ?
Superantigènes et activation non régulée des lymphocytes T
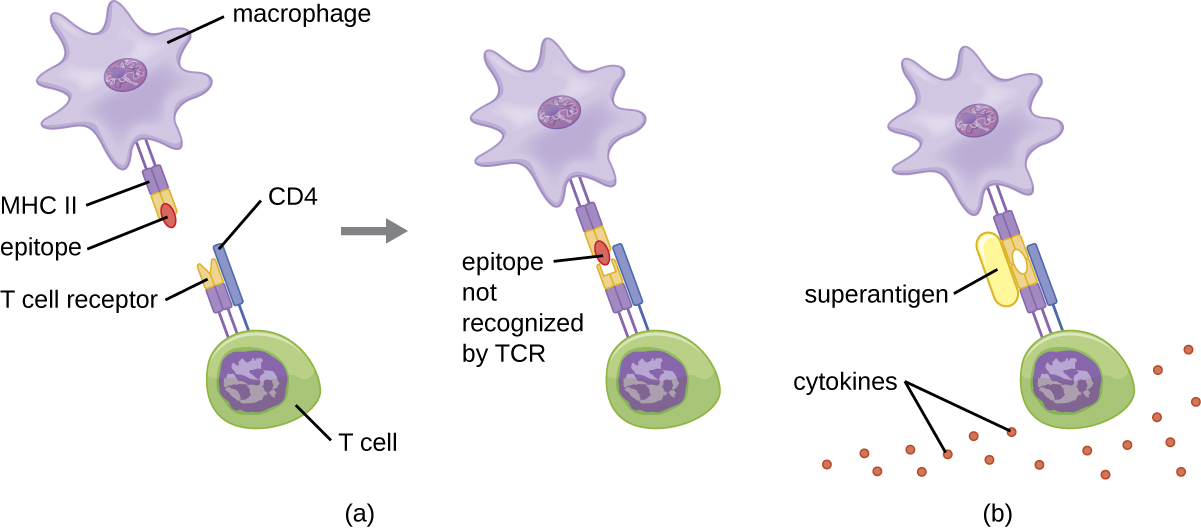
Lorsque l'activation des lymphocytes T est contrôlée et régulée, il en résulte une réponse protectrice efficace pour combattre les infections. Cependant, si l'activation des lymphocytes T n'est pas régulée et excessive, le résultat peut mettre la vie en danger. Certains agents pathogènes bactériens et viraux produisent des toxines appelées superantigènes (voir Facteurs de virulence des agents pathogènes bactériens et viraux) qui peuvent déclencher une telle réponse non régulée. Les superantigènes bactériens connus comprennent la toxine du syndrome du choc toxique (TSST), les entérotoxines staphylococciques, les toxines pyrogènes streptococciques, le superantigène streptococcique et l'exotoxine mitogène streptococcique. Les virus connus pour produire des superantigènes incluent le virus d'Epstein-Barr (herpèsvirus humain 4), le cytomégalovirus (herpèsvirus humain 5) et d'autres.
Le mécanisme d'activation des lymphocytes T par les superantigènes implique leur liaison simultanée aux molécules MHC II des APC et à la région variable de la chaîne β du TCR. Cette liaison se produit en dehors de la fente de liaison à l'antigène du MHC II, de sorte que le superantigène fait le pont entre eux et active le MHC II et le TCR sans reconnaissance spécifique d'épitopes étrangers (Figure\(\PageIndex{7}\)). Il en résulte une libération excessive et incontrôlée de cytokines, souvent appelée tempête de cytokines, qui stimule une réponse inflammatoire excessive. Cela peut entraîner une baisse dangereuse de la pression artérielle, un choc, une défaillance multiviscérale et potentiellement la mort.
Exercice\(\PageIndex{5}\)
- Quels sont des exemples de superantigènes ?
- Comment un superantigène active-t-il un lymphocyte T auxiliaire ?
- Quel est l'effet d'un superantigène sur un lymphocyte T ?
Exemple : les superantigènes
Melissa, une jeune femme de 22 ans par ailleurs en bonne santé, est emmenée aux urgences par son petit ami inquiet. Elle se plaint de l'apparition soudaine d'une forte fièvre, de vomissements, de diarrhée et de douleurs musculaires. Lors de son entretien initial, elle dit au médecin traitant qu'elle prend des contraceptifs hormonaux et qu'elle est également à deux jours de la période menstruelle de son cycle. Elle ne prend aucun autre médicament et ne consomme pas de drogues ni d'alcool. Elle ne fume pas. Elle n'est pas diabétique et ne souffre actuellement d'aucune infection à sa connaissance.
Pendant qu'elle attend aux urgences, la tension artérielle de Melissa commence à chuter de façon spectaculaire et son état mental se détériore au point de créer une confusion générale. Le médecin pense qu'elle souffre probablement du syndrome de choc toxique (TSS). Le TSS est causé par la toxine TSST-1, un superantigène associé au Staphylococcus aureus, et l'utilisation inappropriée de tampons est une cause fréquente d'infections menant au SCT. Le superantigène stimule de manière inappropriée l'activation généralisée des lymphocytes T et la libération excessive de cytokines, ce qui entraîne une réponse inflammatoire massive et systémique qui peut être fatale.
Des écouvillons vaginaux ou cervicaux peuvent être prélevés pour confirmer la présence du microbe, mais ces tests ne sont pas essentiels à effectuer en fonction des symptômes et des antécédents médicaux de Melissa. Le médecin prescrit une réhydratation, un traitement de soutien et des antibiotiques pour endiguer l'infection bactérienne. Elle prescrit également des médicaments pour augmenter la tension artérielle de Melissa. Melissa passe trois jours à l'hôpital pour suivre un traitement ; de plus, sa fonction rénale est surveillée en raison du risque élevé d'insuffisance rénale associé au SCT. Après 72 heures, Melissa se porte suffisamment bien pour être libérée et poursuivre sa convalescence à la maison.
Exercice\(\PageIndex{6}\)
En quoi l'antibiothérapie aiderait-elle à combattre un superantigène ?
Orientation clinique : partie 2
L'enflure des ganglions lymphatiques, de l'abdomen et de la rate d'Olivia suggère une forte réponse immunitaire à une infection systémique en cours. De plus, la petite Olivia hésite à tourner la tête et semble ressentir de fortes douleurs au cou. Le médecin prescrit une formule sanguine complète, une hémoculture et une ponction lombaire. Le liquide céphalorachidien (LCR) obtenu semble trouble et est ensuite évalué par une évaluation de la coloration de Gram et une culture pour détecter d'éventuels agents pathogènes bactériens. La formule sanguine complète indique un nombre élevé de globules blancs dans le sang d'Olivia. L'augmentation du nombre de globules blancs est enregistrée à 28,5 K/µL (plage normale : 6,0 à 17,5 K/µL). Le pourcentage de neutrophiles a été enregistré à 60 % (fourchette normale : 23 à 45 %). Les taux de glucose dans le LCR ont été enregistrés à 30 mg/100 ml (plage normale : 50 à 80 mg/100 ml). Le nombre de globules blancs dans le LCR était de 1 163 mm3 (plage normale : 5 à 20/mm 3).
Exercice\(\PageIndex{7}\)
- Sur la base de ces résultats, avez-vous un diagnostic préliminaire ?
- Quel est le traitement recommandé sur la base de ce diagnostic préliminaire ?
Concepts clés et résumé
- Les lymphocytes T immatures sont produits dans la moelle osseuse rouge et se déplacent vers le thymus pour mûrir.
- La sélection thymique est un processus en trois étapes de sélection négative et positive qui permet de déterminer quels lymphocytes T arriveront à maturité et quitteront le thymus pour se rendre dans la circulation sanguine périphérique.
- La tolérance centrale implique une sélection négative des lymphocytes T autoréactifs dans le thymus, et la tolérance périphérique implique l'anergie et les lymphocytes T régulateurs qui empêchent les réponses immunitaires autoréactives et l'auto-immunité.
- La structure du TCR est similaire à celle des immunoglobulines, mais elle est moins complexe. Des millions de TCR uniques se liant à des épitopes sont codés par un processus de réarrangement génétique des segments des gènes V, D et J.
- Les lymphocytes T peuvent être divisés en trois classes : les lymphocytes T auxiliaires, les lymphocytes T cytotoxiques et les lymphocytes T régulateurs, en fonction de leur expression du CD4 ou du CD8, des molécules du CMH avec lesquelles ils interagissent pour l'activation, et de leurs fonctions respectives.
- Les lymphocytes T auxiliaires activés se différencient en sous-types de lymphocytes T H 1, T H 2, T H 17 ou en sous-types de lymphocytes T mémoire. La différenciation est dirigée par les cytokines spécifiques auxquelles ils sont exposés. T H 1, T H 2 et T H 17 remplissent différentes fonctions liées à la stimulation des défenses immunitaires adaptatives et innées. Les lymphocytes T à mémoire sont des cellules à longue durée de vie qui peuvent réagir rapidement à des expositions secondaires.
- Une fois activés, les lymphocytes T cytotoxiques ciblent et tuent les cellules infectées par des agents pathogènes intracellulaires. La mise à mort nécessite la reconnaissance d'épitopes pathogènes spécifiques présentés à la surface des cellules à l'aide de molécules du MHC I. La mort est médiée par la perforine et les granzymes qui induisent l'apoptose.
- Les superantigènes sont des protéines bactériennes ou virales qui provoquent une activation non spécifique des lymphocytes T auxiliaires, entraînant une libération excessive de cytokines (tempête de cytokines) et une réponse inflammatoire systémique, potentiellement fatale.
Notes
- 1 Blaschitz C., Raffatellu M. « Les cytokines Th17 et la barrière de la muqueuse intestinale ». J Colin Immunol. 2010 mars ; 30 (2) :196-203. doi : 10.1007/s10875-010-9368-7.


