18.1 : Architecture du système immunitaire
- Page ID
- 187702
Objectifs d'apprentissage
- Définition de la mémoire, de la réponse principale, de la réponse secondaire et de la spécificité
- Distinguer l'immunité humorale de l'immunité cellulaire
- Différencier les antigènes, les épitopes et les haptènes
- Décrire la structure et la fonction des anticorps et distinguer les différentes classes d'anticorps
Orientation clinique : 1ère partie
Olivia, un nourrisson d'un an, est amenée aux urgences par ses parents, qui signalent ses symptômes : pleurs excessifs, irritabilité, sensibilité à la lumière, léthargie inhabituelle et vomissements. Un médecin ressent un gonflement des ganglions lymphatiques dans la gorge et les aisselles d'Olivia. De plus, la zone de l'abdomen au-dessus de la rate est enflée et sensible.
Exercice\(\PageIndex{1}\)
- Que suggèrent ces symptômes ?
- Quels tests peuvent être prescrits pour tenter de diagnostiquer le problème ?
L'immunité adaptative est définie par deux caractéristiques importantes : la spécificité et la mémoire. La spécificité fait référence à la capacité du système immunitaire adaptatif à cibler des agents pathogènes spécifiques, et la mémoire fait référence à sa capacité à réagir rapidement aux agents pathogènes auxquels il a déjà été exposé. Par exemple, lorsqu'une personne se rétablit de la varicelle, son corps acquiert un souvenir de l'infection qui la protégera spécifiquement de l'agent causal, le virus varicelle-zona, s'il est de nouveau exposé au virus par la suite.
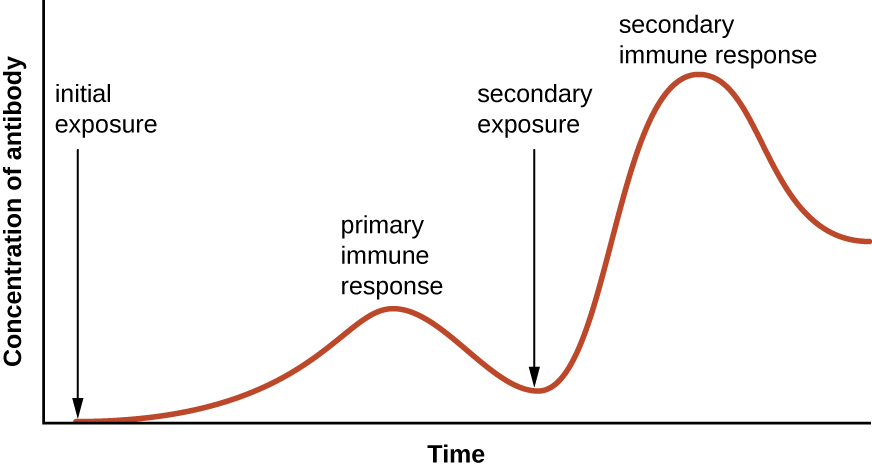
La spécificité et la mémoire sont obtenues essentiellement en programmant certaines cellules impliquées dans la réponse immunitaire pour qu'elles réagissent rapidement aux expositions ultérieures du pathogène. Cette programmation se produit à la suite de la première exposition à un agent pathogène ou à un vaccin, qui déclenche une réponse primaire. Les expositions ultérieures entraînent une réponse secondaire plus rapide et plus forte grâce à la mémorisation par l'organisme de la première exposition (Figure\(\PageIndex{1}\)). Cette réponse secondaire est toutefois spécifique à l'agent pathogène en question. Par exemple, l'exposition à un virus (par exemple, le virus de la varicelle et du zona) ne fournit pas de protection contre d'autres maladies virales (par exemple, la rougeole, les oreillons ou la poliomyélite).
L'immunité spécifique adaptative implique l'action de deux types de cellules distincts : les lymphocytes B (lymphocytes B) et les lymphocytes T (lymphocytes T). Bien que les lymphocytes B et les lymphocytes T soient issus d'une voie commune de différenciation des cellules souches hématopoïétiques, leurs sites de maturation et leurs rôles dans l'immunité adaptative sont très différents.
Les lymphocytes B arrivent à maturité dans la moelle osseuse et sont responsables de la production de glycoprotéines appelées anticorps ou immunoglobulines. Les anticorps participent à la défense de l'organisme contre les agents pathogènes et les toxines de l'environnement extracellulaire. Les mécanismes de l'immunité spécifique adaptative qui impliquent la production de lymphocytes B et d'anticorps sont appelés immunité humorale. La maturation des lymphocytes T se produit dans le thymus. Les lymphocytes T jouent le rôle d'orchestrateur central des réponses immunitaires innées et adaptatives. Ils sont également responsables de la destruction des cellules infectées par des agents pathogènes intracellulaires. Le ciblage et la destruction des agents pathogènes intracellulaires par les lymphocytes T sont appelés immunité à médiation cellulaire, ou immunité cellulaire.
Exercice\(\PageIndex{2}\)
- Énumérez les deux caractéristiques qui définissent l'immunité adaptative.
- Expliquez la différence entre une réponse immunitaire primaire et une réponse immunitaire secondaire.
- En quoi l'immunité humorale et cellulaire diffère-t-elle ?
Antigènes
L'activation des défenses immunitaires adaptatives est déclenchée par des structures moléculaires spécifiques à l'agent pathogène appelées antigènes. Les antigènes sont similaires aux modèles moléculaires associés aux agents pathogènes (PAMP) abordés dans la section Reconnaissance des agents pathogènes et phagocytose ; toutefois, alors que les PAMP sont des structures moléculaires présentes sur de nombreux agents pathogènes, les antigènes sont uniques à un pathogène spécifique. Les antigènes qui stimulent l'immunité adaptative contre la varicelle, par exemple, sont propres au virus de la varicelle et du zona, mais sont très différents des antigènes associés à d'autres agents pathogènes viraux.
Le terme antigène a été initialement utilisé pour décrire les molécules qui stimulent la production d'anticorps ; en fait, le terme vient d'une combinaison des mots « anti-corps » et « générateur », et une molécule qui stimule la production d'anticorps est dite antigénique. Cependant, le rôle des antigènes ne se limite pas à l'immunité humorale et à la production d'anticorps ; les antigènes jouent également un rôle essentiel dans la stimulation de l'immunité cellulaire, raison pour laquelle les antigènes sont parfois plus précisément appelés immunogènes. Dans ce texte, cependant, nous les désignerons généralement sous le nom d'antigènes.
Les agents pathogènes possèdent diverses structures qui peuvent contenir des antigènes. Par exemple, les antigènes des cellules bactériennes peuvent être associés à leurs capsules, à leurs parois cellulaires, à leurs fimbriae, à leurs flagelles ou à leurs pili. Les antigènes bactériens peuvent également être associés à des toxines extracellulaires et à des enzymes qu'ils sécrètent. Les virus possèdent divers antigènes associés à leurs capsides, à leurs enveloppes et aux structures en épis qu'ils utilisent pour se fixer aux cellules.
Les antigènes peuvent appartenir à un certain nombre de classes moléculaires, y compris les glucides, les lipides, les acides nucléiques, les protéines et les combinaisons de ces molécules. Les antigènes de différentes classes varient dans leur capacité à stimuler les défenses immunitaires adaptatives ainsi que dans le type de réponse qu'ils stimulent (humorale ou cellulaire). La complexité structurale d'une molécule antigénique est un facteur important de son potentiel antigénique. En général, les molécules plus complexes sont plus efficaces en tant qu'antigènes. Par exemple, la structure complexe tridimensionnelle des protéines en fait les antigènes les plus efficaces et les plus puissants, capables de stimuler l'immunité humorale et cellulaire. En comparaison, les glucides ont une structure moins complexe et sont donc moins efficaces en tant qu'antigènes ; ils ne peuvent que stimuler les défenses immunitaires humorales. Les lipides et les acides nucléiques sont les molécules les moins antigéniques et, dans certains cas, ils ne peuvent le devenir que lorsqu'ils sont combinés à des protéines ou à des glucides pour former des glycolipides, des lipoprotéines ou des nucléoprotéines.
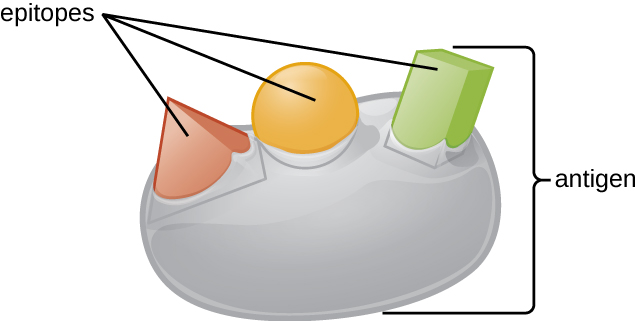
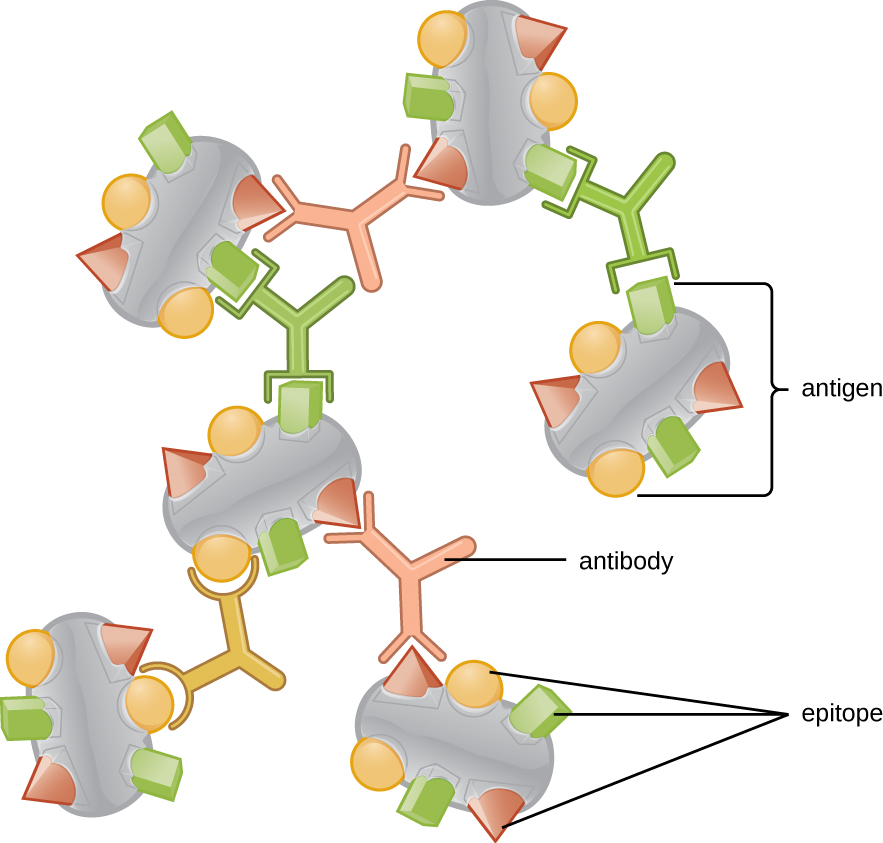
L'une des raisons pour lesquelles la complexité tridimensionnelle des antigènes est si importante est que les anticorps et les lymphocytes T ne reconnaissent pas l'antigène entier et n'interagissent pas avec lui, mais avec de plus petites régions exposées à la surface des antigènes appelées épitopes. Un seul antigène peut posséder plusieurs épitopes différents (Figure\(\PageIndex{2}\)), et différents anticorps peuvent se lier à différents épitopes du même antigène (Figure\(\PageIndex{3}\)). Par exemple, le flagelle bactérien est une grande structure protéique complexe qui peut posséder des centaines, voire des milliers d'épitopes dotés de structures tridimensionnelles uniques. De plus, les flagelles de différentes espèces bactériennes (ou même de souches de la même espèce) contiennent des épitopes uniques qui ne peuvent être liés que par des anticorps spécifiques.
La taille d'un antigène est un autre facteur important de son potentiel antigénique. Alors que les grandes structures antigéniques comme les flagelles possèdent de multiples épitopes, certaines molécules sont trop petites pour être antigéniques en elles-mêmes. Ces molécules, appelées haptènes, sont essentiellement des épitopes libres qui ne font pas partie de la structure tridimensionnelle complexe d'un antigène plus gros. Pour qu'un haptène devienne antigénique, il doit d'abord se fixer à une molécule porteuse plus grosse (généralement une protéine) pour produire un antigène conjugué. Les anticorps spécifiques à l'haptène produits en réponse à l'antigène conjugué peuvent ensuite interagir avec des molécules d'haptène libre non conjuguées. On ne sait pas que les haptènes sont associés à des agents pathogènes spécifiques, mais ils sont responsables de certaines réactions allergiques. Par exemple, l'haptène urushiol, une molécule présente dans l'huile végétale qui cause l'herbe à puce, provoque une réponse immunitaire qui peut provoquer une éruption cutanée grave (dermatite de contact). De même, la pénicilline, un haptène, peut provoquer des réactions allergiques aux médicaments de la classe des pénicillines.
Exercice\(\PageIndex{3}\)
- Quelle est la différence entre un antigène et un épitope ?
- Quels facteurs influent sur le potentiel antigénique d'un antigène ?
- Pourquoi les haptènes ne sont-ils généralement pas antigéniques et comment le deviennent-ils ?
Anticorps
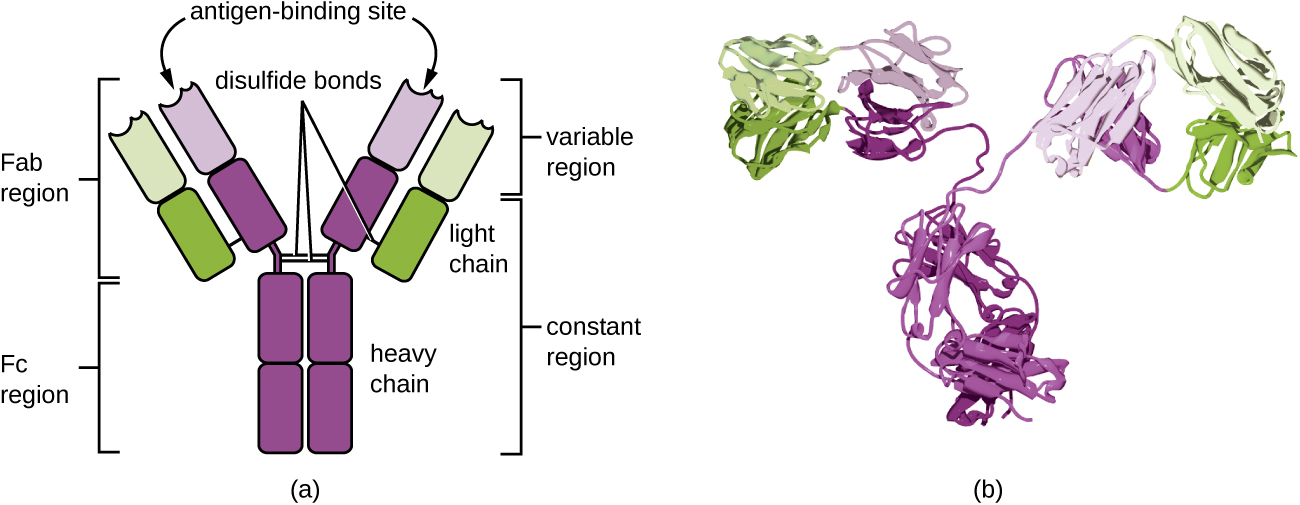
Les anticorps (également appelés immunoglobulines) sont des glycoprotéines présentes à la fois dans le sang et dans les liquides tissulaires. La structure de base d'un monomère d'anticorps est constituée de quatre chaînes protéiques maintenues ensemble par des liaisons disulfure (Figure\(\PageIndex{4}\)). Une liaison disulfure est une liaison covalente entre les groupes sulfhydryl R présents sur deux acides aminés de la cystéine. Les deux plus grandes chaînes sont identiques et sont appelées chaînes lourdes. Les deux chaînes plus petites sont également identiques l'une à l'autre et sont appelées chaînes légères. Assemblées, les chaînes lourdes et légères forment une structure de base en forme de Y.
Les deux « bras » de la molécule d'anticorps en forme de Y sont connus sous le nom de région Fab, pour « fragment de liaison à l'antigène ». L'extrémité de la région Fab est la région variable, qui sert de site de liaison à l'antigène. La séquence d'acides aminés dans la région variable dicte la structure tridimensionnelle, et donc l'épitope tridimensionnel spécifique auquel la région Fab est capable de se lier. Bien que la spécificité des épitopes des régions Fab soit identique pour chaque bras d'une seule molécule d'anticorps, cette région présente un degré élevé de variabilité entre des anticorps ayant des spécificités épitopiques différentes. La liaison à la région Fab est nécessaire à la neutralisation des agents pathogènes, à l'agglutination ou à l'agrégation des agents pathogènes et à la cytotoxicité à médiation cellulaire dépendante des anticorps.
La région constante de la molécule d'anticorps comprend le tronc du Y et la partie inférieure de chaque bras du Y. Le tronc du Y est également appelé région Fc, pour « fragment de cristallisation », et est le site de liaison du facteur complémentaire et de liaison aux cellules phagocytaires lors de l'opsonisation médiée par les anticorps.
Exercice\(\PageIndex{4}\)
Décrivez les différentes fonctions de la région Fab et de la région Fc.
Classes d'anticorps
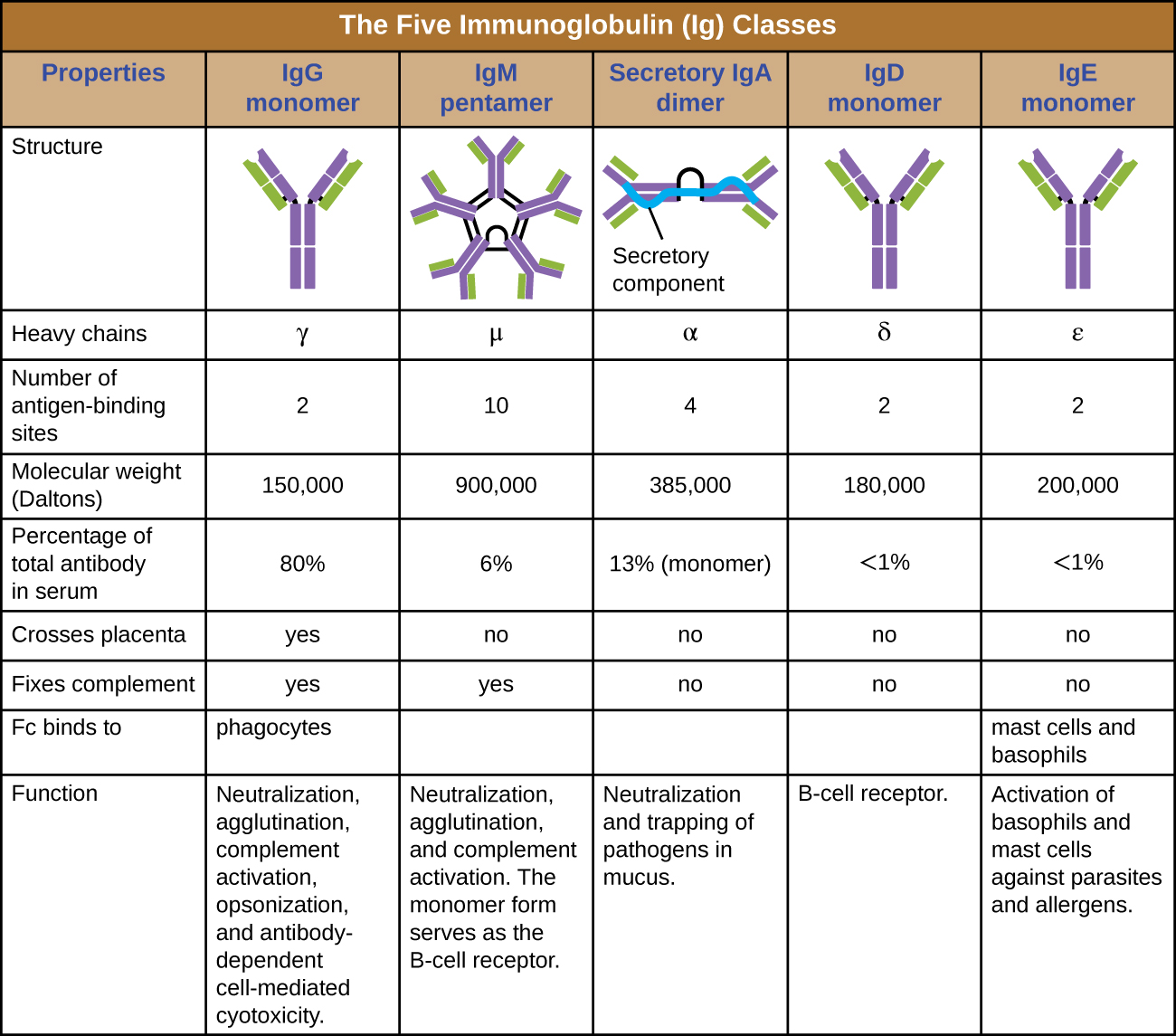
La région constante d'une molécule d'anticorps détermine sa classe ou son isotype. Les cinq classes d'anticorps sont les IgG, les IgM, les IgA, les IgD et les IgE. Chaque classe possède des chaînes lourdes uniques désignées par les lettres grecques γ, μ, α, δ et ε, respectivement. Les classes d'anticorps présentent également d'importantes différences en termes d'abondance sérique, de disposition, de sites d'action corporels, de rôles fonctionnels et de taille (Figure\(\PageIndex{5}\)).
L'IgG est un monomère qui est de loin l'anticorps le plus abondant dans le sang humain, représentant environ 80 % du total des anticorps sériques. Les IgG pénètrent efficacement dans les espaces tissulaires et constituent la seule classe d'anticorps capable de traverser la barrière placentaire, conférant ainsi une immunité passive au fœtus en développement pendant la grossesse. L'IgG est également la classe d'anticorps la plus polyvalente en termes de rôle dans la défense de l'organisme contre les agents pathogènes.
L'IgM est initialement produite sous une forme monomère liée à la membrane qui sert de récepteur de liaison à l'antigène sur les lymphocytes B. La forme sécrétée de l'IgM s'assemble en un pentamère avec cinq monomères d'IgM liés entre eux par une structure protéique appelée chaîne J. Bien que la localisation de la chaîne J par rapport aux régions Fc des cinq monomères empêche les IgM de remplir certaines des fonctions des IgG, les dix sites Fab disponibles associés à une IgM pentamérique en font un anticorps important dans l'arsenal de défenses de l'organisme. L'IgM est le premier anticorps produit et sécrété par les lymphocytes B au cours des réponses immunitaires primaires et secondaires, faisant de l'IgM spécifique à un pathogène un marqueur diagnostique précieux lors d'infections actives ou récentes.
Les IgA représentent environ 13 % du total des anticorps sériques, et les IgA sécrétoires sont la classe d'anticorps la plus courante et la plus abondante que l'on trouve dans les sécrétions muqueuses qui protègent les muqueuses. Les IgA peuvent également être présentes dans d'autres sécrétions telles que le lait maternel, les larmes et la salive. L'IgA sécrétoire est assemblée sous une forme dimère avec deux monomères reliés par une structure protéique appelée composant sécrétoire. L'une des fonctions importantes des IgA sécrétoires est de piéger les agents pathogènes dans le mucus afin qu'ils puissent ensuite être éliminés de l'organisme.
Semblable à l'IgM, l'IgD est un monomère lié à la membrane présent à la surface des lymphocytes B, où il sert de récepteur de liaison à l'antigène. Cependant, les IgD ne sont pas sécrétées par les lymphocytes B et seules des traces sont détectées dans le sérum. Ces traces proviennent très probablement de la dégradation des anciens lymphocytes B et de la libération de molécules d'IgD par leurs membranes cytoplasmiques.
Les IgE sont la classe d'anticorps la moins abondante dans le sérum. Comme l'IgG, elle est sécrétée sous forme de monomère, mais son rôle dans l'immunité adaptative se limite aux défenses antiparasitaires. La région Fc de l'IgE se lie aux basophiles et aux mastocytes. La région Fab de l'IgE liée interagit ensuite avec des épitopes antigéniques spécifiques, provoquant la libération par les cellules de puissants médiateurs pro-inflammatoires. La réaction inflammatoire résultant de l'activation des mastocytes et des basophiles contribue à la défense contre les parasites, mais cette réaction est également au cœur des réactions allergiques (voir Maladies du système immunitaire).
Exercice\(\PageIndex{5}\)
- Quelle partie d'une molécule d'anticorps détermine sa classe ?
- Quelle classe d'anticorps intervient dans la protection contre les parasites ?
- Décrivez la différence de structure entre les IgM et les IgG.
Interactions antigène-anticorps
Différentes classes d'anticorps jouent un rôle important dans la défense de l'organisme contre les agents pathogènes. Ces fonctions incluent la neutralisation des agents pathogènes, l'opsonisation pour la phagocytose, l'agglutination, l'activation du complément et la cytotoxicité cellulaire dépendante des anticorps. Pour la plupart de ces fonctions, les anticorps constituent également un lien important entre l'immunité spécifique adaptative et l'immunité non spécifique innée.
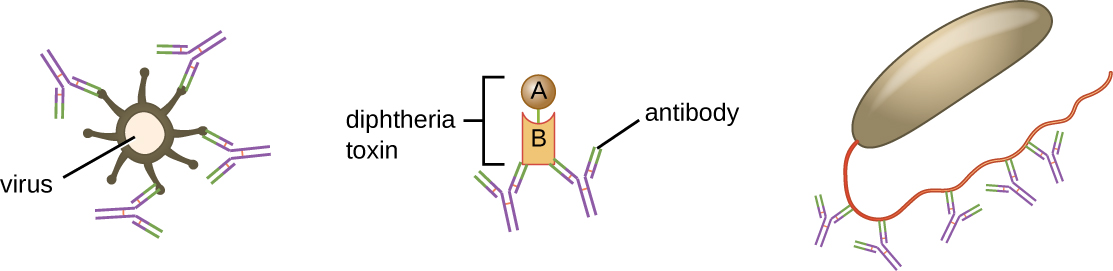
La neutralisation implique la liaison de certains anticorps (IgG, IgM ou IgA) à des épitopes à la surface d'agents pathogènes ou de toxines, empêchant ainsi leur fixation aux cellules. Par exemple, les IgA sécrétoires peuvent se lier à des agents pathogènes spécifiques et bloquer la fixation initiale aux cellules de la muqueuse intestinale. De même, des anticorps spécifiques peuvent se lier à certaines toxines, les empêchant ainsi de se fixer aux cellules cibles et neutralisant ainsi leurs effets toxiques. Les virus peuvent être neutralisés et empêchés d'infecter une cellule par le même mécanisme (Figure\(\PageIndex{6}\)).
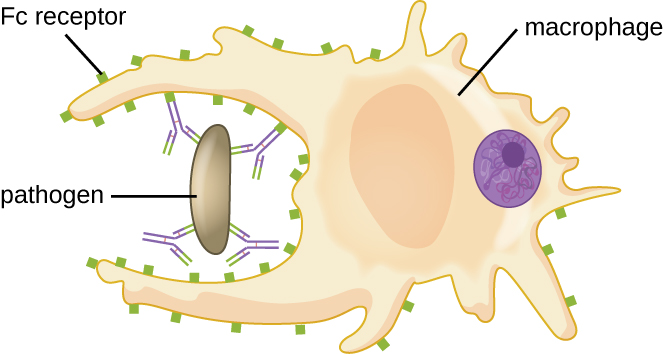
Comme décrit dans Chemical Defenses, l'opsonisation consiste à enrober un agent pathogène de molécules, telles que des facteurs complémentaires, une protéine C-réactive et une amyloïde A sérique, pour aider à la fixation des phagocytes afin de faciliter la phagocytose. Les anticorps IgG constituent également d'excellentes opsonines, liant leurs sites Fab à des épitopes spécifiques à la surface des agents pathogènes. Les cellules phagocytaires telles que les macrophages, les cellules dendritiques et les neutrophiles possèdent des récepteurs à leur surface qui reconnaissent et se lient à la partie Fc des molécules d'IgG ; ainsi, les IgG aident ces phagocytes à se fixer aux agents pathogènes qu'ils se sont liés et à les engloutir (Figure\(\PageIndex{7}\)).
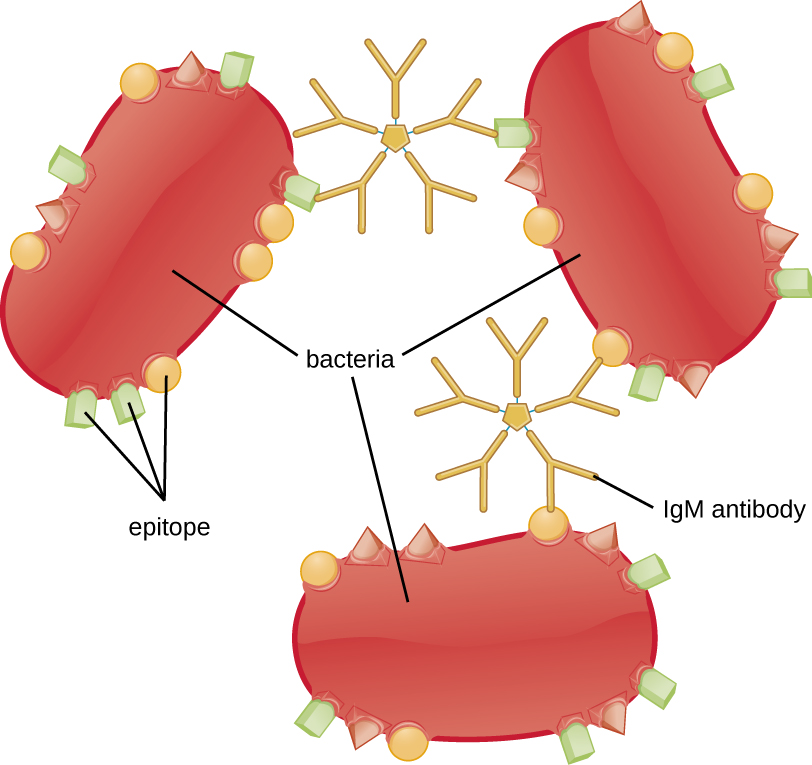
L'agglutination ou l'agrégation implique la réticulation d'agents pathogènes par des anticorps pour créer de grands agrégats (Figure\(\PageIndex{8}\)). L'IgG possède deux sites de liaison à l'antigène Fab, qui peuvent se lier à deux cellules pathogènes distinctes, les agglutinant ainsi. Lorsque plusieurs anticorps IgG sont impliqués, de gros agrégats peuvent se développer ; ces agrégats sont plus faciles à filtrer par les reins et la rate dans le sang et plus faciles à ingérer pour les phagocytes en vue de leur destruction. La structure pentamérique de l'IgM fournit dix sites de liaison Fab par molécule, ce qui en fait l'anticorps le plus efficace pour l'agglutination.
Une autre fonction importante des anticorps est l'activation de la cascade du complément. Comme indiqué dans le chapitre précédent, le système du complément est un élément important des défenses innées : il favorise la réponse inflammatoire, recrute les phagocytes sur le site de l'infection, améliore la phagocytose par opsonisation et tue les bactéries pathogènes gram-négatives à l'aide du complexe d'attaque membranaire (MAC). ). L'activation du complément peut se faire par trois voies différentes (voir Figure 17.2.2), mais la plus efficace est la voie classique, qui nécessite la liaison initiale des anticorps IgG ou IgM à la surface d'une cellule pathogène, permettant ainsi le recrutement et l'activation du complexe C1.
Une autre fonction importante des anticorps est la cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC), qui favorise la destruction des agents pathogènes trop gros pour être phagocytés. Ce processus est mieux caractérisé pour les cellules tueuses naturelles (cellules NK), comme le montre la figure\(\PageIndex{9}\), mais il peut également impliquer des macrophages et des éosinophiles. L'ADCC se produit lorsque la région Fab d'un anticorps IgG se lie à un pathogène de grande taille ; les récepteurs Fc des cellules effectrices (par exemple, les cellules NK) se lient ensuite à la région Fc de l'anticorps, les rapprochant ainsi étroitement du pathogène cible. La cellule effectrice sécrète ensuite de puissantes cytotoxines (par exemple, de la perforine et des granzymes) qui tuent le pathogène.
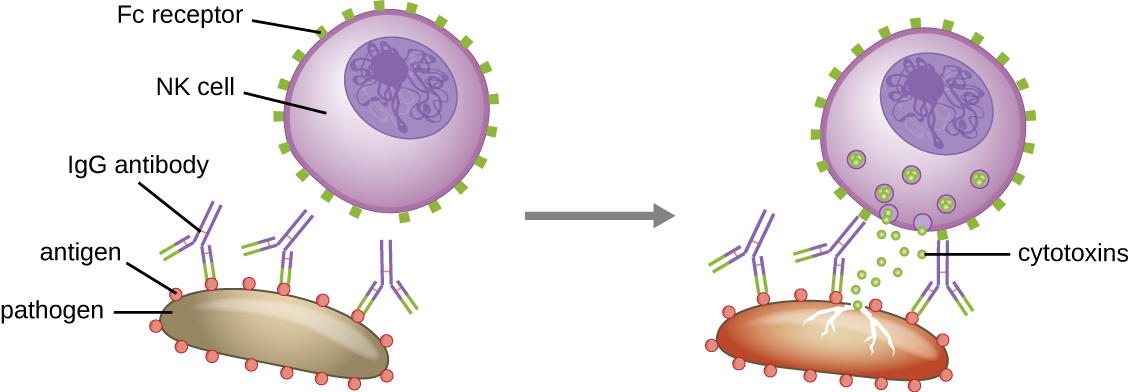
Exercice\(\PageIndex{6}\)
- Où se trouve normalement l'IgA ?
- Quelle classe d'anticorps traverse le placenta pour protéger le fœtus ?
- Comparez les mécanismes de l'opsonisation et de la cytotoxicité à médiation cellulaire dépendante des anticorps.
Concepts clés et résumé
- L'immunité adaptative est une défense acquise contre les agents pathogènes étrangers caractérisée par la spécificité et la mémoire. La première exposition à un antigène stimule une réponse primaire, et les expositions suivantes stimulent une réponse secondaire plus rapide et plus forte.
- L'immunité adaptative est un double système impliquant l'immunité humorale (anticorps produits par les lymphocytes B) et l'immunité cellulaire (lymphocytes T dirigés contre les agents pathogènes intracellulaires).
- Les antigènes, également appelés immunogènes, sont des molécules qui activent l'immunité adaptative. Un seul antigène possède des épitopes plus petits, chacun étant capable d'induire une réponse immunitaire adaptative spécifique.
- La capacité d'un antigène à stimuler une réponse immunitaire dépend de plusieurs facteurs, dont sa classe moléculaire, sa complexité moléculaire et sa taille.
- Les anticorps (immunoglobulines) sont des glycoprotéines en forme de Y dotées de deux sites Fab pour la liaison aux antigènes et d'une partie Fc impliquée dans l'activation et l'opsonisation du complément.
- Les cinq classes d'anticorps sont les IgM, les IgG, les IgA, les IgE et les IgD, chacune différant par sa taille, sa disposition, sa localisation dans l'organisme et sa fonction. Les cinq fonctions principales des anticorps sont la neutralisation, l'opsonisation, l'agglutination, l'activation du complément et la cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC).


