17.4 : Reconnaissance des agents pathogènes et phagocytose
- Page ID
- 187598
Objectifs d'apprentissage
- Expliquer comment les leucocytes migrent du sang périphérique vers les tissus infectés
- Expliquer les mécanismes par lesquels les leucocytes reconnaissent les agents pathogènes
- Expliquer le processus de phagocytose et les mécanismes par lesquels les phagocytes détruisent et dégradent les agents pathogènes
Plusieurs des types de cellules abordés dans la section précédente peuvent être décrits comme des phagocytes, c'est-à-dire des cellules dont la fonction principale est de rechercher, d'ingérer et de tuer les agents pathogènes. Ce processus, appelé phagocytose, a été observé pour la première fois chez les étoiles de mer dans les années 1880 par le zoologiste lauréat du prix Nobel Ilya Metchnikoff (1845-1916), qui a établi le lien avec les globules blancs (WBC) chez l'homme et d'autres animaux. À l'époque, Pasteur et d'autres scientifiques pensaient que les globules blancs propageaient des agents pathogènes au lieu de les tuer (ce qui est vrai pour certaines maladies, comme la tuberculose). Mais dans la plupart des cas, les phagocytes fournissent une défense forte, rapide et efficace contre un large éventail de microbes, ce qui en fait un élément essentiel de l'immunité innée non spécifique. Cette section se concentrera sur les mécanismes par lesquels les phagocytes sont capables de rechercher, de reconnaître et de détruire les agents pathogènes.
Extravasation (diapédèse) des leucocytes
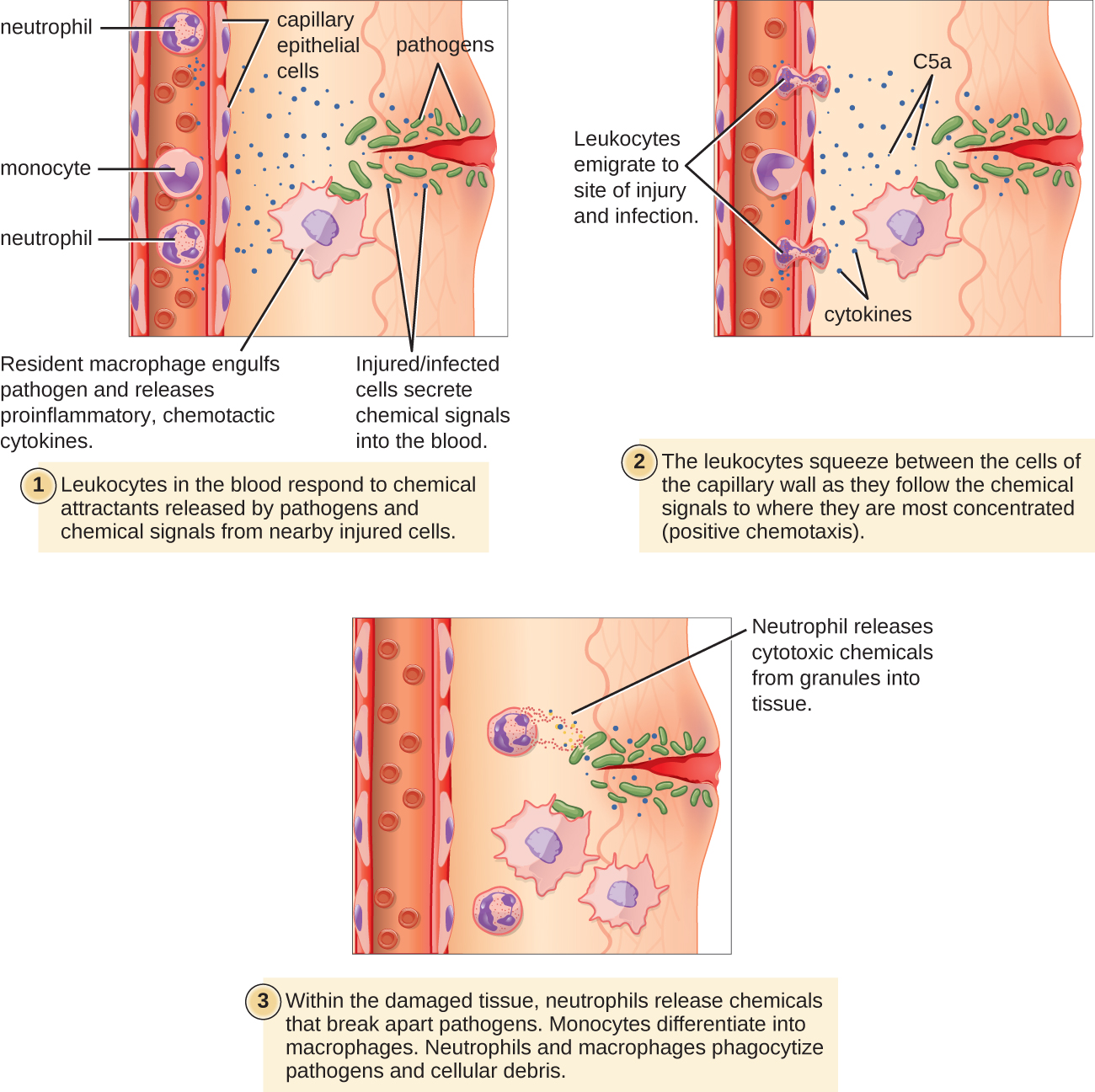
Certains phagocytes sont des leucocytes (WBC) qui circulent normalement dans le sang. Pour atteindre les agents pathogènes situés dans les tissus infectés, les leucocytes doivent traverser les parois des petits vaisseaux sanguins capillaires des tissus. Ce processus, appelé extravasation, ou diapédèse, est initié par le facteur complémentaire C5a, ainsi que par les cytokines libérées à proximité immédiate par les macrophages résidents et les cellules tissulaires réagissant à la présence de l'agent infectieux (Figure\(\PageIndex{1}\)). Comme la C5a, bon nombre de ces cytokines sont pro-inflammatoires et chimiotactiques, et elles se lient aux cellules des petits vaisseaux sanguins capillaires, déclenchant une réponse dans les cellules endothéliales qui tapissent l'intérieur des parois des vaisseaux sanguins. Cette réponse implique la régulation positive et l'expression de divers récepteurs et molécules d'adhésion cellulaire. Les leucocytes qui les traversent adhèrent légèrement aux molécules d'adhésion, ralentissent et roulent le long des parois des vaisseaux sanguins à proximité de la zone infectée. Lorsqu'elles atteignent une jonction cellulaire, elles se lient à un plus grand nombre de ces molécules d'adhésion, s'aplatissant et traversant la jonction cellulaire dans le cadre d'un processus connu sous le nom de migration transendothéliale. Ce mécanisme d' « adhésion progressive » permet aux leucocytes de sortir de la circulation sanguine et de pénétrer dans les zones infectées, où ils peuvent commencer à phagocyter les agents pathogènes envahisseurs.
Notez que l'extravasation ne se produit pas dans les artères ou les veines. Ces vaisseaux sanguins sont entourés de parois protectrices multicouches plus épaisses, contrairement aux fines parois unicellulaires des capillaires. De plus, le flux sanguin dans les artères est trop turbulent pour permettre une adhésion par roulement. De plus, certains leucocytes ont tendance à réagir à une infection plus rapidement que d'autres. Les premiers à arriver sont généralement les neutrophiles, souvent dans les heures qui suivent une infection bactérienne. Par contrat, les monocytes peuvent mettre plusieurs jours à quitter la circulation sanguine et à se différencier en macrophages.
Regardez les vidéos suivantes sur l'extravasation des leucocytes et le roulement des leucocytes pour en savoir plus.
Exercice\(\PageIndex{1}\)
Expliquer le rôle des molécules d'adhésion dans le processus d'extravasation.
Reconnaissance des pathogènes
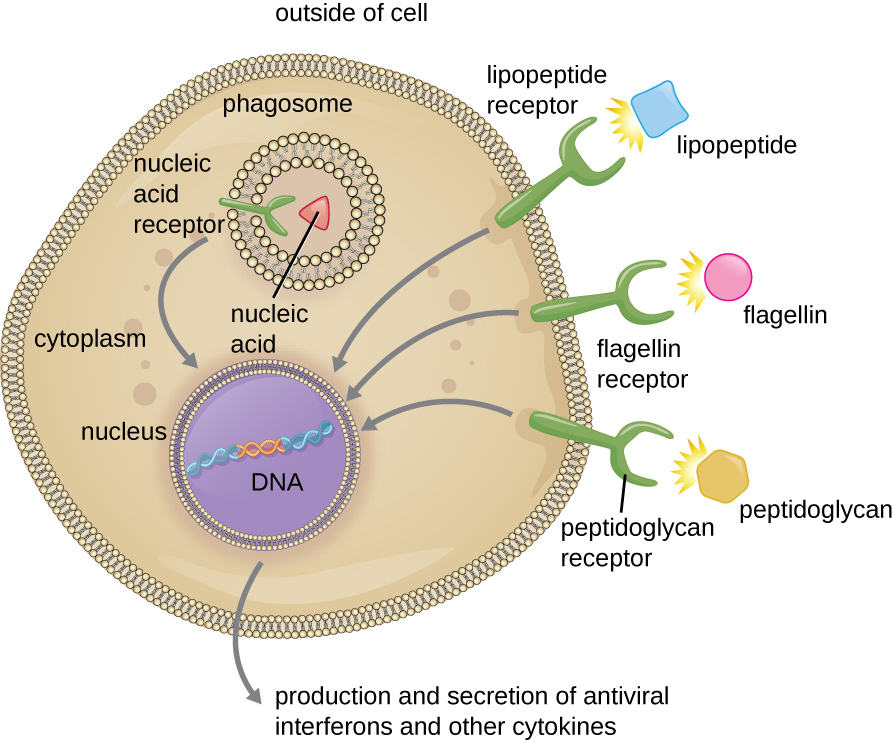
Comme décrit dans la section précédente, l'opsonisation des agents pathogènes par les anticorps, les facteurs complémentaires C1q, C3b et C4b et les lectines peut aider les cellules phagocytaires à reconnaître les agents pathogènes et à se fixer pour initier la phagocytose. Cependant, la reconnaissance des agents pathogènes ne dépend pas toujours de l'opsonine. Les phagocytes peuvent également reconnaître les structures moléculaires communes à de nombreux groupes de microbes pathogènes. Ces structures sont appelées modèles moléculaires associés aux agents pathogènes (PAMP). Les PAMP courants sont les suivants :
- le peptidoglycane, présent dans les parois cellulaires bactériennes ;
- la flagelline, une protéine présente dans les flagelles bactériens ;
- lipopolysaccharide (LPS) provenant de la membrane externe de bactéries gram-négatives ;
- les lipopeptides, molécules exprimées par la plupart des bactéries ; et
- des acides nucléiques tels que l'ADN ou l'ARN viraux.
Comme de nombreux autres PAMP, ces substances font partie intégrante de la structure de grandes classes de microbes.
Les structures qui permettent aux cellules phagocytaires de détecter les PAMP sont appelées récepteurs de reconnaissance des formes (PRR). Un groupe de PRR est constitué des récepteurs de type Toll (TLR), qui se lient à divers PAMP et communiquent avec le noyau du phagocyte pour provoquer une réponse. De nombreux TLR (et autres PRR) sont situés à la surface d'un phagocyte, mais certains peuvent également être trouvés incrustés dans les membranes des compartiments intérieurs et des organites (Figure\(\PageIndex{2}\)). Ces PRR intérieurs peuvent être utiles pour la fixation et la reconnaissance d'agents pathogènes intracellulaires qui auraient pu accéder à l'intérieur de la cellule avant que la phagocytose ne se produise. Les acides nucléiques viraux, par exemple, peuvent rencontrer un PRR interne, déclenchant la production de l'interféron cytokine antiviral.
En plus de constituer la première étape de la reconnaissance des agents pathogènes, l'interaction entre les PAMP et les PRR sur les macrophages fournit un signal intracellulaire qui active le phagocyte, le faisant passer d'un état de préparation dormant et de prolifération lente à un état d'hyperactivité, de prolifération, production/sécrétion de cytokines et destruction intracellulaire accrue. Les PRR sur les macrophages répondent également aux signaux de détresse chimique émis par des cellules endommagées ou stressées. Cela permet aux macrophages d'étendre leurs réponses au-delà de la protection contre les maladies infectieuses pour jouer un rôle plus large dans la réponse inflammatoire déclenchée par des blessures ou d'autres maladies.
Exercice\(\PageIndex{2}\)
- Nommez quatre modèles moléculaires associés aux agents pathogènes (PAMP).
- Décrire le processus d'activation des phagocytes.
dégradation des agents pathogènes
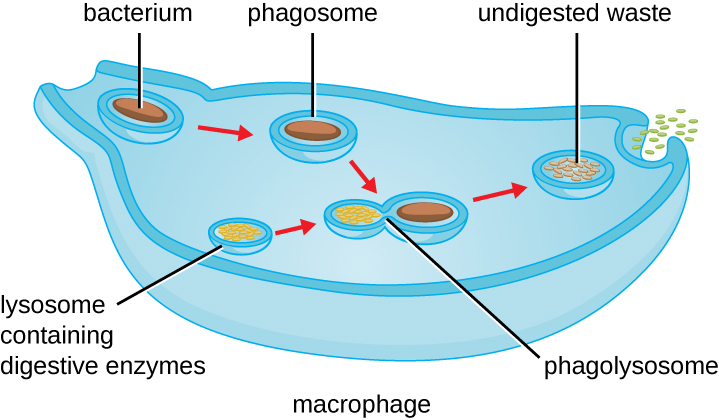
Une fois que l'agent pathogène est reconnu et attaché, celui-ci est englouti dans une vésicule et introduit dans le compartiment interne du phagocyte dans le cadre d'un processus appelé phagocytose (Figure\(\PageIndex{3}\)). Les PRR peuvent favoriser la phagocytose en se liant d'abord à la surface de l'agent pathogène, mais les phagocytes sont également capables d'engloutir des éléments voisins même s'ils ne sont pas liés à des récepteurs spécifiques. Pour engloutir l'agent pathogène, le phagocyte forme un pseudopode qui s'enroule autour du pathogène, puis le pince dans une vésicule membranaire appelée phagosome. L'acidification du phagosome (diminution du pH de l'ordre de 4 à 5) constitue un important mécanisme antibactérien précoce. Le phagosome contenant le pathogène fusionne avec un ou plusieurs lysosomes pour former un phagolysosome. La formation du phagolysosome favorise l'acidification, essentielle à l'activation des enzymes lysosomales digestives dépendantes du pH et à la production de peroxyde d'hydrogène et d'espèces oxygénées réactives toxiques. Les enzymes lysosomales telles que le lysozyme, la phospholipase et les protéases digèrent le pathogène. D'autres enzymes sont impliquées dans une crise respiratoire. Lors de l'explosion respiratoire, les phagocytes augmenteront leur absorption et leur consommation d'oxygène, mais pas pour la production d'énergie. L'augmentation de la consommation d'oxygène se concentre sur la production d'anion superoxyde, de peroxyde d'hydrogène, de radicaux hydroxyles et d'autres espèces réactives de l'oxygène qui sont antibactériennes.
Outre les espèces réactives de l'oxygène produites par l'explosion respiratoire, des composés azotés réactifs ayant un potentiel cytotoxique (destruction cellulaire) peuvent également se former. Par exemple, l'oxyde nitrique peut réagir avec le superoxyde pour former du peroxynitrite, un composé azoté hautement réactif dont les capacités de dégradation sont similaires à celles des espèces réactives de l'oxygène. Certains phagocytes contiennent même un réservoir interne de protéines microbicides de défensine (par exemple, des granules de neutrophiles). Ces forces destructrices peuvent être libérées dans la zone autour de la cellule pour dégrader les microbes à l'extérieur. Les neutrophiles, en particulier, peuvent être très efficaces dans ce mécanisme antimicrobien secondaire.
Une fois la dégradation terminée, les déchets restants sont excrétés de la cellule dans une vésicule exocytaire. Cependant, il est important de noter que tous les restes de l'agent pathogène ne sont pas excrétés sous forme de déchets. Les macrophages et les cellules dendritiques sont également des cellules présentatrices d'antigènes impliquées dans la réponse immunitaire adaptative spécifique. Ces cellules traitent ensuite les restes du pathogène dégradé et présentent des antigènes clés (protéines pathogènes spécifiques) à leur surface cellulaire. Il s'agit d'une étape importante pour la stimulation de certaines réponses immunitaires adaptatives, comme nous le verrons plus en détail dans le chapitre suivant.
Cliquez sur ce lien pour voir un phagocyte pourchassant et engloutissant un agent pathogène.
Exercice\(\PageIndex{3}\)
Quelle est la différence entre un phagosome et un lysosome ?
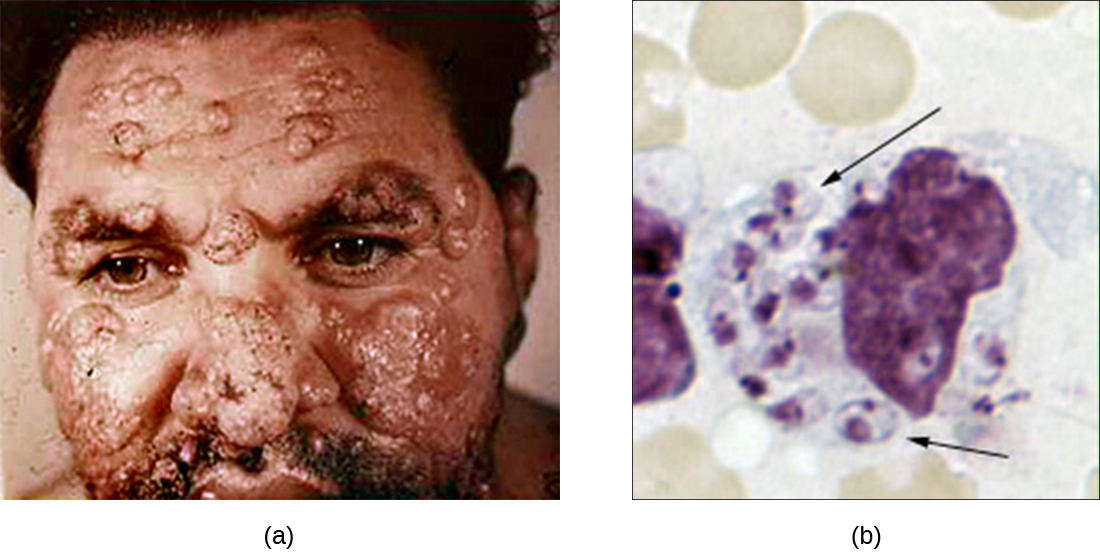
Bien que la phagocytose détruise avec succès de nombreux agents pathogènes, certains sont capables de survivre et même d'exploiter ce mécanisme de défense pour se multiplier dans l'organisme et provoquer une infection généralisée. Les protozoaires du genre Leishmania en sont un exemple. Ces parasites intracellulaires obligatoires sont des flagellés transmis à l'homme par la piqûre d'une mouche des sables. Les infections provoquent des plaies et des ulcères graves et parfois défigurants sur la peau et d'autres tissus (Figure\(\PageIndex{4}\)). Dans le monde, on estime que 1,3 million de personnes sont nouvellement infectées par la leishmaniose chaque année. 1
Les peptides salivaires du phlébotome activent les macrophages de l'hôte sur le site de leur morsure. La voie classique ou alternative d'activation du complément résulte de l'opsonisation C3b du parasite. Les cellules de Leishmania sont phagocytées, perdent leurs flagelles et se multiplient sous une forme connue sous le nom d'amastigote (corps de Leishman-Donovan) dans le phagolysosome. Bien que de nombreux autres agents pathogènes soient détruits par le phagolysosome, la survie des amastigotes de Leishmania est maintenue par la présence de lipophosphoglycanes de surface et de phosphatase acide. Ces substances inhibent l'explosion respiratoire des macrophages et les enzymes lysosomales. Le parasite se multiplie ensuite à l'intérieur de la cellule et lyse le macrophage infecté, libérant les amastigotes pour infecter d'autres macrophages du même hôte. Si une autre mouche des sables mord une personne infectée, elle peut ingérer des amastigotes puis les transmettre à une autre personne par une autre morsure.
Il existe différentes formes de leishmaniose. La plus courante est une forme cutanée localisée de la maladie causée par L. tropica, qui disparaît généralement spontanément avec le temps, mais avec une infiltration lymphocytaire importante et des cicatrices permanentes. Une forme cutanéo-muqueuse de la maladie, causée par L. viannia brasilienfsis, produit des lésions dans les tissus du nez et de la bouche et peut mettre la vie en danger. Une forme viscérale de la maladie peut être causée par plusieurs espèces de Leishmania. Elle affecte divers systèmes organiques et provoque une hypertrophie anormale du foie et de la rate. Fièvres irrégulières, anémie, dysfonction hépatique et perte de poids sont tous des signes et des symptômes de la leishmaniose viscérale. Si elle n'est pas traitée, elle est généralement fatale.
Concepts clés et résumé
- Les phagocytes sont des cellules qui reconnaissent les agents pathogènes et les détruisent par phagocytose.
- La reconnaissance se fait souvent par l'utilisation de récepteurs phagocytaires qui se lient aux molécules que l'on trouve couramment sur les agents pathogènes, connus sous le nom de modèles moléculaires associés aux agents pathogènes (PAMP).
- Les récepteurs qui se lient aux PAMP sont appelés récepteurs de reconnaissance de formes, ou PRR. Les récepteurs de type Toll (TLR) sont un type de PRR présent sur les phagocytes.
- L'extravasation des globules blancs de la circulation sanguine vers les tissus infectés se produit par le biais du processus de migration transendothéliale.
- Les phagocytes dégradent les agents pathogènes par phagocytose, qui consiste à engloutir l'agent pathogène, à le tuer et à le digérer dans un phagolysosome, puis à excréter les matières non digérées.
Notes
- 1 Organisation mondiale de la santé. « Leishmaniose ». 2016. http://www.who.int/mediacentre/factsheets/fs375/en/.


