10.4 : Structure et fonction des génomes cellulaires
- Page ID
- 187648
Objectifs d'apprentissage
- Définir le gène et le génotype et différencier le génotype du phénotype
- Décrire la structure et l'emballage des chromosomes
- Comparez les chromosomes procaryotes et eucaryotes
- Expliquer pourquoi l'ADN extrachromosomique est important dans une cellule
Jusqu'à présent, nous avons discuté de la structure et de la fonction de fragments individuels d'ADN et d'ARN. Dans cette section, nous verrons comment tout le matériel génétique d'un organisme, collectivement appelé génome, est organisé à l'intérieur de la cellule. Étant donné que la génétique d'un organisme détermine dans une large mesure ses caractéristiques, il n'est pas surprenant que les organismes diffèrent dans la disposition de leur ADN et de leur ARN.
Génotype contre phénotype
Toutes les activités cellulaires sont codées dans l'ADN d'une cellule. La séquence de bases au sein d'une molécule d'ADN représente l'information génétique de la cellule. Les segments des molécules d'ADN sont appelés gènes, et les gènes individuels contiennent le code pédagogique nécessaire à la synthèse de diverses protéines, enzymes ou molécules d'ARN stables.
La collection complète de gènes qu'une cellule contient dans son génome est appelée génotype. Cependant, une cellule n'exprime pas tous ses gènes simultanément. Au lieu de cela, il active (exprime) ou désactive certains gènes lorsque cela est nécessaire. L'ensemble des gènes exprimés à un moment donné détermine les activités de la cellule et ses caractéristiques observables, appelées phénotype. Les gènes qui sont toujours exprimés sont appelés gènes constitutifs ; certains gènes constitutifs sont appelés gènes domestiques parce qu'ils sont nécessaires aux fonctions de base de la cellule.
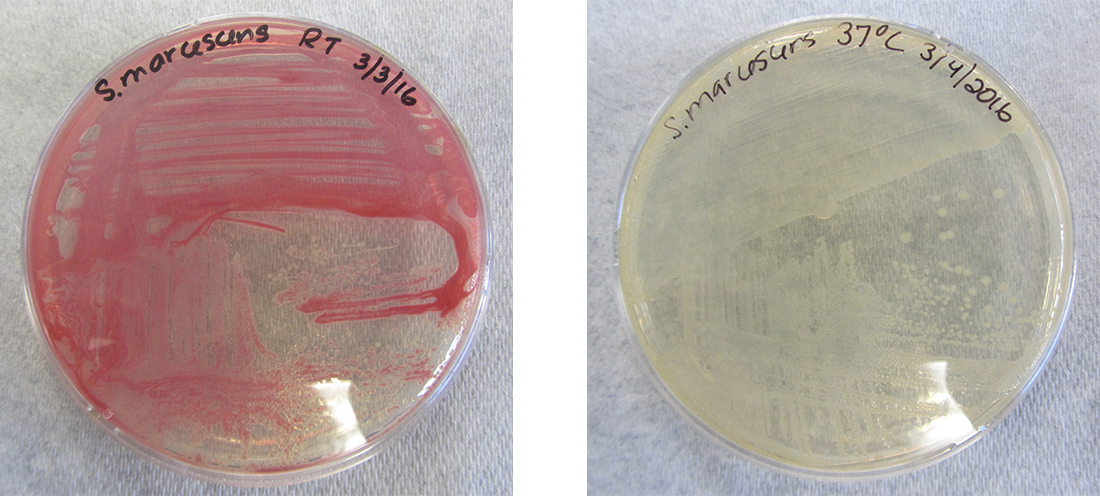
Bien que le génotype d'une cellule demeure constant, le phénotype peut changer en réponse à des signaux environnementaux (par exemple, des changements de température ou de disponibilité des nutriments) qui influent sur les gènes non constitutifs exprimés. Par exemple, la bactérie orale Streptococcus mutans produit une couche visqueuse collante qui lui permet d'adhérer aux dents, formant ainsi une plaque dentaire ; toutefois, les gènes qui contrôlent la production de la couche visqueuse ne s'expriment qu'en présence de saccharose (sucre de table). Ainsi, alors que le génotype de S. mutans est constant, son phénotype change en fonction de la présence et de l'absence de sucre dans son environnement. La température peut également réguler l'expression des gènes. Par exemple, la bactérie gram-négative Serratia marcescens, un pathogène fréquemment associé aux infections nosocomiales, produit un pigment rouge à 28 °C mais pas à 37 °C, la température interne normale du corps humain (Figure\(\PageIndex{1}\)).
Organisation du matériel génétique
La grande majorité du génome d'un organisme est organisée en chromosomes de la cellule, qui sont des structures d'ADN distinctes au sein des cellules qui contrôlent l'activité cellulaire. Rappelons que même si les chromosomes eucaryotes sont logés dans le noyau lié à la membrane, la plupart des procaryotes contiennent un seul chromosome circulaire qui se trouve dans une zone du cytoplasme appelée nucléoïde (voir Caractéristiques uniques des cellules procaryotes). Un chromosome peut contenir plusieurs milliers de gènes.
Organisation du chromosome eucaryote
La structure des chromosomes diffère quelque peu entre les cellules eucaryotes et procaryotes. Les chromosomes eucaryotes sont généralement linéaires et les cellules eucaryotes contiennent plusieurs chromosomes distincts. De nombreuses cellules eucaryotes contiennent deux copies de chaque chromosome et sont donc diploïdes.
La longueur d'un chromosome dépasse largement la longueur de la cellule, de sorte qu'un chromosome doit être emballé dans un très petit espace pour s'insérer dans la cellule. Par exemple, la longueur combinée de l'ensemble des 3 milliards de paires de bases 1 d'ADN du génome humain mesurerait environ 2 mètres s'ils étaient complètement étirés, et certains génomes eucaryotes sont beaucoup plus grands que le génome humain. Le superenroulement de l'ADN fait référence au processus par lequel l'ADN est tordu pour s'adapter à l'intérieur de la cellule. Le superenroulement peut produire de l'ADN soit sous l'enroulement (moins d'un tour d'hélice pour 10 paires de bases), soit recouvert (plus d'un tour pour 10 paires de bases) par rapport à son état normal de relaxation. Les protéines connues pour être impliquées dans le superenroulement incluent les topoisomérases ; ces enzymes aident à maintenir la structure des chromosomes surenroulés, empêchant ainsi le débordement de l'ADN lors de certains processus cellulaires tels que la réplication de l'ADN.
Lors du conditionnement de l'ADN, les protéines liant l'ADN appelées histones réalisent divers niveaux d'encapsulation de l'ADN et de fixation aux protéines d'échafaudage. La combinaison de l'ADN avec ces protéines attachées est appelée chromatine. Chez les eucaryotes, l'empaquetage de l'ADN par les histones peut être influencé par des facteurs environnementaux qui influent sur la présence de groupes méthyle sur certains nucléotides cytosiniques de l'ADN. L'influence des facteurs environnementaux sur l'emballage de l'ADN est appelée épigénétique. L'épigénétique est un autre mécanisme permettant de réguler l'expression des gènes sans modifier la séquence des nucléotides. Les changements épigénétiques peuvent être maintenus par de multiples cycles de division cellulaire et peuvent donc être héréditaires.
Regardez cette animation du centre d'apprentissage sur l'ADN pour en savoir plus sur l'emballage de l'ADN chez les eucaryotes.
Organisation des chromosomes procaryotes
Les chromosomes des bactéries et des archées sont généralement circulaires, et une cellule procaryote ne contient généralement qu'un seul chromosome au sein du nucléoïde. Comme le chromosome ne contient qu'une seule copie de chaque gène, les procaryotes sont haploïdes. Comme dans les cellules eucaryotes, le superenroulement de l'ADN est nécessaire pour que le génome s'insère dans la cellule procaryote. L'ADN du chromosome bactérien est organisé en plusieurs domaines superspiralés. Comme chez les eucaryotes, les topoisomérases sont impliquées dans le superenroulement de l'ADN. L'ADN gyrase est un type de topoisomérase, présent dans les bactéries et certaines archées, qui aide à prévenir le débordement de l'ADN. (Certains antibiotiques tuent les bactéries en ciblant l'ADN gyrase.) De plus, les protéines de type histone lient l'ADN et contribuent à l'encapsulation de l'ADN. D'autres protéines se lient à l'origine de la réplication, c'est-à-dire à l'emplacement du chromosome où commence la réplication de l'ADN. Comme les différentes régions de l'ADN sont conditionnées différemment, certaines régions de l'ADN chromosomique sont plus accessibles aux enzymes et peuvent donc être utilisées plus facilement comme modèles d'expression génique. Fait intéressant, il a été démontré que plusieurs bactéries, dont Helicobacter pylori et Shigella flexneri, induisent des modifications épigénétiques chez leurs hôtes lors de l'infection, entraînant un remodelage de la chromatine qui peut avoir des effets à long terme sur l'immunité de l'hôte. 2
Exercice\(\PageIndex{1}\)
- Quelle est la différence entre le génotype et le phénotype d'une cellule ?
- Comment s'insère l'ADN dans les cellules ?
ADN non codant
En plus des gènes, un génome contient également de nombreuses régions d'ADN non codantes qui ne codent pas pour des protéines ou des produits d'ARN stables. L'ADN non codant se trouve généralement dans des zones situées avant le début des séquences codantes des gènes ainsi que dans des régions intergéniques (c'est-à-dire des séquences d'ADN situées entre les gènes) (Figure\(\PageIndex{2}\)).
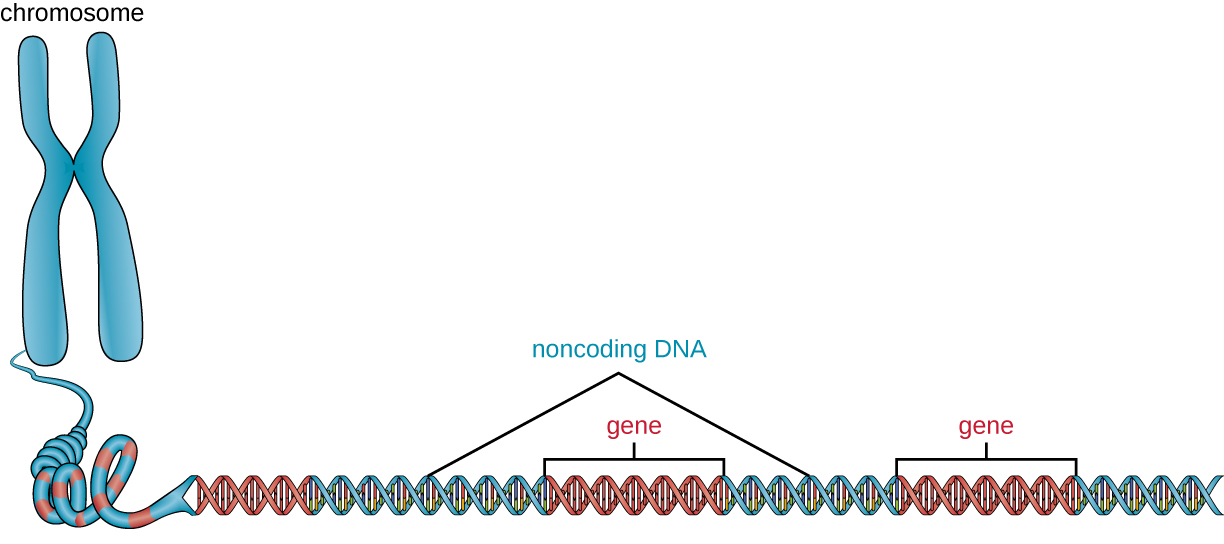
Les procaryotes semblent utiliser leur génome de manière très efficace, seuls 12 % du génome étant en moyenne occupés par des séquences non codantes. En revanche, l'ADN non codant peut représenter environ 98 % du génome chez les eucaryotes, comme chez l'homme, mais le pourcentage d'ADN non codant varie selon les espèces. 3 Ces régions d'ADN non codantes étaient autrefois appelées « ADN indésirable » ; cependant, cette terminologie n'est plus largement acceptée car les scientifiques ont depuis découvert des rôles pour certaines de ces régions, dont beaucoup contribuent à la régulation de la transcription ou de la traduction grâce à la production de molécules d'ARN non codantes, conditionnement de l'ADN et stabilité chromosomique. Bien que les scientifiques ne comprennent peut-être pas complètement le rôle de toutes les régions non codantes de l'ADN, on pense généralement qu'elles ont des objectifs au sein de la cellule.
Exercice\(\PageIndex{2}\)
Quel est le rôle de l'ADN non codant ?
ADN extrachromosomique
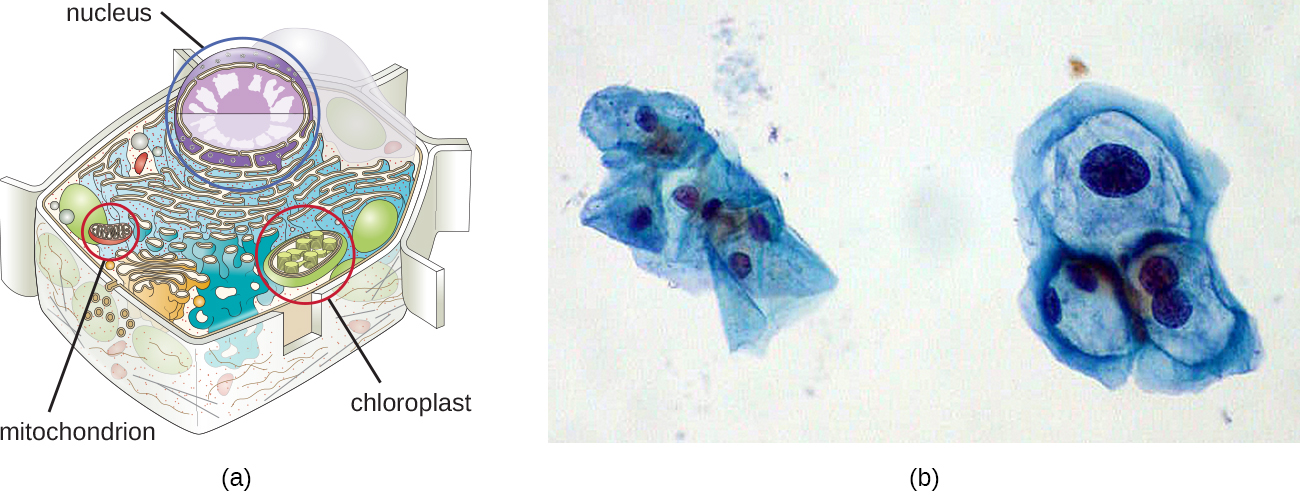
Bien que la majeure partie de l'ADN soit contenue dans les chromosomes d'une cellule, de nombreuses cellules contiennent des molécules d'ADN supplémentaires à l'extérieur des chromosomes, appelées ADN extrachromosomal, qui font également partie de leur génome. Les génomes des cellules eucaryotes incluraient également les chromosomes de tous les organites tels que les mitochondries et/ou les chloroplastes que ces cellules entretiennent (Figure\(\PageIndex{3}\)). Le maintien de chromosomes circulaires dans ces organites est un vestige de leurs origines procaryotes et soutient la théorie endosymbiotique (voir Fondements de la théorie cellulaire moderne). Dans certains cas, les génomes de certains virus à ADN peuvent également être conservés indépendamment dans les cellules hôtes lors d'une infection virale latente. Dans ces cas, ces virus constituent une autre forme d'ADN extrachromosomique. Par exemple, le virus du papillome humain (HPV) peut être maintenu dans les cellules infectées de cette manière.
Outre les chromosomes, certains procaryotes possèdent également de plus petites boucles d'ADN appelées plasmides qui peuvent contenir un ou quelques gènes non essentiels à une croissance normale (Figure 3.3.1). Les bactéries peuvent échanger ces plasmides avec d'autres bactéries dans le cadre d'un processus connu sous le nom de transfert horizontal de gènes (HGT). L'échange de matériel génétique sur des plasmides fournit parfois aux microbes de nouveaux gènes bénéfiques à la croissance et à la survie dans des conditions particulières. Dans certains cas, les gènes obtenus à partir de plasmides peuvent avoir des implications cliniques, codant pour des facteurs de virulence qui confèrent à un microbe la capacité de provoquer une maladie ou de le rendre résistant à certains antibiotiques. Les plasmides sont également largement utilisés en génie génétique et en biotechnologie pour déplacer des gènes d'une cellule à l'autre. Le rôle des plasmides dans le transfert horizontal de gènes et la biotechnologie sera discuté plus en détail dans Mécanismes de génétique microbienne et applications modernes de la génétique microbienne.
Exercice\(\PageIndex{3}\)
Comment les plasmides sont-ils impliqués dans la résistance aux antibiotiques ?
Plasmides létaux
Maria, une étudiante en anthropologie de 20 ans originaire du Texas, est récemment tombée malade au Botswana, pays africain, où elle menait des recherches dans le cadre d'un programme d'études à l'étranger. Les recherches de Maria se sont concentrées sur les méthodes traditionnelles africaines de tannage des peaux destinées à la production de cuir. Pendant trois semaines, elle s'est rendue quotidiennement dans une tannerie pendant plusieurs heures pour observer et participer au processus de tannage. Un jour, après son retour de la tannerie, Maria a développé de la fièvre, des frissons et des maux de tête, ainsi que des douleurs thoraciques, des douleurs musculaires, des nausées et d'autres symptômes pseudo-grippaux. Au début, elle n'était pas inquiète, mais lorsque sa fièvre a augmenté et qu'elle a commencé à cracher du sang, sa famille d'accueil africaine s'est alarmée et l'a emmenée d'urgence à l'hôpital, où son état a continué de s'aggraver.
Après avoir pris connaissance de ses récents travaux à la tannerie, le médecin a soupçonné Maria d'avoir été exposée à l'anthrax. Il lui a prescrit une radiographie pulmonaire, un échantillon de sang et une ponction lombaire, et a immédiatement commencé à lui administrer de la pénicilline par voie intraveineuse. Malheureusement, des analyses de laboratoire ont confirmé le diagnostic présomptif du médecin. La radiographie pulmonaire de Maria a révélé un épanchement pleural, une accumulation de liquide dans l'espace entre les membranes pleurales et une coloration de Gram sur son sang a révélé la présence de bactéries grampositives en forme de bâtonnets disposées en courtes chaînes, ce qui correspond à Bacillus anthracis. On a également constaté la présence de sang et de bactéries dans son liquide céphalorachidien, ce qui indique que l'infection avait évolué vers une méningite. Malgré un traitement de soutien et une antibiothérapie agressive, Maria est tombée dans un état d'inactivité et est décédée trois jours plus tard.
L'anthrax est une maladie causée par l'introduction dans l'organisme d'endospores provenant de la bactérie à Gram positif B. anthracis. Une fois infectés, les patients développent généralement une méningite, souvent fatale. Dans le cas de Maria, elle a inhalé les endospores tout en manipulant les peaux d'animaux infectés.
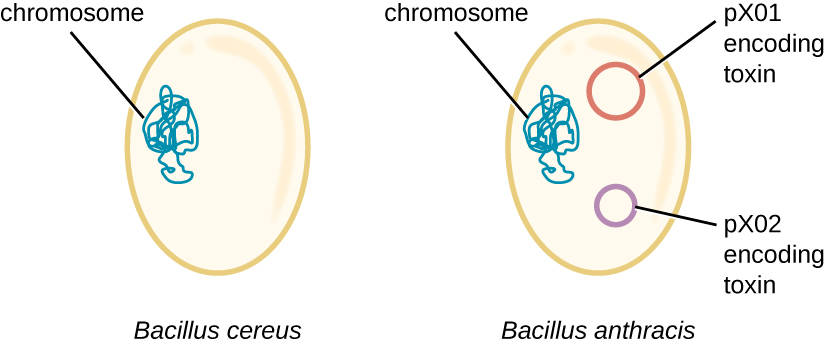
Le génome de B. anthracis montre comment de petites différences structurales peuvent entraîner des différences majeures de virulence. En 2003, les génomes de B. anthracis et de Bacillus cereus, une bactérie similaire mais moins pathogène du même genre, ont été séquencés et comparés. 4 Les chercheurs ont découvert que les séquences géniques de l'ARNr 16S de ces bactéries sont identiques à plus de 99 %, ce qui signifie qu'elles appartiennent en fait à la même espèce malgré leur classification traditionnelle en tant qu'espèces distinctes. Bien que leurs séquences chromosomiques aient également révélé une grande similitude, plusieurs facteurs de virulence de B. anthracis se sont révélés codés sur deux grands plasmides absents de B. cereus. Le plasmide pX01 code pour une toxine en trois parties qui supprime le système immunitaire de l'hôte, tandis que le plasmide pX02 code pour un polysaccharide capsulaire qui protège davantage la bactérie contre le système immunitaire de l'hôte (Figure\(\PageIndex{4}\)). Comme B. cereus ne possède pas ces plasmides, il ne produit pas ces facteurs de virulence et, bien qu'il soit toujours pathogène, il est généralement associé à des cas bénins de diarrhée dont l'organisme peut rapidement se remettre. Malheureusement pour Maria, la présence de ces plasmides codant pour des toxines chez B. anthracis lui confère sa virulence létale.
Exercice\(\PageIndex{4}\)
Selon vous, qu'adviendrait-il de la pathogénicité de B. anthracis s'il perdait l'un de ses plasmides ou les deux ?
Orientation clinique : résolution
En 24 heures, les résultats du test diagnostique de l'échantillon de selles d'Alex ont révélé la présence d'entérotoxine thermolabile (LT), d'entérotoxine thermostable (ST) et de facteur de colonisation (CF), confirmant ainsi les soupçons du médecin de l'hôpital concernant l'ETEC. Lors d'un suivi auprès du médecin de famille d'Alex, ce médecin a remarqué que les symptômes d'Alex ne disparaissaient pas rapidement et qu'il éprouvait une gêne qui l'empêchait de retourner aux cours. Le médecin de famille a prescrit à Alex une cure de ciprofloxacine pour atténuer ses symptômes. Heureusement, la ciprofloxacine a résolu les symptômes d'Alex en quelques jours.
Alex a probablement contracté son infection en ingérant des aliments ou de l'eau contaminés. Les pays industrialisés émergents tels que le Mexique continuent de développer des pratiques d'assainissement qui empêchent la contamination de l'eau par des matières fécales. Les voyageurs dans ces pays devraient éviter d'ingérer des aliments insuffisamment cuits, en particulier des viandes, des fruits de mer, des légumes et des produits laitiers non pasteurisés. Ils doivent également éviter d'utiliser de l'eau qui n'a pas été traitée, notamment de l'eau potable, des glaçons et même de l'eau utilisée pour se brosser les dents. L'utilisation d'eau en bouteille à ces fins est une bonne alternative. Une bonne hygiène (lavage des mains) peut également aider à prévenir une infection par ETEC. Alex n'avait pas fait attention à sa consommation de nourriture ou d'eau, ce qui a entraîné sa maladie.
Les symptômes d'Alex étaient très similaires à ceux du choléra, causé par la bactérie gram-négative Vibrio cholerae, qui produit également une toxine similaire à la ST et à la LT. À un moment donné de l'histoire évolutive de l'ETEC, une souche non pathogène d'E. coli similaire à celles que l'on trouve habituellement dans l'intestin pourrait avoir acquis les gènes codant pour les toxines ST et LT de V. cholerae. Le fait que les gènes codant ces toxines soient codés sur des plasmides extrachromosomaux dans l'ETEC confirme l'idée que ces gènes ont été acquis par E. coli et sont probablement maintenus dans des populations bactériennes par transfert horizontal de gènes.
Génomes viraux
Les génomes viraux présentent une grande diversité de structure. Certains virus possèdent un génome constitué d'ADN comme matériel génétique. Cet ADN peut être monocaténaire, comme le montrent les parvovirus humains, ou bicaténaire, comme c'est le cas pour les herpèsvirus et les poxvirus. De plus, bien que toute vie cellulaire utilise l'ADN comme matériel génétique, certains génomes viraux sont constitués de molécules d'ARN monocaténaires ou bicaténaires, comme nous l'avons vu. Les génomes viraux sont généralement plus petits que la plupart des génomes bactériens et ne codent que quelques gènes, car ils dépendent de leurs hôtes pour exécuter de nombreuses fonctions nécessaires à leur réplication. La diversité des structures du génome viral et leurs implications pour les cycles de vie de la réplication virale sont discutées plus en détail dans The Viral Life Cycle.
Exercice\(\PageIndex{5}\)
Pourquoi les génomes viraux varient-ils considérablement d'un virus à l'autre ?
La taille du génome
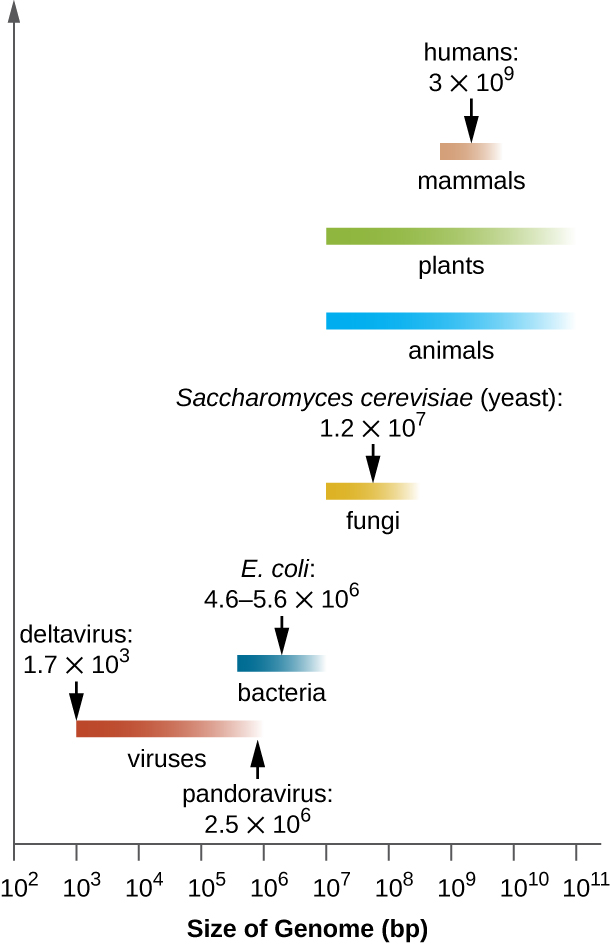
La taille des génomes varie considérablement d'un organisme à l'autre. La plupart des eucaryotes possèdent plusieurs chromosomes ; les humains, par exemple, en ont 23 paires, ce qui leur donne 46 chromosomes. Malgré sa taille de 3 milliards de paires de bases, le génome humain est loin d'être le plus gros génome. Les plantes possèdent souvent de très gros génomes, jusqu'à 150 milliards de paires de bases, et sont généralement polyploïdes, possédant de multiples copies de chaque chromosome.
La taille des génomes bactériens varie également considérablement, bien qu'ils aient tendance à être plus petits que les génomes eucaryotes (Figure\(\PageIndex{5}\)). Certains génomes bactériens peuvent ne compter que 112 000 paires de bases. Souvent, la taille du génome d'une bactérie est directement liée à la mesure dans laquelle la bactérie dépend de son hôte pour sa survie. Lorsqu'une bactérie dépend de la cellule hôte pour exécuter certaines fonctions, elle perd les gènes codant pour les capacités nécessaires à l'exécution de ces fonctions elle-même. Ces types d'endosymbiotes bactériens rappellent les origines procaryotes des mitochondries et des chloroplastes.
D'un point de vue clinique, les agents pathogènes intracellulaires obligatoires ont également tendance à avoir de petits génomes (environ 1 million de paires de bases). Comme les cellules hôtes fournissent la plupart de leurs nutriments, elles ont tendance à avoir un nombre réduit de gènes codant pour les fonctions métaboliques. En raison de leur petite taille, les génomes d'organismes tels que Mycoplasma genitalium (580 000 paires de bases), Chlamydia trachomatis (1 million), Rickettsia prowazekii (1,1 million) et Treponema pallidum (1,1 million) faisaient partie des premiers génomes bactériens séquencé. Respectivement, ces agents pathogènes provoquent une urétrite et une inflammation pelvienne, une chlamydia, un typhus et une syphilis.
Alors que les agents pathogènes intracellulaires obligatoires ont un génome anormalement petit, d'autres bactéries aux capacités métaboliques et enzymatiques très diverses possèdent des génomes bactériens exceptionnellement grands. Le Pseudomonas aeruginosa, par exemple, est une bactérie que l'on trouve couramment dans l'environnement et qui est capable de se développer sur un large éventail de substrats. Son génome contient 6,3 millions de paires de bases, ce qui lui confère une capacité métabolique élevée et la capacité de produire des facteurs de virulence responsables de plusieurs types d'infections opportunistes.
Il est intéressant de noter qu'il existe également une variabilité significative de la taille du génome des virus, allant de 3 500 paires de bases à 2,5 millions de paires de bases, dépassant de manière significative la taille de nombreux génomes bactériens. La grande variation observée dans la taille des génomes viraux contribue également à la grande diversité des caractéristiques du génome viral déjà discutées.
Visitez la base de données génomiques du National Center for Biotechnology Information (NCBI) pour voir les génomes qui ont été séquencés et leur taille.
Concepts clés et résumé
- L'ensemble du contenu génétique d'une cellule est son génome.
- Les gènes codent pour des protéines, ou des molécules d'ARN stables, chacune remplissant une fonction spécifique dans la cellule.
- Bien que le génotype d'une cellule demeure constant, l'expression des gènes dépend des conditions environnementales.
- Un phénotype est l'ensemble des caractéristiques observables d'une cellule (ou d'un organisme) à un moment donné et résulte du complément de gènes actuellement utilisés.
- La majeure partie du matériel génétique est organisée en chromosomes qui contiennent l'ADN qui contrôle les activités cellulaires.
- Les procaryotes sont généralement haploïdes et possèdent généralement un seul chromosome circulaire dans le nucléoïde. Les eucaryotes sont diploïdes ; l'ADN est organisé en plusieurs chromosomes linéaires présents dans le noyau.
- Le superenroulement et le conditionnement de l'ADN à l'aide de protéines liant l'ADN permettent à de longues molécules de s'insérer dans une cellule. Les eucaryotes et les archées utilisent des protéines histones, et les bactéries utilisent différentes protéines ayant des fonctions similaires.
- Les génomes procaryotes et eucaryotes contiennent tous deux de l'ADN non codant, dont la fonction n'est pas bien comprise. Certains ADN non codants semblent participer à la formation de petites molécules d'ARN non codantes qui influencent l'expression des gènes ; d'autres semblent jouer un rôle dans le maintien de la structure chromosomique et dans le conditionnement de l'ADN.
- L'ADN extrachromosomique des eucaryotes comprend les chromosomes présents dans les organites d'origine procaryote (mitochondries et chloroplastes) qui ont évolué par endosymbiose. Certains virus peuvent également se maintenir par voie extrachromosomique.
- L'ADN extrachromosomique des procaryotes est généralement conservé sous forme de plasmides codant pour quelques gènes non essentiels qui peuvent être utiles dans des conditions spécifiques. Les plasmides peuvent être transmis à travers une communauté bactérienne par transfert horizontal de gènes.
- Les génomes viraux présentent des variations importantes et peuvent être composés d'ARN ou d'ADN, et peuvent être bicaténaires ou monocaténaires.
Notes
- 1 Institut national de recherche sur le génome humain. « L'achèvement du projet sur le génome humain : questions fréquemment posées ». https://www.genome.gov/11006943. Consulté le 10 juin 2016
- 2 H. Bierne et coll. « Épigénétique et infections bactériennes. » Perspectives de Cold Spring Harbor en médecine 2 n° 12 (2012) :a010272.
- 3 R.J. Taft et coll. « La relation entre l'ADN ne codant pas pour les protéines et la complexité eucaryote. » Bioessais 29 no 3 (2007) :288—299.
- 4 N. Ivanova et coll. « Séquence génomique de Bacillus cereus et analyse comparative avec Bacillus anthracis. » Nature 423 n° 6935 (2003) :87—91.


