9.1 : Comment se développent les microbes
- Page ID
- 187938
Objectifs d'apprentissage
- Définissez la durée de génération pour la croissance sur la base de la fission binaire
- Identifier et décrire les activités des microorganismes subissant des phases typiques de fission binaire (division cellulaire simple) dans une courbe de croissance
- Expliquer plusieurs méthodes de laboratoire utilisées pour déterminer le nombre de cellules viables et totales dans les populations en croissance exponentielle
- Décrire des exemples de division cellulaire n'impliquant pas de fission binaire, comme le bourgeonnement ou la fragmentation
- Décrire la formation et les caractéristiques des biofilms
- Identifier les risques pour la santé associés aux biofilms et la manière dont ils sont traités
- Décrire la détection du quorum et son rôle dans la communication intercellulaire et la coordination des activités cellulaires
Orientation clinique : 1ère partie
Jeni, une femme enceinte de 24 ans qui en est à son deuxième trimestre de grossesse, se rend dans une clinique pour se plaindre d'une forte fièvre, de 38,9 °C (102 °F), de fatigue et de douleurs musculaires, signes et symptômes typiques de la grippe. Jeni fait de l'exercice régulièrement et suit un régime alimentaire nutritif mettant l'accent sur les aliments biologiques, y compris le lait cru qu'elle achète sur un marché fermier local. Toutes ses vaccinations sont à jour. Cependant, le professionnel de santé qui voit Jeni est inquiet et demande qu'un échantillon de sang soit envoyé pour analyse par le laboratoire de microbiologie.
Exercice\(\PageIndex{1}\)
Pourquoi le professionnel de santé s'inquiète-t-il des signes et symptômes de Jeni ?
Le cycle cellulaire bactérien implique la formation de nouvelles cellules par la réplication de l'ADN et la division des composants cellulaires en deux cellules filles. Chez les procaryotes, la reproduction est toujours asexuée, bien qu'une recombinaison génétique importante sous forme de transfert horizontal de gènes ait lieu, comme cela sera exploré dans un autre chapitre. La plupart des bactéries possèdent un seul chromosome circulaire, mais il existe quelques exceptions. Par exemple, Borrelia burgdorferi, l'agent causal de la maladie de Lyme, possède un chromosome linéaire.
Fission binaire
Le mécanisme le plus courant de réplication cellulaire chez les bactéries est un processus appelé fission binaire, qui est représenté dans la Figure\(\PageIndex{1}\) :. Avant de se diviser, la cellule se développe et augmente son nombre de composants cellulaires. Ensuite, la réplication de l'ADN commence à un endroit du chromosome circulaire appelé origine de la réplication, où le chromosome est attaché à la membrane cellulaire interne. La réplication se poursuit dans des directions opposées le long du chromosome jusqu'à ce que l'extrémité soit atteinte.
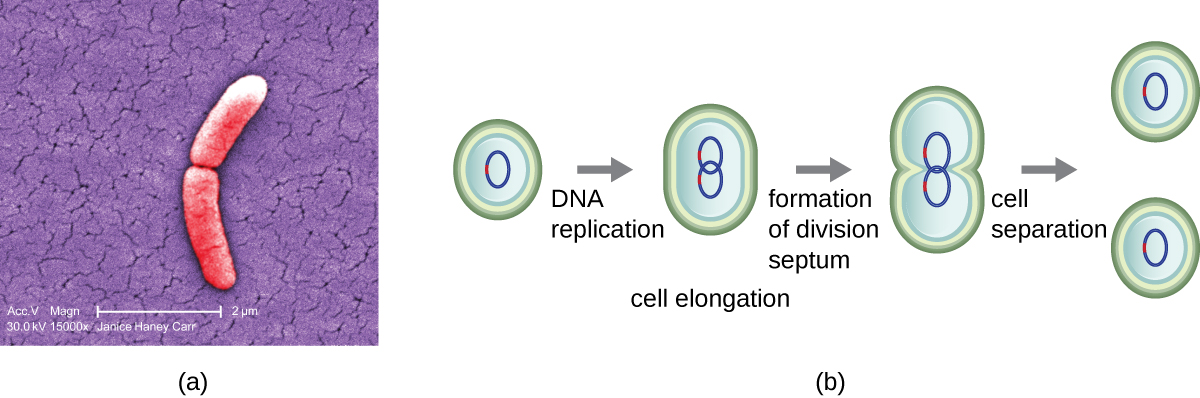
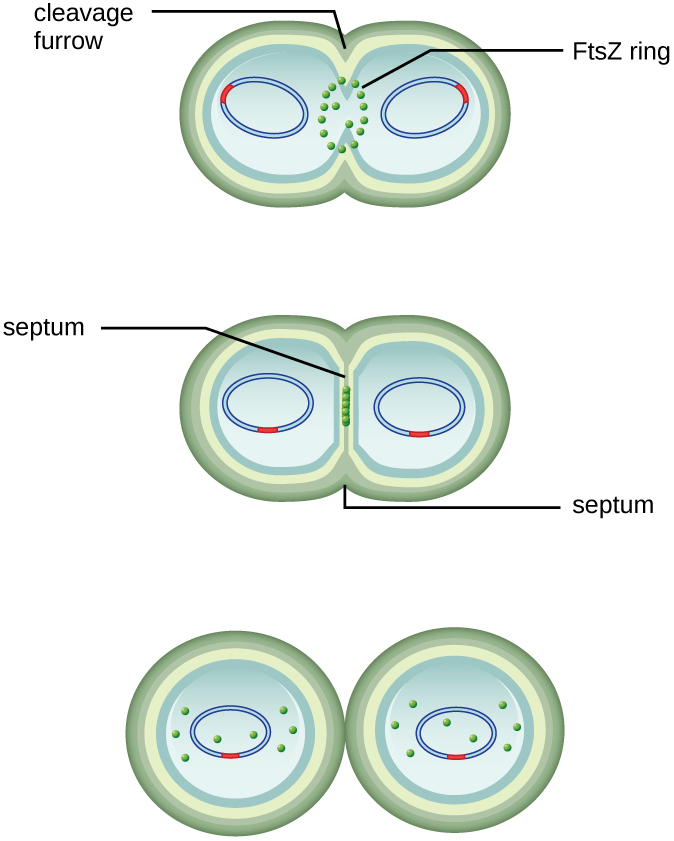
Le centre de la cellule agrandie se resserre jusqu'à la formation de deux cellules filles, chaque progéniture recevant une copie complète du génome parental et une division du cytoplasme (cytokinèse). Ce processus de cytokinèse et de division cellulaire est dirigé par une protéine appelée fTSz. Le fTSz s'assemble en un anneau Z sur la membrane cytoplasmique (Figure\(\PageIndex{2}\)). L'anneau Z est ancré par des protéines liant le FTSZ et définit le plan de division entre les deux cellules filles. Des protéines supplémentaires nécessaires à la division cellulaire sont ajoutées au cycle Z pour former une structure appelée divisome. Le divisome s'active pour produire une paroi cellulaire de peptidoglycane et construire un septum qui divise les deux cellules filles. Les cellules filles sont séparées par le septum de division, où toutes les couches externes des cellules (la paroi cellulaire et les membranes externes, le cas échéant) doivent être remodelées pour terminer la division. Par exemple, nous savons que des enzymes spécifiques rompent les liaisons entre les monomères des peptidoglycanes et permettent l'ajout de nouvelles sous-unités le long du septum de division.
Exercice\(\PageIndex{2}\)
Quel est le nom de la protéine qui s'assemble en anneau Z pour initier la cytokinèse et la division cellulaire ?
Durée d'une génération
Chez les organismes eucaryotes, la durée d'une génération est le temps entre les mêmes points du cycle de vie de deux générations successives. Par exemple, la durée d'une génération typique pour la population humaine est de 25 ans. Cette définition n'est pas pratique pour les bactéries, qui peuvent se reproduire rapidement ou rester dormantes pendant des milliers d'années. Chez les procaryotes (bactéries et archées), la durée d'une génération est également appelée temps de doublement et est définie comme le temps nécessaire pour que la population double au cours d'une série de fission binaire. Les temps de doublement des bactéries varient énormément. Alors qu'Escherichia coli peut doubler en à peine 20 minutes dans des conditions de croissance optimales en laboratoire, les bactéries de la même espèce peuvent avoir besoin de plusieurs jours pour doubler dans des environnements particulièrement difficiles. La plupart des agents pathogènes se développent rapidement, comme E. coli, mais il existe des exceptions. Par exemple, Mycobacterium tuberculosis, l'agent causal de la tuberculose, a une durée de génération comprise entre 15 et 20 heures. En revanche, M. leprae, responsable de la maladie de Hansen (lèpre), se développe beaucoup plus lentement, avec un temps de doublement de 14 jours.
Calcul du nombre de cellules
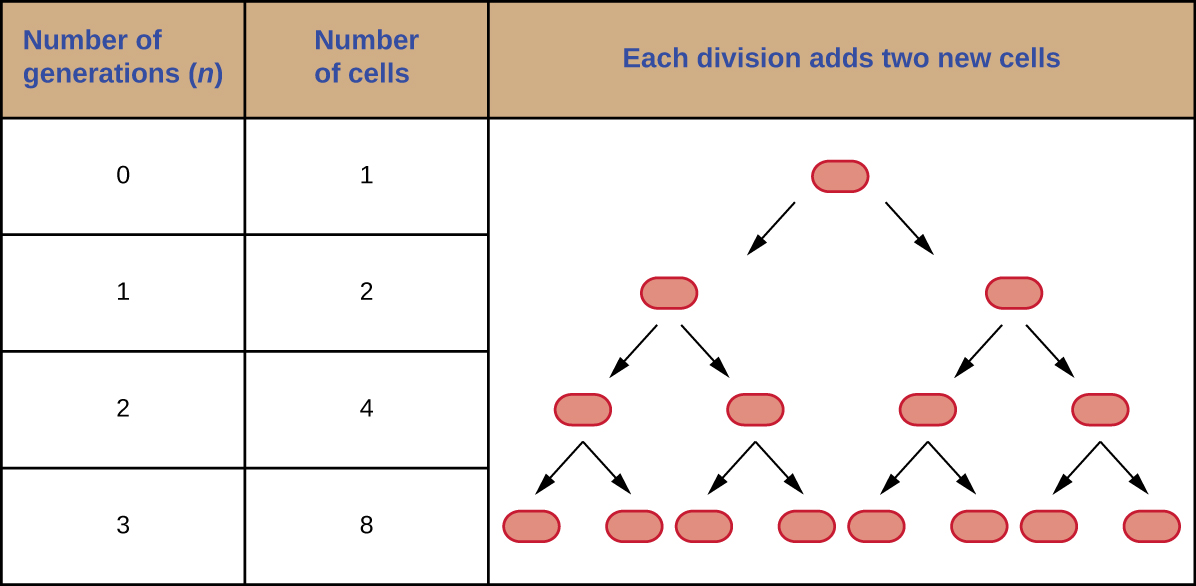
Il est possible de prédire le nombre de cellules d'une population lorsqu'elles se divisent par fission binaire à vitesse constante. Par exemple, imaginez ce qui se passe si une cellule se divise toutes les 30 minutes pendant 24 heures. Le diagramme de la figure\(\PageIndex{3}\) montre l'augmentation du nombre de cellules au cours des trois premières générations.
Le nombre de cellules augmente de façon exponentielle et peut être exprimé par 2 n, où n est le nombre de générations. Si les cellules se divisent toutes les 30 minutes, 48 divisions auraient eu lieu après 24 heures. Si nous appliquons la formule 2 n, où n est égal à 48, la cellule unique donnera naissance à 2 48 ou 281 474 976 710 656 cellules en 48 générations (24 heures). Lorsqu'il s'agit de nombres aussi énormes, il est plus pratique d'utiliser la notation scientifique. Par conséquent, nous exprimons le nombre de cellules comme 2,8 × 10 14 cellules.
Dans notre exemple, nous avons utilisé une cellule comme nombre initial de cellules. Pour un nombre quelconque de cellules de départ, la formule est adaptée comme suit :
\[N_n = N_02^n\]
N n est le nombre de cellules de n'importe quelle génération n, N 0 est le nombre initial de cellules et n est le nombre de générations.
Exercice\(\PageIndex{3}\)
Avec un temps de doublement de 30 minutes et une taille de population initiale de 1 × 10 5 cellules, combien de cellules seront présentes après 2 heures, en supposant qu'il n'y aura pas de mort cellulaire ?
La courbe de croissance
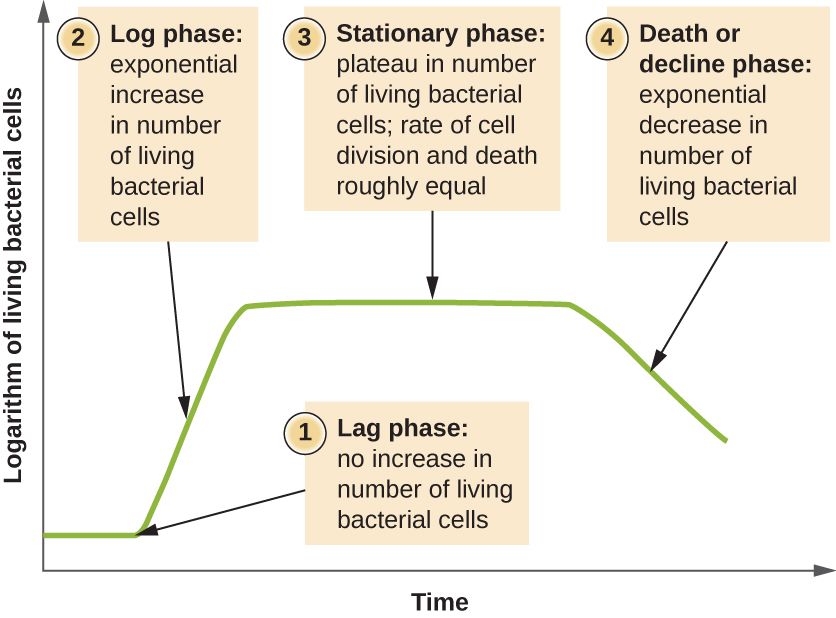
Les microorganismes cultivés en culture fermée (également appelée culture discontinue), dans laquelle aucun élément nutritif n'est ajouté et où la plupart des déchets ne sont pas éliminés, suivent un schéma de croissance reproductible appelé courbe de croissance. Un exemple de culture par lots dans la nature est un étang dans lequel un petit nombre de cellules se développent dans un environnement fermé. La densité de culture est définie comme le nombre de cellules par unité de volume. Dans un environnement fermé, la densité de culture est également une mesure du nombre de cellules dans la population. Les infections du corps ne suivent pas toujours la courbe de croissance, mais des corrélations peuvent exister selon le site et le type d'infection. Lorsque le nombre de cellules vivantes est tracé en fonction du temps, des phases distinctes peuvent être observées sur la courbe (Figure\(\PageIndex{4}\)).
La phase de latence
Le début de la courbe de croissance représente un petit nombre de cellules, appelées inoculum, qui sont ajoutées à un milieu de culture frais, un bouillon nutritionnel qui favorise la croissance. La phase initiale de la courbe de croissance est appelée phase de latence, au cours de laquelle les cellules se préparent pour la phase de croissance suivante. Le nombre de cellules ne change pas pendant la phase de latence ; toutefois, les cellules grossissent et sont métaboliquement actives, synthétisant les protéines nécessaires à leur croissance dans le milieu. Si des cellules ont été endommagées ou ont subi un choc pendant le transfert vers le nouveau support, la réparation a lieu pendant la phase de latence. La durée de la phase de latence est déterminée par de nombreux facteurs, notamment l'espèce et la constitution génétique des cellules, la composition du milieu et la taille de l'inoculum original.
La phase de journalisation
Dans la phase de croissance logarithmique (log), parfois appelée phase de croissance exponentielle, les cellules se divisent activement par fission binaire et leur nombre augmente de façon exponentielle. Pour toute espèce bactérienne donnée, la durée d'une génération dans des conditions de croissance spécifiques (nutriments, température, pH, etc.) est déterminée génétiquement, et cette durée de génération est appelée taux de croissance intrinsèque. Pendant la phase logarithmique, la relation entre le temps et le nombre de cellules n'est pas linéaire mais exponentielle ; cependant, la courbe de croissance est souvent tracée sur un graphique semi-logarithmique, comme le montre la figure\(\PageIndex{5}\), qui donne l'apparence d'une relation linéaire.
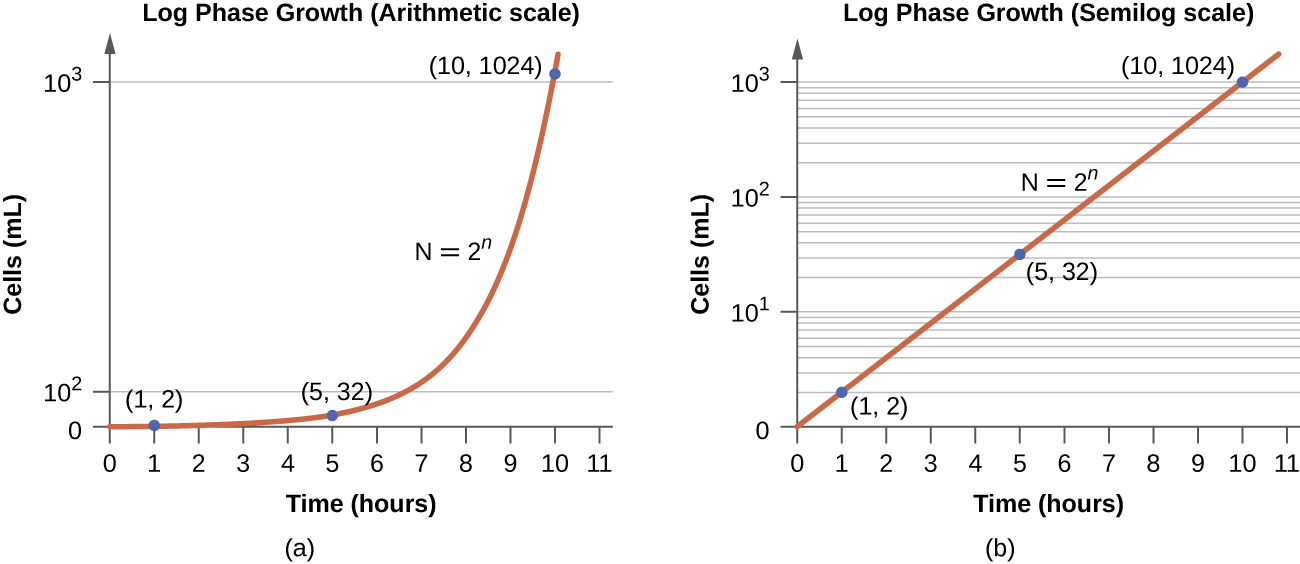
Les cellules en phase logarithmique présentent un taux de croissance constant et une activité métabolique uniforme. Pour cette raison, les cellules en phase logarithmique sont utilisées de préférence pour des applications industrielles et des travaux de recherche. La phase logarithmique est également le stade où les bactéries sont les plus sensibles à l'action des désinfectants et des antibiotiques courants qui affectent la synthèse des protéines, de l'ADN et des parois cellulaires.
Phase stationnaire
À mesure que le nombre de cellules augmente au cours de la phase logarithmique, plusieurs facteurs contribuent au ralentissement du taux de croissance. Les déchets s'accumulent et les nutriments sont progressivement épuisés. De plus, l'épuisement progressif de l'oxygène commence à limiter la croissance des cellules aérobies. Cette combinaison de conditions défavorables ralentit et finit par bloquer la croissance démographique. Le nombre total de cellules vivantes atteint un plateau appelé phase stationnaire (Figure\(\PageIndex{4}\)). Dans cette phase, le nombre de nouvelles cellules créées par division cellulaire est désormais équivalent au nombre de cellules mourantes ; ainsi, la population totale de cellules vivantes est relativement stagnante. La densité de culture dans une culture stationnaire est constante. La capacité de charge de la culture, ou densité de culture maximale, dépend des types de microorganismes présents dans la culture et des conditions spécifiques de la culture ; toutefois, la capacité de charge est constante pour un organisme donné cultivé dans les mêmes conditions.
Pendant la phase stationnaire, les cellules passent à un mode métabolique de survie. À mesure que la croissance ralentit, la synthèse de peptidoglycanes, de protéines et d'acides nucléiques diminue également ; les cultures stationnaires sont donc moins sensibles aux antibiotiques qui perturbent ces processus. Chez les bactéries capables de produire des endospores, de nombreuses cellules sont sporulées pendant la phase stationnaire. Les métabolites secondaires, y compris les antibiotiques, sont synthétisés en phase stationnaire. Chez certaines bactéries pathogènes, la phase stationnaire est également associée à l'expression de facteurs de virulence, des produits qui contribuent à la capacité d'un microbe à survivre, à se reproduire et à provoquer des maladies dans un organisme hôte. Par exemple, la détection du quorum chez Staphylococcus aureus déclenche la production d'enzymes capables de décomposer les tissus humains et les débris cellulaires, ouvrant ainsi la voie à la propagation des bactéries vers de nouveaux tissus où les nutriments sont plus abondants.
La phase de la mort
Au fur et à mesure qu'un milieu de culture accumule des déchets toxiques et que les nutriments sont épuisés, les cellules meurent de plus en plus nombreuses. Bientôt, le nombre de cellules mourantes dépasse le nombre de cellules en division, ce qui entraîne une diminution exponentielle du nombre de cellules (Figure\(\PageIndex{4}\)). Il s'agit de la phase de mort bien nommée, parfois appelée phase de déclin. De nombreuses cellules se lysent et libèrent des nutriments dans le milieu, ce qui permet aux cellules survivantes de maintenir leur viabilité et de former des endospores. Quelques cellules, appelées cellules persistantes, se caractérisent par un métabolisme lent. Les cellules persistantes sont importantes sur le plan médical car elles sont associées à certaines infections chroniques, comme la tuberculose, qui ne répondent pas aux traitements antibiotiques.
Soutenir la croissance microbi
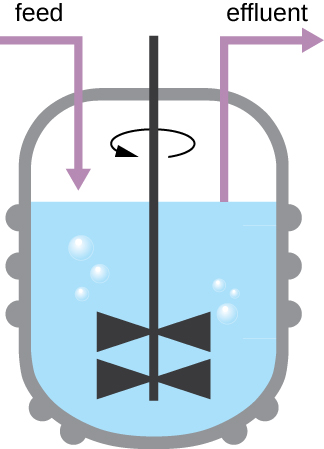
Le schéma de croissance illustré à la figure\(\PageIndex{4}\) a lieu dans un environnement fermé ; aucun élément nutritif n'est ajouté et les déchets et les cellules mortes ne sont pas éliminés. Dans de nombreux cas, cependant, il est avantageux de maintenir les cellules dans la phase logarithmique de croissance. Les industries qui récoltent des produits microbiens en sont un exemple. Un chimiostat (Figure\(\PageIndex{6}\)) est utilisé pour maintenir une culture continue dans laquelle les nutriments sont fournis à un rythme constant. Une quantité contrôlée d'air est mélangée pour les processus aérobies. La suspension bactérienne est éliminée au même rythme que les nutriments y pénètrent afin de maintenir un environnement de croissance optimal.
Exercice\(\PageIndex{4}\)
- Au cours de quelle phase la croissance se produit-elle le plus rapidement ?
- Nommez deux facteurs qui limitent la croissance microbienne.
Mesure de la croissance bactérienne
L'estimation du nombre de cellules bactériennes dans un échantillon, connue sous le nom de numération bactérienne, est une tâche courante des microbiologistes. Le nombre de bactéries présentes dans un échantillon clinique indique l'étendue d'une infection. Le contrôle de la qualité de l'eau potable, des aliments, des médicaments et même des cosmétiques repose sur des estimations du nombre de bactéries afin de détecter la contamination et de prévenir la propagation de maladies. Deux approches principales sont utilisées pour mesurer le nombre de cellules. Les méthodes directes impliquent le comptage des cellules, tandis que les méthodes indirectes dépendent de la mesure de la présence ou de l'activité des cellules sans réellement compter les cellules individuelles. Les méthodes directes et indirectes présentent des avantages et des inconvénients pour des applications spécifiques.
Nombre direct de cellules
Le comptage cellulaire direct fait référence au comptage des cellules d'une culture liquide ou des colonies sur une plaque. Il s'agit d'un moyen direct d'estimer le nombre d'organismes présents dans un échantillon. Examinons d'abord une méthode simple et rapide qui ne nécessite qu'une lame spécialisée et un microscope composé.
La méthode la plus simple pour dénombrer les bactéries est la numération cellulaire directe au microscope, qui consiste à transférer un volume connu d'une culture sur une lame étalonnée et à compter les cellules au microscope optique. La lame étalonnée est appelée chambre de Petroff-Hausser (Figure\(\PageIndex{7}\)) et ressemble à un hémocytomètre utilisé pour compter les globules rouges. La zone centrale de la chambre de comptage est gravée en carrés de différentes tailles. Un échantillon de la suspension de culture est ajouté à la chambre sous une lamelle placée à une hauteur spécifique par rapport à la surface de la grille. Il est possible d'estimer la concentration de cellules dans l'échantillon initial en comptant les cellules individuelles dans un certain nombre de carrés et en déterminant le volume de l'échantillon observé. La surface des carrés et la hauteur à laquelle le couvercle est positionné sont spécifiées pour la chambre. La concentration doit être corrigée pour tenir compte de la dilution si l'échantillon a été dilué avant le dénombrement.
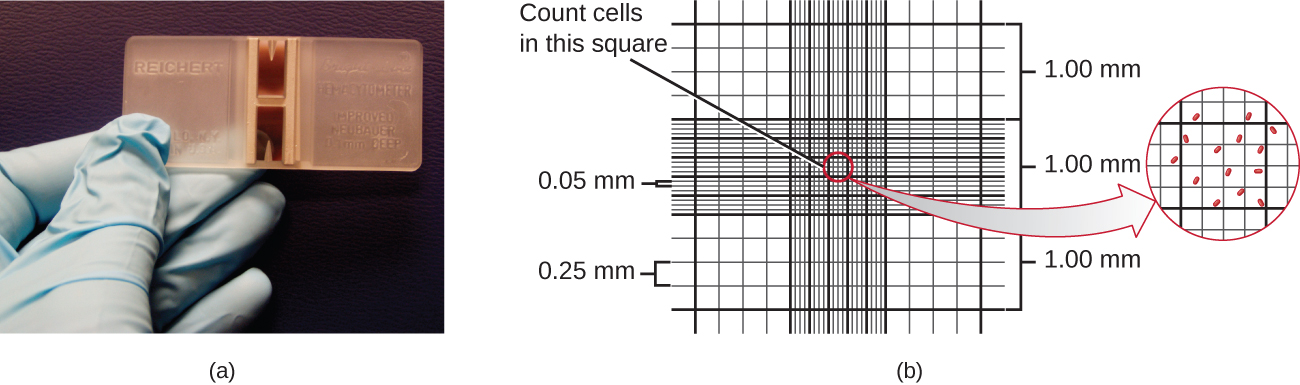
Les cellules de plusieurs petits carrés doivent être comptées et la moyenne doit être prise pour obtenir une mesure fiable. Les avantages de la chambre sont que le procédé est facile à utiliser, relativement rapide et peu coûteux. En revanche, la chambre de comptage ne fonctionne pas bien avec les cultures diluées, car il se peut qu'il n'y ait pas assez de cellules pour les dénombrer.
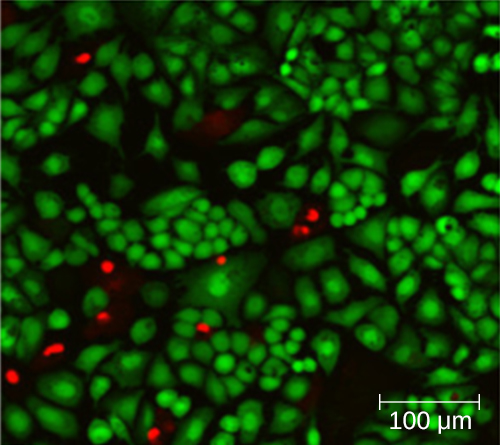
L'utilisation d'une chambre de comptage ne permet pas nécessairement de compter avec précision le nombre de cellules vivantes, car il n'est pas toujours possible de faire la distinction entre les cellules vivantes, les cellules mortes et les débris de même taille au microscope. Cependant, les nouvelles techniques de coloration par fluorescence permettent de distinguer les bactéries viables des bactéries mortes. Ces colorants de viabilité (ou colorants vivants) se lient aux acides nucléiques, mais les colorants primaires et secondaires diffèrent quant à leur capacité à traverser la membrane cytoplasmique. La coloration primaire, qui émet une lumière verte, peut pénétrer les membranes cytoplasmiques intactes et colorer à la fois les cellules vivantes et mortes. La coloration secondaire, qui émet une fluorescence en rouge, ne peut colorer une cellule que si la membrane cytoplasmique est considérablement endommagée. Ainsi, les cellules vivantes émettent une fluorescence verte parce qu'elles n'absorbent que la tache verte, tandis que les cellules mortes apparaissent rouges parce que la tache rouge déplace la tache verte sur leurs acides nucléiques (Figure\(\PageIndex{8}\)).
Une autre technique utilise un dispositif électronique de comptage des cellules (compteur Coulter) pour détecter et compter les variations de résistance électrique dans une solution saline. Un tube de verre avec une petite ouverture est immergé dans une solution électrolytique. Une première électrode est suspendue dans le tube de verre. Une seconde électrode est située à l'extérieur du tube. Lorsque les cellules sont aspirées à travers la petite ouverture du tube de verre, elles modifient brièvement la résistance mesurée entre les deux électrodes et le changement est enregistré par un capteur électronique (Figure\(\PageIndex{9}\)) ; chaque changement de résistance représente une cellule. La méthode est rapide et précise dans une gamme de concentrations ; toutefois, si la culture est trop concentrée, plus d'une cellule peut traverser l'ouverture à tout moment et fausser les résultats. Cette méthode ne permet pas non plus de différencier les cellules vivantes des cellules mortes.
Les dénombrements directs fournissent une estimation du nombre total de cellules dans un échantillon. Cependant, dans de nombreuses situations, il est important de connaître le nombre de cellules vivantes ou viables. Le dénombrement des cellules vivantes est nécessaire pour évaluer l'étendue d'une infection, l'efficacité des composés antimicrobiens et des médicaments, ou la contamination des aliments et de l'eau.
Exercice\(\PageIndex{5}\)
- Pourquoi compteriez-vous le nombre de cellules sur plus d'un carré dans la chambre de Petroff-Hausser pour estimer le nombre de cellules ?
- Dans la méthode de coloration de viabilité, pourquoi les cellules mortes apparaissent-elles en rouge ?
Nombre de plaques
Le nombre de plaques viables, ou simplement le nombre de plaques, est le nombre de cellules viables ou vivantes. Il repose sur le principe selon lequel les cellules viables se répliquent et donnent naissance à des colonies visibles lorsqu'elles sont incubées dans des conditions adaptées à l'échantillon. Les résultats sont généralement exprimés en unités formant des colonies par millilitre (UFC/ml) plutôt que sous forme de cellules par millilitre, car plusieurs cellules peuvent avoir atterri au même endroit pour donner naissance à une seule colonie. De plus, les échantillons de bactéries qui se développent en grappes ou en chaînes sont difficiles à disperser et une seule colonie peut représenter plusieurs cellules. Certaines cellules sont décrites comme viables mais non cultivables et ne formeront pas de colonies sur des milieux solides. Pour toutes ces raisons, le nombre de plaques viables est considéré comme une faible estimation du nombre réel de cellules vivantes. Ces limites n'enlèvent rien à l'utilité de la méthode, qui fournit des estimations du nombre de bactéries vivantes.
Les microbiologistes comptent généralement des plaques de 30 à 300 colonies. Les échantillons contenant trop peu de colonies (300 <30) do not give statistically reliable numbers, and overcrowded plates (> colonies) rendent difficile le dénombrement précis des colonies individuelles. De plus, les dénombrements dans cette fourchette minimisent la présence de plus d'une cellule bactérienne formant une seule colonie. Ainsi, le CFU calculé est plus proche du nombre réel de bactéries vivantes dans la population.
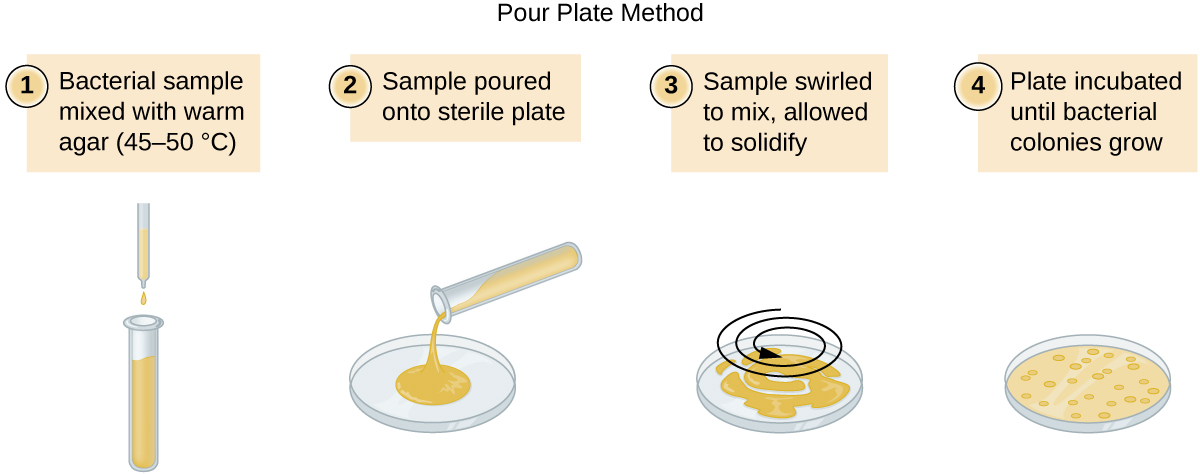
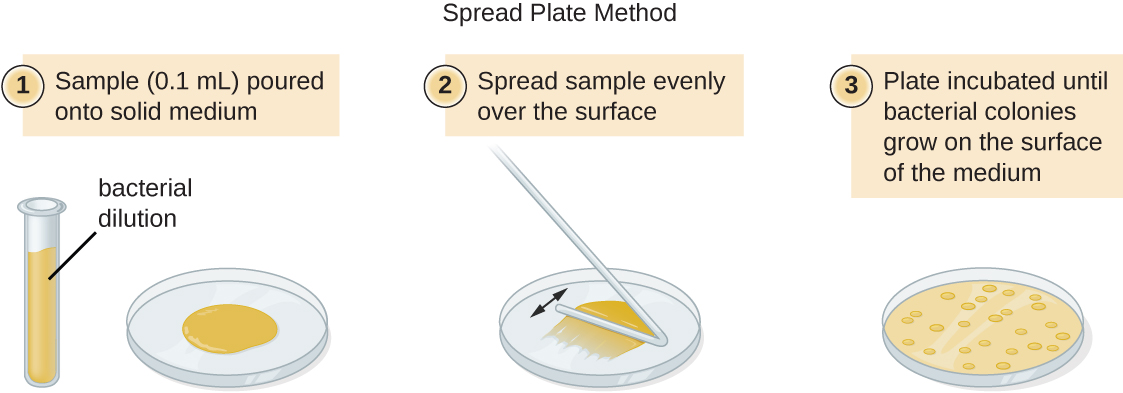
Il existe deux approches courantes pour inoculer les plaques pour les dénombrements viables : la méthode sur plaque verseuse et la méthode sur plaque étalée. Bien que la procédure finale d'inoculation diffère entre ces deux méthodes, elles commencent toutes deux par une dilution en série de la culture.
Dilution en série
La dilution en série d'une culture est une première étape importante avant de passer à la méthode sur plaque verseuse ou sur plaque à étaler. L'objectif du processus de dilution en série est d'obtenir des plaques contenant des CFU compris entre 30 et 300, et le processus implique généralement plusieurs dilutions par multiples de 10 pour simplifier le calcul. Le nombre de dilutions en série est choisi en fonction d'une estimation préliminaire de la densité de culture. La figure\(\PageIndex{10}\) illustre la méthode de dilution en série.
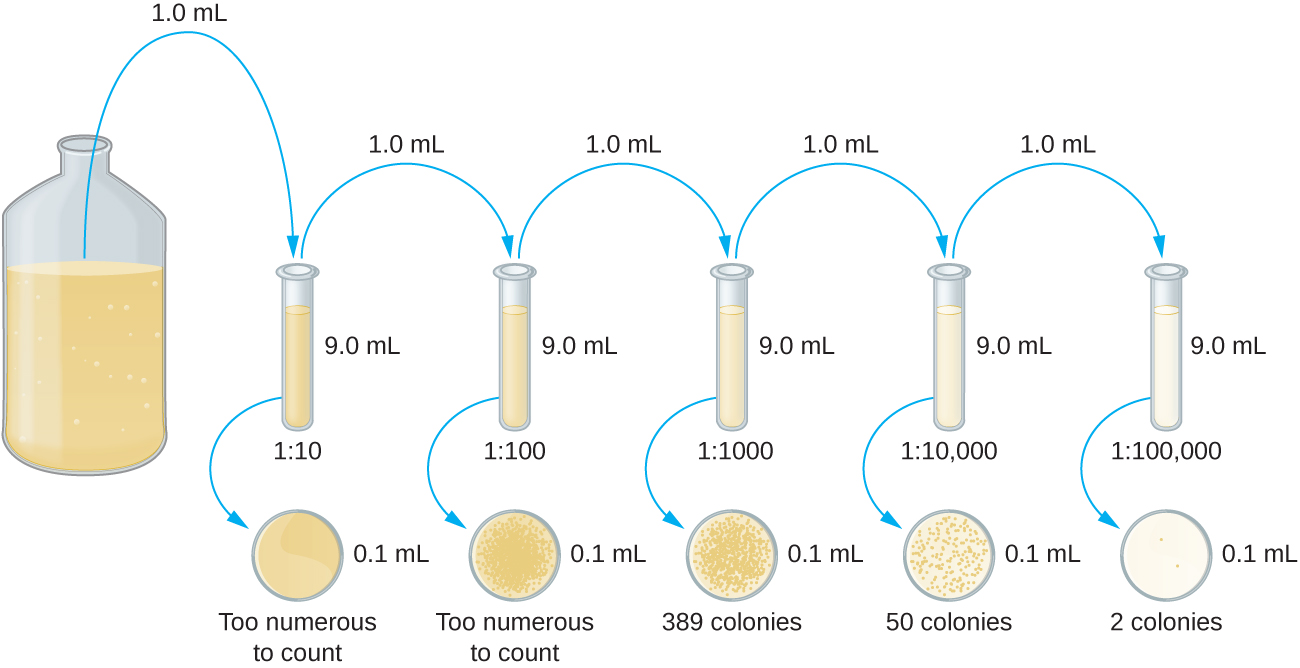
Un volume fixe de la culture initiale, 1,0 ml, est ajouté à la solution du premier tube de dilution, qui contient 9,0 ml de bouillon stérile, et mélangé à celle-ci. Cette étape représente un facteur de dilution de 10, soit 1:10, par rapport à la culture d'origine. De cette première dilution, le même volume, 1,0 ml, est prélevé et mélangé à un tube neuf de 9,0 ml de solution de dilution. Le facteur de dilution est désormais de 1:100 par rapport à la culture d'origine. Ce processus se poursuit jusqu'à ce qu'une série de dilutions soit produite pour fixer la concentration cellulaire souhaitée pour un comptage précis. À partir de chaque tube, un échantillon est plaqué sur un milieu solide en utilisant soit la méthode du plateau verseur (Figure\(\PageIndex{11}\)), soit la méthode de la plaque étalée (Figure\(\PageIndex{12}\)). Les plaques sont incubées jusqu'à l'apparition de colonies. Deux à trois plaques sont généralement préparées à partir de chaque dilution et le nombre de colonies comptées sur chaque plaque est calculé en moyenne. Dans tous les cas, il est essentiel de bien mélanger les échantillons avec le milieu de dilution (afin de garantir que la distribution des cellules dans le tube est aléatoire) pour obtenir des résultats fiables.
Le facteur de dilution est utilisé pour calculer le nombre de cellules dans la culture cellulaire d'origine. Dans notre exemple, 50 colonies en moyenne ont été dénombrées sur les plaques obtenues à partir de la dilution au 1:10 000. Comme seulement 0,1 ml de suspension a été pipetté sur la plaque, le multiplicateur requis pour reconstituer la concentration initiale est de 10 × 10 000. Le nombre de CFU par ml est égal à 50 × 100 × 10 000 = 5 000 000. Le nombre de bactéries présentes dans la culture est estimé à 5 millions de cellules/ml. Le nombre de colonies obtenu à partir de la dilution de 1:1000 était de 389, bien en deçà des 500 attendus pour une différence de 10 fois dans les dilutions. Cela met en évidence le problème d'imprécision lorsque le nombre de colonies est supérieur à 300 et que plus d'une cellule bactérienne se développe en une seule colonie.
Un échantillon très dilué (eau potable, par exemple) peut ne pas contenir suffisamment d'organismes pour utiliser l'une ou l'autre des méthodes de comptage sur plaques décrites. Dans de tels cas, l'échantillon d'origine doit être concentré plutôt que dilué avant le placage. Cela peut être réalisé en utilisant une modification de la technique de comptage des plaques appelée technique de filtration sur membrane. Les volumes connus sont filtrés sous vide de manière aseptique à travers une membrane dont la taille des pores est suffisamment petite pour piéger les microorganismes. La membrane est transférée sur une plaque de Petri contenant un milieu de croissance approprié. Les colonies sont dénombrées après incubation. Le calcul de la densité cellulaire est effectué en divisant le nombre de cellules par le volume de liquide filtré.
Regardez cette vidéo pour des démonstrations de dilutions en série et de techniques d'étalement de plaques.
Le nombre le plus probable
Le nombre de microorganismes dans les échantillons dilués est généralement trop faible pour être détecté par les méthodes de comptage sur plaques décrites jusqu'à présent. Pour ces échantillons, les microbiologistes utilisent régulièrement la méthode du nombre le plus probable (MPN), une procédure statistique permettant d'estimer le nombre de microorganismes viables dans un échantillon. Souvent utilisée pour les échantillons d'eau et d'aliments, la méthode MPN évalue la croissance détectable en observant les changements de turbidité ou de couleur dus à l'activité métabolique.
Une application typique de la méthode MPN est l'estimation du nombre de coliformes dans un échantillon d'eau de bassin. Les coliformes sont des bactéries gram-négatives qui fermentent le lactose. La présence de coliformes dans l'eau est considérée comme un signe de contamination par des matières fécales. Pour la méthode illustrée à la figure\(\PageIndex{13}\), une série de trois dilutions de l'échantillon d'eau est testée en inoculant cinq tubes de bouillon de lactose avec 10 ml d'échantillon, cinq tubes de bouillon de lactose avec 1 ml d'échantillon et cinq tubes de bouillon de lactose avec 0,1 ml d'échantillon. Les tubes du bouillon de lactose contiennent un indicateur de pH qui passe du rouge au jaune lorsque le lactose est fermenté. Après inoculation et incubation, les tubes sont examinés pour déterminer la croissance des coliformes par un changement de couleur du milieu passant du rouge au jaune. La première série de tubes (échantillon de 10 ml) a montré une croissance dans tous les tubes ; la deuxième série de tubes (1 ml) a montré une croissance dans deux tubes sur cinq ; dans la troisième série de tubes, aucune croissance n'a été observée dans aucun des tubes (dilution de 0,1 ml). Les nombres 5, 2 et 0 sont comparés à la figure B1 de l'annexe B, qui a été construite à l'aide d'un modèle de probabilité de la procédure d'échantillonnage. D'après notre lecture du tableau, nous concluons que 49 est le nombre le plus probable de bactéries pour 100 ml d'eau de bassin.
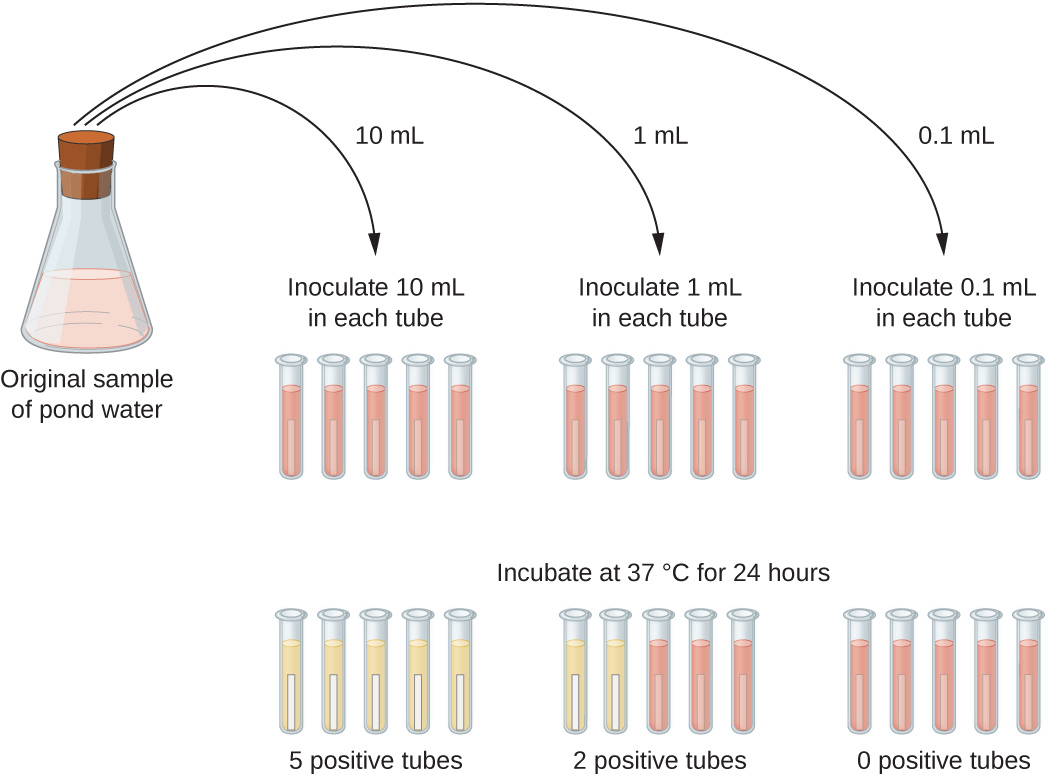
Exercice\(\PageIndex{6}\)
- Qu'est-ce qu'une unité formant une colonie ?
- Quelles sont les deux méthodes fréquemment utilisées pour estimer le nombre de bactéries dans les échantillons d'eau ?
Nombre de cellules indirect
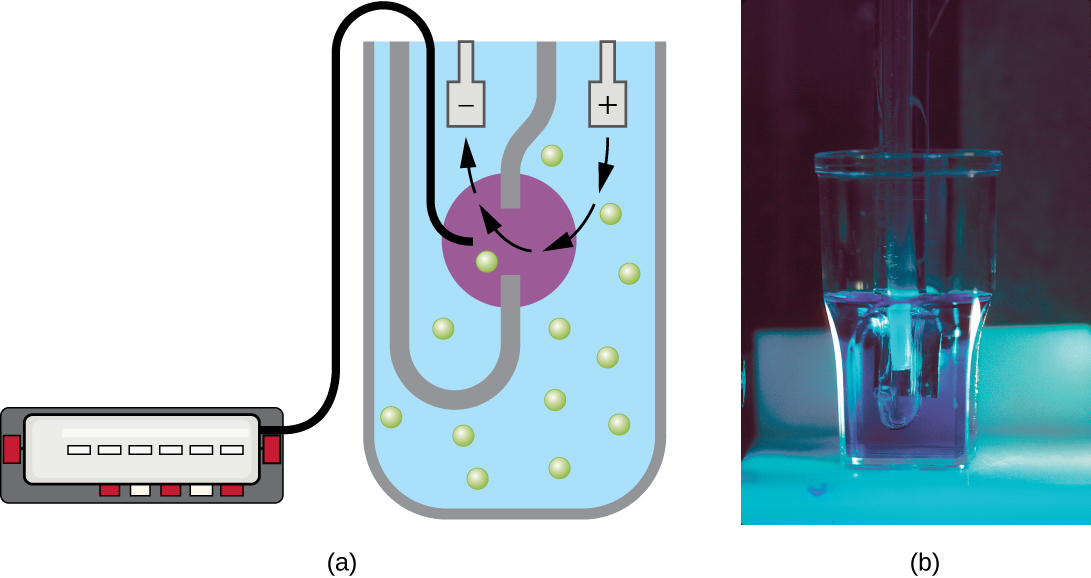
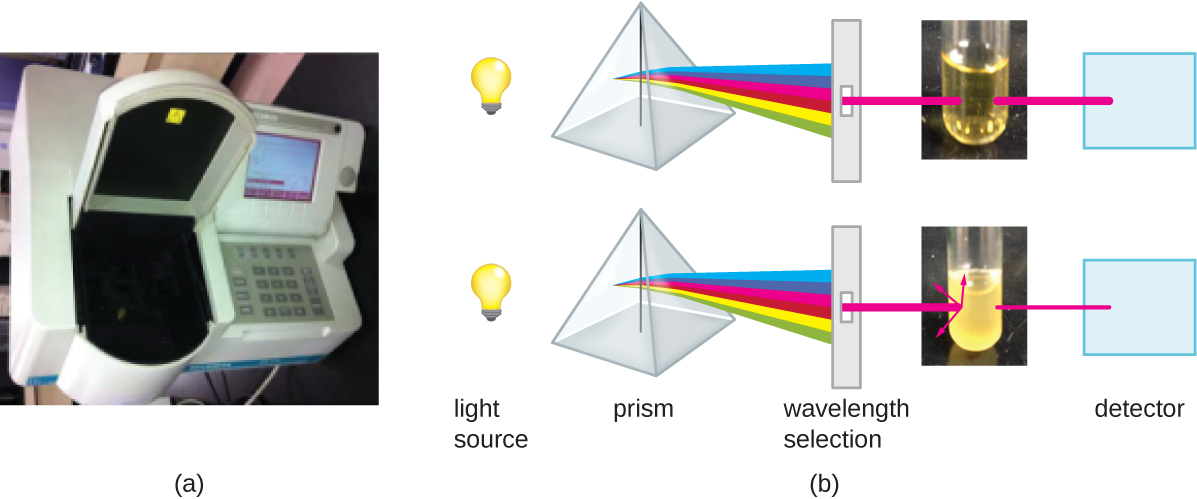
Outre les méthodes directes de comptage des cellules, d'autres méthodes, basées sur une détection indirecte de la densité cellulaire, sont couramment utilisées pour estimer et comparer les densités cellulaires dans une culture. La première approche consiste à mesurer la turbidité (turbidité) d'un échantillon de bactéries dans une suspension liquide. L'instrument de laboratoire utilisé pour mesurer la turbidité est appelé spectrophotomètre (Figure\(\PageIndex{14}\)). Dans un spectrophotomètre, un faisceau lumineux est transmis à travers une suspension bactérienne, la lumière traversant la suspension est mesurée par un détecteur, et la quantité de lumière traversant l'échantillon et atteignant le détecteur est convertie en pourcentage de transmission ou en une valeur logarithmique appelée absorbance (densité optique). À mesure que le nombre de bactéries dans une suspension augmente, la turbidité augmente également et réduit la quantité de lumière qui atteint le détecteur. La diminution de la lumière traversant l'échantillon et atteignant le détecteur est associée à une diminution du pourcentage de transmission et à une augmentation de l'absorbance mesurées par le spectrophotomètre.
La mesure de la turbidité est une méthode rapide pour estimer la densité cellulaire, à condition qu'il y ait suffisamment de cellules dans un échantillon pour produire de la turbidité. Il est possible de corréler les mesures de turbidité au nombre réel de cellules en effectuant un comptage sur plaque viable d'échantillons prélevés sur des cultures présentant une plage de valeurs d'absorbance. À l'aide de ces valeurs, une courbe d'étalonnage est générée en traçant la turbidité en fonction de la densité cellulaire. Une fois que la courbe d'étalonnage a été produite, elle peut être utilisée pour estimer le nombre de cellules pour tous les échantillons obtenus ou cultivés dans des conditions similaires et avec des densités comprises dans la plage de valeurs utilisée pour construire la courbe.
La mesure du poids sec d'un échantillon de culture est une autre méthode indirecte d'évaluation de la densité de culture sans mesurer directement le nombre de cellules. La suspension cellulaire utilisée pour la pesée doit être concentrée par filtration ou centrifugation, lavée puis séchée avant les mesures. Le degré de séchage doit être normalisé pour tenir compte de la teneur en eau résiduelle. Cette méthode est particulièrement utile pour les microorganismes filamenteux, qui sont difficiles à dénombrer par comptage direct ou viable sur plaque.
Comme nous l'avons vu, les méthodes d'estimation du nombre de cellules viables peuvent demander beaucoup de travail et prendre du temps car les cellules doivent être cultivées. Récemment, des méthodes indirectes de mesure des cellules vivantes ont été développées, qui sont à la fois rapides et faciles à mettre en œuvre. Ces méthodes mesurent l'activité cellulaire en suivant la production de produits métaboliques ou la disparition de réactifs. La formation d'adénosine triphosphate (ATP), la biosynthèse des protéines et des acides nucléiques et la consommation d'oxygène peuvent toutes être surveillées pour estimer le nombre de cellules.
Exercice\(\PageIndex{7}\)
- À quoi sert une courbe d'étalonnage lors de l'estimation du nombre de cellules à partir de mesures de turbidité ?
- Quelles sont les nouvelles méthodes indirectes de comptage des cellules vivantes ?
Modèles alternatifs de division cellulaire
La fission binaire est le schéma de division cellulaire le plus courant chez les procaryotes, mais ce n'est pas le seul. D'autres mécanismes impliquent généralement une division asymétrique (comme lors du bourgeonnement) ou la production de spores dans des filaments aériens.
Chez certaines cyanobactéries, de nombreux nucléoïdes peuvent s'accumuler dans une cellule ronde élargie ou le long d'un filament, ce qui entraîne la génération de nombreuses nouvelles cellules à la fois. Les nouvelles cellules se séparent souvent du filament parent et s'éloignent par flottation selon un processus appelé fragmentation (Figure\(\PageIndex{15}\)). La fragmentation est fréquemment observée chez les actinomycètes, un groupe de bactéries anaérobies gram-positives que l'on trouve couramment dans le sol. Un autre exemple curieux de division cellulaire chez les procaryotes, qui rappelle les naissances vivantes chez les animaux, est présenté par la bactérie géante Epulopiscium. Plusieurs cellules filles se développent complètement dans la cellule mère, qui finit par se désintégrer, libérant les nouvelles cellules dans l'environnement. D'autres espèces peuvent former une extension longue et étroite à un pôle au cours d'un processus appelé bourgeonnement. L'extrémité de l'extension gonfle et forme une cellule plus petite, le bourgeon qui finit par se détacher de la cellule mère. Le bourgeonnement est plus fréquent chez les levures (Figure\(\PageIndex{15}\)), mais il est également observé chez les bactéries prothéquées et certaines cyanobactéries.

La bactérie du sol Actinomyces se développe en longs filaments divisés par des septa, semblables au mycélium observé chez les champignons, ce qui donne de longues cellules contenant de multiples nucléoïdes. Les signaux environnementaux, probablement liés à la faible disponibilité des nutriments, entraînent la formation de filaments aériens. Au sein de ces filaments aériens, les cellules allongées se divisent simultanément. Les nouvelles cellules, qui contiennent un seul nucléoïde, se transforment en spores qui donnent naissance à de nouvelles colonies.
Exercice\(\PageIndex{8}\)
Identifiez au moins une différence entre la fragmentation et le bourgeonnement.
Biofilms
Dans la nature, les microorganismes se développent principalement dans des biofilms, des écosystèmes complexes et dynamiques qui se forment sur diverses surfaces environnementales, des conduits industriels aux canalisations de traitement de l'eau en passant par les roches du lit des rivières. Les biofilms ne se limitent toutefois pas aux substrats de surface solides. Presque toutes les surfaces d'un environnement liquide contenant un minimum de nutriments finiront par développer un biofilm. Les tapis microbiens qui flottent sur l'eau, par exemple, sont des biofilms qui contiennent de grandes populations de microorganismes photosynthétiques. Les biofilms trouvés dans la bouche humaine peuvent contenir des centaines d'espèces bactériennes. Quel que soit l'environnement dans lequel ils se trouvent, les biofilms ne sont pas des collections aléatoires de microorganismes ; il s'agit plutôt de communautés hautement structurées qui fournissent un avantage sélectif aux microorganismes qui les constituent.
Structure du biofilm
Des observations par microscopie confocale ont montré que les conditions environnementales influencent la structure globale des biofilms. Des biofilms filamenteux appelés flûtes se forment dans les eaux qui s'écoulent rapidement, telles que les ruisseaux d'eau douce, les tourbillons et les cellules d'écoulement de laboratoire spécialement conçues pour reproduire les conditions de croissance dans des fluides en mouvement rapide. Les flûtes sont ancrées au substrat par une « tête » et la « queue » flotte vers l'aval dans le courant. Dans les eaux calmes ou lentes, les biofilms prennent principalement la forme d'un champignon. La structure des biofilms peut également changer en fonction d'autres conditions environnementales telles que la disponibilité des nutriments.
Des observations détaillées de biofilms au microscope confocal au laser et au microscope électronique à balayage révèlent des amas de microorganismes intégrés dans une matrice entrecoupée de canaux d'eau libres. La matrice extracellulaire est constituée de substances polymères extracellulaires (EPS) sécrétées par les organismes présents dans le biofilm. La matrice extracellulaire représente une grande partie du biofilm, représentant 50 à 90 % de la masse sèche totale. Les propriétés de l'EPS varient en fonction des organismes résidents et des conditions environnementales.
L'EPS est un gel hydraté composé principalement de polysaccharides et contenant d'autres macromolécules telles que des protéines, des acides nucléiques et des lipides. Il joue un rôle clé dans le maintien de l'intégrité et de la fonction du biofilm. Les canaux de l'EPS permettent la circulation des nutriments, des déchets et des gaz à travers le biofilm. Cela permet de maintenir les cellules hydratées, empêchant ainsi la dessiccation. L'EPS protège également les organismes du biofilm contre la prédation par d'autres microbes ou cellules (par exemple, les protozoaires, les globules blancs du corps humain).
Formation de biofilms
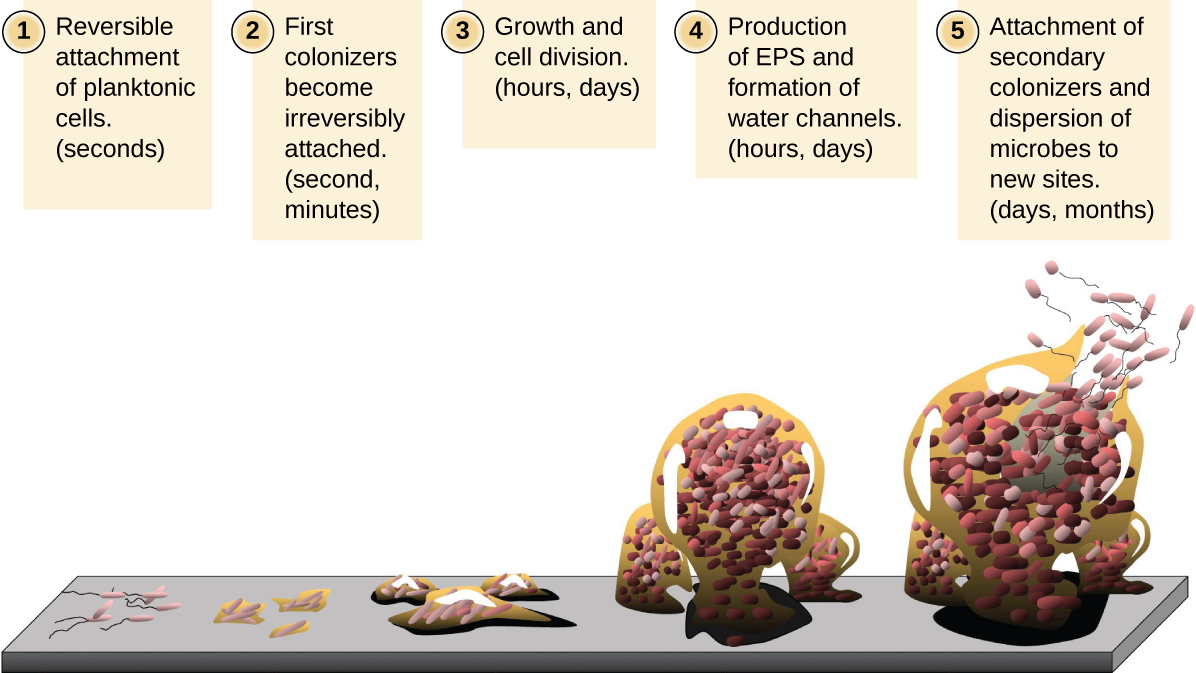
Les cellules microbiennes flottantes qui vivent dans un environnement aquatique sont appelées cellules planctoniques. La formation d'un biofilm implique essentiellement la fixation de cellules planctoniques sur un substrat, où elles deviennent sessiles (fixées à une surface). Cela se fait par étapes, comme le montre la figure\(\PageIndex{16}\). La première étape consiste à fixer des cellules planctoniques sur une surface recouverte d'un film de conditionnement en matière organique. À ce stade, la fixation au substrat est réversible, mais à mesure que les cellules expriment de nouveaux phénotypes qui facilitent la formation de l'EPS, elles passent d'un mode de vie planctonique à un mode de vie sessile. Le biofilm développe des structures caractéristiques, notamment une matrice étendue et des canaux d'eau. Des appendices tels que les fimbriae, les pili et les flagelles interagissent avec l'EPS, et la microscopie et l'analyse génétique suggèrent que de telles structures sont nécessaires à l'établissement d'un biofilm mature. Au dernier stade du cycle de vie du biofilm, les cellules situées à la périphérie du biofilm reprennent un mode de vie planctonique, se détachant du biofilm mature pour coloniser de nouveaux sites. Cette étape est appelée dispersion.
Au sein d'un biofilm, différentes espèces de microorganismes établissent des collaborations métaboliques dans lesquelles les déchets d'un organisme deviennent les nutriments d'un autre. Par exemple, les microorganismes aérobies consomment de l'oxygène, créant des régions anaérobies qui favorisent la croissance des anaérobies. Cela se produit dans de nombreuses infections polymicrobiennes impliquant à la fois des agents pathogènes aérobies et anaérobies.
Le mécanisme par lequel les cellules d'un biofilm coordonnent leurs activités en réponse à des stimuli environnementaux est appelé détection du quorum. La détection du quorum, qui peut se produire entre des cellules de différentes espèces au sein d'un biofilm, permet aux microorganismes de détecter leur densité cellulaire en libérant et en liant de petites molécules diffusibles appelées auto-inducteurs. Lorsque la population cellulaire atteint un seuil critique (un quorum), ces auto-inducteurs déclenchent une cascade de réactions qui activent des gènes associés à des fonctions cellulaires qui ne sont bénéfiques que lorsque la population atteint une densité critique. Par exemple, chez certains agents pathogènes, la synthèse des facteurs de virulence ne commence que lorsque suffisamment de cellules sont présentes pour neutraliser les défenses immunitaires de l'hôte. Bien qu'elle soit principalement étudiée sur des populations bactériennes, la détection du quorum a lieu entre les bactéries et les eucaryotes et entre des cellules eucaryotes telles que le champignon Candida albicans, un membre courant du microbiote humain qui peut provoquer des infections chez les personnes immunodéprimées.
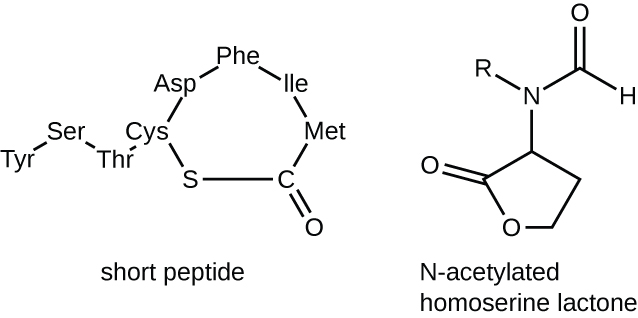
Les molécules de signalisation utilisées pour la détection du quorum appartiennent à deux grandes classes. Les bactéries gram-négatives communiquent principalement à l'aide de lactones d'homosérine N-acylées, tandis que les bactéries gram-positives utilisent principalement de petits peptides (Figure\(\PageIndex{17}\)). Dans tous les cas, la première étape de la détection du quorum consiste à lier l'auto-inducteur à son récepteur spécifique uniquement lorsqu'un seuil de concentration de molécules de signalisation est atteint. Une fois que la liaison au récepteur a lieu, une cascade d'événements de signalisation entraîne des modifications de l'expression génique. Il en résulte l'activation de réponses biologiques liées à la détection du quorum, notamment une augmentation de la production des molécules de signalisation elles-mêmes, d'où le terme auto-inducteur.
Les biofilms et la santé humaine
Le corps humain abrite de nombreux types de biofilms, certains bénéfiques et d'autres nocifs. Par exemple, les couches de microbiote normal qui tapissent les muqueuses intestinales et respiratoires jouent un rôle dans la prévention des infections par des agents pathogènes. Cependant, d'autres biofilms présents dans l'organisme peuvent avoir un effet néfaste sur la santé. Par exemple, la plaque qui se forme sur les dents est un biofilm qui peut contribuer aux maladies dentaires et parodontales. Des biofilms peuvent également se former dans les plaies, provoquant parfois de graves infections qui peuvent se propager. La bactérie Pseudomonas aeruginosa colonise souvent les biofilms des voies respiratoires des patients atteints de mucoviscidose, provoquant des infections pulmonaires chroniques et parfois mortelles. Des biofilms peuvent également se former sur les dispositifs médicaux utilisés dans ou sur le corps, provoquant des infections chez les patients porteurs de cathéters internes, d'articulations artificielles ou de lentilles de contact.
Les agents pathogènes intégrés dans les biofilms présentent une résistance aux antibiotiques plus élevée que leurs homologues flottants. Plusieurs hypothèses ont été proposées pour expliquer pourquoi. Les cellules des couches profondes d'un biofilm sont métaboliquement inactives et peuvent être moins sensibles à l'action des antibiotiques qui perturbent les activités métaboliques. L'EPS peut également ralentir la diffusion des antibiotiques et des antiseptiques, les empêchant ainsi d'atteindre les cellules des couches profondes du biofilm. Les changements phénotypiques peuvent également contribuer à l'augmentation de la résistance des cellules bactériennes dans les biofilms. Par exemple, la production accrue de pompes d'efflux, des protéines intégrées à la membrane qui extraient activement les antibiotiques des cellules bactériennes, s'est révélée être un mécanisme important de résistance aux antibiotiques chez les bactéries associées aux biofilms. Enfin, les biofilms constituent un environnement idéal pour l'échange d'ADN extrachromosomique, qui inclut souvent des gènes conférant une résistance aux antibiotiques.
Exercice\(\PageIndex{9}\)
- De quoi est composée la matrice d'un biofilm ?
- Quel est le rôle de la détection du quorum dans un biofilm ?
Concepts clés et résumé
- La plupart des cellules bactériennes se divisent par fission binaire. La durée d'une génération dans la croissance bactérienne est définie comme le temps de doublement de la population.
- Les cellules d'un système fermé suivent un schéma de croissance comportant quatre phases : latence, logarithmique (exponentielle), stationnaire et mort.
- Les cellules peuvent être comptées par comptage direct des cellules viables. Les méthodes sur plaque coulée et sur plaque étalée sont utilisées pour étaler des dilutions en série dans ou sur de la gélose, respectivement, afin de permettre le comptage des cellules viables qui donnent naissance à des unités formant des colonies. La filtration sur membrane est utilisée pour compter les cellules vivantes dans des solutions diluées. La méthode du nombre de cellules le plus probable (MPN) permet d'estimer le nombre de cellules dans les cultures sans utiliser de milieu solide.
- Des méthodes indirectes peuvent être utilisées pour estimer la densité de culture en mesurant la turbidité d'une culture ou la densité des cellules vivantes en mesurant l'activité métabolique.
- Les autres modèles de division cellulaire incluent la formation de multiples nucléoïdes dans les cellules, la division asymétrique, comme lors du bourgeonnement, et la formation d'hyphes et de spores terminales.
- Les biofilms sont des communautés de microorganismes imbriqués dans une matrice de substance polymère extracellulaire. La formation d'un biofilm se produit lorsque les cellules planctoniques se fixent à un substrat et deviennent sessiles. Les cellules des biofilms coordonnent leur activité en communiquant par le biais de la détection du quorum.
- Les biofilms se trouvent couramment sur des surfaces naturelles et dans le corps humain, où ils peuvent être bénéfiques ou provoquer de graves infections. Les agents pathogènes associés aux biofilms sont souvent plus résistants aux antibiotiques et aux désinfectants.


