8.1 : Énergie, matière et enzymes
- Page ID
- 187718
Objectifs d'apprentissage
- Définir et décrire le métabolisme
- Comparez et opposez les autotrophes et les hétérotrophes
- Décrire l'importance des réactions d'oxydoréduction dans le métabolisme
- Décrivez pourquoi l'ATP, le FAD, le NAD+ et le NADP + sont importants dans une cellule
- Identifier la structure et les composants structuraux d'une enzyme
- Décrire les différences entre les inhibiteurs enzymatiques compétitifs et non compétitifs
Orientation clinique : 1ère partie
Hannah est une jeune fille de 15 mois de l'État de Washington. Elle passe l'été en Gambie, où ses parents travaillent pour une organisation non gouvernementale. Environ 3 semaines après son arrivée en Gambie, l'appétit d'Hannah a commencé à diminuer et ses parents ont remarqué qu'elle semblait exceptionnellement léthargique, fatiguée et confuse. Elle semblait également très irritable lorsqu'elle était à l'extérieur, surtout pendant la journée. Quand elle a commencé à vomir, ses parents ont pensé qu'elle avait contracté un virus 24 heures sur 24, mais lorsque ses symptômes ont persisté, ils l'ont emmenée à la clinique. Le médecin local a remarqué que les réflexes d'Hannah semblaient anormalement lents et, lorsqu'il a examiné ses yeux avec une lumière, elle semblait exceptionnellement sensible à la lumière. Elle semblait également avoir une raideur de la nuque.
Exercice\(\PageIndex{1}\)
Quelles sont les causes possibles des symptômes de Hannah ?
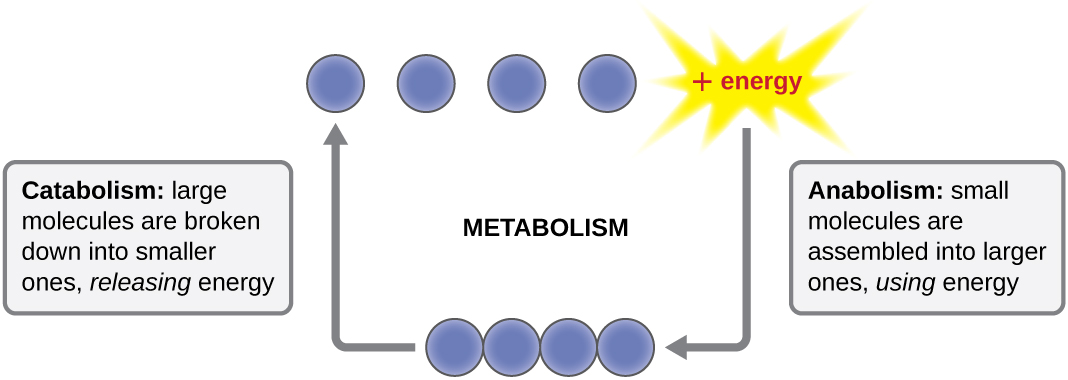
Le terme utilisé pour décrire toutes les réactions chimiques à l'intérieur d'une cellule est métabolisme (Figure\(\PageIndex{1}\)). Les processus cellulaires tels que la construction ou la dégradation de molécules complexes se produisent par une série de réactions chimiques interconnectées par étapes appelées voies métaboliques. Les réactions spontanées qui libèrent de l'énergie sont des réactions exergoniques, alors que les réactions endergoniques nécessitent de l'énergie pour se produire. Le terme anabolisme fait référence aux voies métaboliques endergoniques impliquées dans la biosynthèse, convertissant des éléments de construction moléculaires simples en molécules plus complexes, et alimentées par l'utilisation de l'énergie cellulaire. À l'inverse, le terme catabolisme fait référence à des voies exergoniques qui décomposent des molécules complexes en molécules plus simples. L'énergie moléculaire stockée dans les liaisons de molécules complexes est libérée par des voies cataboliques et récoltée de telle sorte qu'elle peut être utilisée pour produire des molécules à haute énergie, qui sont utilisées pour entraîner les voies anabolisantes. Ainsi, en termes d'énergie et de molécules, les cellules équilibrent continuellement le catabolisme et l'anabolisme.
Classification par source de carbone et d'énergie
Les organismes peuvent être identifiés en fonction de la source de carbone qu'ils utilisent pour leur métabolisme ainsi que de leur source d'énergie. Les préfixes auto- (« self ») et hetero- (« autre ») font référence à l'origine des sources de carbone que divers organismes peuvent utiliser. Les organismes qui transforment le dioxyde de carbone inorganique (CO 2) en composés organiques carbonés sont autotrophes. Les plantes et les cyanobactéries sont des exemples bien connus d'autotrophes. À l'inverse, les hétérotrophes ont besoin de composés organiques de carbone plus complexes comme nutriments ; ceux-ci leur sont fournis initialement par les autotrophes. De nombreux organismes, allant des humains à de nombreux procaryotes, y compris la célèbre Escherichia coli, sont hétérotrophes.
Les organismes peuvent également être identifiés par la source d'énergie qu'ils utilisent. Toute l'énergie provient du transfert d'électrons, mais la source des électrons diffère selon les différents types d'organismes. Les préfixes photo- (« lumière ») et chimio- (« chimique ») font référence aux sources d'énergie utilisées par divers organismes. Ceux qui tirent leur énergie pour le transfert d'électrons de la lumière sont des phototrophes, tandis que les chimiotrophes obtiennent de l'énergie pour le transfert d'électrons en rompant les liaisons chimiques. Il existe deux types de chimiotrophes : les organotrophes et les lithotrophes. Les organotrophes, y compris les humains, les champignons et de nombreux procaryotes, sont des chimiotrophes qui tirent leur énergie de composés organiques. Les lithotrophes (« litho » signifie « roche ») sont des chimiotrophes qui tirent leur énergie de composés inorganiques, notamment du sulfure d'hydrogène (H 2 S) et du fer réduit. La lithotrophie est unique au monde microbien.
Les stratégies utilisées pour obtenir à la fois du carbone et de l'énergie peuvent être combinées pour la classification des organismes selon leur type nutritionnel. La plupart des organismes sont des chimiohétérotrophes parce qu'ils utilisent des molécules organiques comme sources d'électrons et de carbone. \(\PageIndex{1}\)Le tableau résume cette classification et les autres.
| Classements | Source d'énergie | Source de carbone | Exemples | |
|---|---|---|---|---|
| Chimiotrophes | Chimioautotrophes | Produit chimique | Inorganique | Bactéries oxydant l'hydrogène, le soufre, le fer, l'azote et le monoxyde de carbone |
| Chimiohétérotrophes | Produit chimique | Composés organiques | Tous les animaux, la plupart des champignons, des protozoaires et des bactéries | |
| Phototrophes | Photoautotrophes | Lumière | Inorganique | Toutes les plantes, algues, cyanobactéries et bactéries soufrées vertes et violettes |
| Photohétérotrophes | Lumière | Composés organiques | Bactéries vertes et violettes sans soufre, héliobactéries | |
Exercice\(\PageIndex{2}\)
- Expliquez la différence entre le catabolisme et l'anabolisme.
- Expliquez la différence entre les autotrophes et les hétérotrophes.
Oxydation et réduction du métabolisme
Le transfert d'électrons entre les molécules est important car la majeure partie de l'énergie stockée dans les atomes et utilisée pour les fonctions des piles à combustible se présente sous forme d'électrons de haute énergie. Le transfert d'énergie sous forme d'électrons permet à la cellule de transférer et d'utiliser l'énergie de manière incrémentielle, c'est-à-dire en petits paquets plutôt qu'en une seule rafale destructrice. Les réactions qui retirent des électrons des molécules donneuses, les laissant oxydées, sont des réactions d'oxydation ; celles qui ajoutent des électrons aux molécules acceptrices, les laissant réduites, sont des réactions de réduction. Comme les électrons peuvent passer d'une molécule à l'autre, l'oxydation et la réduction se produisent en tandem. Ces paires de réactions sont appelées réactions d'oxydoréduction ou réactions d'oxydoréduction.
Transporteurs énergétiques : NAD +, NADP +, FAD et ATP
L'énergie libérée par la rupture des liaisons chimiques au sein des nutriments peut être stockée soit par la réduction des porteurs d'électrons, soit par les liaisons de l'adénosine triphosphate (ATP). Dans les systèmes vivants, une petite classe de composés fonctionne comme des porteurs d'électrons mobiles, des molécules qui se lient aux électrons de haute énergie et les transportent entre eux par des voies. Les principaux porteurs d'électrons que nous allons examiner proviennent du groupe des vitamines B et sont des dérivés de nucléotides ; il s'agit du nicotinamide adénine dinucléotide, de la nicotine adénine dinucléotide phosphate et de la flavine adénine dinucléotide. Ces composés peuvent être facilement réduits ou oxydés. Le nicotinamide adénine dinucléotide (NAD + /NADH) est le support d'électrons mobile le plus couramment utilisé dans le catabolisme. Le NAD+ est la forme oxydée de la molécule ; le NADH est la forme réduite de la molécule. L'adénine dinucléotide phosphate de nicotine (NADP +), la forme oxydée d'un variant du NAD+ qui contient un groupe phosphate supplémentaire, est un autre vecteur d'électrons important ; il forme du NADPH lorsqu'il est réduit. La forme oxydée de la flavine adénine dinucléotide est le FAD et sa forme réduite est le FADH 2. Le NAD + /NADH et le FAD/FADH 2 sont tous deux largement utilisés dans l'extraction énergétique des sucres lors du catabolisme des chimiohétérotrophes, tandis que le NADP + /NADPH joue un rôle important dans les réactions anaboliques et la photosynthèse. Collectivement, le FADH 2, le NADH et le NADPH sont souvent considérés comme ayant un pouvoir réducteur en raison de leur capacité à donner des électrons à diverses réactions chimiques.
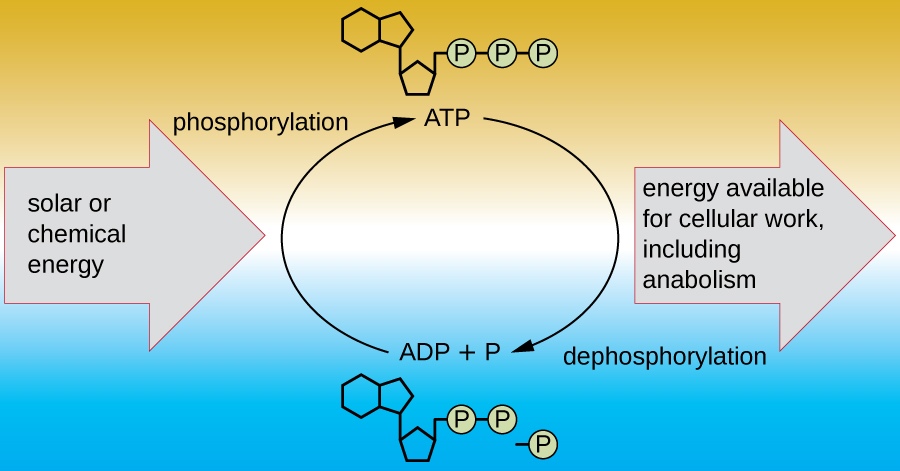
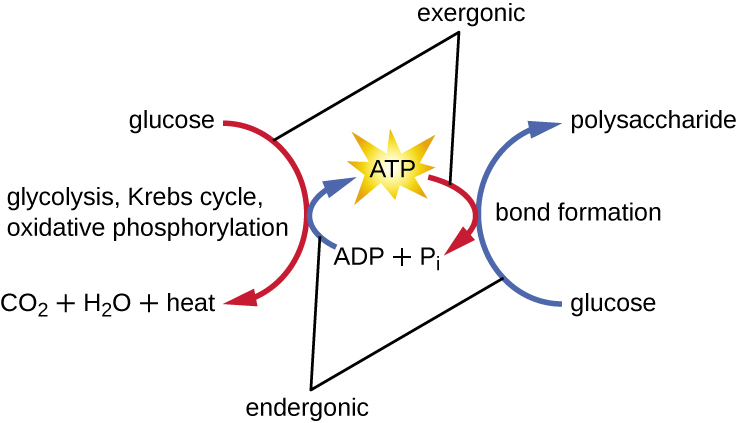
Une cellule vivante doit être capable de gérer l'énergie libérée lors du catabolisme de manière à lui permettre de stocker l'énergie en toute sécurité et de la libérer pour l'utiliser uniquement en cas de besoin. Les cellules vivantes y parviennent en utilisant le composé d'adénosine triphosphate (ATP). L'ATP est souvent appelé la « monnaie énergétique » de la cellule et, comme la monnaie, ce composé polyvalent peut être utilisé pour répondre à tous les besoins énergétiques de la cellule. Au cœur de l'ATP se trouve une molécule d'adénosine monophosphate (AMP), composée d'une molécule d'adénine liée à une molécule de ribose et d'un seul groupe phosphate. Le ribose est un sucre à cinq carbones présent dans l'ARN, et l'AMP est l'un des nucléotides de l'ARN. L'ajout d'un deuxième groupe phosphate à cette molécule centrale entraîne la formation d'adénosine diphosphate (ADP) ; l'ajout d'un troisième groupe phosphate forme de l'ATP (Figure\(\PageIndex{2}\)). L'ajout d'un groupe phosphate à une molécule, un processus appelé phosphorylation, nécessite de l'énergie. Les groupes phosphates sont chargés négativement et se repoussent donc les uns les autres lorsqu'ils sont disposés en série, comme c'est le cas dans l'ADP et l'ATP. Cette répulsion rend les molécules d'ADP et d'ATP intrinsèquement instables. Ainsi, les liaisons entre les groupes phosphates (un dans l'ADP et deux dans l'ATP) sont appelées liaisons phosphates à haute énergie. Lorsque ces liaisons à haute énergie sont brisées pour libérer un phosphate (appelé phosphate inorganique [P i]) ou deux groupes phosphates connectés (appelés pyrophosphate [PP i]) à partir de l'ATP par un processus appelé déphosphorylation, de l'énergie est libérée pour provoquer des réactions endergoniques (Figure\(\PageIndex{3}\)).
Exercice\(\PageIndex{3}\)
Quelle est la fonction d'un porteur d'électrons ?
Structure et fonction des enzymes
Une substance qui contribue à accélérer une réaction chimique est un catalyseur. Les catalyseurs ne sont pas utilisés ou changés lors de réactions chimiques et sont donc réutilisables. Alors que les molécules inorganiques peuvent servir de catalyseurs pour un large éventail de réactions chimiques, les protéines appelées enzymes servent de catalyseurs pour les réactions biochimiques à l'intérieur des cellules. Les enzymes jouent donc un rôle important dans le contrôle du métabolisme cellulaire.
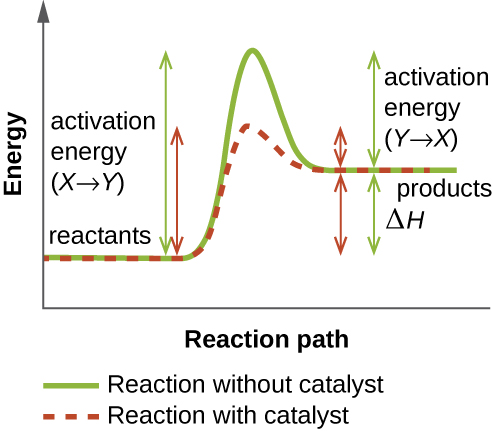
Une enzyme fonctionne en diminuant l'énergie d'activation d'une réaction chimique à l'intérieur de la cellule. L'énergie d'activation est l'énergie nécessaire pour former ou rompre des liaisons chimiques et convertir les réactifs en produits (Figure\(\PageIndex{4}\)). Les enzymes réduisent l'énergie d'activation en se liant aux molécules du réactif et en les maintenant de manière à accélérer la réaction.
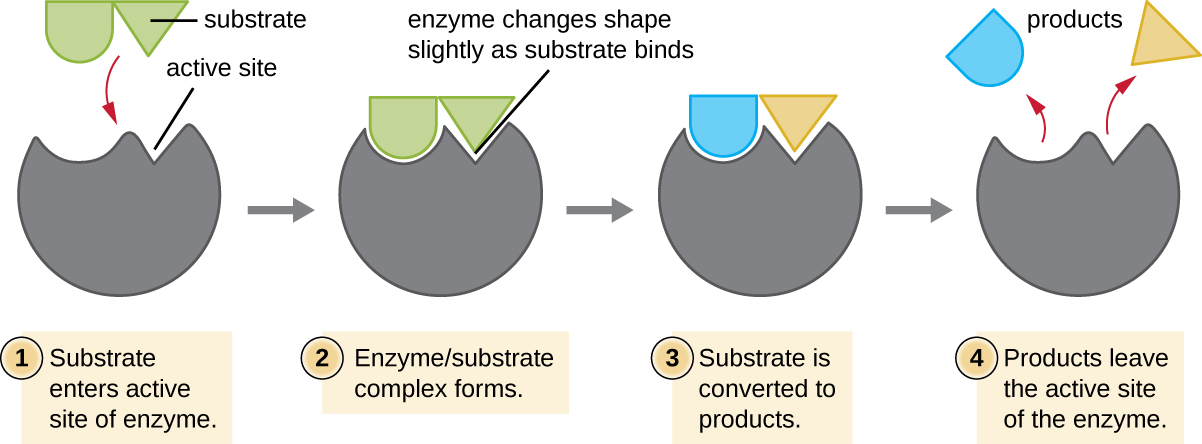
Les réactifs chimiques auxquels une enzyme se lie sont appelés substrats, et l'emplacement au sein de l'enzyme où le substrat se lie est appelé site actif de l'enzyme. Les caractéristiques des acides aminés situés à proximité du site actif créent un environnement chimique très spécifique au sein du site actif qui induit l'aptitude à se lier, quoique brièvement, à un substrat (ou à des substrats) spécifiques. En raison de cette correspondance semblable à un puzzle entre une enzyme et ses substrats, les enzymes sont connues pour leur spécificité. En fait, lorsqu'une enzyme se lie à son ou ses substrats, sa structure change légèrement pour trouver le meilleur ajustement entre l'état de transition (un intermédiaire structurel entre le substrat et le produit) et le site actif, tout comme un gant en caoutchouc épouse la forme d'une main insérée dans celui-ci. Cette modification du site actif en présence de substrat, associée à la formation simultanée de l'état de transition, est appelée ajustement induit (Figure\(\PageIndex{5}\)). Dans l'ensemble, il existe une enzyme spécifiquement adaptée à chaque substrat et donc à chaque réaction chimique ; cependant, il existe également une certaine flexibilité. Certaines enzymes ont la capacité d'agir sur plusieurs substrats structuralement apparentés.
Les enzymes sont soumises aux influences des conditions environnementales locales telles que le pH, la concentration du substrat et la température. Bien que l'augmentation de la température ambiante augmente généralement les taux de réaction, catalysés par des enzymes ou non, l'augmentation ou la diminution de la température en dehors d'une plage optimale peut affecter les liaisons chimiques au sein du site actif, les rendant moins aptes à se lier aux substrats. Les températures élevées finiront par provoquer la dénaturation des enzymes, comme les autres molécules biologiques, et leur perte de structure et de fonction tridimensionnelles. Les enzymes sont également adaptées pour fonctionner au mieux dans une certaine plage de pH et, comme pour la température, les valeurs extrêmes du pH environnemental (acide ou basique) peuvent provoquer la dénaturation des enzymes. Les chaînes latérales d'acides aminés du site actif possèdent leurs propres propriétés acides ou basiques qui sont optimales pour la catalyse et sont donc sensibles aux variations du pH.
Un autre facteur qui influence l'activité enzymatique est la concentration du substrat : l'activité enzymatique augmente à des concentrations plus élevées de substrat jusqu'à atteindre un point de saturation auquel l'enzyme ne peut se lier à aucun substrat supplémentaire. Dans l'ensemble, les enzymes sont optimisées pour fonctionner au mieux dans les conditions environnementales dans lesquelles vivent les organismes qui les produisent. Par exemple, alors que les microbes qui peuplent les sources thermales possèdent des enzymes qui fonctionnent le mieux à des températures élevées, les agents pathogènes humains ont des enzymes qui fonctionnent le mieux à 37 °C. De même, alors que les enzymes produites par la plupart des organismes fonctionnent mieux à un pH neutre, les microbes qui se développent dans des environnements acides fabriquent des enzymes optimisées à un pH faible conditions, permettant leur croissance dans ces conditions.
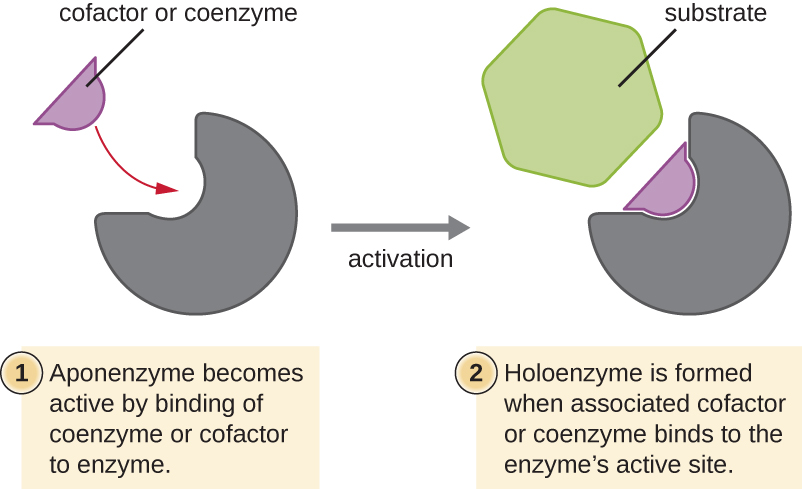
De nombreuses enzymes ne fonctionnent pas de manière optimale, voire pas du tout, à moins d'être liées à d'autres molécules auxiliaires spécifiques non protéiques, soit temporairement par des liaisons ioniques ou hydrogène, soit de manière permanente par des liaisons covalentes plus fortes. La liaison à ces molécules favorise une conformation et une fonction optimales de leurs enzymes respectives. Deux types de molécules auxiliaires sont les cofacteurs et les coenzymes. Les cofacteurs sont des ions inorganiques tels que le fer (Fe 2+) et le magnésium (Mg 2+) qui aident à stabiliser la conformation et la fonction des enzymes. Un exemple d'enzyme qui a besoin d'un ion métallique comme cofacteur est l'enzyme qui construit les molécules d'ADN, l'ADN polymérase, qui a besoin d'un ion zinc lié (Zn 2+) pour fonctionner.
Les coenzymes sont des molécules auxiliaires organiques nécessaires à l'action enzymatique. Comme les enzymes, elles ne sont pas consommées et sont donc réutilisables. Les sources les plus courantes de coenzymes sont les vitamines alimentaires. Certaines vitamines sont des précurseurs de coenzymes tandis que d'autres agissent directement comme des coenzymes.
Certains cofacteurs et coenzymes, comme la coenzyme A (CoA), se lient souvent au site actif de l'enzyme, ce qui contribue à la chimie de la transition d'un substrat vers un produit (Figure\(\PageIndex{6}\)). Dans de tels cas, une enzyme dépourvue d'un cofacteur ou d'une coenzyme nécessaire est appelée apoenzyme et est inactive. À l'inverse, une enzyme associée au cofacteur ou à la coenzyme nécessaire est appelée holoenzyme et est active. Le NADH et l'ATP sont également des exemples de coenzymes couramment utilisées qui fournissent des électrons de haute énergie ou des groupes phosphates, respectivement, qui se lient aux enzymes, les activant ainsi.
Exercice\(\PageIndex{4}\)
Quel rôle jouent les enzymes dans une réaction chimique ?
inhibiteurs enzymatiques
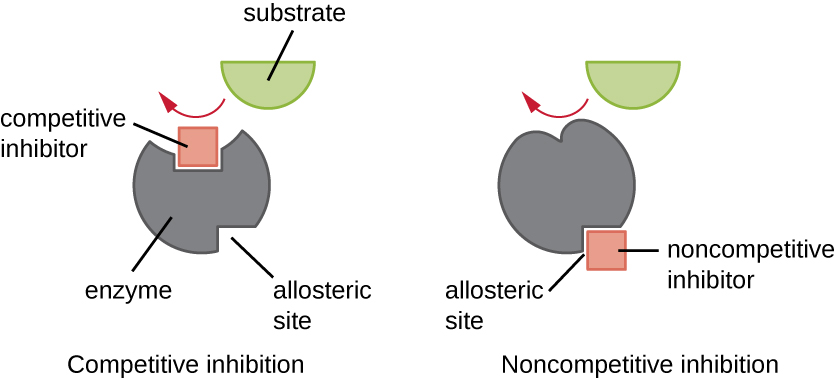
Les enzymes peuvent être régulées de manière à favoriser ou à réduire leur activité. Il existe de nombreux types de molécules qui inhibent ou favorisent la fonction enzymatique, et divers mécanismes existent pour le faire (Figure\(\PageIndex{7}\)). Un inhibiteur compétitif est une molécule suffisamment similaire à un substrat pour pouvoir entrer en compétition avec le substrat pour se lier au site actif en empêchant simplement le substrat de se lier. Pour qu'un inhibiteur compétitif soit efficace, la concentration de l'inhibiteur doit être approximativement égale à la concentration du substrat. Les sulfamides constituent un bon exemple de concurrence concurrentielle. Ils sont utilisés pour traiter les infections bactériennes car ils se lient au site actif d'une enzyme dans la voie de synthèse de l'acide folique bactérien. Lorsqu'il est présent à une dose suffisante, un sulfamide empêche la synthèse de l'acide folique et les bactéries ne peuvent pas se développer parce qu'elles ne peuvent pas synthétiser l'ADN, l'ARN et les protéines. Les humains ne sont pas affectés parce que nous obtenons de l'acide folique dans notre alimentation.
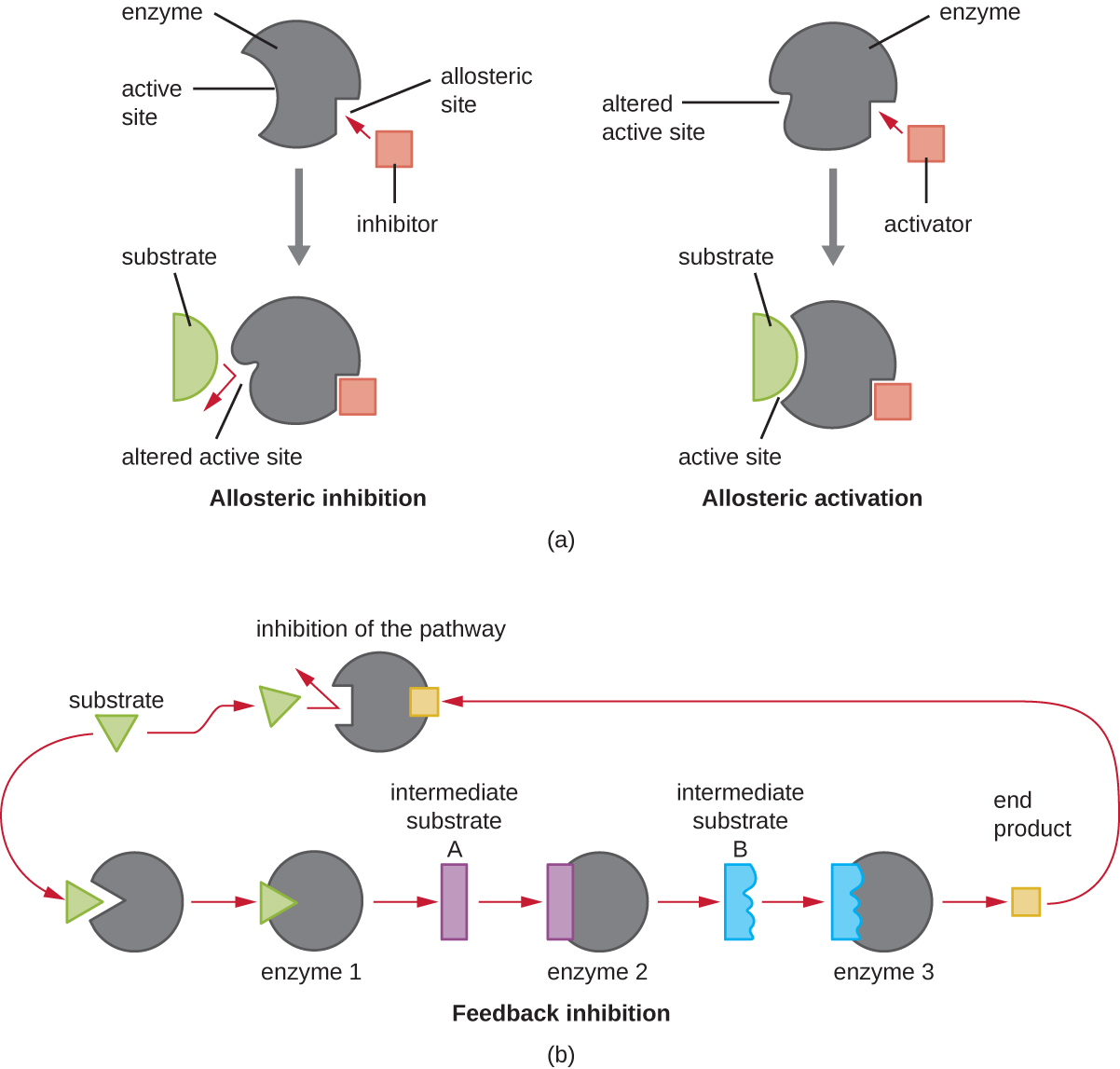
D'autre part, un inhibiteur non compétitif (allostérique) se lie à l'enzyme au niveau d'un site allostérique, à un endroit autre que le site actif, tout en parvenant à bloquer la liaison du substrat au site actif en induisant un changement de conformation qui réduit l'affinité de l'enzyme pour son substrat (Figure \(\PageIndex{8}\)). Comme une seule molécule inhibitrice est nécessaire par enzyme pour une inhibition efficace, la concentration d'inhibiteurs nécessaire à une inhibition non compétitive est généralement bien inférieure à la concentration du substrat.
Outre les inhibiteurs allostériques, il existe des activateurs allostériques qui se lient à des emplacements d'une enzyme éloignés du site actif, induisant un changement de conformation qui augmente l'affinité du ou des sites actifs de l'enzyme pour son ou ses substrats.
Le contrôle allostérique est un mécanisme important de régulation des voies métaboliques impliquées à la fois dans le catabolisme et l'anabolisme. De la manière la plus efficace et la plus élégante, les cellules ont également évolué pour utiliser les produits de leurs propres réactions métaboliques pour la rétroinhibition de l'activité enzymatique. La rétroinhibition implique l'utilisation d'un produit de synthèse pour réguler sa propre production ultérieure. La cellule répond à l'abondance de produits spécifiques en ralentissant la production lors de réactions anaboliques ou cataboliques (Figure\(\PageIndex{8}\)).
Exercice\(\PageIndex{5}\)
Expliquez la différence entre un inhibiteur compétitif et un inhibiteur non compétitif.
Concepts clés et résumé
- Le métabolisme comprend des réactions chimiques qui décomposent les molécules complexes (catabolisme) et celles qui fabriquent des molécules complexes (anabolisme).
- Les organismes peuvent être classés en fonction de leur source de carbone. Les autotrophes convertissent le dioxyde de carbone inorganique en carbone organique ; les hétérotrophes utilisent des composés de carbone organique fixes.
- Les organismes peuvent également être classés en fonction de leur source d'énergie. Les phototrophes tirent leur énergie de la lumière. Les chimiotrophes tirent leur énergie de composés chimiques. Les organotrophes utilisent des molécules organiques et les lithotrophes utilisent des produits chimiques inorganiques.
- Les porteurs d'électrons cellulaires acceptent les électrons de haute énergie provenant des aliments et servent ensuite de donneurs d'électrons dans les réactions redox ultérieures. Le FAD/FADH 2, le NAD + /NADH et le NADP + /NADPH sont d'importants porteurs d'électrons.
- L'adénosine triphosphate (ATP) est la monnaie énergétique de la cellule, stockant en toute sécurité l'énergie chimique dans ses deux liaisons phosphates à haute énergie pour une utilisation ultérieure dans le cadre de processus nécessitant de l'énergie.
- Les enzymes sont des catalyseurs biologiques qui augmentent la vitesse des réactions chimiques à l'intérieur des cellules en diminuant l'énergie d'activation requise pour que la réaction se déroule.
- Dans la nature, les réactions exergoniques ne nécessitent pas d'énergie au-delà de l'énergie d'activation pour se produire, et elles libèrent de l'énergie. Ils peuvent se produire sans enzymes, mais à un rythme lent. Inversement, les réactions endergoniques ont besoin d'énergie au-delà de l'énergie d'activation pour se produire Dans les cellules, les réactions endergoniques sont couplées à des réactions exergoniques, ce qui rend la combinaison énergétiquement favorable.
- Les substrats se lient au site actif de l'enzyme. Ce processus modifie généralement les structures du site actif et du substrat, favorisant ainsi la formation d'un état de transition ; c'est ce que l'on appelle l'ajustement induit.
- Les cofacteurs sont des ions inorganiques qui stabilisent la conformation et la fonction des enzymes. Les coenzymes sont des molécules organiques nécessaires au bon fonctionnement des enzymes et sont souvent dérivées de vitamines. Une enzyme dépourvue de cofacteur ou de coenzyme est une apoenzyme ; une enzyme avec un cofacteur ou une coenzyme lié est une holoenzyme.
- Les inhibiteurs compétitifs régulent les enzymes en se liant au site actif de l'enzyme, empêchant ainsi la liaison au substrat. Les inhibiteurs non compétitifs (allostériques) se lient aux sites allostériques, induisant un changement conformationnel de l'enzyme qui l'empêche de fonctionner. La rétroinhibition se produit lorsque le produit d'une voie métabolique se lie de manière non compétitive à une enzyme au début de la voie, empêchant ainsi la synthèse du produit.


