7.1 : Molécules organiques
- Page ID
- 187789
Objectifs d'apprentissage
- Identifier les éléments et les structures communs des molécules organiques
- Expliquer le concept d'isomérie
- Identifier des exemples de groupes fonctionnels
- Décrire le rôle des groupes fonctionnels dans la synthèse des polymères
Orientation clinique : 1ère partie
Penny est une étudiante de 16 ans qui a consulté son médecin pour se plaindre d'une éruption cutanée qui démange. Elle avait des antécédents d'allergies. Le médecin a examiné sa peau bronzée par le soleil et lui a demandé si elle avait changé de crème solaire. Elle a dit que oui, alors le médecin a diagnostiqué un eczéma allergique. Les symptômes étant légers, le médecin a dit à Penny d'éviter d'utiliser la crème solaire à l'origine de la réaction et lui a prescrit une crème hydratante en vente libre pour garder sa peau hydratée et soulager les démangeaisons.
Exercice\(\PageIndex{1}\)
- Quels types de substances vous attendriez-vous à trouver dans une crème hydratante ?
- Quelles propriétés physiques ou chimiques de ces substances aideraient à soulager les démangeaisons et les inflammations de la peau ?
La biochimie est la discipline qui étudie la chimie de la vie et a pour objectif d'expliquer la forme et la fonction en se basant sur des principes chimiques. La chimie organique est la discipline consacrée à l'étude de la chimie basée sur le carbone, qui est à la base de l'étude des biomolécules et de la discipline de la biochimie. La biochimie et la chimie organique sont toutes deux basées sur les concepts de chimie générale, dont certains sont présentés à l'annexe A.
Éléments contenus dans les cellules vivantes
L'élément le plus abondant dans les cellules est l'hydrogène (H), suivi du carbone (C), de l'oxygène (O), de l'azote (N), du phosphore (P) et du soufre (S). Nous appelons ces éléments des macronutriments, et ils représentent environ 99 % du poids sec des cellules. Certains éléments, tels que le sodium (Na), le potassium (K), le magnésium (Mg), le zinc (Zn), le fer (Fe), le calcium (Ca), le molybdène (Mo), le cuivre (Cu), le cobalt (Co), le manganèse (Mn) ou le vanadium (Va), sont nécessaires à certaines cellules en très petites quantités et sont appelés micronutriments ou oligo-éléments. Tous ces éléments sont essentiels au fonctionnement de nombreuses réactions biochimiques et, par conséquent, à la vie.
Les quatre éléments les plus abondants de la matière vivante (C, N, O et H) ont un faible numéro atomique et sont donc des éléments légers capables de former des liens solides avec d'autres atomes pour produire des molécules (Figure\(\PageIndex{1}\)). Le carbone forme quatre liaisons chimiques, tandis que l'azote en forme trois, l'oxygène en forme deux et l'hydrogène en forme une. Lorsqu'ils sont liés entre eux au sein de molécules, l'oxygène, le soufre et l'azote possèdent souvent une ou plusieurs « paires isolées » d'électrons qui jouent un rôle important dans la détermination de nombreuses propriétés physiques et chimiques des molécules (voir annexe A). Ces caractéristiques combinées permettent la formation d'un grand nombre d'espèces moléculaires diverses nécessaires à la formation des structures et au fonctionnement des organismes vivants.
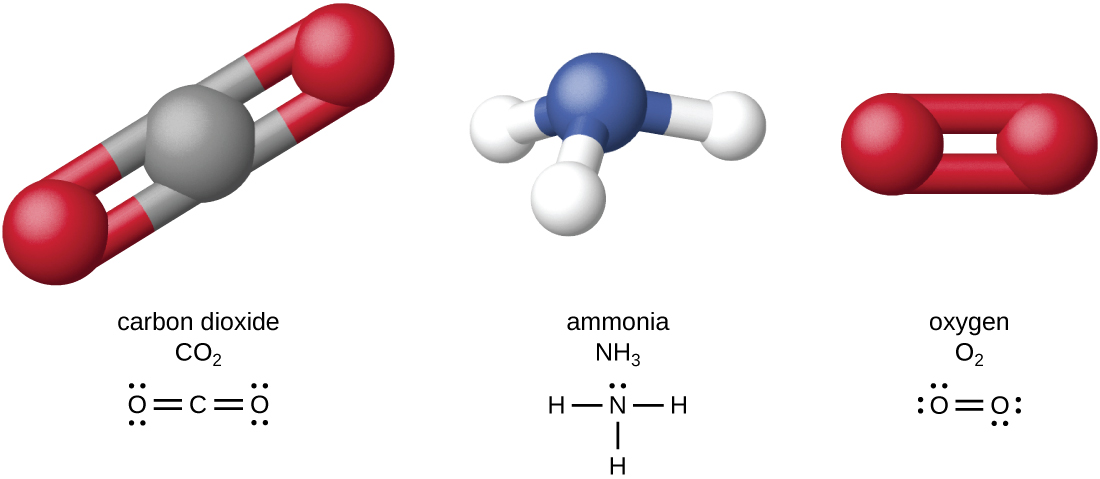
Les organismes vivants contiennent des composés inorganiques (principalement de l'eau et des sels ; voir l'annexe A) et des molécules organiques. Les molécules organiques contiennent du carbone, mais pas les composés inorganiques. Les oxydes de carbone et les carbonates sont des exceptions ; ils contiennent du carbone mais sont considérés comme inorganiques car ils ne contiennent pas d'hydrogène. Les atomes d'une molécule organique sont généralement organisés autour de chaînes d'atomes de carbone.
Les composés inorganiques représentent entre 1 % et 1,5 % de la masse d'une cellule vivante. Ce sont de petits composés simples qui jouent un rôle important dans la cellule, bien qu'ils ne forment pas de structures cellulaires. La majeure partie du carbone présent dans les molécules organiques provient de sources de carbone inorganique telles que le dioxyde de carbone capté par fixation du carbone par des microorganismes.
Exercice\(\PageIndex{2}\)
- Décrivez les éléments les plus abondants de la nature.
- Quelles sont les différences entre les molécules organiques et inorganiques ?
Molécules organiques et isomérisme
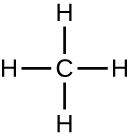
Les molécules organiques des organismes sont généralement plus grosses et plus complexes que les molécules inorganiques. Leurs squelettes en carbone sont maintenus ensemble par des liaisons covalentes. Elles forment les cellules d'un organisme et effectuent les réactions chimiques qui facilitent la vie. Toutes ces molécules, appelées biomolécules parce qu'elles font partie de la matière vivante, contiennent du carbone, élément constitutif de la vie. Le carbone est un élément tout à fait unique en ce sens qu'il possède quatre électrons de valence sur ses orbitales extérieures et qu'il peut former quatre liaisons covalentes simples avec jusqu'à quatre autres atomes en même temps (voir l'annexe A). Ces atomes sont généralement l'oxygène, l'hydrogène, l'azote, le soufre, le phosphore et le carbone lui-même ; le composé organique le plus simple est le méthane, dans lequel le carbone ne se lie qu'à l'hydrogène (Figure\(\PageIndex{2}\)).
En raison de la combinaison unique de taille et de propriétés de liaison du carbone, les atomes de carbone peuvent se lier en grand nombre, produisant ainsi une chaîne ou un squelette carboné. Le squelette carboné des molécules organiques peut être droit, ramifié ou en forme d'anneau (cyclique). Les molécules organiques sont construites sur des chaînes d'atomes de carbone de différentes longueurs ; la plupart sont généralement très longues, ce qui permet la formation d'un grand nombre et d'une grande variété de composés. Aucun autre élément n'a la capacité de former autant de molécules différentes de tailles et de formes différentes.
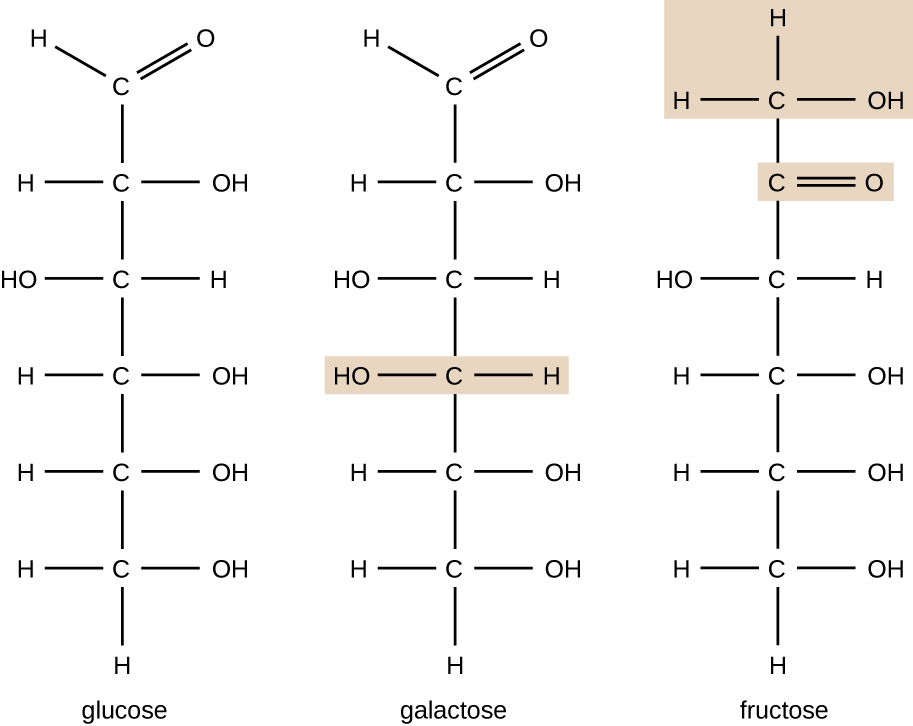
Les molécules ayant la même composition atomique mais une disposition structurelle différente des atomes sont appelées isomères. Le concept d'isomérie est très important en chimie car la structure d'une molécule est toujours directement liée à sa fonction. De légères modifications des arrangements structuraux des atomes d'une molécule peuvent conduire à des propriétés très différentes. Les chimistes représentent les molécules par leur formule structurale, qui est une représentation graphique de la structure moléculaire, montrant comment les atomes sont disposés. Les composés qui ont des formules moléculaires identiques mais dont la séquence de liaison des atomes diffère sont appelés isomères structuraux. Les monosaccharides glucose, galactose et fructose ont tous la même formule moléculaire, C 6 H 12 O 6, mais nous pouvons voir sur la figure\(\PageIndex{3}\) que les atomes sont liés entre eux différemment.
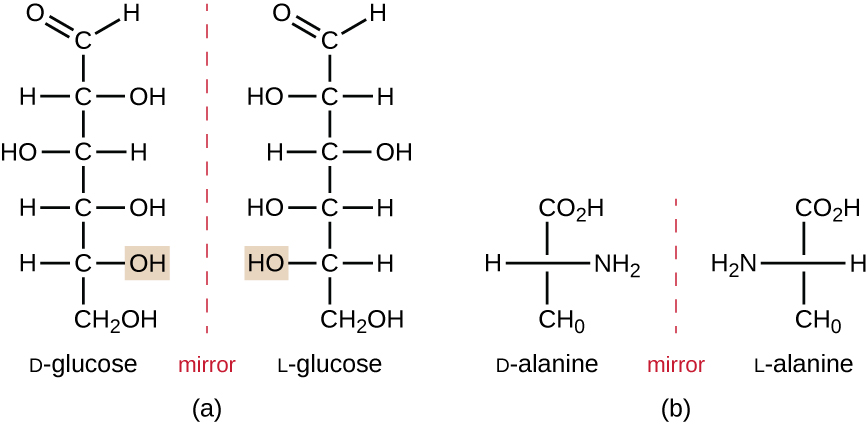
Les isomères qui diffèrent dans la disposition spatiale des atomes sont appelés stéréoisomères ; les énantiomères constituent un type unique. Les propriétés des énantiomères ont été découvertes à l'origine par Louis Pasteur en 1848 alors qu'il utilisait un microscope pour analyser les produits de fermentation cristallisés du vin. Les énantiomères sont des molécules qui ont la caractéristique de chiralité, dans lesquelles leurs structures sont des images miroir non superposables les unes des autres. La chiralité est une caractéristique importante de nombreuses molécules biologiquement importantes, comme l'illustrent les exemples de différences structurales entre les formes énantiomériques du glucose monosaccharide ou de l'acide aminé alanine (Figure\(\PageIndex{4}\)).
De nombreux organismes ne peuvent utiliser qu'une seule forme énantiomérique de certains types de molécules comme nutriments et comme éléments constitutifs pour créer des structures au sein d'une cellule. Certaines formes énantiomériques d'acides aminés ont des goûts et des odeurs nettement différents lorsqu'elles sont consommées comme aliments. Par exemple, le L-aspartame, communément appelé aspartame, a un goût sucré, tandis que le D-aspartame est insipide. Les énantiomères des médicaments peuvent avoir des effets pharmacologiques très différents. Par exemple, le composé méthorphane existe sous la forme de deux énantiomères, dont l'un agit comme antitussif (dextrométhorphane, un antitussif), tandis que l'autre agit comme analgésique (lévo méthorphane, un médicament ayant un effet similaire à celui de la codéine).
Les énantiomères sont également appelés isomères optiques car ils peuvent faire pivoter le plan de la lumière polarisée. Certains des cristaux que Pasteur a observés lors de la fermentation du vin tournaient légèrement dans le sens des aiguilles d'une montre, tandis que d'autres tournaient la lumière dans le Aujourd'hui, nous désignons des énantiomères qui font pivoter la lumière polarisée dans le sens des aiguilles d'une montre (+) lorsque d se forme, et l'image miroir de la même molécule qui fait pivoter la lumière polarisée dans le sens antihoraire (−) comme la forme l. Les étiquettes d et l sont dérivées des mots latins dexter (à droite) et laevus (à gauche), respectivement. Ces deux isomères optiques différents ont souvent des propriétés et des activités biologiques très différentes. Certaines espèces de moisissures, de levures et de bactéries, telles que Rhizopus, Yarrowia et Lactobacillus spp., respectivement, ne peuvent métaboliser qu'un seul type d'isomère optique ; l'isomère opposé ne convient pas comme source de nutriments. Une autre raison importante de connaître les isomères optiques est l'utilisation thérapeutique de ces types de produits chimiques pour le traitement médicamenteux, car certains microorganismes ne peuvent être affectés que par un isomère optique spécifique.
Exercice\(\PageIndex{3}\)
Nous disons que la vie est basée sur le carbone. Qu'est-ce qui rend le carbone si apte à faire partie de toutes les macromolécules des organismes vivants ?
Groupes fonctionnels biologiquement significatifs
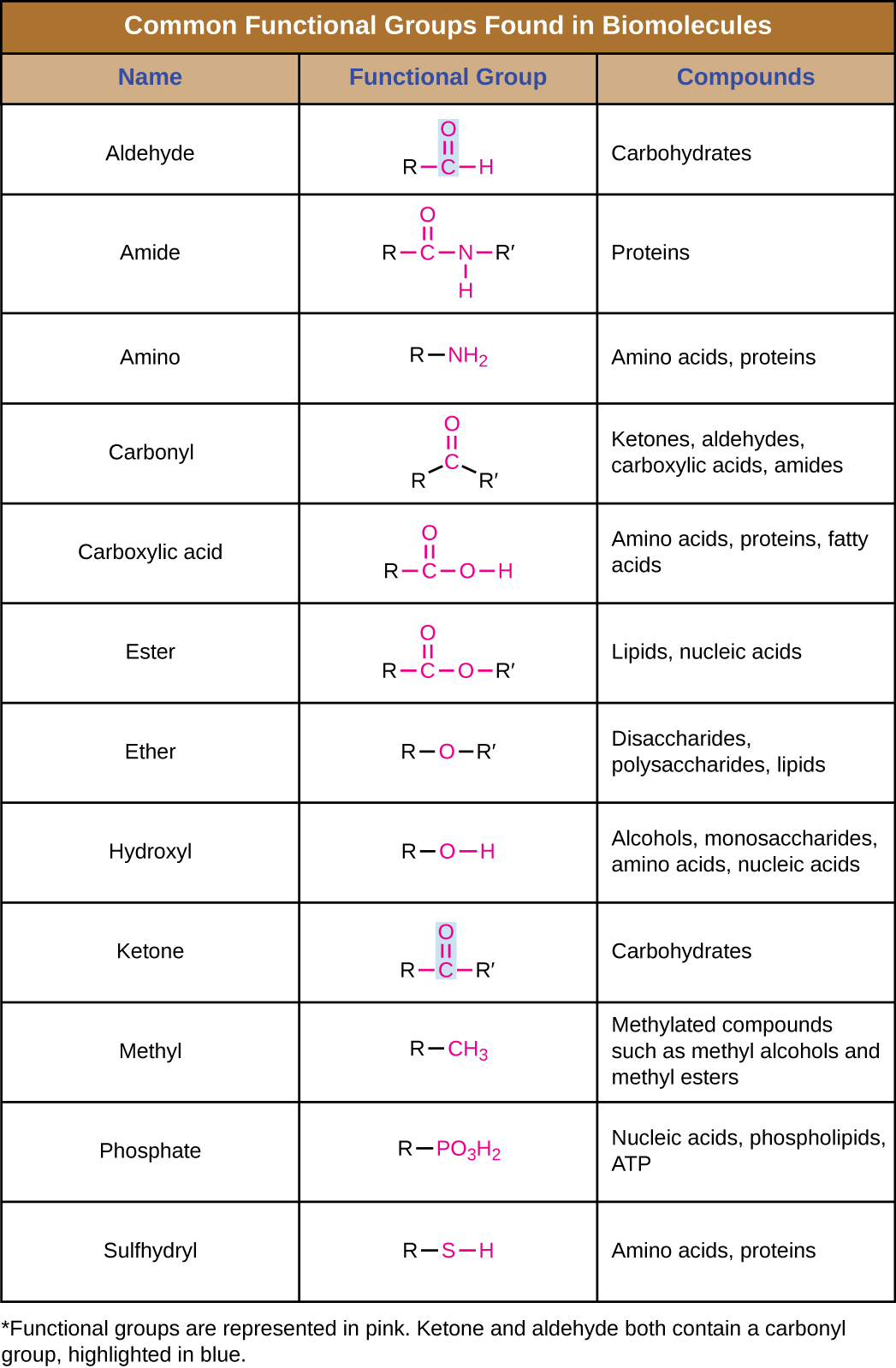
En plus de contenir des atomes de carbone, les biomolécules contiennent également des groupes fonctionnels, c'est-à-dire des groupes d'atomes au sein de molécules qui sont classés selon leur composition chimique spécifique et les réactions chimiques qu'elles effectuent, quelle que soit la molécule dans laquelle le groupe se trouve. Certains des groupes fonctionnels les plus courants sont répertoriés dans la figure\(\PageIndex{5}\). Dans les formules, le symbole R signifie « résidu » et représente le reste de la molécule. R peut symboliser un seul atome d'hydrogène ou représenter un groupe de nombreux atomes. Notez que certains groupes fonctionnels sont relativement simples, composés d'un ou deux atomes seulement, tandis que d'autres comprennent deux de ces groupes fonctionnels plus simples. Par exemple, un groupe carbonyle est un groupe fonctionnel composé d'un atome de carbone lié deux fois à un atome d'oxygène : C=O. Il est présent dans plusieurs classes de composés organiques au sein de groupes fonctionnels plus importants tels que les cétones, les aldéhydes, les acides carboxyliques et les amides. Dans les cétones, le carbonyle est présent sous forme de groupe interne, alors que dans les aldéhydes, il s'agit d'un groupe terminal.
Macromolécules
Les chaînes de carbone forment le squelette de la plupart des molécules organiques. Les groupes fonctionnels se combinent à la chaîne pour former des biomolécules. Comme ces biomolécules sont généralement de grande taille, nous les appelons macromolécules. De nombreuses macromolécules pertinentes du point de vue biologique sont formées en reliant entre elles un grand nombre de molécules organiques plus petites identiques ou très similaires. Les plus petites molécules agissent comme des éléments constitutifs et sont appelées monomères, et les macromolécules qui résultent de leur liaison sont appelées polymères. Les cellules et les structures cellulaires comprennent quatre groupes principaux de macromolécules contenant du carbone : les polysaccharides, les protéines, les lipides et les acides nucléiques. Les trois premiers groupes de molécules seront étudiés tout au long de ce chapitre. La biochimie des acides nucléiques sera abordée dans Biochimie du génome.
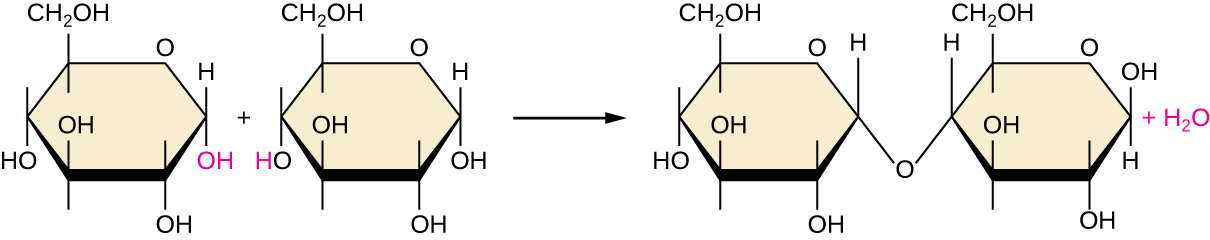
Parmi les nombreuses façons dont les monomères peuvent être combinés pour produire des polymères, la synthèse par déshydratation est une approche courante rencontrée dans la formation de macromolécules biologiques. Dans cette réaction chimique, les molécules de monomères se lient bout à bout dans un processus qui aboutit à la formation de molécules d'eau en tant que sous-produit :
\[\text{H—monomer—OH} + \text{H—monomer—OH} ⟶ \text{H—monomer—monomer—OH} + \ce{H2O}\]
La figure\(\PageIndex{6}\) montre la synthèse par déshydratation du glucose qui se lie pour former du maltose et une molécule d'eau. \(\PageIndex{1}\)Le tableau résume les macromolécules et certaines de leurs fonctions.
| Macromolécule | Fonctions |
|---|---|
| Les glucides | Stockage d'énergie, récepteurs, nourriture, rôle structurel chez les plantes, parois cellulaires fongiques, exosquelettes d'insectes |
| Lipides | Stockage d'énergie, structure de la membrane, isolation, hormones, pigments |
| Acides nucléiques | Stockage et transfert d'informations génétiques |
| Les protéines | Enzymes, structure, récepteurs, transport, rôle structurel dans le cytosquelette d'une cellule et la matrice extracellulaire |
Exercice\(\PageIndex{4}\)
Quel est le sous-produit d'une réaction de synthèse par déshydratation ?
Concepts clés et résumé
- Les éléments les plus abondants dans les cellules sont l'hydrogène, le carbone, l'oxygène, l'azote, le phosphore et le soufre.
- La vie est basée sur le carbone. Chaque atome de carbone peut se lier à un autre, produisant ainsi un squelette de carbone qui peut être droit, ramifié ou en forme d'anneau.
- Les mêmes nombres et types d'atomes peuvent se lier entre eux de différentes manières pour produire différentes molécules appelées isomères. Les isomères peuvent différer dans la séquence de liaison de leurs atomes (isomères structuraux) ou dans la disposition spatiale des atomes dont les séquences de liaison sont les mêmes (stéréoisomères), et leurs propriétés physiques et chimiques peuvent varier légèrement ou radicalement.
- Les groupes fonctionnels confèrent des propriétés chimiques spécifiques aux molécules qui les contiennent. Les groupes fonctionnels courants dans les biomolécules sont l'hydroxyle, le méthyle, le carbonyle, le carboxyle, l'amino, le phosphate et le sulfhydryle.
- Les macromolécules sont des polymères assemblés à partir d'unités individuelles, les monomères, qui se lient ensemble comme des éléments constitutifs. De nombreuses macromolécules importantes sur le plan biologique sont formées par synthèse par déshydratation, un processus dans lequel les monomères se lient entre eux en combinant leurs groupes fonctionnels et en générant des molécules d'eau en tant que sous-produits.


