4.1 : Énergie et métabolisme
- Page ID
- 186410
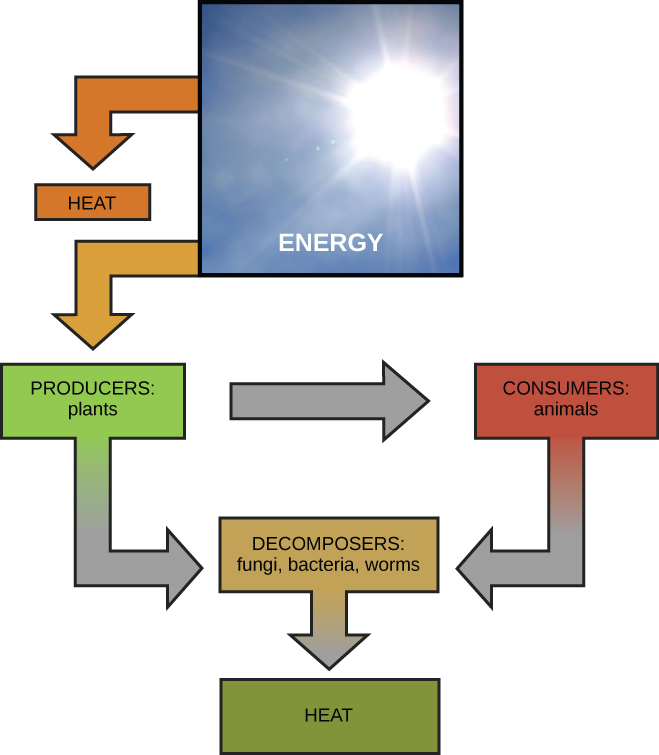
Les scientifiques utilisent le terme bioénergétique pour décrire le concept du flux d'énergie (Figure\(\PageIndex{1}\)) à travers les systèmes vivants, tels que les cellules. Les processus cellulaires tels que la construction et la dégradation de molécules complexes se produisent par des réactions chimiques par étapes. Certaines de ces réactions chimiques sont spontanées et libèrent de l'énergie, tandis que d'autres nécessitent de l'énergie pour se produire. Tout comme les êtres vivants doivent continuellement consommer de la nourriture pour reconstituer leurs réserves d'énergie, les cellules doivent produire continuellement plus d'énergie pour reconstituer celle utilisée par les nombreuses réactions chimiques nécessitant de l'énergie qui se produisent constamment. Ensemble, toutes les réactions chimiques qui se produisent à l'intérieur des cellules, y compris celles qui consomment ou génèrent de l'énergie, sont appelées métabolisme de la cellule.
Voies métaboliques
Considérez le métabolisme du sucre. Il s'agit d'un exemple classique de l'un des nombreux processus cellulaires qui utilisent et produisent de l'énergie. Les êtres vivants consomment des sucres comme source d'énergie majeure, car les molécules de sucre stockent une grande quantité d'énergie dans leurs liaisons. Dans la plupart des cas, les organismes photosynthétiques tels que les plantes produisent ces sucres. Lors de la photosynthèse, les plantes utilisent de l'énergie (provenant de la lumière solaire) pour convertir le dioxyde de carbone (CO 2) en molécules de sucre (comme le glucose : C 6 H 12 O 6). Ils consomment du dioxyde de carbone et produisent de l'oxygène sous forme de déchets. Cette réaction est résumée comme suit :
\[\ce{6CO2 + 6H2O -> C6H12O6 + 6O2}\nonumber\]
Comme ce processus implique la synthèse d'une molécule stockant de l'énergie, il nécessite un apport d'énergie pour se poursuivre. Lors des réactions lumineuses de la photosynthèse, l'énergie est fournie par une molécule appelée adénosine triphosphate (ATP), qui est la principale monnaie énergétique de toutes les cellules. Tout comme le dollar est utilisé comme monnaie pour acheter des biens, les cellules utilisent des molécules d'ATP comme monnaie énergétique pour effectuer un travail immédiat. En revanche, les molécules de stockage d'énergie telles que le glucose ne sont consommées que pour être décomposées afin d'utiliser leur énergie. La réaction qui permet de récolter l'énergie d'une molécule de sucre dans les cellules qui ont besoin d'oxygène pour survivre peut être résumée par la réaction inverse à la photosynthèse. Lors de cette réaction, de l'oxygène est consommé et du dioxyde de carbone est libéré sous forme de déchets. La réaction est résumée comme suit :
\[\ce{C6H12O6 + 6O2 -> 6H2O + 6CO2}\nonumber\]
Ces deux réactions impliquent de nombreuses étapes.
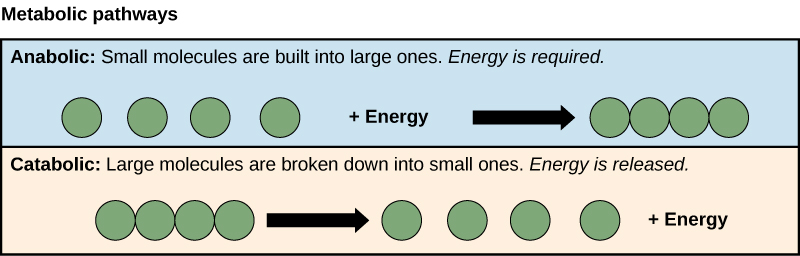
Les processus de fabrication et de dégradation des molécules de sucre illustrent deux exemples de voies métaboliques. Une voie métabolique est une série de réactions chimiques qui prennent une molécule de départ et la modifient, étape par étape, par le biais d'une série d'intermédiaires métaboliques, pour finalement aboutir à un produit final. Dans l'exemple du métabolisme du sucre, la première voie métabolique synthétisait le sucre à partir de molécules plus petites, et l'autre voie décomposait le sucre en molécules plus petites. Ces deux processus opposés, le premier nécessitant de l'énergie et le second produisant de l'énergie, sont appelés voies anaboliques (polymères de construction) et voies cataboliques (décomposition des polymères en leurs monomères), respectivement. Par conséquent, le métabolisme est composé de synthèse (anabolisme) et de dégradation (catabolisme) (Figure\(\PageIndex{2}\)).
Il est important de savoir que les réactions chimiques des voies métaboliques ne se produisent pas d'elles-mêmes. Chaque étape de la réaction est facilitée, ou catalysée, par une protéine appelée enzyme. Les enzymes sont importantes pour catalyser tous les types de réactions biologiques, qu'elles nécessitent de l'énergie ou qu'elles libèrent de l'énergie.
Énergie
La thermodynamique fait référence à l'étude de l'énergie et du transfert d'énergie impliquant de la matière physique. La matière qui se rapporte à un cas particulier de transfert d'énergie est appelée système, et tout ce qui se trouve en dehors de cette matière est appelé environnement. Par exemple, lorsque vous chauffez une casserole d'eau sur la cuisinière, le système inclut la cuisinière, la marmite et l'eau. L'énergie est transférée dans le système (entre le poêle, la marmite et l'eau). Il existe deux types de systèmes : ouverts et fermés. Dans un système ouvert, l'énergie peut être échangée avec son environnement. Le système de cuisson est ouvert car la chaleur peut être perdue dans l'air. Un système fermé ne peut pas échanger d'énergie avec son environnement.
Les organismes biologiques sont des systèmes ouverts. L'énergie est échangée entre eux et leur environnement lorsqu'ils utilisent l'énergie du soleil pour effectuer la photosynthèse ou consomment des molécules qui stockent de l'énergie et libèrent de l'énergie dans l'environnement en travaillant et en libérant de la chaleur. Comme tout ce qui se passe dans le monde physique, l'énergie est soumise à des lois physiques. Les lois de la thermodynamique régissent le transfert d'énergie dans et entre tous les systèmes de l'univers.
En général, l'énergie est définie comme la capacité de travailler ou de créer une sorte de changement. L'énergie existe sous différentes formes. Par exemple, l'énergie électrique, l'énergie lumineuse et l'énergie thermique sont toutes des types d'énergie différents. Pour comprendre la façon dont l'énergie entre et sort des systèmes biologiques, il est important de comprendre deux des lois physiques qui régissent l'énergie.
Thermodynamique
La première loi de la thermodynamique stipule que la quantité totale d'énergie dans l'univers est constante et conservée. En d'autres termes, il y a toujours eu et il y aura toujours exactement la même quantité d'énergie dans l'univers. L'énergie existe sous de nombreuses formes différentes. Selon la première loi de la thermodynamique, l'énergie peut être transférée d'un endroit à l'autre ou transformée sous différentes formes, mais elle ne peut être ni créée ni détruite. Les transferts et les transformations d'énergie se produisent tout le temps autour de nous. Les ampoules transforment l'énergie électrique en énergie lumineuse et thermique. Les cuisinières à gaz transforment l'énergie chimique du gaz naturel en énergie thermique. Les plantes effectuent l'une des transformations énergétiques les plus utiles sur Terre sur le plan biologique : celle de convertir l'énergie de la lumière solaire en énergie chimique stockée dans les molécules organiques (Figure\(\PageIndex{1}\)). Quelques exemples de transformations énergétiques sont présentés dans la figure\(\PageIndex{3}\).
Le défi pour tous les organismes vivants est d'obtenir de l'énergie de leur environnement sous des formes qu'ils peuvent transférer ou transformer en énergie utilisable pour leur travail. Les cellules vivantes ont évolué pour relever ce défi. L'énergie chimique stockée dans les molécules organiques telles que les sucres et les graisses est transférée et transformée par une série de réactions chimiques cellulaires en énergie au sein des molécules d'ATP. L'énergie contenue dans les molécules d'ATP est facilement accessible pour travailler. Parmi les types de travail que les cellules doivent effectuer, citons la construction de molécules complexes, le transport de matériaux, la stimulation du mouvement des cils ou des flagelles et la contraction des fibres musculaires pour créer du mouvement.

Les principales tâches d'une cellule vivante qui consistent à obtenir, transformer et utiliser l'énergie pour travailler peuvent sembler simples. Cependant, la deuxième loi de la thermodynamique explique pourquoi ces tâches sont plus difficiles qu'il n'y paraît. Tous les transferts et transformations d'énergie ne sont jamais totalement efficaces. Lors de chaque transfert d'énergie, une certaine quantité d'énergie est perdue sous une forme inutilisable. Dans la plupart des cas, cette forme est l'énergie thermique. Sur le plan thermodynamique, l'énergie thermique est définie comme l'énergie transférée d'un système à un autre qui ne fonctionne pas. Par exemple, lorsqu'une ampoule est allumée, une partie de l'énergie convertie de l'énergie électrique en énergie lumineuse est perdue sous forme d'énergie thermique. De même, une partie de l'énergie est perdue sous forme d'énergie thermique lors des réactions métaboliques cellulaires.
Un concept important des systèmes physiques est celui de l'ordre et du désordre. Plus un système perd de l'énergie dans son environnement, moins il est ordonné et aléatoire. Les scientifiques appellent entropie la mesure du caractère aléatoire ou du désordre au sein d'un système. Une entropie élevée signifie un désordre élevé et une faible énergie. Les molécules et les réactions chimiques ont également une entropie variable. Par exemple, l'entropie augmente à mesure que les molécules à forte concentration se diffusent et s'étalent en un seul endroit. La deuxième loi de la thermodynamique dit que l'énergie sera toujours perdue sous forme de chaleur lors des transferts ou des transformations d'énergie.
Les êtres vivants sont très ordonnés et nécessitent un apport énergétique constant pour être maintenus dans un état de faible entropie.
Énergie potentielle et cinétique
Lorsqu'un objet est en mouvement, de l'énergie est associée à cet objet. Pense à un boulet de démolition. Même une boule de démolition lente peut infliger de gros dégâts à d'autres objets. L'énergie associée aux objets en mouvement est appelée énergie cinétique (Figure\(\PageIndex{4}\)). Une balle en excès de vitesse, une personne qui marche et le mouvement rapide des molécules dans l'air (qui produisent de la chaleur) ont tous de l'énergie cinétique.
Et si cette même boule de démolition immobile était soulevée deux étages au-dessus du sol avec une grue ? Si la boule de démolition suspendue est immobile, y a-t-il de l'énergie qui lui est associée ? La réponse est oui. L'énergie qui était nécessaire pour soulever la boule de démolition n'a pas disparu, mais est maintenant stockée dans la boule de démolition en raison de sa position et de la force de gravité agissant sur elle. Ce type d'énergie est appelé énergie potentielle (Figure\(\PageIndex{4}\)). Si la balle tombait, l'énergie potentielle serait transformée en énergie cinétique jusqu'à ce que toute l'énergie potentielle soit épuisée lorsque la balle reposait sur le sol. Les balles de démolition se balancent également comme un pendule ; à travers la balançoire, il y a un changement constant de l'énergie potentielle (la plus élevée en haut de la balançoire) en énergie cinétique (la plus élevée en bas de la balançoire). D'autres exemples d'énergie potentielle incluent l'énergie de l'eau retenue derrière un barrage ou celle d'une personne sur le point de sortir d'un avion en parachute.

L'énergie potentielle n'est pas seulement associée à la localisation de la matière, mais également à sa structure. Même un ressort posé au sol a de l'énergie potentielle s'il est comprimé, de même qu'un élastique tendu. Au niveau moléculaire, les liaisons qui unissent les atomes des molécules existent dans une structure particulière qui possède une énergie potentielle. N'oubliez pas que les voies cellulaires anaboliques ont besoin d'énergie pour synthétiser des molécules complexes à partir de molécules plus simples et que les voies cataboliques libèrent de l'énergie lorsque des molécules complexes sont décomposées. Le fait que de l'énergie puisse être libérée par la rupture de certaines liaisons chimiques implique que ces liaisons possèdent de l'énergie potentielle. En fait, une énergie potentielle est stockée dans les liaisons de toutes les molécules alimentaires que nous consommons, qui est ensuite exploitée pour être utilisée. En effet, ces liaisons peuvent libérer de l'énergie lorsqu'elles sont rompues. Le type d'énergie potentielle qui existe dans les liaisons chimiques et qui est libérée lorsque ces liaisons sont rompues est appelé énergie chimique. L'énergie chimique est chargée de fournir aux cellules vivantes de l'énergie provenant des aliments. La libération d'énergie se produit lorsque les liaisons moléculaires au sein des molécules alimentaires sont rompues.
CONCEPT EN ACTION
Visitez le site et sélectionnez « Pendulum » dans le menu « Travail et énergie » pour voir l'énergie cinétique et potentielle changeante d'un pendule en mouvement.
Énergie gratuite et d'activation
Après avoir appris que les réactions chimiques libèrent de l'énergie lorsque les liaisons de stockage d'énergie sont rompues, une question importante suivante est la suivante : Comment l'énergie associée à ces réactions chimiques est-elle quantifiée et exprimée ? Comment comparer l'énergie libérée par une réaction à celle d'une autre réaction ? Une mesure de l'énergie libre est utilisée pour quantifier ces transferts d'énergie. Rappelons que selon la deuxième loi de la thermodynamique, tous les transferts d'énergie impliquent la perte d'une certaine quantité d'énergie sous une forme inutilisable telle que la chaleur. L'énergie libre fait spécifiquement référence à l'énergie associée à une réaction chimique qui est disponible une fois les pertes prises en compte. En d'autres termes, l'énergie gratuite est de l'énergie utilisable, ou de l'énergie disponible pour travailler.
Si de l'énergie est libérée lors d'une réaction chimique, la variation de l'énergie libre, exprimée par ∆G (delta G), sera un nombre négatif. Une variation négative de l'énergie libre signifie également que les produits de la réaction ont moins d'énergie libre que les réactifs, car ils libèrent de l'énergie libre pendant la réaction. Les réactions qui entraînent une modification négative de l'énergie libre et qui, par conséquent, libèrent de l'énergie libre sont appelées réactions exergoniques. Pensez : l'expression « exergonique » signifie que l'énergie sort du système. Ces réactions sont également appelées réactions spontanées, et leurs produits contiennent moins d'énergie stockée que les réactifs. Une distinction importante doit être faite entre le terme spontané et l'idée d'une réaction chimique se produisant immédiatement. Contrairement à l'usage courant du terme, une réaction spontanée n'est pas une réaction qui se produit soudainement ou rapidement. La rouille du fer est un exemple de réaction spontanée qui se produit lentement, petit à petit, au fil du temps.
Si une réaction chimique absorbe de l'énergie au lieu de libérer de l'énergie en équilibre, le ∆G de cette réaction sera une valeur positive. Dans ce cas, les produits contiennent plus d'énergie libre que les réactifs. Ainsi, les produits de ces réactions peuvent être considérés comme des molécules stockant de l'énergie. Ces réactions chimiques sont appelées réactions endergoniques et ne sont pas spontanées. Une réaction endergonique ne se produira pas seule sans l'ajout d'énergie libre.
ART CONNECTION

Examinez chacun des processus présentés et déterminez s'il est endergonique ou exergonique.
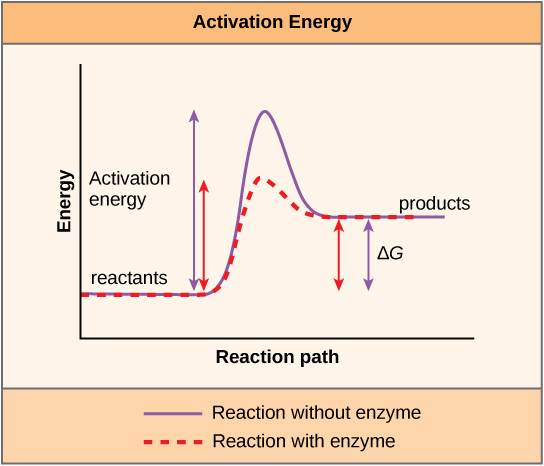
Un autre concept important doit être pris en compte concernant les réactions endergoniques et exergoniques. Les réactions exergoniques nécessitent un faible apport d'énergie pour démarrer, avant de pouvoir poursuivre leurs étapes de libération d'énergie. Ces réactions génèrent une libération nette d'énergie, mais nécessitent tout de même un apport énergétique au début. Cette petite quantité d'énergie nécessaire pour que toutes les réactions chimiques se produisent est appelée énergie d'activation.
CONCEPT EN ACTION
Regardez une animation montrant le passage de l'énergie libre à l'état de transition de la réaction.
Des enzymes
Une substance qui contribue à la survenue d'une réaction chimique est appelée catalyseur, et les molécules qui catalysent les réactions biochimiques sont appelées enzymes. La plupart des enzymes sont des protéines et ont pour fonction essentielle de réduire les énergies d'activation des réactions chimiques à l'intérieur de la cellule. La plupart des réactions critiques pour une cellule vivante se produisent trop lentement à des températures normales pour être utiles à la cellule. Sans enzymes capables d'accélérer ces réactions, la vie ne pourrait pas durer. Les enzymes y parviennent en se liant aux molécules du réactif et en les maintenant de manière à faciliter les processus chimiques de rupture et de formation des liaisons. Il est important de se rappeler que les enzymes ne changent pas, que la réaction soit exergonique (spontanée) ou endergonique. En effet, ils ne modifient pas l'énergie libre des réactifs ou des produits. Ils ne font que réduire l'énergie d'activation requise pour que la réaction se poursuive (Figure\(\PageIndex{6}\)). De plus, une enzyme elle-même n'est pas modifiée par la réaction qu'elle catalyse. Une fois qu'une réaction a été catalysée, l'enzyme peut participer à d'autres réactions.
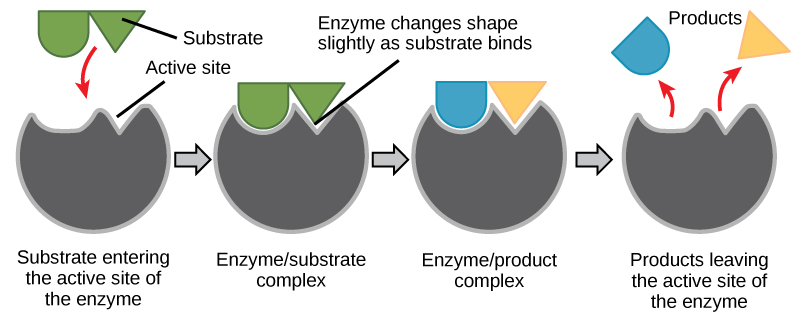
Les réactifs chimiques auxquels une enzyme se lie sont appelés substrats de l'enzyme. Il peut y avoir un ou plusieurs substrats, en fonction de la réaction chimique particulière. Dans certaines réactions, un seul substrat réactif est décomposé en plusieurs produits. Dans d'autres cas, deux substrats peuvent se réunir pour créer une molécule plus grosse. Deux réactifs peuvent également entrer dans une réaction et tous deux être modifiés, mais ils quittent la réaction sous forme de deux produits. L'emplacement au sein de l'enzyme où le substrat se lie est appelé site actif de l'enzyme. Le site actif est l'endroit où « l'action » se produit. Les enzymes étant des protéines, il existe une combinaison unique de chaînes latérales d'acides aminés au sein du site actif. Chaque chaîne latérale se caractérise par des propriétés différentes. Ils peuvent être grands ou petits, faiblement acides ou basiques, hydrophiles ou hydrophobes, chargés positivement ou négativement, ou neutres. La combinaison unique de chaînes latérales crée un environnement chimique très spécifique au sein du site actif. Cet environnement spécifique est adapté pour se lier à un substrat chimique (ou à des substrats) spécifiques.
Les sites actifs sont soumis aux influences de l'environnement local. L'augmentation de la température ambiante augmente généralement les vitesses de réaction, catalysées par des enzymes ou non. Cependant, des températures situées en dehors d'une plage optimale réduisent la vitesse à laquelle une enzyme catalyse une réaction. Les températures élevées finiront par provoquer la dénaturation des enzymes, une modification irréversible de la forme tridimensionnelle et donc de la fonction de l'enzyme. Les enzymes sont également adaptées pour fonctionner au mieux dans une certaine plage de pH et de concentration en sel et, comme pour la température, un pH extrême et des concentrations de sel peuvent provoquer la dénaturation des enzymes.
Pendant de nombreuses années, les scientifiques ont pensé que la liaison enzyme-substrat se faisait d'une manière simple « verrouillée ». Ce modèle a affirmé que l'enzyme et le substrat s'assemblent parfaitement en une seule étape instantanée. Cependant, les recherches actuelles soutiennent un modèle appelé ajustement induit (Figure\(\PageIndex{7}\)). Le modèle d'ajustement induit développe le modèle verrouillable en décrivant une liaison plus dynamique entre l'enzyme et le substrat. Lorsque l'enzyme et le substrat se rejoignent, leur interaction provoque une légère modification de la structure de l'enzyme qui forme un arrangement de liaison idéal entre l'enzyme et le substrat.
CONCEPT EN ACTION
Visionnez une animation de l'ajustement induit.
Lorsqu'une enzyme lie son substrat, un complexe enzyme-substrat se forme. Ce complexe réduit l'énergie d'activation de la réaction et favorise sa progression rapide de plusieurs manières possibles. À un niveau basique, les enzymes favorisent des réactions chimiques impliquant plus d'un substrat en rapprochant les substrats dans une orientation optimale pour la réaction. Les enzymes peuvent également favoriser la réaction de leurs substrats en créant un environnement optimal au sein du site actif pour que la réaction se produise. Les propriétés chimiques qui se dégagent de la disposition particulière des groupes d'acides aminés R au sein d'un site actif créent l'environnement idéal pour la réaction des substrats spécifiques d'une enzyme.
Le complexe enzyme-substrat peut également réduire l'énergie d'activation en compromettant la structure de la liaison afin qu'elle soit plus facile à rompre. Enfin, les enzymes peuvent également réduire les énergies d'activation en participant à la réaction chimique elle-même. Dans ces cas, il est important de se rappeler que l'enzyme retrouvera toujours son état d'origine à la fin de la réaction. L'une des propriétés caractéristiques des enzymes est qu'elles restent finalement inchangées par les réactions qu'elles catalysent. Une fois qu'une enzyme a catalysé une réaction, elle libère ses produits et peut catalyser une nouvelle réaction.
Il semblerait idéal d'avoir un scénario dans lequel toutes les enzymes d'un organisme existent en abondance et fonctionnent de manière optimale dans toutes les conditions cellulaires, dans toutes les cellules et à tout moment. Cependant, divers mécanismes garantissent que cela ne se produise pas. Les besoins et les conditions cellulaires varient constamment d'une cellule à l'autre et changent au sein de chaque cellule au fil du temps. Les enzymes requises pour les cellules de l'estomac diffèrent de celles des cellules adipeuses, des cellules de la peau, des cellules sanguines et des cellules nerveuses. De plus, une cellule d'un organe digestif travaille beaucoup plus dur pour traiter et décomposer les nutriments pendant la période qui suit de près un repas, par rapport à plusieurs heures après un repas. À mesure que ces exigences et conditions cellulaires varient, les quantités et la fonctionnalité des différentes enzymes doivent également varier.
Comme les vitesses des réactions biochimiques sont contrôlées par l'énergie d'activation et que les enzymes diminuent et déterminent les énergies d'activation des réactions chimiques, les quantités relatives et le fonctionnement des diverses enzymes au sein d'une cellule déterminent en fin de compte quelles réactions se produiront et à quelle vitesse. Cette détermination est étroitement contrôlée dans les cellules. Dans certains environnements cellulaires, l'activité enzymatique est partiellement contrôlée par des facteurs environnementaux tels que le pH, la température, la concentration en sel et, dans certains cas, des cofacteurs ou des coenzymes.
Les enzymes peuvent également être régulées de manière à favoriser ou à réduire l'activité enzymatique. Il existe de nombreux types de molécules qui inhibent ou favorisent la fonction enzymatique, ainsi que divers mécanismes par lesquels elles le font. Dans certains cas d'inhibition enzymatique, une molécule inhibitrice est suffisamment similaire à un substrat pour se lier au site actif et simplement empêcher le substrat de se lier. Lorsque cela se produit, l'enzyme est inhibée par inhibition compétitive, car une molécule inhibitrice entre en compétition avec le substrat pour se lier au site actif.
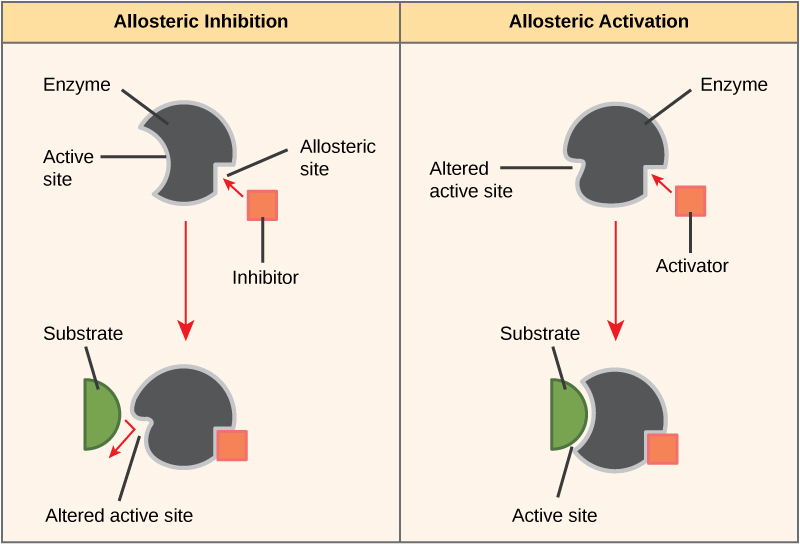
D'autre part, lors d'une inhibition non compétitive, une molécule inhibitrice se lie à l'enzyme à un endroit autre que le site actif, appelé site allostérique, mais parvient tout de même à bloquer la liaison du substrat au site actif. Certaines molécules inhibitrices se lient aux enzymes à un endroit où leur liaison induit un changement de conformation qui réduit l'affinité de l'enzyme pour son substrat. Ce type d'inhibition est appelé inhibition allostérique (Figure\(\PageIndex{8}\)). La plupart des enzymes régulées allostériquement sont constituées de plus d'un polypeptide, ce qui signifie qu'elles possèdent plus d'une sous-unité protéique. Lorsqu'un inhibiteur allostérique se lie à une région d'une enzyme, tous les sites actifs des sous-unités protéiques sont légèrement modifiés de telle sorte qu'ils se lient à leurs substrats avec moins d'efficacité. Il existe des activateurs allostériques ainsi que des inhibiteurs. Les activateurs allostériques se lient à des emplacements d'une enzyme éloignés du site actif, induisant un changement de conformation qui augmente l'affinité du ou des sites actifs de l'enzyme pour son ou ses substrats (Figure\(\PageIndex{8}\)).
CARRIÈRES EN ACTION : Développeur de médicaments pharmaceutiques

Les enzymes sont des composants clés des voies métaboliques. Comprendre le fonctionnement des enzymes et la manière dont elles peuvent être régulées sont des principes clés qui sous-tendent le développement de nombreux médicaments actuellement sur le marché. Les biologistes travaillant dans ce domaine collaborent avec d'autres scientifiques pour concevoir des médicaments (Figure\(\PageIndex{9}\)).
Prenons l'exemple des statines : les statines sont le nom donné à une classe de médicaments qui peuvent réduire le taux de cholestérol. Ces composés sont des inhibiteurs de l'enzyme HMG-CoA réductase, qui est l'enzyme qui synthétise le cholestérol à partir des lipides de l'organisme. En inhibant cette enzyme, le taux de cholestérol synthétisé dans l'organisme peut être réduit. De même, l'acétaminophène, couramment commercialisé sous le nom de marque Tylenol, est un inhibiteur de l'enzyme cyclooxygénase. Bien qu'il soit utilisé pour soulager la fièvre et l'inflammation (douleur), son mécanisme d'action n'est toujours pas complètement compris.
Comment découvre-t-on les médicaments ? L'un des plus grands défis de la découverte de médicaments consiste à identifier une cible médicamenteuse. Une cible médicamenteuse est une molécule qui est littéralement la cible du médicament. Dans le cas des statines, l'HMG-CoA réductase est la cible du médicament. Les cibles des médicaments sont identifiées grâce à des recherches minutieuses en laboratoire. Il ne suffit pas d'identifier la cible à elle seule ; les scientifiques doivent également savoir comment la cible agit à l'intérieur de la cellule et quelles réactions se produisent mal en cas de maladie. Une fois que la cible et la voie sont identifiées, le processus proprement dit de conception du médicament commence. À ce stade, les chimistes et les biologistes travaillent ensemble pour concevoir et synthétiser des molécules capables de bloquer ou d'activer une réaction particulière. Cependant, ce n'est qu'un début : si et quand un prototype de médicament réussit à remplir sa fonction, il est soumis à de nombreux tests, allant d'expériences in vitro à des essais cliniques, avant de pouvoir obtenir l'approbation de la Food and Drug Administration des États-Unis pour sa mise sur le marché.
De nombreuses enzymes ne fonctionnent pas de manière optimale, voire pas du tout, à moins d'être liées à d'autres molécules auxiliaires spécifiques non protéiques. Ils peuvent se lier soit temporairement par des liaisons ioniques ou hydrogène, soit de façon permanente par des liaisons covalentes plus fortes. La liaison à ces molécules favorise la forme et le fonctionnement optimaux de leurs enzymes respectives. Les cofacteurs et les coenzymes sont deux exemples de ces types de molécules auxiliaires. Les cofacteurs sont des ions inorganiques tels que les ions de fer et de magnésium. Les coenzymes sont des molécules auxiliaires organiques, celles dont la structure atomique de base est composée de carbone et d'hydrogène. Comme les enzymes, ces molécules participent aux réactions sans être elles-mêmes modifiées et sont finalement recyclées et réutilisées. Les vitamines sont à l'origine des coenzymes. Certaines vitamines sont les précurseurs des coenzymes et d'autres agissent directement comme des coenzymes. La vitamine C est une coenzyme directe de multiples enzymes qui participent à la construction du tissu conjonctif important, le collagène. La fonction enzymatique est donc en partie régulée par l'abondance de divers cofacteurs et coenzymes, qui peuvent être fournis par le régime alimentaire d'un organisme ou, dans certains cas, produits par l'organisme.
Inhibition du feedback dans les voies métaboliques
Les molécules peuvent réguler la fonction enzymatique de nombreuses manières. La grande question demeure toutefois : quelles sont ces molécules et d'où viennent-elles ? Certains sont des cofacteurs et des coenzymes, comme vous l'avez appris. Quelles autres molécules de la cellule assurent la régulation enzymatique, telle que la modulation allostérique et l'inhibition compétitive et non compétitive ? Les sources les plus pertinentes de molécules régulatrices, en ce qui concerne le métabolisme cellulaire enzymatique, sont peut-être les produits des réactions métaboliques cellulaires elles-mêmes. De la manière la plus efficace et la plus élégante, les cellules ont évolué pour utiliser les produits de leurs propres réactions pour inhiber par rétroaction l'activité enzymatique. La rétroinhibition implique l'utilisation d'un produit de réaction pour réguler sa propre production ultérieure (Figure\(\PageIndex{10}\)). La cellule répond à une abondance de produits en ralentissant la production lors de réactions anaboliques ou cataboliques. Ces produits de réaction peuvent inhiber les enzymes qui ont catalysé leur production par les mécanismes décrits ci-dessus.
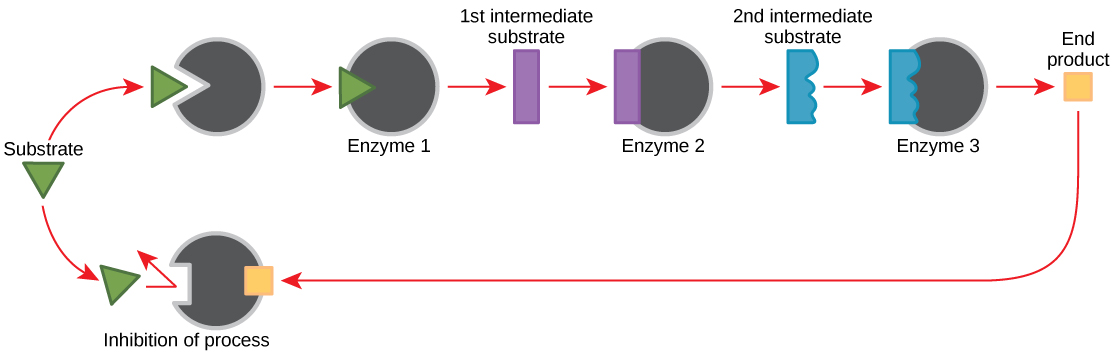
La production d'acides aminés et de nucléotides est contrôlée par une rétroinhibition. De plus, l'ATP est un régulateur allostérique de certaines enzymes impliquées dans la dégradation catabolique du sucre, le processus qui crée l'ATP. Ainsi, lorsque l'ATP est abondant, la cellule peut empêcher la production d'ATP. D'autre part, l'ADP sert de régulateur allostérique positif (activateur allostérique) pour certaines des enzymes inhibées par l'ATP. Ainsi, lorsque les niveaux relatifs d'ADP sont élevés par rapport à l'ATP, la cellule est déclenchée pour produire plus d'ATP par le biais du catabolisme du sucre.
Résumé de la section
Les cellules remplissent les fonctions de la vie par le biais de diverses réactions chimiques. Le métabolisme d'une cellule fait référence à la combinaison de réactions chimiques qui s'y produisent. Les réactions cataboliques décomposent les produits chimiques complexes en substances plus simples et sont associées à la libération d'énergie. Les processus anaboliques construisent des molécules complexes à partir de molécules plus simples et nécessitent de l'énergie.
Dans l'étude de l'énergie, le terme système fait référence à la matière et à l'environnement impliqués dans les transferts d'énergie. L'entropie est une mesure du désordre d'un système. Les lois physiques qui décrivent le transfert d'énergie sont les lois de la thermodynamique. La première loi stipule que la quantité totale d'énergie dans l'univers est constante. La deuxième loi de la thermodynamique stipule que chaque transfert d'énergie entraîne une certaine perte d'énergie sous une forme inutilisable, telle que l'énergie thermique. L'énergie se présente sous différentes formes : cinétique, potentielle et libre. La variation de l'énergie libre d'une réaction peut être négative (libère de l'énergie, exergonique) ou positive (consomme de l'énergie, endergonique). Toutes les réactions nécessitent un apport initial d'énergie pour se produire, appelé énergie d'activation.
Les enzymes sont des catalyseurs chimiques qui accélèrent les réactions chimiques en diminuant leur énergie d'activation. Les enzymes possèdent un site actif doté d'un environnement chimique unique qui convient à des réactifs chimiques particuliers à cette enzyme, appelés substrats. On pense que les enzymes et les substrats se lient selon un modèle d'ajustement induit. L'action des enzymes est régulée afin de préserver les ressources et de répondre de manière optimale à l'environnement.
Connexions artistiques
Figure\(\PageIndex{5}\) : Examinez chacun des processus présentés et déterminez s'il est endergonique ou exergonique.
- Réponse
-
La décomposition d'un tas de compost est un processus exergonique. Le développement d'un bébé à partir d'un ovule fécondé est un processus endergonique. La dissolution du thé dans l'eau est un processus exergonique. Une descente à billes est un processus exergonique.
Lexique
- énergie d'activation
- la quantité d'énergie initiale nécessaire pour que les réactions se produisent
- site actif
- une région spécifique de l'enzyme où le substrat se lie
- inhibition allostérique
- le mécanisme d'inhibition de l'action enzymatique par lequel une molécule régulatrice se lie à un second site (et non au site actif) et déclenche un changement de conformation dans le site actif, empêchant ainsi la liaison avec le substrat
- anabolisant
- décrit la voie qui nécessite un apport énergétique net pour synthétiser des molécules complexes à partir de molécules plus simples
- bioénergétique
- le concept du flux d'énergie à travers les systèmes vivants
- catabolique
- décrit la voie par laquelle les molécules complexes sont décomposées en molécules plus simples, produisant de l'énergie en tant que produit supplémentaire de la réaction
- inhibition compétitive
- un mécanisme général de régulation de l'activité enzymatique dans lequel une molécule autre que le substrat de l'enzyme est capable de se lier au site actif et d'empêcher le substrat lui-même de se lier, inhibant ainsi la vitesse globale de réaction de l'enzyme
- endergonique
- décrit une réaction chimique qui donne lieu à des produits qui emmagasinent plus d'énergie potentielle chimique que les réactifs
- enzyme
- une molécule qui catalyse une réaction biochimique
- exergonique
- décrit une réaction chimique qui donne lieu à des produits dont l'énergie potentielle chimique est inférieure à celle des réactifs, plus la libération d'énergie libre
- inhibition de la rétroaction
- un mécanisme de régulation de l'activité enzymatique dans lequel le produit d'une réaction ou le produit final d'une série de réactions séquentielles inhibe une enzyme pour une étape antérieure de la série de réactions
- énergie thermique
- l'énergie transférée d'un système à un autre qui ne fonctionne pas
- énergie cinétique
- le type d'énergie associé aux objets en mouvement
- métabolisme
- toutes les réactions chimiques qui se produisent à l'intérieur des cellules, y compris celles qui utilisent de l'énergie et celles qui libèrent de l'énergie
- inhibition non compétitive
- un mécanisme général de régulation de l'activité enzymatique dans lequel une molécule régulatrice se lie à un site autre que le site actif et empêche le site actif de se lier au substrat ; ainsi, la molécule inhibitrice n'entre pas en compétition avec le substrat pour le site actif ; l'inhibition allostérique est une forme de inhibition non compétitive
- énergie potentielle
- le type d'énergie qui fait référence à la capacité de travailler
- substrat
- une molécule sur laquelle l'enzyme agit
- thermodynamique
- la science des relations entre chaleur, énergie et travail


