39.4 : Transport de gaz dans les fluides corporels humains
- Page ID
- 189357
Compétences à développer
- Décrire comment l'oxygène est lié à l'hémoglobine et transporté vers les tissus corporels
- Expliquer comment le dioxyde de carbone est transporté des tissus corporels vers les poumons
Une fois que l'oxygène se diffuse à travers les alvéoles, il entre dans la circulation sanguine et est transporté vers les tissus où il est déchargé, et le dioxyde de carbone se diffuse hors du sang vers les alvéoles pour être expulsé du corps. Bien que l'échange de gaz soit un processus continu, l'oxygène et le dioxyde de carbone sont transportés par différents mécanismes.
Transport de l'oxygène dans le sang
Bien que l'oxygène se dissout dans le sang, seule une petite quantité d'oxygène est transportée de cette manière. Seulement 1,5 pour cent de l'oxygène présent dans le sang est dissous directement dans le sang lui-même. La majeure partie de l'oxygène, soit 98,5 %, est liée à une protéine appelée hémoglobine et transportée vers les tissus.
L'hémoglobine
L'hémoglobine, ou Hb, est une molécule protéique présente dans les globules rouges (érythrocytes) composée de quatre sous-unités : deux sous-unités alpha et deux sous-unités bêta (Figure\(\PageIndex{1}\)). Chaque sous-unité entoure un groupe hème central qui contient du fer et lie une molécule d'oxygène, ce qui permet à chaque molécule d'hémoglobine de lier quatre molécules d'oxygène. Les molécules contenant plus d'oxygène liées aux groupes hèmes sont d'un rouge plus vif. Par conséquent, le sang artériel oxygéné dans lequel l'Hb transporte quatre molécules d'oxygène est rouge vif, tandis que le sang veineux désoxygéné est rouge plus foncé.
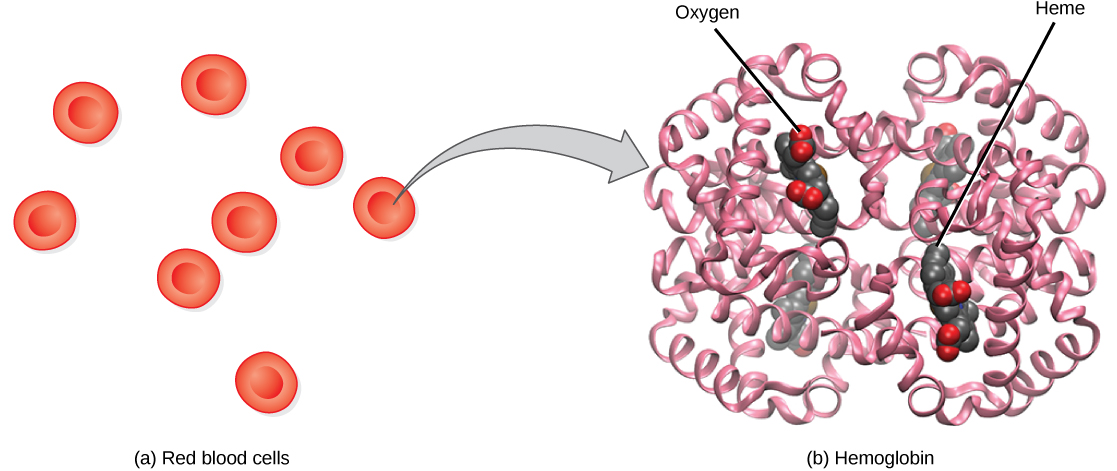
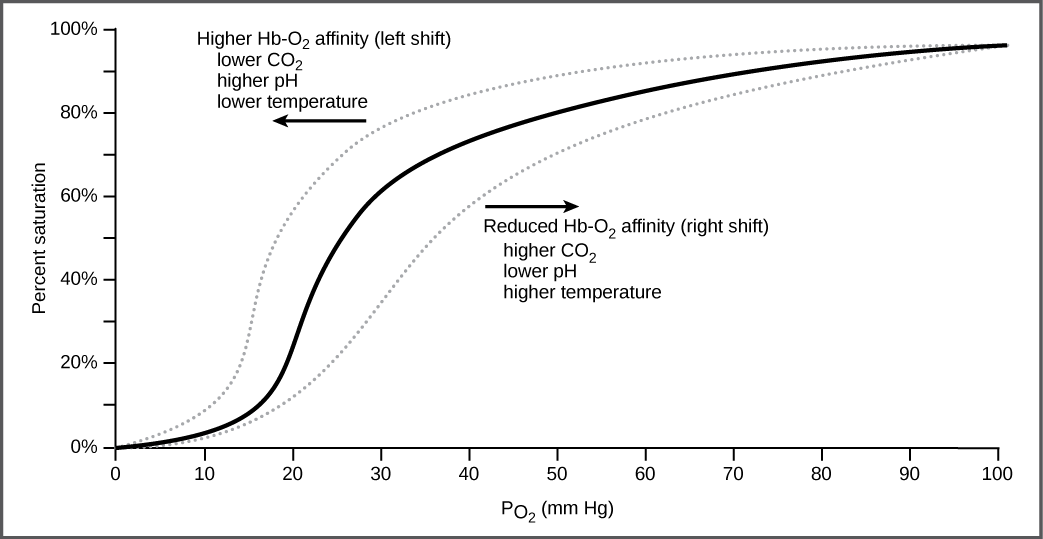
Il est plus facile de lier une deuxième et une troisième molécule d'oxygène à l'Hb que la première molécule. Cela est dû au fait que la molécule d'hémoglobine change de forme, ou de conformation, lorsque l'oxygène se lie. Le quatrième oxygène est alors plus difficile à lier. La liaison de l'oxygène à l'hémoglobine peut être tracée en fonction de la pression partielle d'oxygène dans le sang (axe des abscisses) par rapport à la saturation relative en HB en oxygène (axe des ordonnées). Le graphe obtenu, une courbe de dissociation de l'oxygène, est sigmoïdal ou en forme de S (Figure\(\PageIndex{2}\)). À mesure que la pression partielle d'oxygène augmente, l'hémoglobine devient de plus en plus saturée en oxygène.
Art Connection
Les reins sont responsables de l'élimination de l'excès d'ions H + du sang. En cas de défaillance des reins, qu'adviendrait-il du pH sanguin et de l'affinité de l'hémoglobine pour l'oxygène ?
Facteurs affectant la liaison à l'oxygène
La capacité de transport d'oxygène de l'hémoglobine détermine la quantité d'oxygène transportée dans le sang. En outre\(\text{P}_{\text{O}_2}\), d'autres facteurs environnementaux et maladies peuvent affecter la capacité de transport et l'apport d'oxygène.
Les niveaux de dioxyde de carbone, le pH sanguin et la température corporelle affectent la capacité de transport de l'oxygène (Figure\(\PageIndex{2}\)). Lorsque le dioxyde de carbone est présent dans le sang, il réagit avec l'eau pour former du bicarbonate (\(\text{HCO}_3^-\)) et des ions hydrogène (H +). À mesure que le taux de dioxyde de carbone dans le sang augmente, plus de H + est produit et le pH diminue. Cette augmentation du dioxyde de carbone et la diminution subséquente du pH réduisent l'affinité de l'hémoglobine pour l'oxygène. L'oxygène se dissocie de la molécule d'Hb, déplaçant la courbe de dissociation de l'oxygène vers la droite. Il faut donc plus d'oxygène pour atteindre le même niveau de saturation en hémoglobine que lorsque le pH était plus élevé. Un déplacement similaire de la courbe résulte également d'une augmentation de la température corporelle. L'augmentation de la température, due par exemple à une activité accrue du muscle squelettique, entraîne une diminution de l'affinité de l'hémoglobine pour l'oxygène.
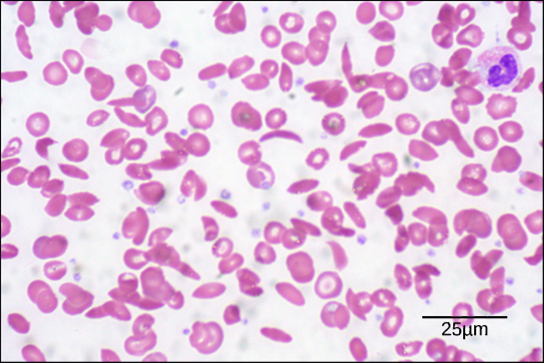
Des maladies telles que la drépanocytose et la thalassémie diminuent la capacité du sang à fournir de l'oxygène aux tissus et sa capacité à transporter l'oxygène. Dans l'anémie falciforme, les globules rouges ont la forme d'un croissant, sont allongés et raidis, ce qui réduit leur capacité à fournir de l'oxygène (Figure\(\PageIndex{3}\)). Sous cette forme, les globules rouges ne peuvent pas traverser les capillaires. C'est douloureux quand cela se produit. La thalassémie est une maladie génétique rare causée par un défaut de la sous-unité alpha ou bêta de l'Hb. Les patients atteints de thalassémie produisent un grand nombre de globules rouges, mais ces cellules ont un taux d'hémoglobine inférieur à la normale. Par conséquent, la capacité de transport d'oxygène est diminuée.
Transport du dioxyde de carbone dans le sang
Les molécules de dioxyde de carbone sont transportées dans le sang des tissus corporels vers les poumons par l'une des trois méthodes suivantes : dissolution directe dans le sang, liaison à l'hémoglobine ou transport sous forme d'ion bicarbonate. Plusieurs propriétés du dioxyde de carbone dans le sang affectent son transport. Premièrement, le dioxyde de carbone est plus soluble dans le sang que l'oxygène. Environ 5 à 7 pour cent de tout le dioxyde de carbone est dissous dans le plasma. Ensuite, le dioxyde de carbone peut se lier aux protéines plasmatiques ou pénétrer dans les globules rouges et se lier à l'hémoglobine. Cette forme transporte environ 10 pour cent du dioxyde de carbone. Lorsque le dioxyde de carbone se lie à l'hémoglobine, une molécule appelée carbaminohémoglobine se forme. La liaison du dioxyde de carbone à l'hémoglobine est réversible. Par conséquent, lorsqu'il atteint les poumons, le dioxyde de carbone peut se dissocier librement de l'hémoglobine et être expulsé du corps.
Troisièmement, la majorité des molécules de dioxyde de carbone (85 %) sont transportées dans le système tampon au bicarbonate. Dans ce système, le dioxyde de carbone diffuse dans les globules rouges. L'anhydrase carbonique (CA) présente dans les globules rouges convertit rapidement le dioxyde de carbone en acide carbonique (H 2 CO 3). L'acide carbonique est une molécule intermédiaire instable qui se dissocie immédiatement en ions bicarbonate (\(\text{HCO}_3^-\)) et en ions hydrogène (H +). Comme le dioxyde de carbone est rapidement converti en ions bicarbonate, cette réaction permet l'absorption continue du dioxyde de carbone dans le sang le long de son gradient de concentration. Il entraîne également la production d'ions H +. Si une trop grande quantité de H+ est produite, cela peut modifier le pH sanguin. Cependant, l'hémoglobine se lie aux ions H + libres et limite ainsi les variations du pH. L'ion bicarbonate nouvellement synthétisé est transporté hors des globules rouges vers le composant liquide du sang en échange d'un ion chlorure (Cl -) ; c'est ce que l'on appelle le déplacement du chlorure. Lorsque le sang atteint les poumons, l'ion bicarbonate est renvoyé dans les globules rouges en échange de l'ion chlorure. L'ion H+ se dissocie de l'hémoglobine et se lie à l'ion bicarbonate. Cela produit l'acide carbonique intermédiaire, qui est reconverti en dioxyde de carbone par l'action enzymatique du CA. Le dioxyde de carbone produit est expulsé par les poumons lors de l'expiration.
L'avantage du système tampon au bicarbonate est que le dioxyde de carbone est « absorbé » dans le sang sans que le pH du système change peu. Ceci est important car il suffit d'une légère modification du pH global du corps pour provoquer des blessures graves ou la mort. La présence de ce système tampon au bicarbonate permet également aux personnes de voyager et de vivre à haute altitude : lorsque la pression partielle de l'oxygène et du dioxyde de carbone change à haute altitude, le système tampon au bicarbonate s'ajuste pour réguler le dioxyde de carbone tout en maintenant le pH correct dans le corps.
Intoxication au monoxyde
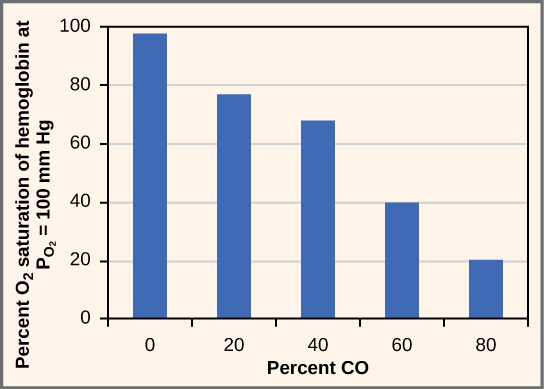
Alors que le dioxyde de carbone peut facilement s'associer et se dissocier de l'hémoglobine, d'autres molécules comme le monoxyde de carbone (CO) ne le peuvent pas. Le monoxyde de carbone a une plus grande affinité pour l'hémoglobine que l'oxygène Par conséquent, lorsque le monoxyde de carbone est présent, il se lie à l'hémoglobine de préférence à l'oxygène. Par conséquent, l'oxygène ne peut pas se lier à l'hémoglobine, de sorte que très peu d'oxygène est transporté dans le corps (Figure\(\PageIndex{4}\)). Le monoxyde de carbone est un gaz incolore et inodore qui est donc difficile à détecter. Il est produit par des véhicules et des outils à essence. Le monoxyde de carbone peut provoquer des maux de tête, de la confusion et des nausées ; une exposition prolongée peut provoquer des lésions cérébrales ou la mort L'administration d'oxygène (pur) à 100 % est le traitement habituel en cas d'intoxication au monoxyde de carbone. L'administration d'oxygène pur accélère la séparation du monoxyde de carbone de l'hémoglobine.
Résumé
L'hémoglobine est une protéine présente dans les globules rouges qui comprend deux sous-unités alpha et deux sous-unités bêta qui entourent un groupe hème contenant du fer. L'oxygène lie facilement ce groupe hème. La capacité de liaison de l'oxygène augmente à mesure que de plus en plus de molécules d'oxygène sont liées à l'hème. Les états pathologiques et les conditions altérées du corps peuvent affecter la capacité de liaison de l'oxygène et augmenter ou diminuer sa capacité à se dissocier de l'hémoglobine.
Le dioxyde de carbone peut être transporté par le sang par trois méthodes. Il est dissous directement dans le sang, lié aux protéines plasmatiques ou à l'hémoglobine, ou converti en bicarbonate. La majeure partie du dioxyde de carbone est transportée dans le système au bicarbonate. Le dioxyde de carbone diffuse dans les globules rouges. À l'intérieur, l'anhydrase carbonique convertit le dioxyde de carbone en acide carbonique (H 2 CO 3), qui est ensuite hydrolysé en bicarbonate (\(\text{HCO}_3^-\)) et en H +. L'ion H+ se lie à l'hémoglobine dans les globules rouges et le bicarbonate est transporté hors des globules rouges en échange d'un ion chlorure. C'est ce qu'on appelle le décalage du chlorure. Le bicarbonate quitte les globules rouges et pénètre dans le plasma sanguin. Dans les poumons, le bicarbonate est renvoyé dans les globules rouges en échange de chlorure. Le H + se dissocie de l'hémoglobine et se combine au bicarbonate pour former de l'acide carbonique à l'aide de l'anhydrase carbonique, qui catalyse davantage la réaction de reconversion de l'acide carbonique en dioxyde de carbone et en eau. Le dioxyde de carbone est ensuite expulsé des poumons.
Connexions artistiques
Figure\(\PageIndex{2}\) : Les reins sont responsables de l'élimination de l'excès d'ions H + du sang. En cas de défaillance des reins, qu'adviendrait-il du pH sanguin et de l'affinité de l'hémoglobine pour l'oxygène ?
- Réponse
-
Le pH sanguin chutera et l'affinité de l'hémoglobine pour l'oxygène diminuera.
Lexique
- système tampon au bicarbonate
- système sanguin qui absorbe le dioxyde de carbone et régule le pH
- ion bicarbonate (\(\text{HCO}_3^-\))
- ion créé lorsque l'acide carbonique se dissocie en H + et\((\ce{HCO3-})\)
- carbaminohémoglobine
- molécule qui se forme lorsque le dioxyde de carbone se lie à l'hémoglobine
- anhydrase carbonique (CA)
- enzyme qui catalyse le dioxyde de carbone et l'eau en acide carbonique
- déplacement des chlorures
- changement de chlorure (échange du chlorure contre du bicarbonate à l'intérieur ou à l'extérieur des globules rouges)
- groupe thématique
- groupe centralisé contenant du fer entouré par les sous-unités alpha et bêta de l'hémoglobine
- hémoglobine
- molécule présente dans les globules rouges qui peut lier l'oxygène, le dioxyde de carbone et le monoxyde de carbone
- capacité de transport d'oxygène
- quantité d'oxygène pouvant être transportée dans le sang
- courbe de dissociation de l'oxygène
- courbe illustrant l'affinité de l'oxygène pour l'hémoglobine
- drépanocytose
- trouble génétique qui affecte la forme des globules rouges et leur capacité à transporter l'oxygène et à se déplacer dans les capillaires
- thalassémie
- maladie génétique rare qui entraîne la mutation des sous-unités alpha ou bêta de l'hémoglobine, créant ainsi des globules rouges plus petits contenant moins d'hémoglobine


