6.2 : Énergie potentielle, cinétique, libre et d'activation
- Page ID
- 189561
Compétences à développer
- Définissez « énergie »
- Expliquer la différence entre l'énergie cinétique et l'énergie potentielle
- Discuter des concepts d'énergie libre et d'énergie d'activation
- Décrire les réactions endergoniques et exergoniques
L'énergie est définie comme la capacité de travailler. Comme vous l'avez appris, l'énergie existe sous différentes formes. Par exemple, l'énergie électrique, l'énergie lumineuse et l'énergie thermique sont toutes des types d'énergie différents. Bien que ce soient tous des types d'énergie familiers que l'on peut voir ou ressentir, il existe un autre type d'énergie qui est beaucoup moins tangible. Cette énergie est associée à quelque chose d'aussi simple qu'un objet maintenu au-dessus du sol. Afin d'apprécier la façon dont l'énergie entre et sort des systèmes biologiques, il est important de mieux comprendre les différents types d'énergie qui existent dans le monde physique.
Types d'énergie
Lorsqu'un objet est en mouvement, de l'énergie est associée à cet objet. Dans l'exemple d'un avion en vol, une grande quantité d'énergie est associée au mouvement de l'avion. Cela est dû au fait que les objets en mouvement sont capables d'apporter un changement ou de travailler. Pense à un boulet de démolition. Même une boule de démolition lente peut infliger de gros dégâts à d'autres objets. Cependant, une boule de démolition qui n'est pas en mouvement est incapable de travailler. L'énergie associée aux objets en mouvement est appelée énergie cinétique. Une balle en excès de vitesse, une personne qui marche, le mouvement rapide des molécules dans l'air (qui produisent de la chaleur) et les rayonnements électromagnétiques tels que la lumière ont tous de l'énergie cinétique.
Et si cette même boule de démolition immobile était soulevée deux étages au-dessus d'une voiture avec une grue ? Si la boule de démolition suspendue est immobile, y a-t-il de l'énergie qui lui est associée ? La réponse est oui. La boule de démolition suspendue possède une énergie qui lui est associée qui est fondamentalement différente de l'énergie cinétique des objets en mouvement. Cette forme d'énergie résulte du fait que la boule de démolition a le potentiel de fonctionner. S'il est publié, il fonctionnera en effet. Comme ce type d'énergie fait référence au potentiel de travail, on l'appelle énergie potentielle. Les objets transfèrent leur énergie entre la cinétique et le potentiel de la manière suivante : lorsque la boule de démolition est immobile, elle possède une énergie cinétique nulle et 100 % d'énergie potentielle. Une fois qu'il est relâché, son énergie cinétique commence à augmenter car il augmente sa vitesse grâce à la gravité. En même temps, à mesure qu'il se rapproche du sol, il perd de l'énergie potentielle. À la mi-automne, il possède 50 % d'énergie cinétique et 50 % d'énergie potentielle. Juste avant de toucher le sol, la balle a presque perdu son énergie potentielle et possède une énergie cinétique presque maximale. D'autres exemples d'énergie potentielle incluent l'énergie de l'eau retenue derrière un barrage (Figure\(\PageIndex{1}\)) ou celle d'une personne sur le point de sortir d'un avion en parachute.

L'énergie potentielle n'est pas seulement associée à l'emplacement de la matière (par exemple, un enfant assis sur une branche d'arbre), mais également à la structure de la matière. Un ressort au sol a de l'énergie potentielle s'il est comprimé, de même qu'un élastique tendu. L'existence même des cellules vivantes dépend largement de l'énergie potentielle structurelle. Au niveau chimique, les liaisons qui maintiennent les atomes des molécules ensemble ont une énergie potentielle. N'oubliez pas que les voies cellulaires anaboliques ont besoin d'énergie pour synthétiser des molécules complexes à partir de molécules plus simples, et que les voies cataboliques libèrent de l'énergie lorsque des molécules complexes sont décomposées. Le fait que de l'énergie puisse être libérée par la rupture de certaines liaisons chimiques implique que ces liaisons possèdent de l'énergie potentielle. En fait, il existe une énergie potentielle stockée dans les liaisons de toutes les molécules alimentaires que nous consommons, qui est finalement exploitée pour être utilisée. En effet, ces liaisons peuvent libérer de l'énergie lorsqu'elles sont rompues. Le type d'énergie potentielle qui existe dans les liaisons chimiques et qui est libérée lorsque ces liaisons sont rompues est appelé énergie chimique (Figure\(\PageIndex{2}\)). L'énergie chimique est chargée de fournir aux cellules vivantes de l'énergie provenant des aliments. La libération d'énergie est provoquée par la rupture des liaisons moléculaires au sein des molécules de combustible.

Lien vers l'apprentissage

Visitez ce site et sélectionnez « Un pendule simple » dans le menu (sous « Mouvement harmonique ») pour voir le changement cinétique (K) et l'énergie potentielle (U) d'un pendule en mouvement.
Énergie gratuite
Après avoir appris que les réactions chimiques libèrent de l'énergie lorsque les liaisons de stockage d'énergie sont rompues, une question importante suivante est de savoir comment l'énergie associée aux réactions chimiques est-elle quantifiée et exprimée ? Comment comparer l'énergie libérée par une réaction à celle d'une autre réaction ? Une mesure de l'énergie libre est utilisée pour quantifier ces transferts d'énergie. L'énergie libre est appelée énergie libre de Gibbs (en abrégé par la lettre G) d'après Josiah Willard Gibbs, le scientifique qui a développé la mesure. Rappelons que selon la deuxième loi de la thermodynamique, tous les transferts d'énergie impliquent la perte d'une certaine quantité d'énergie sous une forme inutilisable telle que la chaleur, ce qui entraîne une entropie. L'énergie libre de Gibbs fait spécifiquement référence à l'énergie associée à une réaction chimique qui est disponible après prise en compte de l'entropie. En d'autres termes, l'énergie libre de Gibbs est de l'énergie utilisable, ou de l'énergie disponible pour travailler.
Chaque réaction chimique implique un changement d'énergie libre, appelé delta G (∆G). La variation de l'énergie libre peut être calculée pour tout système soumis à une telle modification, telle qu'une réaction chimique. Pour calculer ∆G, soustrayez la quantité d'énergie perdue par entropie (notée ∆S) du changement d'énergie total du système. Ce changement d'énergie total dans le système est appelé enthalpie et est noté ∆H. La formule pour calculer ∆G est la suivante, où le symbole T fait référence à la température absolue en Kelvin (degrés Celsius + 273) :
Regardez une animation sur le passage de l'énergie libre à l'état de transition sur ce site.
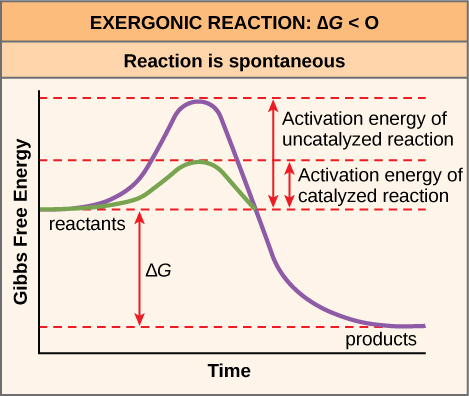
D'où vient l'énergie d'activation requise par les réactifs chimiques ? La source de l'énergie d'activation nécessaire pour faire avancer les réactions est généralement l'énergie thermique provenant de l'environnement. L'énergie thermique (l'énergie de liaison totale des réactifs ou des produits lors d'une réaction chimique) accélère le mouvement des molécules, augmentant ainsi la fréquence et la force avec lesquelles elles entrent en collision ; elle déplace également légèrement les atomes et les liaisons au sein de la molécule, les aidant ainsi à atteindre leur état de transition. Pour cette raison, le fait de chauffer un système provoquera une réaction plus fréquente des réactifs chimiques contenus dans ce système. L'augmentation de la pression sur un système a le même effet. Une fois que les réactifs ont absorbé suffisamment d'énergie thermique provenant de leur environnement pour atteindre l'état de transition, la réaction se poursuit.
L'énergie d'activation d'une réaction donnée détermine la vitesse à laquelle elle se déroulera. Plus l'énergie d'activation est élevée, plus la réaction chimique sera lente. L'exemple de la rouille du fer illustre une réaction intrinsèquement lente. Cette réaction se produit lentement au fil du temps en raison de son E A élevé. En outre, la combustion de nombreux combustibles, qui est fortement exergonique, se fera à un rythme négligeable, à moins que leur énergie d'activation ne soit surmontée par une chaleur suffisante provenant d'une étincelle. Cependant, une fois qu'ils commencent à brûler, les réactions chimiques libèrent suffisamment de chaleur pour poursuivre le processus de combustion, fournissant ainsi l'énergie d'activation aux molécules de combustible environnantes. Comme pour ces réactions à l'extérieur des cellules, l'énergie d'activation de la plupart des réactions cellulaires est trop élevée pour que l'énergie thermique puisse être surmontée à des taux efficaces. En d'autres termes, pour que des réactions cellulaires importantes se produisent à des vitesses appréciables (nombre de réactions par unité de temps), leurs énergies d'activation doivent être abaissées (Figure\(\PageIndex{1}\)\(\PageIndex{5}\)) ; c'est ce que l'on appelle la catalyse. C'est une très bonne chose en ce qui concerne les cellules vivantes. Les macromolécules importantes, telles que les protéines, l'ADN et l'ARN, emmagasinent une quantité considérable d'énergie et leur dégradation est exergonique. Si les températures cellulaires à elles seules fournissaient suffisamment d'énergie thermique pour que ces réactions exergoniques puissent surmonter leurs barrières d'activation, les composants essentiels d'une cellule se désintégreraient.
Connexion artistique
Si aucune énergie d'activation n'était requise pour décomposer le saccharose (sucre de table), seriez-vous capable de le conserver dans un sucrier ?
Résumé
L'énergie se présente sous de nombreuses formes différentes. Les objets en mouvement effectuent un travail physique, et l'énergie cinétique est l'énergie des objets en mouvement. Les objets qui ne sont pas en mouvement peuvent avoir le potentiel de travailler et, par conséquent, de l'énergie potentielle. Les molécules ont également de l'énergie potentielle car la rupture des liaisons moléculaires a le potentiel de libérer de l'énergie. Les cellules vivantes dépendent de la récupération de l'énergie potentielle des liaisons moléculaires pour effectuer leur travail. L'énergie gratuite est une mesure de l'énergie disponible pour travailler. L'énergie libre d'un système change lors de transferts d'énergie tels que des réactions chimiques, et ce changement est appelé ∆G.
Le ∆G d'une réaction peut être négatif ou positif, ce qui signifie que la réaction libère de l'énergie ou consomme de l'énergie, respectivement. Une réaction avec un ∆G négatif qui dégage de l'énergie est appelée réaction exergonique. Une réaction avec un ∆G positif qui nécessite un apport d'énergie est appelée réaction endergonique. Les réactions exergoniques sont dites spontanées, car leurs produits contiennent moins d'énergie que leurs réactifs. Les produits des réactions endergoniques ont un état énergétique supérieur à celui des réactifs et il s'agit donc de réactions non spontanées. Cependant, toutes les réactions (y compris les réactions -∆G spontanées) nécessitent un apport initial d'énergie pour atteindre l'état de transition auquel elles se produiront. Cet apport d'énergie initial est appelé énergie d'activation.
Connexions artistiques
Figure\(\PageIndex{3}\) : Examinez chacun des processus présentés et déterminez s'il est endergonique ou exergonique. Dans chaque cas, l'enthalpie augmente-t-elle ou diminue-t-elle, et l'entropie augmente-t-elle ou diminue-t-elle ?
- Réponse
-
La décomposition d'un tas de compost est un processus exergonique ; l'enthalpie augmente (de l'énergie est libérée) et l'entropie augmente (les grosses molécules sont décomposées en molécules plus petites). Le développement d'un bébé à partir d'un ovule fécondé est un processus endergonique ; l'enthalpie diminue (l'énergie est absorbée) et l'entropie diminue. La destruction de l'art sur sable est un processus exergonique ; l'enthalpie ne change pas, mais l'entropie augmente. Une descente à billes est un processus exergonique ; l'enthalpie diminue (de l'énergie est libérée), mais il n'y a aucun changement d'enthalpie.
Figure\(\PageIndex{5}\) : Si aucune énergie d'activation n'était requise pour décomposer le saccharose (sucre de table), seriez-vous capable de le stocker dans un sucrier ?
- Réponse
-
Non. Nous pouvons stocker de l'énergie chimique en raison de la nécessité de surmonter l'obstacle à sa dégradation.
Lexique
- énergie d'activation
- énergie nécessaire pour que les réactions se produisent
- énergie chimique
- énergie potentielle dans les liaisons chimiques qui est libérée lorsque ces liaisons sont rompues
- endergonique
- décrit les réactions chimiques qui nécessitent un apport énergétique
- enthalpie
- énergie totale d'un système
- exergonique
- décrit les réactions chimiques qui libèrent de l'énergie libre
- énergie gratuite
- L'énergie libre de Gibbs est l'énergie utilisable, ou l'énergie disponible pour travailler.
- énergie thermique
- énergie de liaison totale des réactifs ou des produits lors d'une réaction chimique
- énergie cinétique
- type d'énergie associée à des objets ou à des particules en mouvement
- énergie potentielle
- type d'énergie susceptible de fonctionner ; énergie stockée
- état de transition
- état instable à haute énergie (forme intermédiaire entre le substrat et le produit) survenant lors d'une réaction chimique


