20.E : Chimie organique (exercices)
- Page ID
- 193900
20.1 : Hydrocarbures
Q20.1.1
Écrivez la formule chimique et la structure de Lewis de ce qui suit, chacune contenant cinq atomes de carbone :
- un alcane
- un alcène
- un alcyne
ARTICLE 20.1.1
Il existe plusieurs séries de réponses, dont l'une est la suivante :
a) C 5 H 12
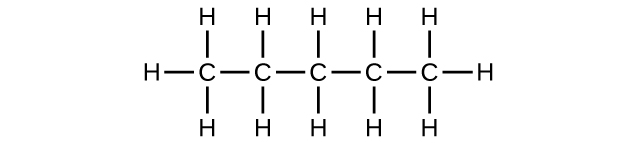
(b) C 5 H 10
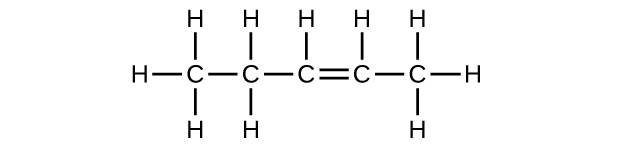
(c) C 5 H 8
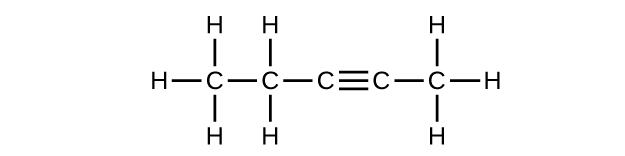
Q20.1.2
Quelle est la différence entre l'hybridation des orbitales de valence des atomes de carbone dans les hydrocarbures saturés et insaturés ?
Q20.1.3
Au niveau microscopique, en quoi la réaction du brome avec un hydrocarbure saturé diffère-t-elle de sa réaction avec un hydrocarbure insaturé ? En quoi sont-ils similaires ?
Q20.1.4
Les deux réactions entraînent l'incorporation de brome dans la structure du produit. La différence réside dans la manière dont cette incorporation a lieu. Dans l'hydrocarbure saturé, une liaison C—H existante est rompue, et une liaison entre le C et le Br peut alors se former. Dans l'hydrocarbure insaturé, la seule liaison rompue dans l'hydrocarbure est la liaison π, dont les électrons peuvent être utilisés pour former une liaison avec l'un des atomes de brome du Br 2 (les électrons de la liaison Br—Br forment l'autre liaison C—Br sur l'autre carbone qui faisait partie de la liaison π dans l'insaturé de départ). hydrocarbure).
Q20.1.5
Au niveau microscopique, en quoi la réaction du brome avec un alcène diffère-t-elle de sa réaction avec un alcyne ? En quoi sont-ils similaires ?
Q20.1.6
Expliquez pourquoi les alcènes non ramifiés peuvent former des isomères géométriques alors que les alcanes non ramifiés ne le peuvent pas. Cette explication implique-t-elle le domaine macroscopique ou le domaine microscopique ?
S20.1.6
Les alcanes non ramifiés ont une rotation libre autour des liaisons C—C, ce qui donne aux substituants toutes les orientations autour de ces liaisons équivalentes, interchangeables par rotation. Dans les alcènes non ramifiés, l'incapacité de tourner autour de la\(\mathrm{C=C}\) liaison entraîne des orientations fixes (immuables) des substituants, ce qui permet la formation de différents isomères. Comme ces concepts concernent des phénomènes au niveau moléculaire, cette explication implique le domaine microscopique.
Expliquez pourquoi ces deux molécules ne sont pas des isomères :
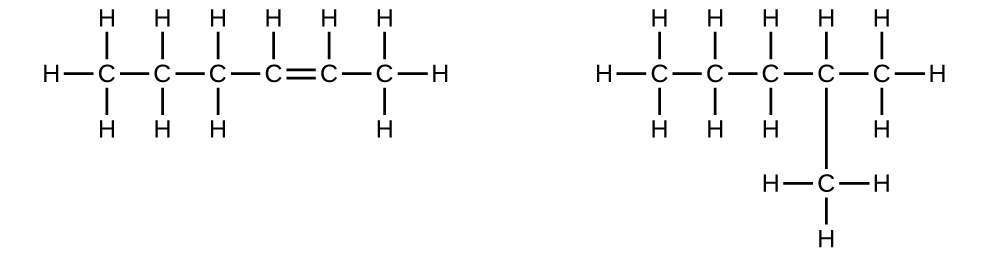
Q20.1.7
Expliquez pourquoi ces deux molécules ne sont pas des isomères :
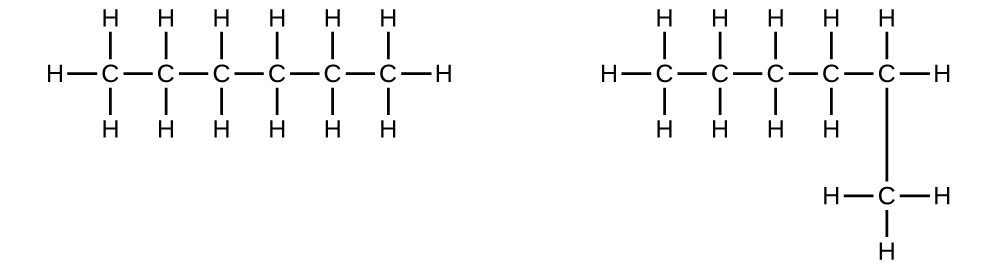
S20.1.6
Il s'agit du même composé car chacun est un hydrocarbure saturé contenant une chaîne non ramifiée de six atomes de carbone.
Q20.1.7
Comment l'hybridation des atomes de carbone évolue-t-elle lorsque le polyéthylène est préparé à partir d'éthylène ?
Q20.1.8
Écrivez la structure de Lewis et la formule moléculaire pour chacun des hydrocarbures suivants :
- hexane
- 3-méthylpentane
- cis -3-hexène
- 4-méthyl-1-pentène
- 3-hexyne
- 4-méthyl-2-pentyne
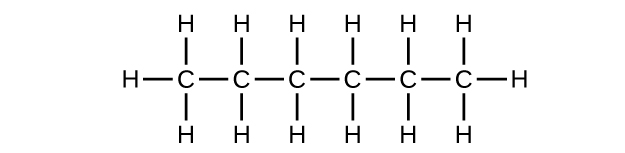
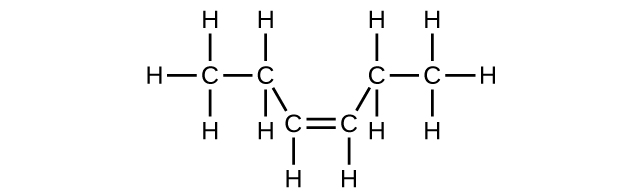
Q20.1.9
a) C 6 H 14
(b) C 6 H 14

(c) C 6 H 12
d) C 6 H 12
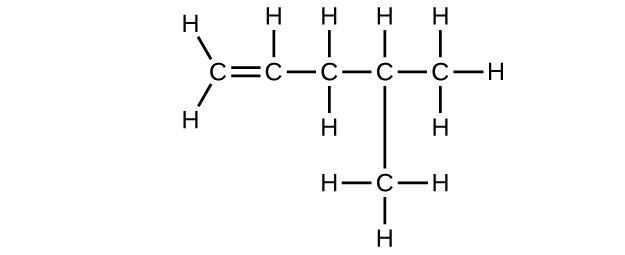
(e) C 6 H 10
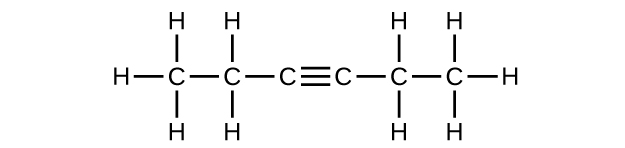
(f) C 6 H 10
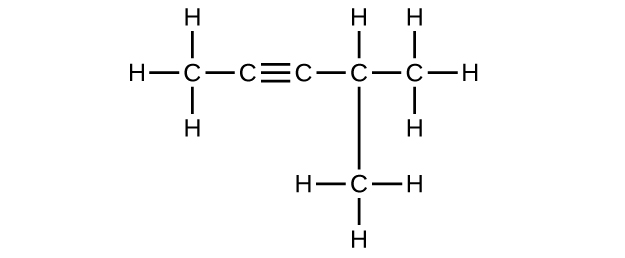
Q20.1.10
Écrivez la formule chimique, la formule condensée et la structure de Lewis pour chacun des hydrocarbures suivants :
- heptane
- 3-méthylhexane
- trans -3-heptène
- 4-méthyl-1-hexène
- 2-heptyne
- 3,4-diméthyl-1-pentyne
Q20.1.11
Donnez le nom complet de l'IUPAC pour chacun des composés suivants :
- CH 3 CH 2 CBr 2 CH 3
- (CH 3) 3 ccL
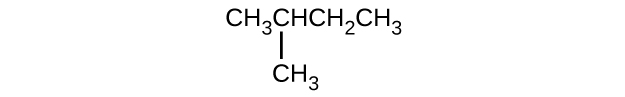
- \ (\ mathrm {CH_3CH_2C≡ CH \, CH_3CH_2C≡ CH} \
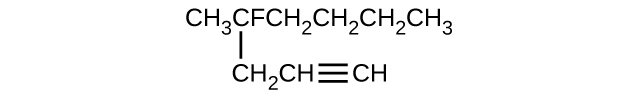

- \(\mathrm{(CH_3)_2CHCH_2CH=CH_2}\)
S20.1.11
(a) 2,2-dibromobutane ; (b) 2-chloro-2-méthylpropane ; (c) 2-méthylbutane ; (d) 1-butyne ; (e) 4-fluoro-4-méthyl-1-octyne ; (f) trans -1-chloropropène ; (g) 5-méthyl-1-pentène
Q20.1.12
Donnez le nom complet de l'IUPAC pour chacun des composés suivants :
- (CH 3) 2 CHF
- CHF 3 CHCLCHCLCH 3
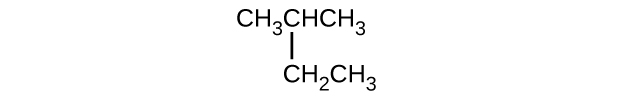
- \(\mathrm{CH_3CH_2CH=CHCH_3}\)
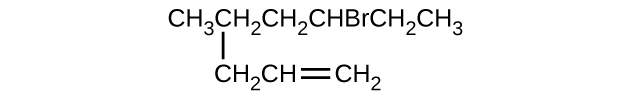
- \(\mathrm{(CH_3)_3CCH_2C≡CH}\)
Q20.1.13
Le butane est utilisé comme combustible dans les briquets jetables. Écrivez la structure de Lewis pour chaque isomère du butane.
S20.1.13
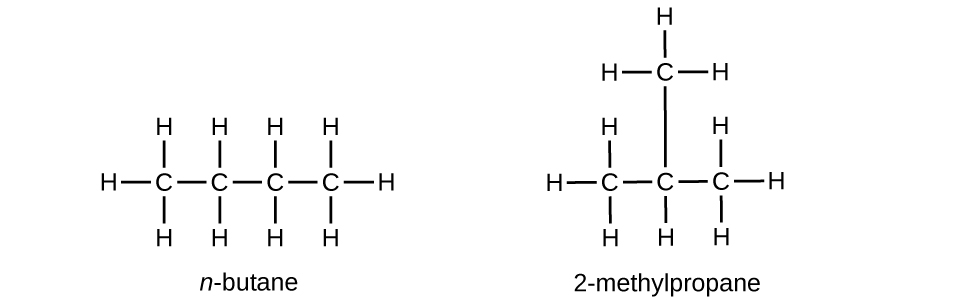
Q20.1.14
Écrivez les structures de Lewis et nommez les cinq isomères structuraux de l'hexane.
Q20.1.15
Ecrire les structures de Lewis pour les isomères cis—trans de\(\mathrm{CH_3CH=CHCl}\).
S20.1.15
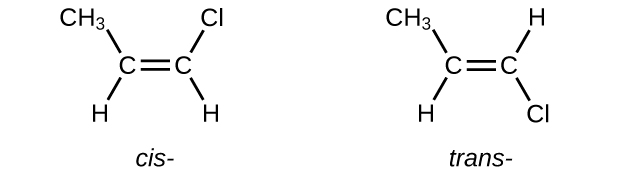
Q20.1.16
Écrire les structures des trois isomères de l'hydrocarbure aromatique xylène, C 6 H 4 (CH 3) 2.
Q20.1.17
L'isooctane est le nom usuel de l'isomère C 8 H 18 utilisé comme étalon de 100 pour l'indice d'octane de l'essence :
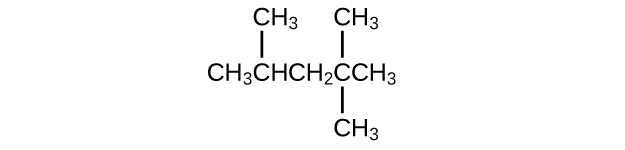
- Quel est le nom IUPAC du composé ?
- Nommez les autres isomères qui contiennent une chaîne à cinq atomes de carbone avec trois substituants méthyles.
Q20.1.18
(a) 2,2,4-triméthylpentane ; (b) 2,2,3-triméthylpentane, 2,3,4-triméthylpentane et 2,3,3-triméthylpentane :
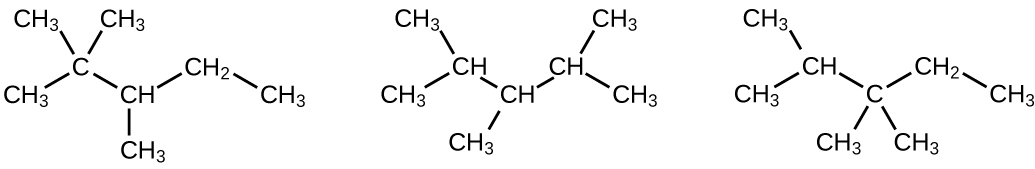
Q20.1.19
Écrivez les structures de Lewis et les noms IUPAC des isomères alcynes du C 4 H 6.
Q20.1.20
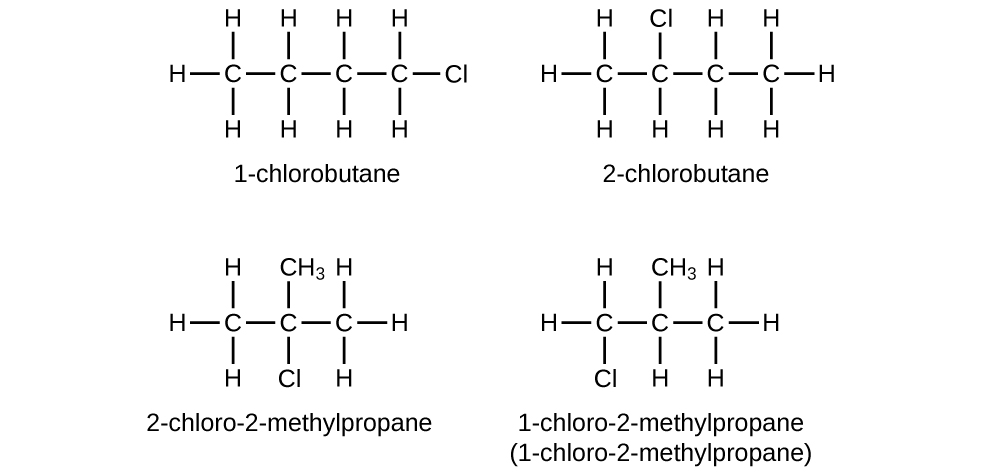
Écrivez les structures de Lewis et les noms IUPAC de tous les isomères du C 4 H 9 Cl.
S20.1.20
Q20.1.21
Nommez et écrivez les structures de tous les isomères des groupes alkyle propyle et butyle.
Q20.1.22
Ecrire les structures de tous les isomères du groupe alkyle -C 5 H 11.
Q20.1.23
Dans ce qui suit, le squelette carboné et le nombre approprié d'atomes d'hydrogène sont présentés sous forme condensée :
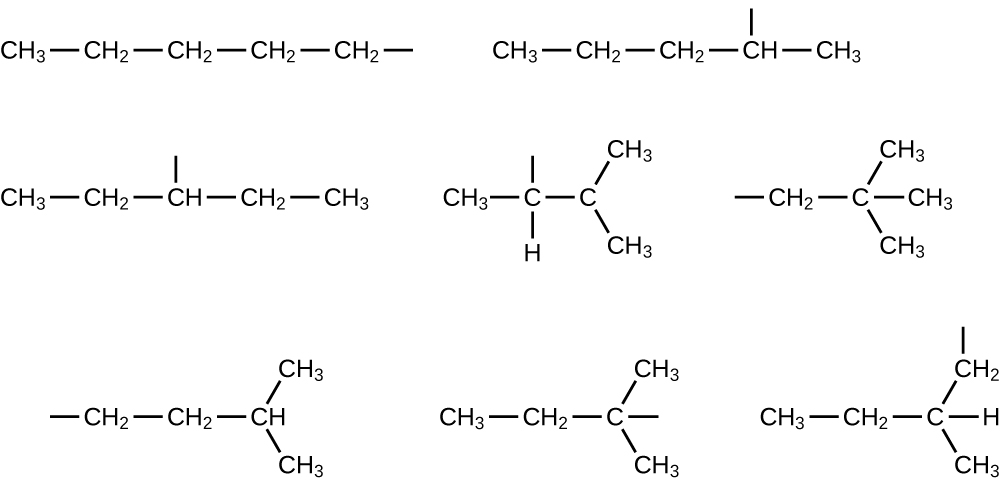
Q20.1.24
Écrivez les structures de Lewis et décrivez la géométrie moléculaire de chaque atome de carbone dans les composés suivants :
- cis -3-hexène
- cis -1-chloro-2-bromoéthène
- 2-pentyne
- trans - 6 -éthyl-7-méthyl-2-octène
Q20.1.25
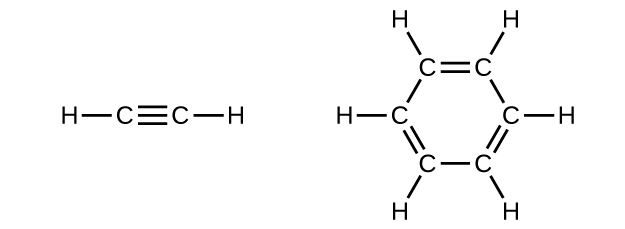
Le benzène est l'un des composés utilisés comme amplificateur d'octane dans l'essence sans plomb. Il est fabriqué par conversion catalytique de l'acétylène en benzène :
\[\ce{3C2H2 ⟶ C6H6}\]
Dessinez des structures de Lewis pour ces composés, avec des structures de résonance le cas échéant, et déterminez l'hybridation des atomes de carbone dans chacun d'eux.
S20.1.25
Q20.1.26
Dans l'acétylène, la liaison utilise des hybrides sp sur les atomes de carbone et des orbitales s sur les atomes d'hydrogène. Dans le benzène, les atomes de carbone sont hybridés sp 2.
Q20.1.27
Le téflon est préparé par polymérisation du tétrafluoroéthylène. Écrivez l'équation qui décrit la polymérisation à l'aide des symboles de Lewis.
Q20.1.28
Écrivez deux équations complètes et équilibrées pour chacune des réactions suivantes, l'une à l'aide de formules condensées et l'autre à l'aide de structures de Lewis.
- 1 mole de 1-butyne réagit avec 2 moles d'iode.
- Le pentane est brûlé dans l'air.
S20.1.28
(a)\(\mathrm{CH=CCH_2CH_3 + 2I_2⟶ CHI_2CI_2CH_2CH_3}\)
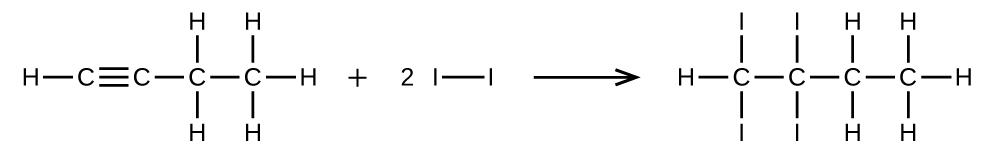
(b)\(\ce{CH3CH2CH2CH2CH3 + 8O2 ⟶ 5CO2 + 6H2O}\)
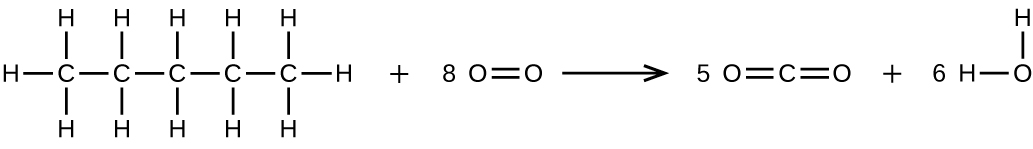
Q20.1.29
Écrivez deux équations complètes et équilibrées pour chacune des réactions suivantes, l'une à l'aide de formules condensées et l'autre à l'aide de structures de Lewis.
- Le 2-butène réagit avec le chlore.
- le benzène brûle dans l'air.
Q20.1.30
Quelle masse de 2-bromopropane peut-on préparer à partir de 25,5 g de propène ? Supposons un rendement de 100 % du produit.
S20.1.30
65,2 g
Q20.1.31
L'acétylène est un acide très faible ; cependant, il réagit avec l'oxyde d'argent (I) humide et forme de l'eau et un composé composé d'argent et de carbone. L'addition d'une solution de HCl à un échantillon de 0,2352 g du composé d'argent et de carbone a produit de l'acétylène et 0,2822 g d'AgCl.
- Quelle est la formule empirique du composé d'argent et de carbone ?
- La production d'acétylène par addition de HCl au composé d'argent et de carbone suggère que le carbone est présent sous forme d'ion acétylure\(\ce{C2^2-}\). Écrivez la formule du composé contenant l'ion acétylure.
Q20.1.32
L'éthylène peut être produit par pyrolyse de l'éthane :
\(\ce{C2H6⟶C2H4 + H2}\)
Combien de kilogrammes d'éthylène sont produits par la pyrolyse de 1 000 × 10 3 kg d'éthane, en supposant un rendement de 100,0 % ?
S20.1.33
9,328 × 10 2 kg
20.2 : Alcools et éthers
Pourquoi les composés hexane, hexanol et hexène ont-ils des noms si similaires ?
Rédiger des formules condensées et fournir des noms IUPAC pour les composés suivants :
- a) alcool éthylique (dans les boissons)
- (b) alcool méthylique (utilisé comme solvant, par exemple, dans la gomme-laque)
- (c) éthylène glycol (antigel)
- d) alcool isopropylique (utilisé dans l'alcool à friction)
- (e) glycérine
(a) alcool éthylique, éthanol : CH 3 CH 2 OH ; (b) alcool méthylique, méthanol : CH 3 OH ; (c) éthylène glycol, éthanediol : HOCH 2 CH 2 OH ; (d) alcool isopropylique, 2-propanol : CH 3 CH (OH) CH 3 ; (e) glycérine, l,2,3-trihydroxypropane : HOCH 2 CH (OH) CH 2 OH
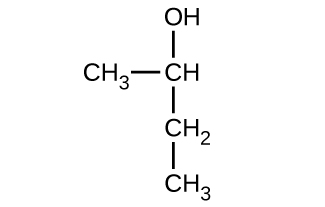
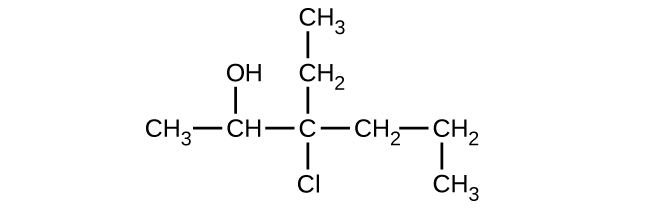
Donnez le nom complet de l'IUPAC pour chacun des composés suivants :
(a)
(b)
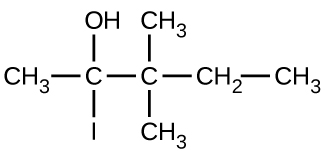
(c)
Donnez le nom IUPAC complet et le nom usuel de chacun des composés suivants :
(a)
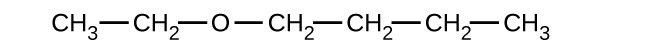
(b)
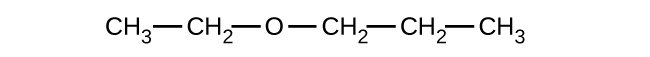
(c)

(a) 1-éthoxybutane, éther butylique et éthylique ; (b) 1-éthoxypropane, éther éthylique ; (c) 1-méthoxypropane, méthylpropyléther
Écrivez les structures condensées des deux isomères avec la formule C 2 H 6 O. Marquez le groupe fonctionnel de chaque isomère.
Ecrire les structures condensées de tous les isomères avec la formule C 2 H 6 O 2. Marquez le groupe fonctionnel (ou les groupes) de chaque isomère.
HOCH 2 CH 2 OH, deux groupes alcools ; CH 3 OCH 2 OH, groupes éther et alcool
Dessinez les formules condensées pour chacun des composés suivants :
- (a) éther dipropylique
- (b) 2,2-diméthyl-3-hexanol
- (c) 2-éthoxybutane
Le MTBE, le méthyltert-butyle éther, CH 3 OC (CH 3) 3, est utilisé comme source d'oxygène dans les essences oxygénées. Le MTBE est fabriqué en faisant réagir du 2-méthylpropène avec du méthanol.
- (a) À l'aide des structures de Lewis, écrivez l'équation chimique représentant la réaction.
- (b) Quel volume de méthanol, densité 0,7915 g/mL, est nécessaire pour produire exactement 1 000 kg de MTBE, en supposant un rendement de 100 % ?
(a)
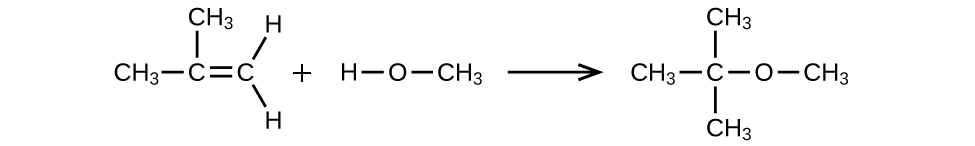
(b) 4 593 × 10 2 L
Écrivez deux équations équilibrées complètes pour chacune des réactions suivantes, l'une en utilisant des formules condensées et l'autre en utilisant des structures de Lewis.
(a) le propanol est converti en éther dipropylique
b) le propène est traité avec de l'eau dans un acide dilué.
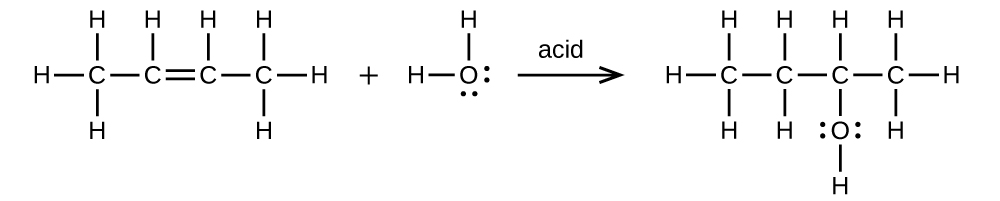
Écrivez deux équations équilibrées complètes pour chacune des réactions suivantes, l'une en utilisant des formules condensées et l'autre en utilisant des structures de Lewis.
- a) Le 2-butène est traité avec de l'eau dans un acide dilué
- (b) l'éthanol est déshydraté pour produire de l'éthylène
(a)\(\mathrm{CH_3CH=CHCH_3+H_2O⟶CH_3CH_2CH(OH)CH_3}\)
;
(b)\(\mathrm{CH_3CH_2OH⟶CH_2=CH_2+H_2O}\)
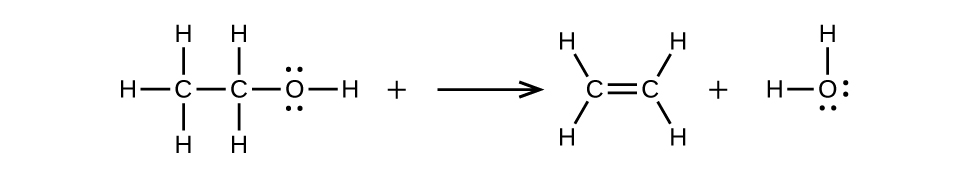
20.3 : Aldéhydes, cétones, acides carboxyliques et esters
Q20.3.1
Classez les molécules suivantes de la moins oxydée à la plus oxydée, en fonction de l'atome de carbone marqué :
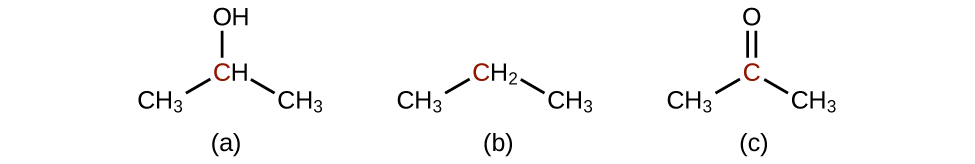
Q20.3.2
Prédisez les produits de l'oxydation des molécules présentées dans ce problème. Dans chaque cas, identifiez le produit qui résultera de l'augmentation minimale de l'état d'oxydation de l'atome de carbone mis en évidence :
(a)
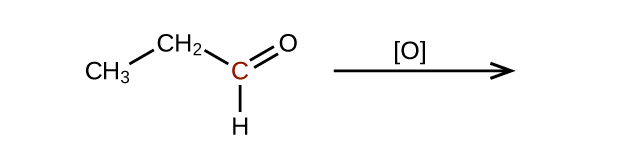
(b)

(c)
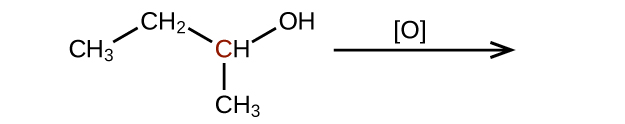
(a)
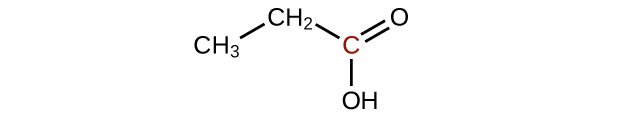
(b)
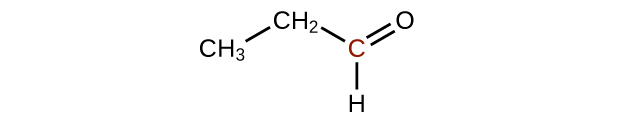
(c)
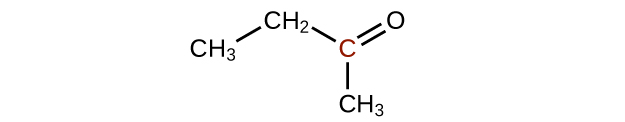
Q20.3.3
Prédisez les produits de la réduction des molécules suivantes. Dans chaque cas, identifiez le produit qui résultera de la diminution minimale de l'état d'oxydation de l'atome de carbone mis en évidence :
(a)
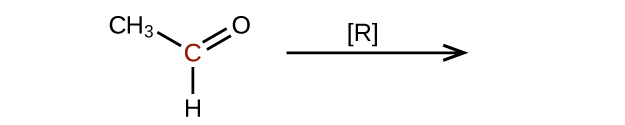
(b)
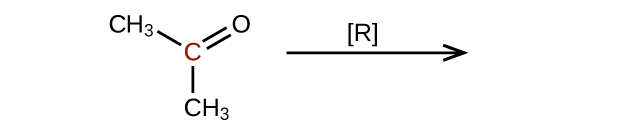
(c)
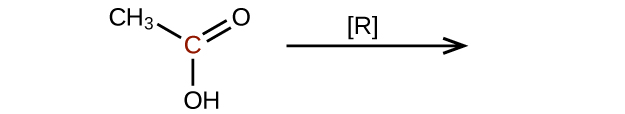
Q20.3.4
Expliquez pourquoi il n'est pas possible de préparer une cétone qui ne contient que deux atomes de carbone.
S20.3.4
Une cétone contient un groupe lié à deux atomes de carbone supplémentaires ; par conséquent, un minimum de trois atomes de carbone sont nécessaires.
Q20.3.5
Comment l'hybridation de l'atome de carbone substitué évolue-t-elle lorsqu'un alcool est converti en aldéhyde ? D'un aldéhyde à un acide carboxylique ?
Q20.3.6
Les acides gras sont des acides carboxyliques qui possèdent de longues chaînes hydrocarbonées liées à un groupe carboxylate. En quoi un acide gras saturé diffère-t-il d'un acide gras insaturé ? En quoi sont-ils similaires ?
S20.3.6
Comme ce sont tous deux des acides carboxyliques, ils contiennent chacun le groupe fonctionnel —COOH et ses caractéristiques. La différence est que la chaîne hydrocarbonée d'un acide gras saturé ne contient aucune liaison double ou triple, alors que la chaîne hydrocarbonée d'un acide gras insaturé contient une ou plusieurs liaisons multiples.
S20.3.7
Écrivez une formule structurale condensée, telle que CH 3 CH 3, et décrivez la géométrie moléculaire de chaque atome de carbone.
- propène
- 1-butanol
- éther éthylique et propylique
- cis -4-bromo-2-heptène
- 2,2,3-triméthylhexane
- méthanal
Q20.3.8
Écrivez une formule structurale condensée, telle que CH 3 CH 3, et décrivez la géométrie moléculaire de chaque atome de carbone.
- 2-propanol
- acétone
- éther diméthylique
- acide acétique
- 3-méthyl-1-hexène
S20.3.8
(a) CH 3 CH (OH) CH 3 : tous les carbones sont tétraédriques ; (b)\(\ce{CH3C(==O)CH3}\) : les carbones terminaux sont tétraédriques et le carbone central est trigonal planaire ; (c) CH 3 OCH 3 : tous sont tétraédriques ; (d) CH 3 COOH : le carbone méthyle est tétraédrique et le carbone acide est plan trigonal ; (e) CH 3 CH 2 CH 2 CH (CH 3) CHCH 2 : tous sont tétraédriques sauf les deux carbones les plus à droite, qui sont trigonaux planaires
Q20.3.9
L'odeur nauséabonde du beurre rance est causée par l'acide butyrique, CH 3 CH 2 CH 2 CO 2 H.
- Dessinez la structure de Lewis et déterminez le nombre d'oxydation et d'hybridation pour chaque atome de carbone de la molécule.
- Les esters formés à partir de l'acide butyrique sont des composés à l'odeur agréable que l'on trouve dans les fruits et utilisés dans les parfums. Dessiner la structure de Lewis pour l'ester formé par la réaction de l'acide butyrique avec le 2-propanol.
Q20.3.10
Écrivez les structures à deux résonances pour l'ion acétate.
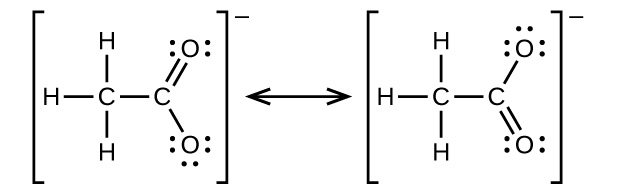
Q20.3.11
Écrivez deux équations complètes et équilibrées pour chacune des réactions suivantes, l'une à l'aide de formules condensées et l'autre à l'aide de structures de Lewis :
- l'éthanol réagit avec l'acide propionique
- de l'acide benzoïque, C 6 H 5 CO 2 H, est ajouté à une solution d'hydroxyde de sodium
Q20.3.12
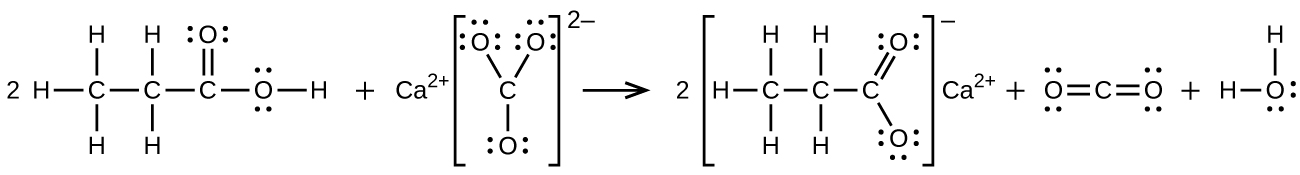
Écrivez deux équations équilibrées complètes pour chacune des réactions suivantes, l'une en utilisant des formules condensées et l'autre en utilisant des structures de Lewis.
- Le 1-butanol réagit avec l'acide acétique
- de l'acide propionique est versé sur du carbonate de calcium solide
S20.3.12
(a)\(\ce{CH3CH2CH2CH2OH + CH3C(O)OH⟶CH3C(O)OCH2CH2CH2CH3 + H2O}\) :
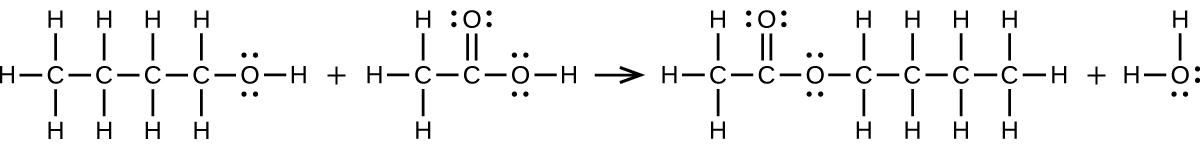
(b)\(\ce{2CH3CH2COOH + CaCO3⟶(CH3CH2COO)2Ca + CO2 + H2O}\) :
Q20.3.13
Les rendements des réactions organiques sont parfois faibles. Quel est le rendement en pourcentage d'un procédé qui produit 13,0 g d'acétate d'éthyle à partir de 10,0 g de CH 3 CO 2 H ?
Q20.3.14
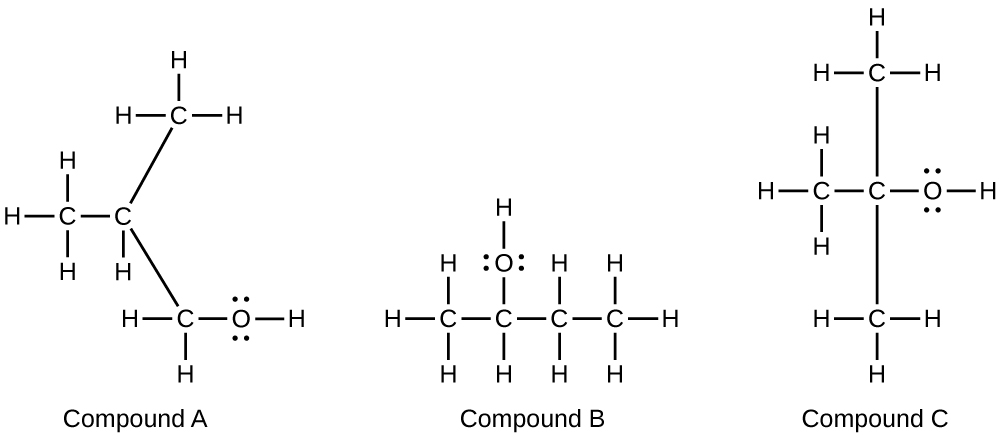
Les alcools A, B et C ont tous la composition C 4 H 10 O. Les molécules d'alcool A contiennent une chaîne carbonée ramifiée et peuvent être oxydées en aldéhyde ; les molécules d'alcool B contiennent une chaîne carbonée linéaire et peuvent être oxydées en cétone ; et les molécules d'alcool C ne peuvent être oxydées ni en aucun un aldéhyde ou une cétone. Écrivez les structures de Lewis de ces molécules.
S20.3.15
20.4 : Amines et amides
Q20.4.1
Ecrire les structures de Lewis des deux isomères avec la formule C 2 H 7 N.
Q20.4.2
Quelle est la structure moléculaire de l'atome d'azote dans la triméthylamine et dans l'ion triméthylammonium, (CH 3) 3 NH + ? Qu'est-ce que l'hybridation de l'atome d'azote dans la triméthylamine et dans l'ion triméthylammonium ?
S20.4.2
Triméthylamine : pyramide trigonale, sp 3 ; ion triméthylammonium : tétraédrique, sp 3
Q20.4.3
Ecrire les deux structures de résonance de l'ion pyridinium, C 5 H 5 NH +.
Q20.4.4
Dessinez les structures de Lewis pour la pyridine et son acide conjugué, l'ion pyridinium, C 5 H 5 NH +. Quelles sont les géométries et les hybridations des atomes d'azote de la pyridine et de l'ion pyridinium ?
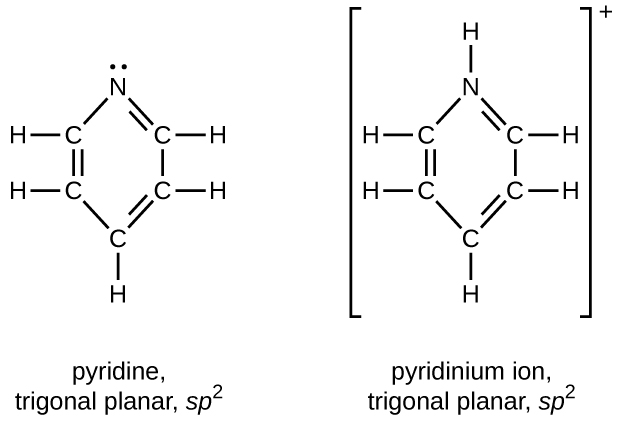
Q20.4.5
Écrivez les structures de Lewis de tous les isomères de formule C 3 H 7 ON qui contiennent une liaison amide.
Q20.4.6
Écrivez deux équations équilibrées complètes pour la réaction suivante, l'une utilisant des formules condensées et l'autre utilisant des structures de Lewis.
- De la méthylamine est ajoutée à une solution de HCl.
S20.4.6
\[\ce{CH3NH2 + H3O+ ⟶CH3NH3+ + H2O}\]
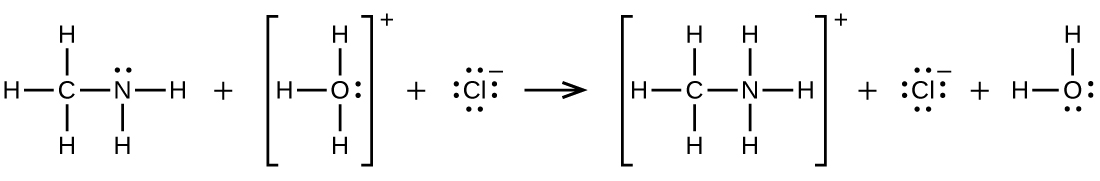
Q20.4.7
Écrivez deux équations complètes et équilibrées pour chacune des réactions suivantes, l'une à l'aide de formules condensées et l'autre à l'aide de structures de Lewis.
Du chlorure d'éthylammonium est ajouté à une solution d'hydroxyde de sodium.
Q20.4.8
Identifiez tous les atomes de carbone qui modifient l'hybridation et le changement d'hybridation au cours des réactions dans [lien].
S20.4.8
CH 3 CH = CHCH 3 (sp 2) + Cl\(⟶\) CH 3 CH (Cl) H (Cl) CH 3 (sp 3) ;
2C 6 H 6 (sp 2) +15O 2\(⟶\) 12CO 2 (sp) + 6H 2 O
Q20.4.9
Identifiez tous les atomes de carbone qui modifient l'hybridation et le changement d'hybridation au cours des réactions dans [lien].
Q20.4.10
Identifiez tous les atomes de carbone qui modifient l'hybridation et le changement d'hybridation au cours des réactions dans [lien].
S20.4.10
le carbone dans le CO 3 2−, initialement à sp 2, change d'hybridation en sp dans le CO 2


