13.1 : Équilibres chimiques
- Page ID
- 194030
- Décrire la nature des systèmes d'équilibre
- Expliquer la nature dynamique d'un équilibre chimique
Une réaction chimique est généralement écrite de manière à suggérer qu'elle se déroule dans une direction, celle dans laquelle nous lisons, mais toutes les réactions chimiques sont réversibles, et la réaction directe et inverse se produisent à un degré ou à un autre selon les conditions. Dans un équilibre chimique, les réactions directe et inverse se produisent à des vitesses égales, et les concentrations de produits et de réactifs restent constantes. Si nous effectuons une réaction dans un système fermé afin que les produits ne puissent pas s'échapper, nous constatons souvent que la réaction ne donne pas un rendement de 100 % en produits. Au lieu de cela, certains réactifs restent après que les concentrations cessent de changer. À ce stade, lorsqu'il n'y a aucun autre changement dans les concentrations de réactifs et de produits, nous disons que la réaction est à l'équilibre. Un mélange de réactifs et de produits se trouve à l'équilibre.
Par exemple, lorsque nous plaçons un échantillon de tétroxyde d'azote (\(N_2O_4\)un gaz incolore) dans un tube en verre, il forme du dioxyde d'azote (\(\ce{NO2}\)un gaz brun) par la réaction
\[\ce{ N2O4(g) \rightleftharpoons 2NO2(g)} \label{13.2.1} \]
La couleur devient plus foncée à mesure qu'elle\(\ce{N2O4}\) est convertie en\(\ce{NO2}\). Lorsque le système atteint l'équilibre,\(\ce{N2O4}\) les deux\(\ce{NO2}\) sont présents (Figure\(\PageIndex{1}\)).
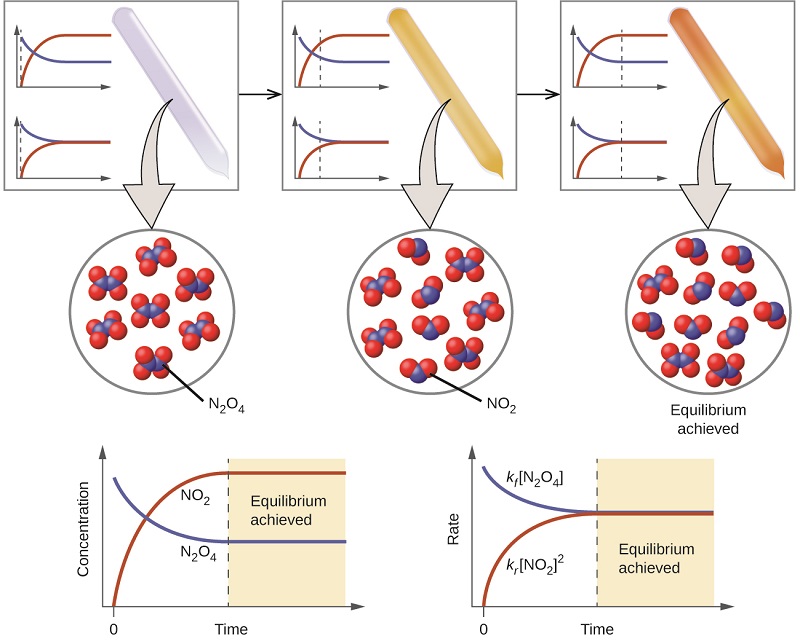
La formation\(\ce{NO2}\) de la forme\(\ce{N2O4}\) est une réaction réversible, identifiée par la flèche d'équilibre (\(\rightleftharpoons\)). Toutes les réactions sont réversibles, mais de nombreuses réactions, à toutes fins pratiques, se déroulent dans une seule direction jusqu'à épuisement des réactifs et ne s'inverseront que dans certaines conditions. Ces réactions sont souvent représentées par une flèche unidirectionnelle allant des réactifs aux produits. De nombreuses autres réactions, telles que la formation\(\ce{NO2}\) de la forme\(\ce{N2O4}\), sont réversibles dans des conditions plus faciles à obtenir et sont donc nommées comme telles. Dans une réaction réversible, les réactifs peuvent se combiner pour former des produits et les produits peuvent réagir pour former les réactifs. Ainsi, non seulement peut\(\ce{N2O4}\) se décomposer pour former\(\ce{NO2}\), mais le\(\ce{NO2}\) produit peut réagir à la forme\(\ce{N2O4}\). Dès que la réaction directe en produit une\(\ce{NO2}\), la réaction inverse commence et\(\ce{NO2}\) commence à réagir pour se former\(\ce{N2O4}\). À l'équilibre, les concentrations de\(\ce{N2O4}\) et\(\ce{NO2}\) ne changent plus car le taux de formation de\(\ce{NO2}\) est exactement égal au taux de consommation de\(\ce{NO2}\), et le taux de formation de\(\ce{N2O4}\) est exactement égal au taux de consommation de\(\ce{N2O4}\). L'équilibre chimique est un processus dynamique : comme chez les nageurs et les baigneurs, le nombre de chacun reste constant, mais il y a un flux aller-retour entre eux (Figure\(\PageIndex{2}\)).

Dans un équilibre chimique, les réactions directe et inverse ne s'arrêtent pas, mais continuent à se produire au même rythme, ce qui entraîne des concentrations constantes des réactifs et des produits. Les graphiques montrant comment les taux de réaction et les concentrations évoluent dans le temps sont présentés dans la figure\(\PageIndex{1}\).
Nous pouvons détecter un état d'équilibre car les concentrations de réactifs et de produits ne semblent pas changer. Cependant, il est important de vérifier que l'absence de changement est due à l'équilibre et non à une vitesse de réaction si lente que les changements de concentration sont difficiles à détecter.
Nous utilisons une double flèche pour écrire une équation pour une réaction réversible. Une telle réaction peut être à l'équilibre ou non. Par exemple, la figure\(\PageIndex{1}\) montre la réaction :
\[\ce{N2O4(g) \rightleftharpoons 2NO2(g)} \label{13.2.2} \]
Lorsque nous voulons parler d'un composant particulier d'une réaction réversible, nous utilisons une seule flèche. Par exemple, dans l'équilibre illustré à la figure\(\PageIndex{1}\), le taux de réaction directe
\[\ce{2NO2(g) \rightarrow N2O4(g)} \label{13.2.3} \]
est égal à la vitesse de la réaction inverse
\[\ce{N2O4(g) \rightarrow 2NO2(g)} \label{13.2.4} \]
Le lien entre la chimie et les boissons gazeuses remonte à 1767, lorsque Joseph Priestley (1733-1804 ; surtout connu aujourd'hui pour son rôle dans la découverte et l'identification de l'oxygène) a découvert une méthode d'infusion de dioxyde de carbone dans l'eau pour fabriquer de l'eau gazéifiée. En 1772, Priestly a publié un article intitulé « Impregnating Water with Fixed Air ». L'article décrit le fait que de l'huile de vitriol (aujourd'hui nous l'appelons acide sulfurique, mais quelle belle façon de décrire l'acide sulfurique : « huile de vitriol » signifie littéralement « méchanceté liquide ») sur de la craie (carbonate de calcium). Le résultat\(CO_2\) tombe dans le récipient d'eau situé sous le récipient dans lequel la réaction initiale a lieu ; l'agitation aide le\(CO_2\) mélange gazeux à l'eau liquide.
\[\ce{H2SO4(l) + CaCO3(s) \rightarrow CO2(g) + H2O (l) + CaSO4 (aq)} \nonumber \]
Le dioxyde de carbone est légèrement soluble dans l'eau. Une réaction d'équilibre se produit lorsque le dioxyde de carbone réagit avec l'eau pour former de l'acide carbonique (\(H_2CO_3\)). L'acide carbonique étant un acide faible, il peut se dissocier en protons (\(H^+\)) et en ions hydrogénocarbonate (\(HCO_3^−\)).
\[\ce{ CO2 (aq) + H2O(l) \rightleftharpoons H2CO3 (aq) \rightleftharpoons HCO3^{-} (aq) + H^{+} (aq)} \nonumber \]
Aujourd'hui,\(\ce{CO_2}\) peut être pressurisé en boissons gazeuses, établissant ainsi l'équilibre indiqué ci-dessus. Cependant, une fois que vous ouvrez le contenant de boisson, une cascade de changements d'équilibre se produit. Tout d'abord, le\(\ce{CO_2}\) gaz présent dans l'espace d'air au-dessus de la bouteille s'échappe, ce qui modifie l'équilibre entre la phase gazeuse\(\ce{CO_2}\) et la phase dissoute ou aqueuse\(\ce{CO_2}\), abaissant ainsi la concentration de\(\ce{CO_2}\) la boisson gazeuse. Moins\(\ce{CO_2}\) dissous dans le liquide, l'acide carbonique se décompose en acide carbonique dissous\(\ce{CO_2}\) et en H 2 O. La baisse de la concentration en acide carbonique entraîne un changement de l'équilibre final. Tant que la boisson gazeuse se trouve dans un récipient ouvert, les\(\ce{CO_2}\) bulles s'échappent de la boisson et libèrent le gaz dans l'air (Figure\(\PageIndex{3}\)). Lorsque le couvercle du flacon est retiré, les\(\ce{CO_2}\) réactions ne sont plus à l'équilibre et se poursuivront jusqu'à ce qu'il ne reste plus de réactifs. Il en résulte une boisson gazeuse à\(\ce{CO_2}\) concentration beaucoup plus faible, souvent qualifiée de « plate ».

Considérons l'évaporation du brome comme deuxième exemple de système en équilibre.
\[\ce{Br2(l) \rightleftharpoons Br2(g)} \nonumber \]
Un équilibre peut être établi pour un changement physique, comme cette transition liquide-gaz, ainsi que pour une réaction chimique. La figure\(\PageIndex{4}\) montre un échantillon de brome liquide en équilibre avec de la vapeur de brome dans un récipient fermé. Lorsque nous versons du brome liquide dans une bouteille vide dans laquelle il n'y a pas de vapeur de brome, une partie du liquide s'évapore, la quantité de liquide diminue et la quantité de vapeur augmente. Si nous bouchons la bouteille de manière à ce qu'aucune vapeur ne s'échappe, la quantité de liquide et de vapeur finira par cesser de changer et un équilibre entre le liquide et la vapeur sera établi. Si la bouteille n'était pas bouchée, les vapeurs de brome s'échapperaient et aucun équilibre ne serait atteint.

Résumé
Une réaction est à l'équilibre lorsque les quantités de réactifs ou de produits ne changent plus. L'équilibre chimique est un processus dynamique, ce qui signifie que la vitesse de formation des produits par la réaction directe est égale à la vitesse à laquelle les produits reforment les réactifs par la réaction inverse.
Lexique
- équilibre
- dans les réactions chimiques, état dans lequel la conversion des réactifs en produits et la reconversion des produits en réactifs se produisent simultanément à la même vitesse ; état d'équilibre
- réaction réversible
- réaction chimique qui peut se produire à la fois dans le sens avant et dans le sens inverse dans des conditions données


