13.0 : Prélude à l'équilibre
- Page ID
- 194029
Imaginez une plage peuplée de baigneurs et de baigneurs. Lorsque ceux qui se prélassent au soleil font trop chaud et veulent se rafraîchir, ils se lancent dans les vagues pour nager. Alors que les nageurs se fatiguent, ils se dirigent vers la plage pour se reposer. Si ces deux taux de transfert (les baigneurs entrent dans l'eau et les nageurs quittent l'eau) sont égaux, le nombre de baigneurs et de nageurs serait constant ou équilibré, bien que l'identité des personnes change constamment d'un bain de soleil à l'autre et vice versa. Une situation analogue se produit dans les réactions chimiques. Les réactions peuvent se produire simultanément dans les deux sens (réactifs vers les produits et produits vers les réactifs) et atteindre finalement un état d'équilibre.
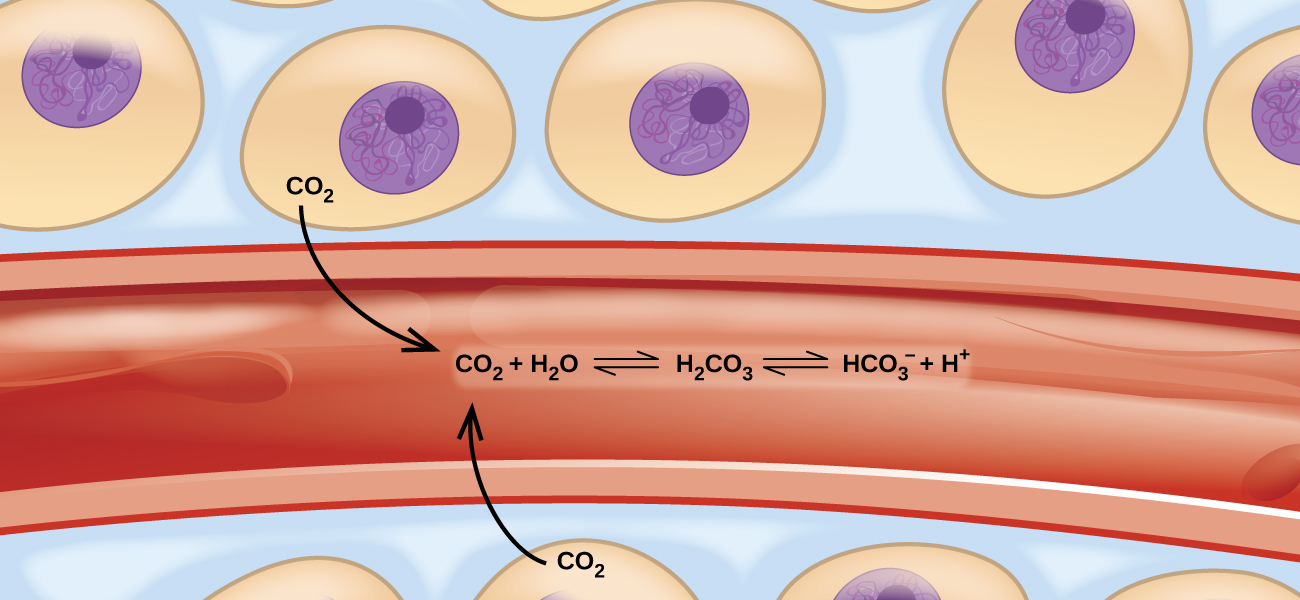
Ces réactions bidirectionnelles équilibrées se produisent tout autour de nous et même en nous. Par exemple, ils se produisent dans notre sang, où la réaction entre le dioxyde de carbone et l'eau forme de l'acide carbonique\(\ce{(HCO3- )}\) (Figure\(\PageIndex{1}\)). La physiologie humaine est adaptée à la quantité de produits ionisés produits par cette réaction (\(\ce{HCO3-}\)et H +). Dans ce chapitre, vous apprendrez comment prédire la position de la balance et le rendement du produit d'une réaction dans des conditions spécifiques, comment modifier les conditions d'une réaction pour augmenter ou réduire le rendement, et comment évaluer la réaction d'un système d'équilibre aux perturbations.


