20.2.2:酸沉积
- Page ID
- 173235
酸沉积这个术语是指大气中含有高于正常含量的硝酸和硫酸的干湿沉积(沉积物质)的混合物。 酸沉积形成的前体或化学先驱者既来自火山和腐烂植被等自然来源,也来自人为来源,主要是化石燃料燃烧产生的二氧化硫(SO 2)和氮氧化物(NO x)的排放(图\(\PageIndex{a}\))。 当这些气体在大气中与水、氧气和其他化学物质反应形成各种酸性化合物时,就会发生酸沉积。 结果是硫酸和硝酸的温和溶液。 当发电厂和其他来源释放二氧化硫和氮氧化物时,盛行的风将这些化合物吹过州和国界,有时会超过数百英里。
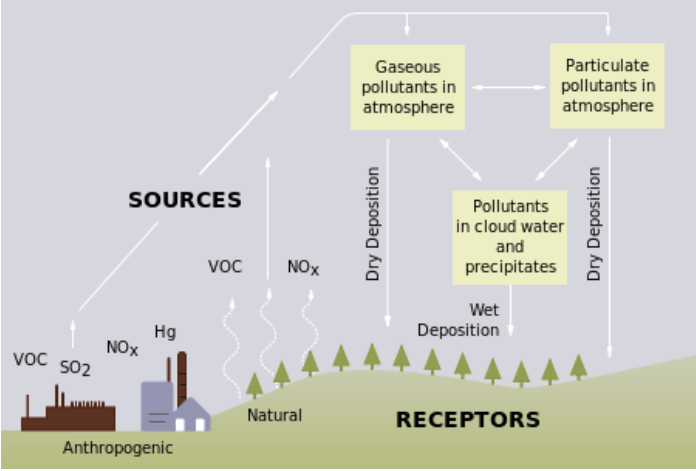
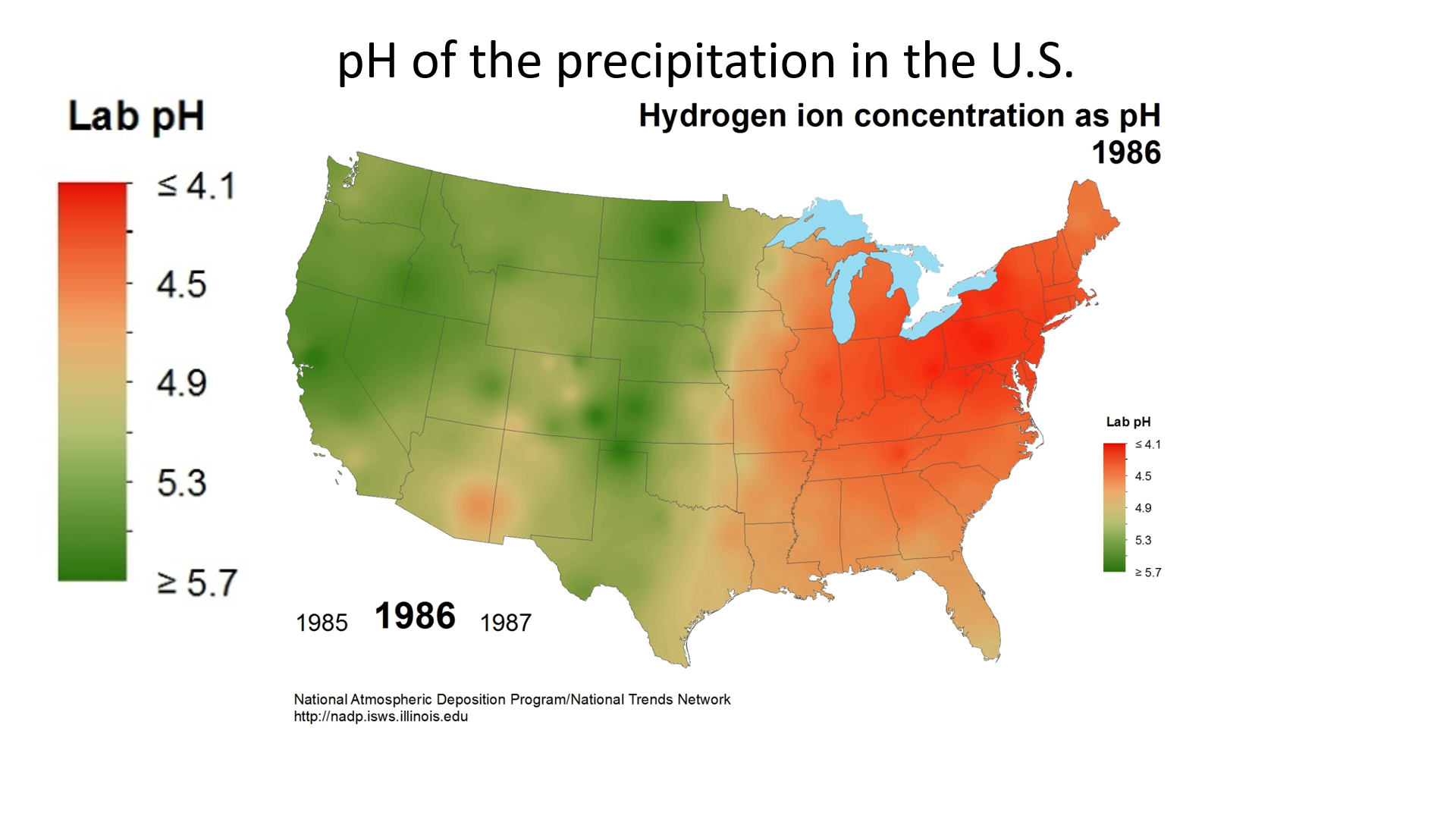
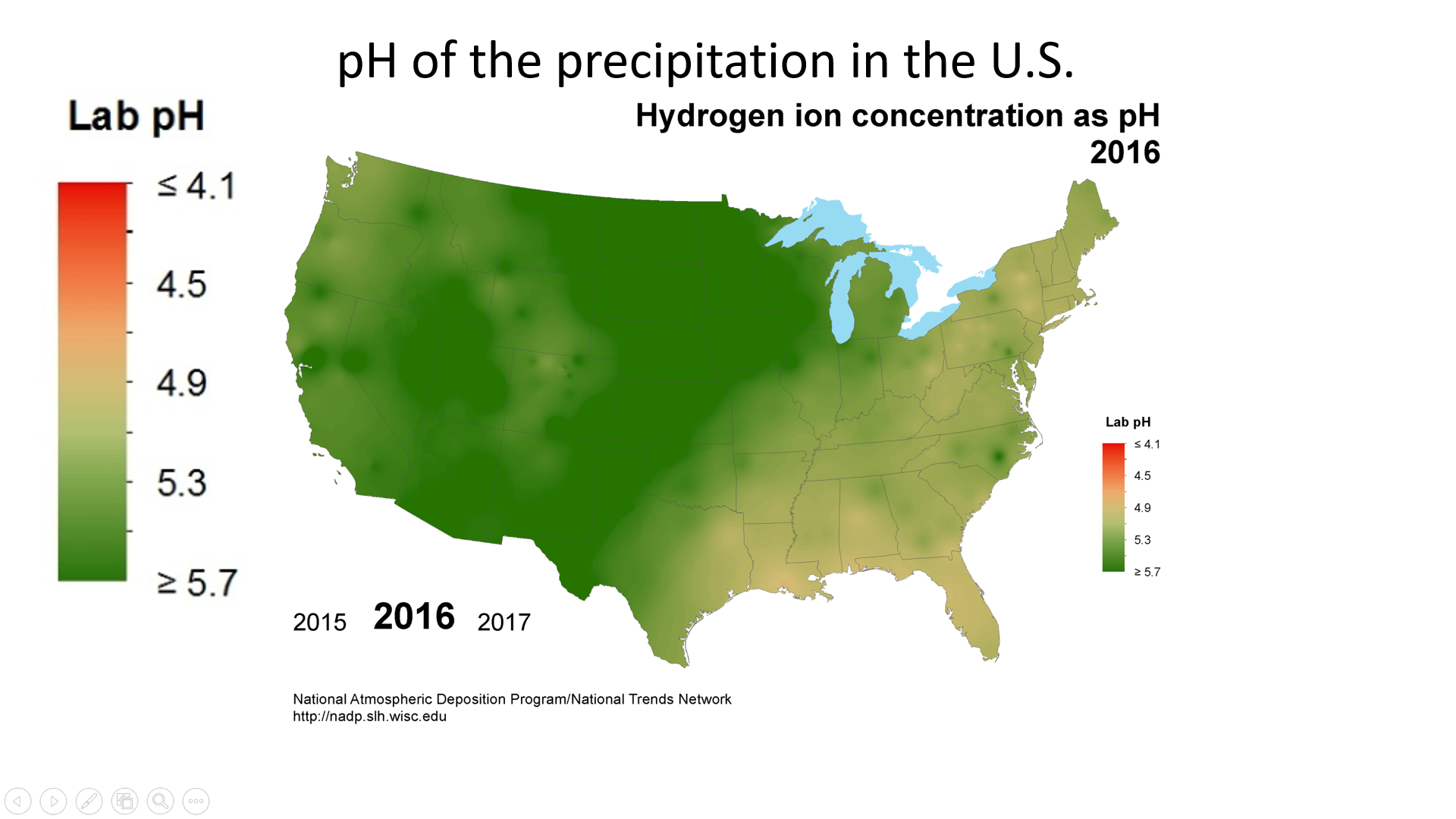
酸沉积使用称为 “pH” 的刻度进行测量。 物质的 pH 值越低,它的酸性就越强。 纯水的 pH 值为 7.0。 但是,普通降雨具有轻微的酸性,因为二氧化碳(CO 2)溶解在雨中形成弱碳酸,在典型的大气二氧化碳浓度下,所得混合物的pH值约为5.6。 1980年美国降水的平均pH值为4.6,但由于二氧化硫和氮氧化物排放的减少,降水量逐渐增加(图\(\PageIndex{b}\))。
酸沉积的影响
酸沉积会导致湖泊和溪流酸化,并导致高海拔树木(例如,2,000 英尺以上的红云杉树)和许多敏感的森林土壤受损。 此外,酸沉积加速了建筑材料和油漆的腐烂,包括作为我们国家文化遗产一部分的不可替代的建筑、雕像和雕塑。 在坠入地球之前,二氧化硫(SO 2)和氮氧化物(NO x)气体及其颗粒物衍生物(硫酸盐和硝酸盐)会导致能见度下降并危害公共健康。
酸沉积的生态影响在水生或水环境中最为明显,例如溪流、湖泊和沼泽。 大多数湖泊和溪流的pH值在6到8之间,尽管有些湖泊即使没有酸沉积的影响,也是天然酸性的。 酸沉积主要影响敏感的水体,这些水体位于流域中,其土壤中和酸性化合物的能力有限(称为 “缓冲能力”)。 当水本身及其周围的土壤无法缓冲酸沉积到足以中和酸沉积物时,湖泊和溪流就会变成酸性(即pH值下降)。 在缓冲能力低的地区,酸沉积会将土壤中的铝释放到湖泊和溪流中;铝对许多种类的水生生物具有剧毒性。 酸沉积会导致森林生长减慢、受伤或死亡。 当然,酸沉积并不是造成这种情况的唯一原因。 其他因素加剧了这些地区的总体压力,包括空气污染物、昆虫、疾病、干旱或非常寒冷的天气。 实际上,在大多数情况下,酸沉积对树木的影响是酸沉积和其他环境压力的综合效应造成的。
酸沉积会导致金属(例如青铜)的腐蚀以及油漆和石材(例如大理石和石灰石)的变质。 这些影响大大降低了建筑物、桥梁、文物(如雕像、纪念碑和墓碑)和汽车(人物\(\PageIndex{c}\))的社会价值。

二氧化硫(SO 2)和氮氧化物(NO x)排放在大气中形成的硫酸盐和硝酸盐会导致能见度受损,这意味着我们无法在空气中看得那么远或清晰。 导致酸沉积的污染物——二氧化硫(SO 2)和氮氧化物(NO x)——会损害人体健康。 这些气体在大气中相互作用,形成细小的硫酸盐和硝酸盐颗粒,这些颗粒可以通过风长距离输送并吸入人的肺部深处。 细颗粒也可以渗透到室内。 许多科学研究已经确定,细颗粒物含量升高与哮喘和支气管炎等心脏和肺部疾病导致的疾病增加和过早死亡之间存在关系。


