17.1: 放射性同位素
- Page ID
- 173283
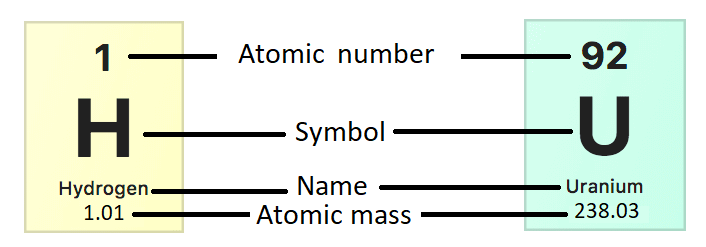
回想一下,原子是元素中最小的成分,它保留了该元素的所有化学特性(参见物质)。 如前所述,原子在原子核中含有未带电的中子和带正电荷的质子。 原子核周围有带负电荷的电子。 原子的原子质量由质子和中子的数量决定,因为电子的质量可以忽略不计。 每个质子或中子重 1 个原子质量单位 (AMU)。 元素周期表中显示的原子质量值不是整数,因为它们代表该元素原子的平均原子质量(图\(\PageIndex{a}\))。 相同元素的原子不一定具有相同的质量,因为它们的中子数可能不同。
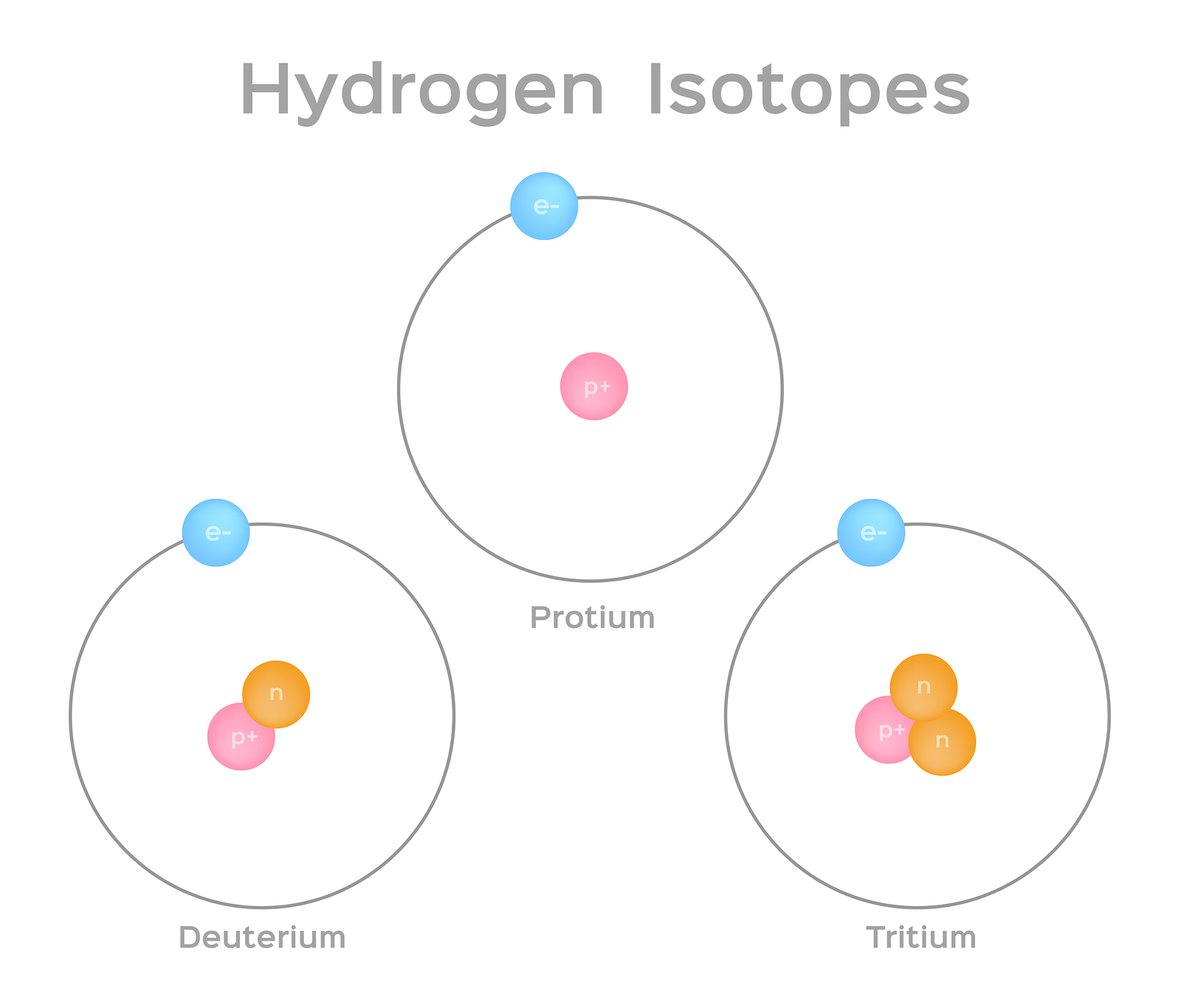
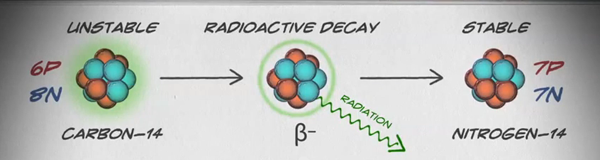
同位素是相同元素的不同形式,具有相同数量的质子,但中子数量不同。 一些元素,例如碳、钾和铀,具有天然存在的同位素。 碳12是最常见的碳同位素,包含六个质子和六个中子。 因此,它的质量数为12(六个质子和六个中子),原子序数为6(这使其成为碳)。 Carbon-14 包含六个质子和八个中子。 因此,它的质量数为14(六个质子和八个中子),原子序数为6,这意味着它仍然是碳元素。 碳的这两种替代形式是同位素。 有些同位素是不稳定的,会以粒子和能量的形式发射辐射以形成更稳定的元素。 某些形式的辐射是危险的。 它们被称为放射性同位素或放射性同位素(图\(\PageIndex{b}\))。 在放射性衰变期间,一种类型的原子可以通过这种方式变成另一种类型的原子(图\(\PageIndex{c}\))。
《半条命》
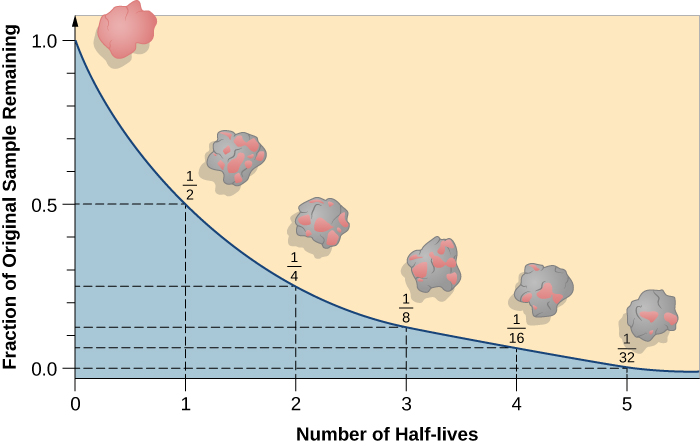
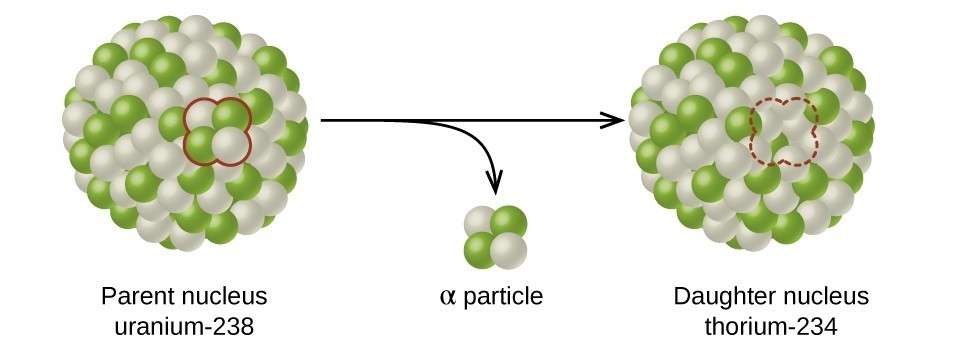
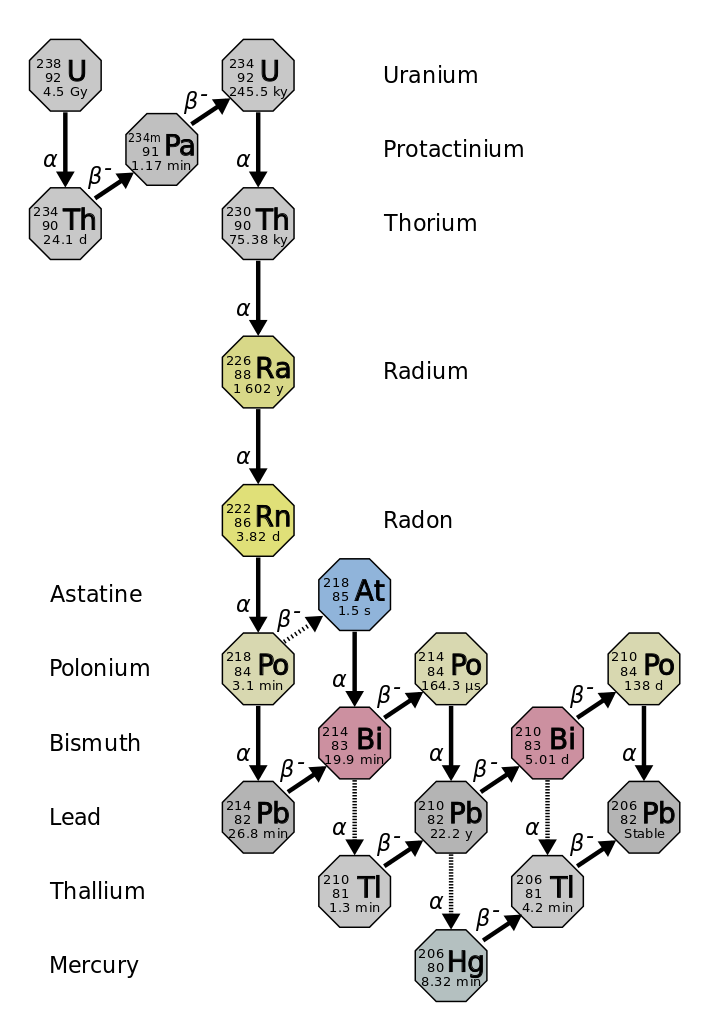
半衰期是原始放射性同位素的一半衰变所需的时间(图\(\PageIndex{d}\))。 例如,铀-238的半衰期约为45亿年。 45亿年后,铀-238最初量的一半(50%)将留下来。 其余的将分解为钍234(它也是放射性的,会迅速分解为一系列放射性同位素,直到最终变成稳定的铅206;图\(\PageIndex{e-f}\))。 在两个半衰期(90亿年)之后,只剩下50%的一半(原始半衰期的25%)。 在三个半衰期之后,将只剩下原始铀238的12.5%。
行动中的进化:碳定年
Carbon-14(14 C)是一种天然存在的放射性同位素,由宇宙射线在大气中产生。 这是一个连续的过程,因此总会创建更多 14 C。 随着活生物体的发育,其体内 14 C的相对水平等于大气中14C的浓度。 当生物死亡时,它不再摄入 14 摄氏度,因此该比例将下降。 14 C 通过一个叫做 β 衰变的过程衰变为 14 N;它在这个缓慢的过程中释放出能量(图\(\PageIndex{c}\))。 大约 5,730 年后,14 C 的起始浓度中只有一半会转化为 14 N。同位素原始浓度的一半衰变为更稳定的形式所需的时间称为其半衰期。
由于 14 C 的半衰期很长,因此它被用来老化以前的活物体,例如化石。 使用在物体中发现的 14 摄氏度浓度与在大气中检测到的 14 摄氏度的比率,可以确定尚未衰变的同位素量。 根据这个数额,可以计算出化石的年龄约为50,000年(\(\PageIndex{g}\)下图)。 半衰期较长的同位素,例如钾40,用于计算较旧化石的年龄。 通过使用碳定年法,科学家可以重建生活在过去 50,000 年内的生物的生态和生物地理学。
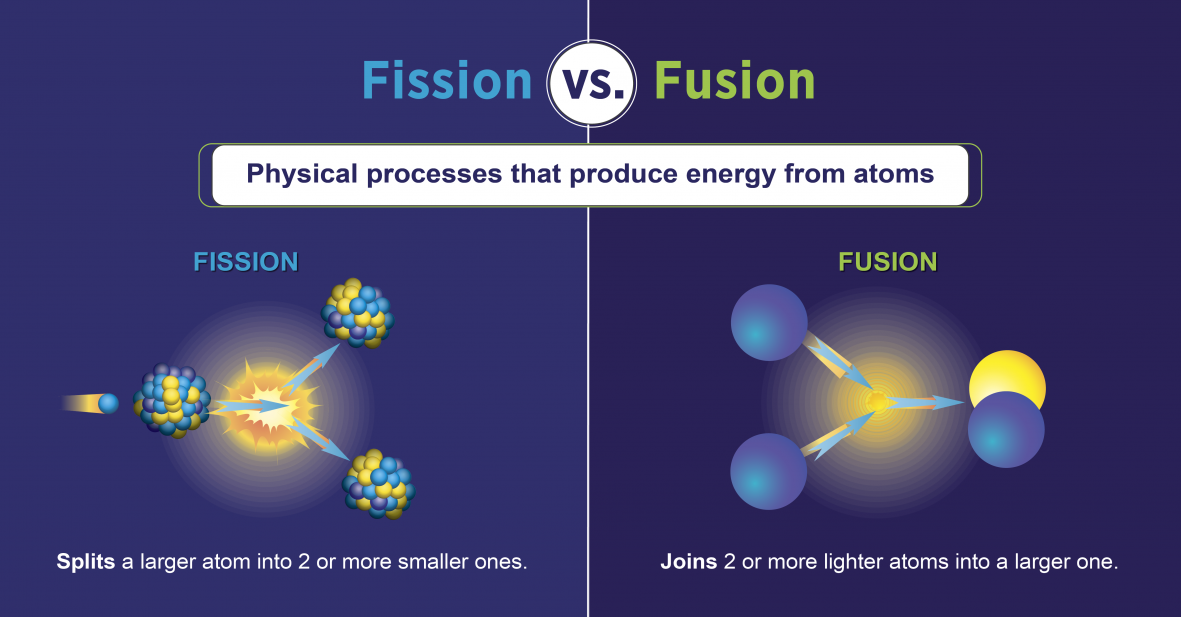
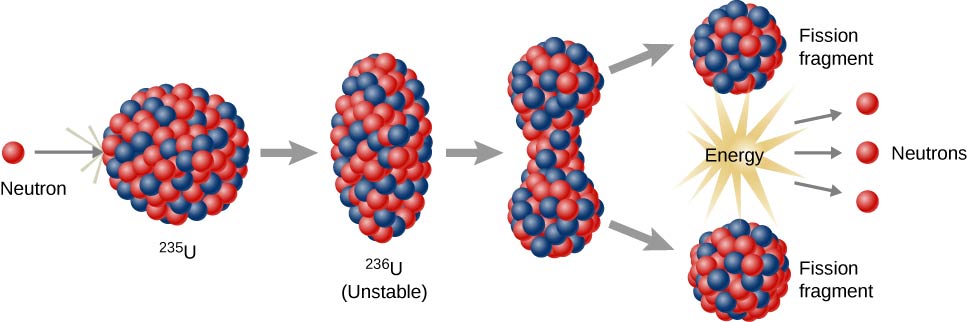
核裂变反应
核裂变反应是指涉及分裂原子核的反应(图\(\PageIndex{h}\))。 它们可以通过用中子爆炸放射性元素来诱发。 与自然放射性衰变一样,诱发的核裂变反应会释放能量。 核裂变时释放的热能可用于发电。 这是核能的基础。 目前,铀235(235 U;原子质量为235的铀同位素)目前被用作核裂变反应的燃料(图\(\PageIndex{h}\))。