12.4:基因工程——风险、收益和认知
- Page ID
- 200492
学习目标
- 总结基因疗法的机制、风险和潜在益处
- 确定涉及基因疗法和监督临床试验的监管机构的伦理问题
- 比较体细胞和生殖系基因疗法
许多类型的基因工程产生了明显的好处,几乎没有明显的风险。 例如,很少有人会质疑我们目前由基因工程细菌产生的大量人胰岛素供应的价值。 但是,基因工程的许多新兴应用更具争议性,这通常是因为它们的潜在好处与实际或感知的重大风险相提并论。 基因疗法确实如此,基因工程是一种临床应用,有朝一日可能会治愈许多疾病,但在很大程度上仍是一种实验性的治疗方法。
基因疗法的机制和风险
由基因突变引起的人类疾病通常很难用药物或其他传统疗法来治疗,因为疾病的体征和症状是由患者基因组的异常引起的。 例如,患者可能有基因突变,该突变会阻止特定细胞类型正常功能所需的特定蛋白质的表达。 严重联合免疫缺陷(SCID)患者就是这种情况,SCID 是一种遗传性疾病,会损害免疫系统必需的某些白细胞的功能。
基因疗法试图通过将非突变的功能性基因引入患者的基因组来纠正遗传异常。 未突变的基因编码一种功能性蛋白,否则患者将无法产生这种蛋白质。 腺病毒等病毒载体有时用于引入功能基因;病毒基因组的一部分被移除,取而代之的是所需的基因(图\(\PageIndex{1}\))。 更先进的基因疗法试图纠正基因组原始位点的突变,例如治疗SCID。
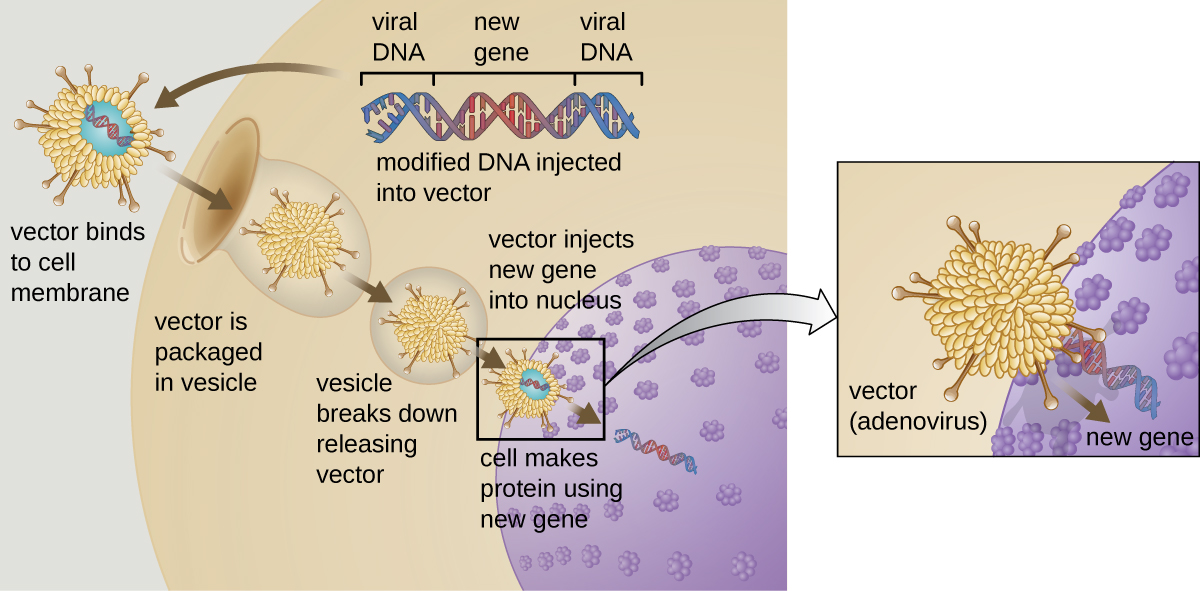
到目前为止,事实证明,基因疗法相对无效,囊性纤维化和腺苷脱氨酶缺乏症(一种SCID)的治疗可能例外。 其他试验表明,尝试对人类等复杂的多细胞生物进行基因操纵具有明显的危害。 在某些患者中,使用腺病毒载体会引发免疫系统意想不到的炎症反应,从而可能导致器官衰竭。 此外,由于病毒通常可以靶向多种细胞类型,因此病毒载体可能会感染非治疗靶向的细胞,破坏这些其他细胞,并可能导致癌症等疾病。 另一个潜在的风险是,改良后的病毒可能恢复传染性并导致患者患病。 最后,插入的基因有可能无意中使患者基因组中的另一个重要基因失活,从而破坏正常的细胞循环,并可能导致肿瘤形成和癌症。 由于基因疗法涉及许多风险,因此在提供接受治疗的知情同意之前,需要将这些风险充分告知基因疗法的候选人。
1999年的杰西·盖尔辛格(Jesse Gelsinger)病例意识到基因治疗的风险。杰西·盖尔辛格是一名18岁的患者,他在宾夕法尼亚大学的一项临床试验中接受了基因治疗。 杰西因一种称为鸟氨酸转氨甲酰化酶(OTC)缺乏的疾病接受了基因治疗,这种疾病由于氨处理不足,导致氨在血液中积累。 治疗四天后,杰西因对腺病毒载体产生大量免疫反应而死亡。 1
在此之前,研究人员还没有真正认为对该载体的免疫反应是合法的风险,但是在调查中,研究人员似乎有一些证据表明这是一种可能的结果。 在杰西接受治疗之前,其他几名人类患者也出现了这种治疗的副作用,试验中使用的三只猴子死于炎症和凝血障碍。 尽管有这些信息,但看来杰西和他的家人在同意治疗时都没有意识到这些结果。 杰西的死亡是第一例因基因疗法治疗而死亡的患者,导致他参与的临床试验立即停止,随后宾夕法尼亚大学停止了所有其他基因疗法试验,并停止了对宾夕法尼亚大学所有其他基因疗法试验的调查美国。 结果,对基因疗法的总体监管和监督进行了重新审查,从而制定了新的监管协议,这些协议至今仍然有效。
练习\(\PageIndex{1}\)
- 解释基因疗法在理论上是如何工作的。
- 确定基因治疗的一些风险。
监督基因疗法
目前,基因疗法临床试验受到重大监督。 在联邦一级,三个机构同时监管基因治疗:美国食品药品监督管理局(FDA)、人类研究保护办公室(OHRP)和国立卫生研究院(NIH)的重组DNA咨询委员会(RAC)。 这些联邦机构与几个地方机构一道,与机构审查委员会互动,以确保制定协议,保护临床试验期间的患者安全。 这些议定书的遵守主要是在地方一级与联邦机构合作执行的。 与其他类型的疗法相比,基因疗法目前正在接受最广泛的联邦和地方审查,后者通常只接受FDA的审查。 一些研究人员认为,这些广泛的法规实际上抑制了基因疗法研究的进展。 2013年,医学研究所(现为美国国家医学院)呼吁美国国立卫生研究院(NIH)在大多数情况下放松对基因疗法试验的审查。 2 但是,确保患者安全仍然是头等大事。
道德问题
除了基因疗法的健康风险外,对人类进行基因改造的能力还带来了许多与这种 “疗法” 的局限性有关的伦理问题。 尽管目前的研究重点是遗传疾病的基因疗法,但科学家有朝一日可能会应用这些方法来操纵其他被认为不理想的遗传特征。 这就提出了一些问题,例如:
练习\(\PageIndex{2}\)
- 哪些遗传特征值得 “纠正”?
- 基因疗法应该出于美容原因还是为了增强人类能力而使用?
- 是否应该使用基因操纵来赋予未出生者理想的特征?
- 每个人都有权接受基因疗法,还是基因疗法的成本会造成新的社会不平等形式?
- 谁应该负责规范和监管基因疗法的不当使用?
使用基因疗法改变生殖细胞的能力也可能产生新的伦理困境。 迄今为止,各种类型的基因疗法已针对体细胞,即体内的非生殖细胞。 由于体细胞特征不是遗传的,因此体细胞基因疗法实现的任何遗传变化都不会传给后代。 但是,如果科学家成功地将新基因引入生殖细胞(卵子或精子),则由此产生的特征可能会传给后代。 这种被称为种系基因疗法的方法有可能用于对抗遗传性疾病,但也可能给子孙后代带来意想不到的后果。 此外,还有知情同意的问题,因为受种系基因疗法影响的人是未出生的,因此无法选择是否接受治疗。 出于这些原因,美国政府目前不资助研究人类种系基因疗法的研究项目。
危险基因疗法
尽管目前美国市场上没有基因疗法,但许多疗法正在研发中,有些很可能最终会获得批准。 随着针对p53的基因疗法的最新进展,p53基因的体细胞突变与50%以上的人类癌症有关,通过基因疗法进行的 3 种癌症治疗一旦进入商业市场,可能会变得更加普遍。
将任何新疗法推向市场都会带来伦理问题,使预期的收益与风险相提并论。 新疗法应该多快上市? 我们怎样才能确保新疗法在向公众上市之前已经过充分的安全性和有效性测试? 新疗法的开发和批准过程使这些问题变得复杂,因为即使面临重大风险,参与批准程序的人员也常常面临获得批准新疗法的巨大压力。
要获得FDA对新疗法的批准,研究人员必须从动物试验中收集重要的实验室数据,并向FDA药物评估与研究中心(CDER)提交研究性新药(IND)申请。 在FDA审查IND的30天等待期之后,可能开始涉及人体受试者的临床试验。 如果FDA在临床试验之前或期间发现了问题,则FDA可以下令 “临床暂停”,直到任何问题得到解决。 在临床试验期间,研究人员收集和分析有关该疗法的有效性和安全性的数据,包括观察到的任何副作用。 一旦该疗法符合FDA的有效性和安全性标准,开发人员就可以提交一份新药申请(NDA),详细说明该疗法的制造、包装、监测和施用方式。
由于新的基因疗法通常是多年(甚至数十年)实验室和临床研究的结果,因此需要大量的金融投资。 当一种疗法进入临床试验阶段时,制药公司及其股东的财务风险很高。 这会造成潜在的利益冲突,有时会影响研究人员、其资助者甚至试验参与者的客观判断。 杰西·盖尔辛格案(参见 Case in Point:基因疗法出错了)就是一个典型的例子。 面对危及生命的疾病,而且没有合理的治疗方法,不难理解为什么无论风险如何,患者都可能急于参与临床试验。 同样不难看出,研究人员会如何将一小部分研究参与者的短期风险视为为改变游戏规则的新疗法的潜在好处付出的微小代价。
盖尔辛格的去世导致对基因疗法的审查越来越多,随后的基因疗法负面结果导致临床试验暂时停止,等待进一步调查。 例如,当接受SCID基因疗法治疗的法国儿童在治疗几年后开始患上白血病时,FDA暂时停止了在美国进行的类似类型基因疗法的临床试验。 4 此类案例突出表明,研究人员和卫生专业人员不仅需要将人类福祉和患者权利置于盈利之上,还需要在评估新疗法的风险和益处时保持科学客观性。
练习\(\PageIndex{3}\)
- 为什么基因疗法研究受到如此严格的监管?
- 与种系基因疗法相关的主要伦理问题是什么?
关键概念和摘要
- 尽管基因疗法在治疗遗传疾病方面显示出巨大前景,但也存在重大风险。
- 联邦和地方对制药公司开发用于人类的基因疗法有大量的监管。
- 在基因疗法的使用急剧增加之前,医学和研究界、政治家和整个社会需要解决许多伦理问题。
脚注
- 1 芭芭拉·西伯尔德。 “死亡,但基因疗法试验的意外后果。” 加拿大医学会第 164 期第 11 期(2001):1612—1612。
- 2 Kerry Greens。 “报告:简易基因疗法评论。” 《科学家》,2013年12月9日。 http://www.the-scientist.com/?articl...erapy-Reviews/。 已于 2016 年 5 月 27 日访问。
- 3 王震和孙毅。 “针对p53进行新型抗癌疗法。” 转化肿瘤学 3,第 1 期(2010):1—12。
- 4 Erika Check。 “基因疗法:悲剧性的挫折。” N@@ ature 420 第 6912 号(2002):116—118。


