9.1: 微生物如何生长
- Page ID
- 200543
学习目标
- 根据二元裂变定义生长的生成时间
- 识别和描述生长曲线中处于二元裂变(简单细胞分裂)典型阶段的微生物的活性
- 解释几种用于确定呈指数增长的人群中存活细胞数和总细胞数的实验室方法
- 描述不涉及二元裂变的细胞分裂示例,例如萌芽或碎裂
- 描述生物膜的形成和特征
- 识别与生物膜相关的健康风险以及如何应对这些风险
- 描述群体感知及其在细胞间通信和细胞活动协调中的作用
杰尼是一名处于妊娠中期的24岁孕妇,她去诊所时抱怨高烧、38.9 °C(102 °F)、疲劳和肌肉酸痛——典型的流感样体征和症状。 Jeni 经常锻炼身体并遵循营养饮食,重点是有机食品,包括她从当地农贸市场购买的生牛奶。 她所有的免疫接种都是最新的。 但是,看过杰尼的医疗保健提供者很担心,下令将血液样本送去微生物实验室进行检测。
练习\(\PageIndex{1}\)
为什么医疗保健提供者担心杰尼的体征和症状?
细菌细胞周期涉及通过复制 DNA 和将细胞成分分分分为两个子细胞来形成新细胞。 在原核生物中,繁殖始终是无性的,尽管以水平基因转移的形式发生了广泛的遗传重组,将在另一章中进行探讨。 大多数细菌只有一条环状染色体;但是,也存在一些例外。 例如,莱姆病的病原体 Borrelia burgdorferi 具有线性染色体。
二元裂变
细菌中最常见的细胞复制机制是一种称为二元裂变的过程,如图\(\PageIndex{1}\):所示。 在分裂之前,细胞会生长并增加其细胞成分的数量。 接下来,DNA的复制从环状染色体上的一个称为复制起源的位置开始,染色体附着在细胞内膜上。 沿着染色体沿相反的方向继续复制,直到到达终点。
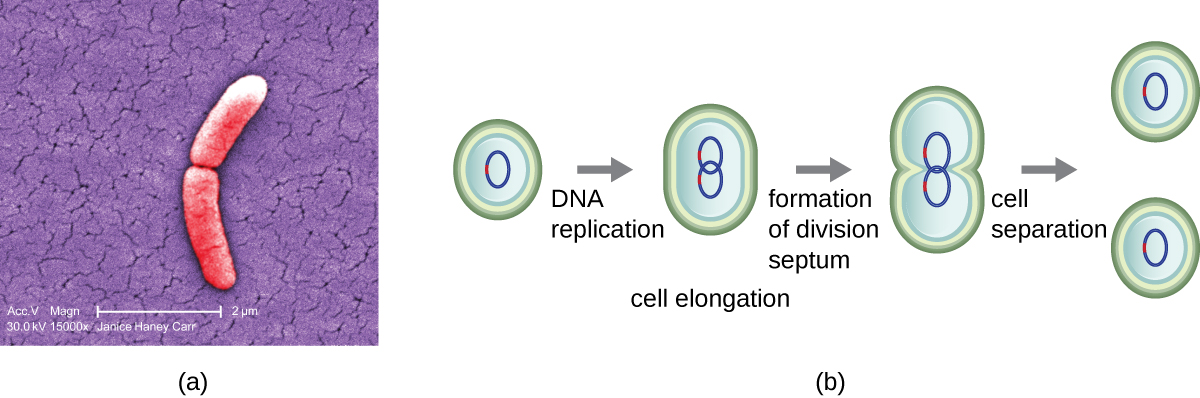
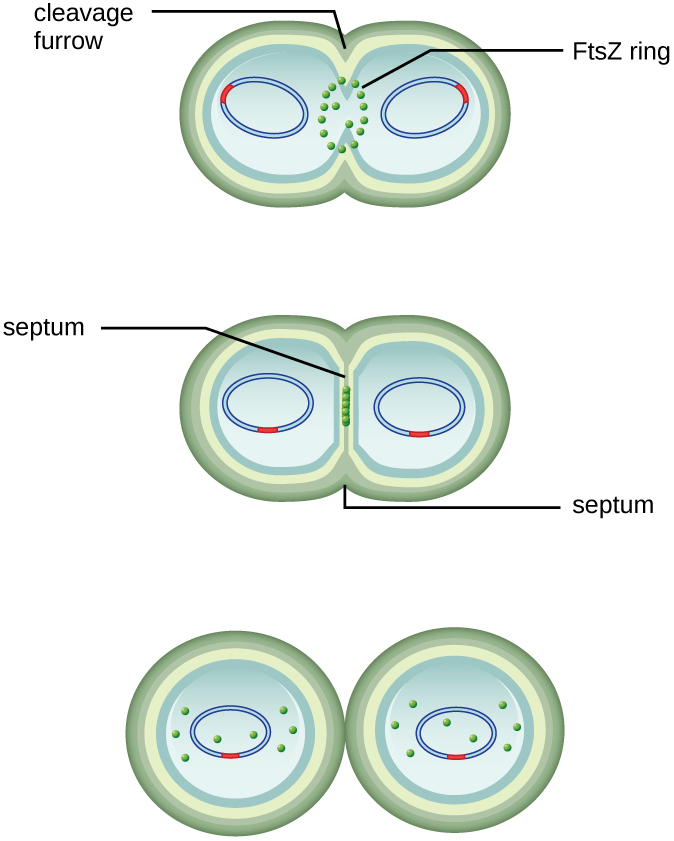
扩大的细胞中心会收缩直到形成两个子细胞,每个后代都获得一份完整的亲本基因组副本和细胞质分裂(细胞分裂)。 这种细胞分裂和细胞分裂过程由一种叫做 FtsZ 的蛋白质引导。 ftsZ 在细胞质膜上组装成一个 Z 环(图\(\PageIndex{2}\))。 Z 环由 FTSZ 结合蛋白锚定,定义了两个子细胞之间的分裂平面。 细胞分裂所需的额外蛋白质被添加到 Z 环中,形成一种叫做 divisome 的结构。 分裂体激活后产生肽聚糖细胞壁并形成分裂两个子细胞的隔膜。 子细胞由分裂隔膜分离,所有细胞的外层(细胞壁和外膜,如果存在)都必须经过重塑才能完全分裂。 例如,我们知道特定的酶会破坏肽聚糖中单体之间的键,并允许沿分裂隔膜添加新的亚基。
练习\(\PageIndex{2}\)
组装成Z环以启动细胞分裂和细胞分裂的蛋白质叫什么名字?
生成时间
在真核生物中,生成时间是连续两代生命周期相同点之间的时间。 例如,人类的典型生成时间为25年。 这个定义对细菌不切实际,细菌可能会迅速繁殖或处于休眠状态数千年。 在原核生物(细菌和古细菌)中,生成时间也称为倍增时间,定义为种群在一轮二元裂变中翻倍所需的时间。 细菌倍增时间差异很大。 尽管在实验室的最佳生长条件下,大肠杆菌可以在短短20分钟内翻一番,但在特别恶劣的环境中,相同物种的细菌可能需要几天才能翻倍。 大多数病原体生长迅速,例如大肠杆菌,但也有例外。 例如,结核病的病原体结核分枝杆菌的生成时间在15到20小时之间。 另一方面,导致汉森氏病(麻风)的麻风杆菌的生长速度要慢得多,翻了一番,为14天。
计算细胞数量
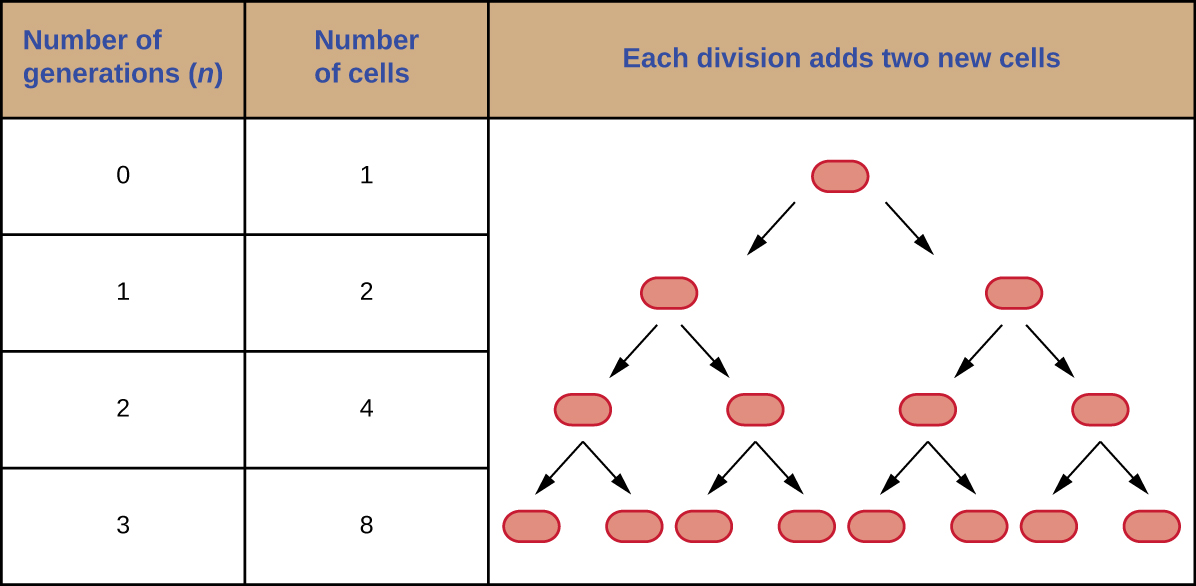
当细胞被二元裂变以恒定速率分裂时,可以预测群体中的细胞数量。 举个例子,假设一个细胞每 30 分钟分裂一次 24 小时会发生什么。 图中的图\(\PageIndex{3}\)表显示了前三代细胞数量的增加。
像元数量呈指数增长,可以表示为 2 n,其中 n 是世代数。 如果细胞每 30 分钟分裂一次,24 小时后就会发生 48 次分裂。 如果我们使用公式 2 n,其中 n 等于 48,则单细胞将在 48 代(24 小时)生成 2 4 8 或 281,474,976,710,656 个细胞。 在处理如此庞大的数字时,使用科学记数法更为实用。 因此,我们将细胞的数量表示为 2.8 × 10 14 个细胞。
在我们的示例中,我们使用一个单元格作为初始单元格数。 对于任意数量的起始细胞,公式调整如下:
\[N_n = N_02^n\]
N n 是任一世代 n 的像元数,N 0 是初始像元数,n 是世代数。
练习\(\PageIndex{3}\)
如果加倍时间为30分钟,起始种群规模为1×10 5 个细胞,假设没有细胞死亡,2小时后会出现多少细胞?
增长曲线
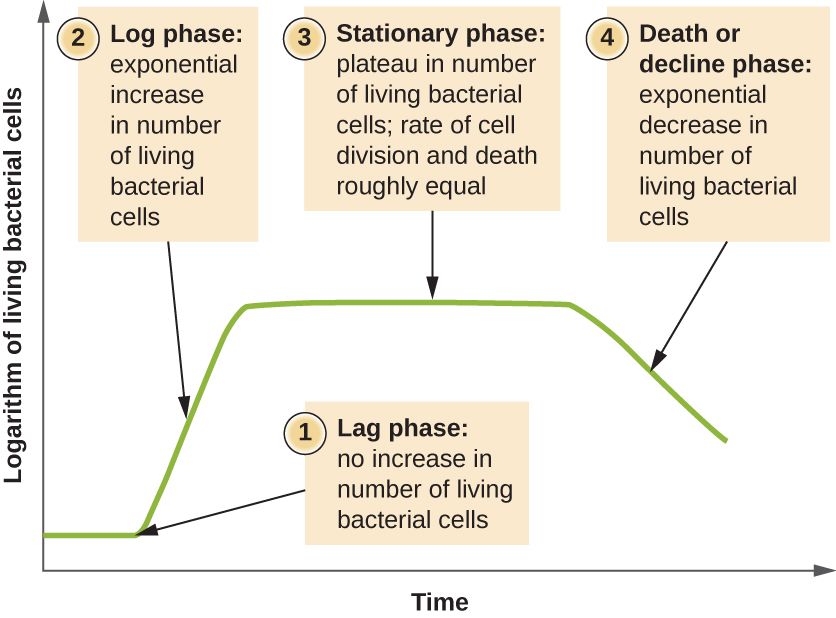
在封闭培养(也称为分批培养)中生长的微生物遵循一种可重复的生长模式,即生长曲线,其中不添加任何营养素,也不会去除大部分废物。 自然界中批量培养的一个例子是池塘,其中少量细胞在封闭的环境中生长。 培养密度定义为每单位体积的细胞数。 在封闭的环境中,培养密度也是衡量群体中细胞数量的指标。 人体感染并不总是遵循生长曲线,但可能存在相关性,具体取决于感染部位和类型。 当根据时间绘制活细胞的数量时,可以在曲线中观察到不同的阶段(图\(\PageIndex{4}\))。
滞后阶段
生长曲线的起点代表少量细胞,称为接种物,它们被添加到新鲜培养基中,新鲜培养基是一种支持生长的营养汤。 生长曲线的初始阶段称为滞后阶段,在此期间,细胞正在为下一阶段的生长做准备。 细胞的数量在滞后阶段没有变化;但是,细胞会变大,具有新陈代谢活性,合成了培养基中生长所需的蛋白质。 如果有任何细胞在转移到新培养基的过程中受到损坏或冲击,则修复将在滞后阶段进行。 滞后期的持续时间由许多因素决定,包括细胞的种类和基因组成、培养基的组成以及原始接种物的大小。
日志阶段
在对数(log)生长阶段(有时称为指数生长阶段)中,细胞被二元裂变主动分裂,其数量呈指数级增长。 对于任何给定的细菌物种,特定生长条件(养分、温度、pH 值等)下的生成时间由基因决定,这个生成时间称为固有生长速度。 在对数阶段,时间和单元格数量之间的关系不是线性的,而是指数的;但是,增长曲线通常绘制在半对数图上,如图所示\(\PageIndex{5}\),它呈现出线性关系。
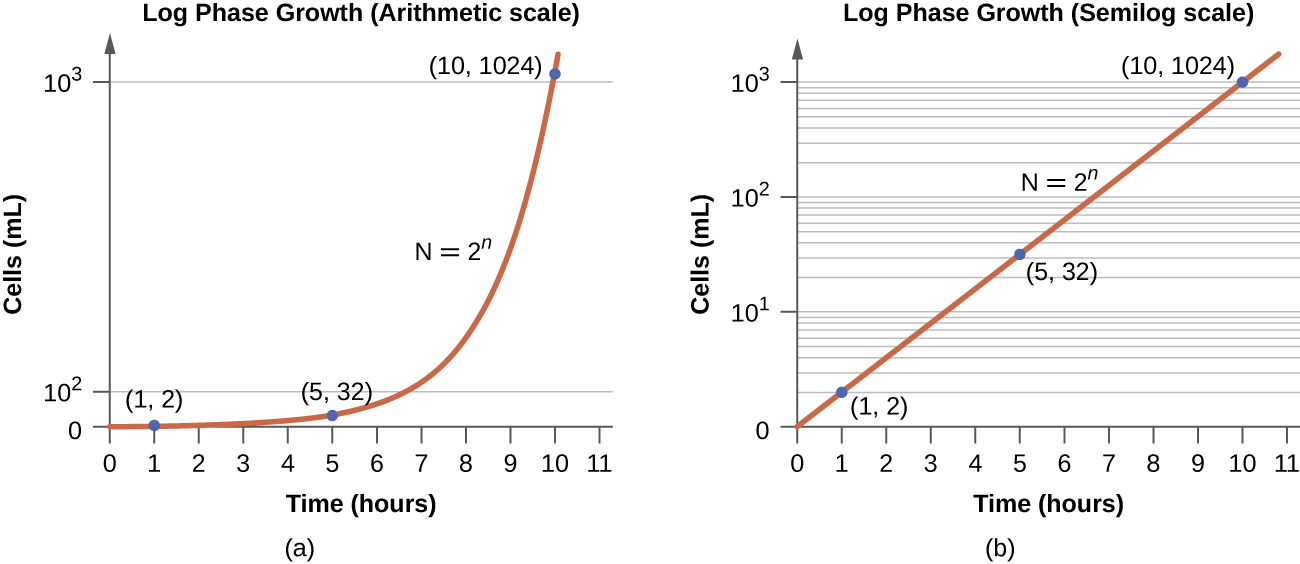
处于对数阶段的细胞表现出恒定的生长速度和均匀的代谢活性。 因此,处于对数阶段的单元优先用于工业应用和研究工作。 记录阶段也是细菌最容易受到影响蛋白质、DNA和细胞壁合成的消毒剂和常见抗生素作用的阶段。
固定相
随着对数阶段细胞数量的增加,有几个因素导致了生长速度的放缓。 废物积聚,养分逐渐耗尽。 此外,氧气的逐渐消耗开始限制有氧细胞的生长。 这种不利条件的结合减缓并最终阻碍了人口增长。 活细胞总数达到称为静止期的稳定期(图\(\PageIndex{4}\))。 在这个阶段,细胞分裂产生的新细胞数量现在等于死亡的细胞数量;因此,活细胞的总数量相对停滞。 固定培养物中的培养密度是恒定的。 培养物的承载能力或最大培养密度取决于培养物中微生物的类型和培养物的具体条件;但是,在相同条件下生长的给定生物的承载能力是恒定的。
在固定阶段,细胞切换到新陈代谢的存活模式。 随着生长放缓,肽聚糖、蛋白质和核酸的合成也会减缓;因此,固定培养物不太容易受到破坏这些过程的抗生素的影响。 在能够产生内孢子的细菌中,许多细胞在静止阶段会产生孢子。 次生代谢物,包括抗生素,在固定相中合成。 在某些致病细菌中,静止期还与毒力因子的表达有关,毒力因子是有助于微生物在宿主生物体中存活、繁殖和引起疾病的能力的产物。 例如,金黄色葡萄球菌中的群体感应会启动酶的产生,这些酶可以分解人体组织和细胞碎片,为细菌传播到营养更丰富的新组织扫清了道路。
死亡阶段
随着培养基积聚有毒废物和营养物质耗尽,细胞越来越多地死亡。 很快,死亡细胞的数量超过了分裂细胞的数量,导致细胞数量呈指数级下降(图\(\PageIndex{4}\))。 这是恰当命名的死亡阶段,有时也称为衰落阶段。 许多细胞裂解并将营养物质释放到培养基中,使存活的细胞能够维持活力并形成内孢子。 一些细胞,即所谓的持久细胞,其特征是新陈代谢速度慢。 Persister 细胞具有医学重要性,因为它们与某些对抗生素治疗没有反应的慢性感染(例如肺结核)有关。
维持微生物生长
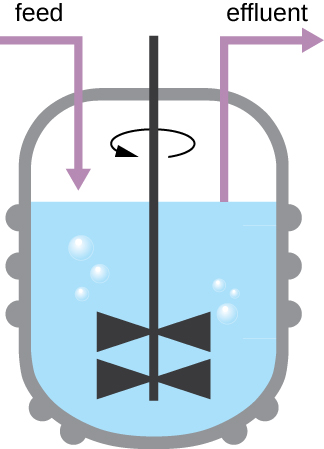
图中所示的生长模式\(\PageIndex{4}\)发生在封闭的环境中;不添加营养物质,也不会去除废物和死细胞。 但是,在许多情况下,将细胞维持在对数生长阶段是有利的。 一个例子是收获微生物产品的行业。 化学稳定器(图\(\PageIndex{6}\))用于维持持续培养,在这种培养中,营养物质以稳定的速度供应。 混合一定量的空气用于有氧运动。 细菌悬浮液的去除速度与营养物质流入的速度相同,以维持最佳的生长环境。
练习\(\PageIndex{4}\)
- 在哪个阶段的增长速度最快?
- 列举限制微生物生长的两个因素。
测量细菌生长
估算样本中细菌细胞的数量(称为细菌数量)是微生物学家执行的一项常见任务。 临床样本中的细菌数量可表明感染程度。 饮用水、食品、药物甚至化妆品的质量控制依赖于细菌数量的估算来检测污染和防止疾病传播。 使用两种主要方法来测量细胞数量。 直接方法涉及计数细胞,而间接方法依赖于对细胞存在或活性的测量,而不实际计算单个细胞。 对于特定的应用,直接和间接方法都有优点和缺点。
直接细胞计数
直接细胞计数是指对液体培养物中的细胞或板上的菌落进行计数。 这是估计样本中存在多少生物的直接方法。 让我们先来看一个简单而快速的方法,它只需要专门的载玻片和一台复合显微镜。
计数细菌的最简单方法称为直接显微细胞计数,它涉及将已知体积的培养物转移到经过校准的载玻片上,然后在光学显微镜下对细胞进行计数。 经过校准的载玻片被称为 Petroff-Hausser 腔室(图\(\PageIndex{7}\)),类似于用于计数红细胞的血细胞计。 计数室的中心区域被蚀刻成各种大小的正方形。 将培养悬浮液样本添加到腔室下方的盖玻片下,该盖片放置在距离网格表面的特定高度。 通过计算多个正方形中的单个细胞并确定观测到的样本的体积,可以估计原始样本中细胞的浓度。 正方形的面积和盖玻片的放置高度是为腔室指定的。 如果样品在枚举前被稀释,则必须校正浓度以进行稀释。
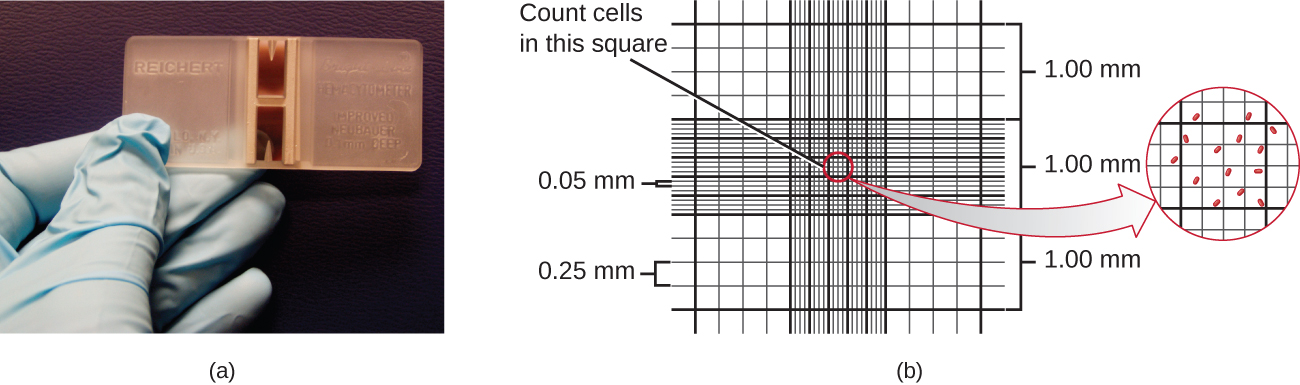
必须对几个小方块中的像元进行计数并取平均值才能获得可靠的测量结果。 该腔室的优点是该方法易于使用,相对较快且价格便宜。 不利的一面是,计数室不能很好地处理稀释培养物,因为可能没有足够的细胞进行计数。
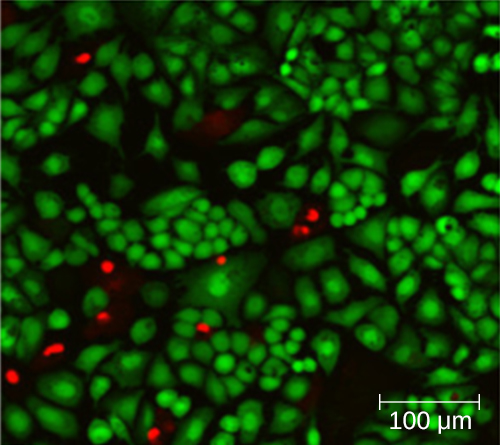
使用计数室不一定能准确计数活细胞的数量,因为在显微镜下并不总是能够区分活细胞、死细胞和相同大小的碎片。 但是,新开发的荧光染色技术使区分活细菌和死亡细菌成为可能。 这些活性污渍(或活体污渍)与核酸结合,但初级和次要染色在穿过细胞质膜的能力方面有所不同。 主要染色呈绿色荧光,可以穿透完整的细胞质膜,染色活细胞和死细胞。 二次染色会发出红色荧光,只有在细胞质膜严重受损的情况下才能染色细胞。 因此,活细胞发出绿色荧光是因为它们只吸收绿色污渍,而死细胞则显示为红色,因为红色污渍取代了核酸上的绿色污渍(图\(\PageIndex{8}\))。
另一种技术使用电子细胞计数设备(库尔特计数器)来检测和计算盐水溶液中电阻的变化。 将带有小开口的玻璃管浸入电解质溶液中。 第一电极悬浮在玻璃管中。 第二个电极位于管外。 当电池穿过玻璃管中的小孔径时,它们会短暂地改变两个电极之间测得的电阻,这种变化由电子传感器记录(图\(\PageIndex{9}\));每一次电阻变化代表一个电池。 该方法在一定浓度范围内快速而准确;但是,如果培养物过于集中,则在任何给定时间都可能有多个细胞通过孔隙并使结果出现偏差。 这种方法也无法区分活细胞和死亡细胞。
直接计数提供样本中细胞总数的估计值。 但是,在许多情况下,重要的是要知道活细胞或活细胞的数量。 在评估感染程度、抗微生物化合物和药物的有效性或食物和水的污染时,需要对活细胞进行计数。
练习\(\PageIndex{5}\)
- 你为什么要计算 Petroff-Hausser 腔室中多个正方形中的细胞数量来估算细胞数量?
- 在活力染色法中,为什么死细胞会出现红色?
牌照数
活板数,或简称板数,是活细胞或活细胞的计数。 它基于这样的原理,即活细胞在适合标本的条件下孵育时会复制并产生可见的菌落。 结果通常以每毫升菌落形成单位(CFU/mL)表示,而不是每毫升细胞数,因为可能有多个细胞落在同一个位置产生单个菌落。 此外,成簇或链生长的细菌样本难以分散,单个菌落可能代表多个细胞。 有些细胞被描述为可存活但不可培养,不会在固体培养基上形成菌落。 出于所有这些原因,活板数被认为是对活细胞实际数量的低估值。 这些局限性不会减损该方法的实用性,该方法提供了活细菌数量的估计值。
微生物学家通常对具有 30—300 个菌落的板块进行计数。 菌落过少(300 个<30) do not give statistically reliable numbers, and overcrowded plates (> 菌落)的样本很难准确计数单个菌落。 此外,该范围内的计数可最大限度地减少多个细菌细胞形成单个菌落的情况。 因此,计算出的 CFU 更接近人群中活细菌的真实数量。
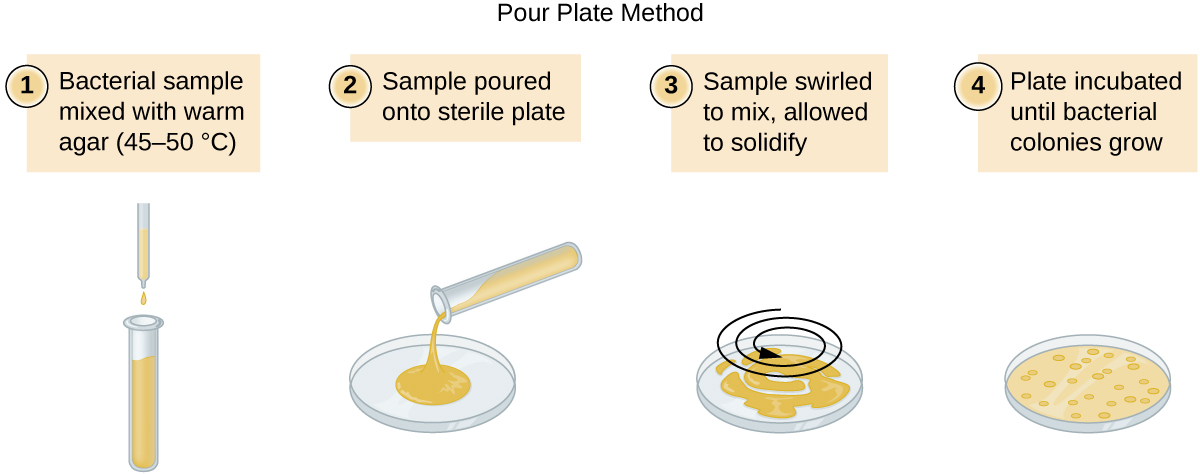
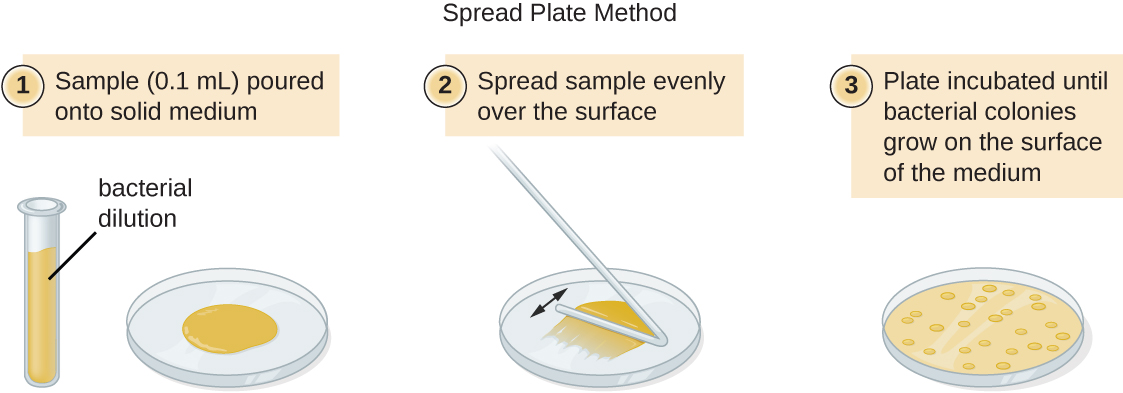
有两种常见的方法可以接种板块以获得可行计数:浇板方法和铺板方法。 尽管这两种方法的最终接种程序有所不同,但它们都从连续稀释培养物开始。
连续稀释
连续稀释培养物是采用浇板法或展板法之前重要的第一步。 连续稀释过程的目标是获得 CFU 在 30—300 之间的板材,该过程通常涉及以 10 的倍数进行多次稀释以简化计算。 连续稀释的次数是根据对培养密度的初步估计选择的。 该图\(\PageIndex{10}\)说明了串行稀释方法。
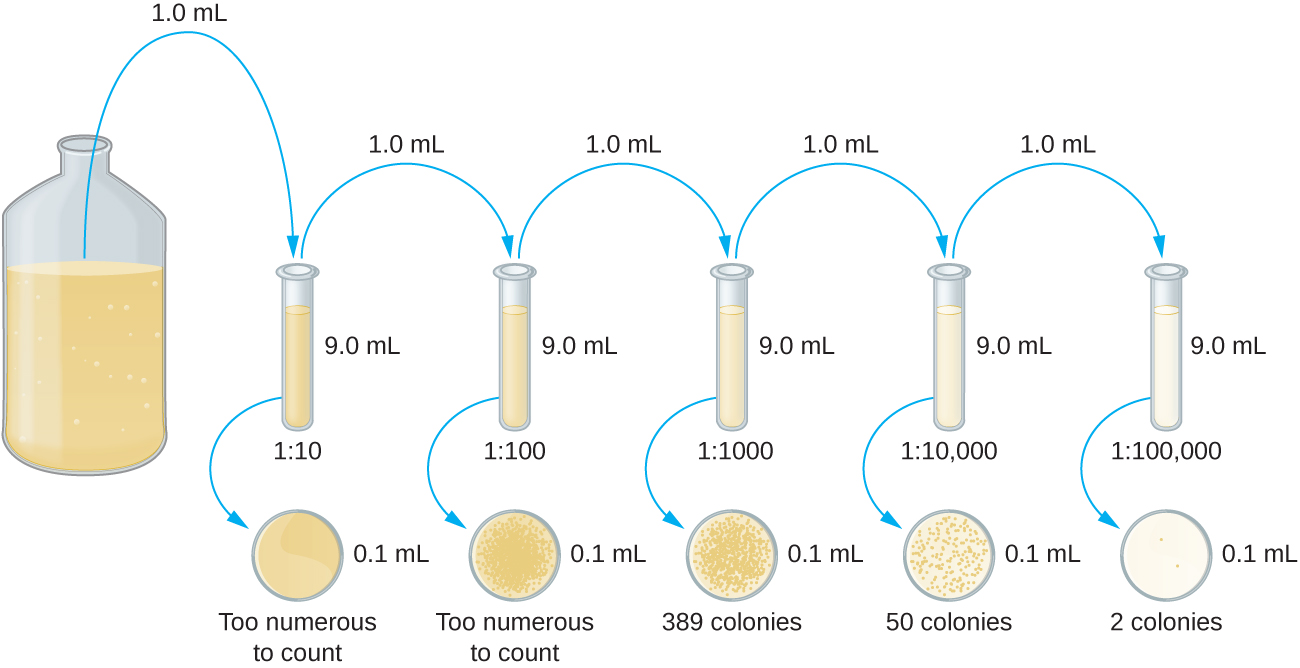
将固定体积的原始培养物 1.0 mL 添加到第一个稀释管溶液中,并与其充分混合,该溶液含有 9.0 mL 的无菌肉汤。 与原始培养物相比,此步骤表示稀释系数为 10 或 1:10。 从第一次稀释开始,提取相同体积的 1.0 mL,并与一管 9.0 mL 的新稀释液混合。 与原始培养物相比,现在的稀释系数为 1:100。 这个过程一直持续到产生一系列稀释液为止,这些稀释液将控制在所需的细胞浓度范围内,以便进行精确计数。 使用浇板法(图\(\PageIndex{11}\))或展板法(图)从每根管中将样品镀在固体介质上。\(\PageIndex{12}\) 盘子经过孵育直到菌落出现。 每次稀释通常制成两到三个盘子,每个盘子上计数的菌落数是平均值。 在所有情况下,样品与稀释介质充分混合(以确保试管中的细胞分布是随机的)对于获得可靠的结果至关重要。
稀释因子用于计算原始细胞培养物中的细胞数量。 在我们的示例中,从 1:10 ,000 稀释中获得的板上平均计算了 50 个菌落。 由于在试板上仅移液了 0.1 mL 的悬浮液,因此重构原始浓度所需的倍数为 10×10,000。 每 mL 的 CFU 数等于 50×100×10,000 = 5,000,000。 培养物中的细菌数量估计为 500 万个细胞/毫升。 从 1:1000 稀释中获得的菌落数为 389,远低于稀释度相差 10 倍时预期的 500。 这凸显了当菌落计数大于 300 且多个细菌细胞长成单个菌落时存在的不准确问题。
非常稀释的样本(例如饮用水)可能不含足够的生物,无法使用上述任何一种牌照计数方法。 在这种情况下,在电镀之前,必须对原始样品进行浓缩而不是稀释。 这可以通过修改称为膜过滤技术的板数技术来实现。 已知体积通过薄膜进行真空无菌过滤,孔径小到足以捕获微生物。 将膜转移到含有适当生长培养基的 Petri 板上。 菌落在孵化后计算在内。 通过将细胞数除以过滤液体的体积来计算细胞密度。
观看此视频,了解连续稀释和展板技术的演示。
最可能的数字
稀释样品中的微生物数量通常太少,无法通过迄今为止描述的板数方法进行检测。 对于这些标本,微生物学家通常使用最可能的数字(MPN)方法,这是一种估算样本中活微生物数量的统计程序。 MPN 方法通常用于水和食物样本,通过观察代谢活动引起的浊度或颜色的变化来评估可检测到的生长。
MPN 方法的一个典型应用是估算池塘水样本中的大肠菌群数量。 大肠菌群是发酵乳糖的革兰氏阴性杆菌。 水中存在大肠菌群被认为是粪便污染的标志。 对于图中所示的方法\(\PageIndex{13}\),通过接种五根含有 10 mL 样品的乳糖汤管、五根含有 1 mL 样品的乳糖汤管和五根装有 0.1 mL 样品的乳糖汤管来测试水样本的系列三次稀释度。 乳糖汤管含有 pH 指示剂,当乳糖发酵时,该指示剂的颜色会从红色变为黄色。 在接种和孵育后,通过培养基的颜色从红色变为黄色,检查试管中是否有大肠菌生长的迹象。 第一组试管(10-mL 样本)显示所有试管都有生长;第二组试管(1 mL)显示五分之二的试管生长;在第三组试管中,任何试管中都没有观察到生长(稀释0.1 mL)。 将数字 5、2 和 0 与附录 B 中的图 B1 进行了比较,后者是使用抽样过程的概率模型构建的。 根据我们对表格的阅读,我们得出的结论是,每 100 mL 池塘水中最有可能有 49 个细菌的数量。
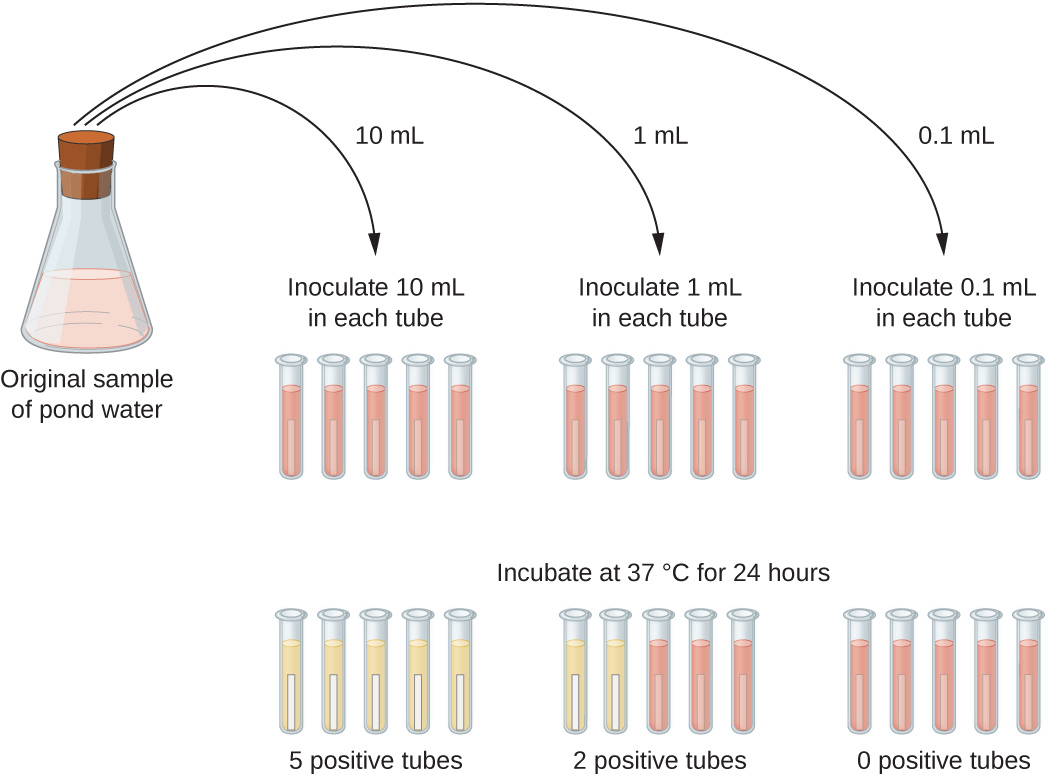
练习\(\PageIndex{6}\)
- 什么是菌落形成单位?
- 经常使用哪两种方法来估算水样中的细菌数量?
间接细胞数
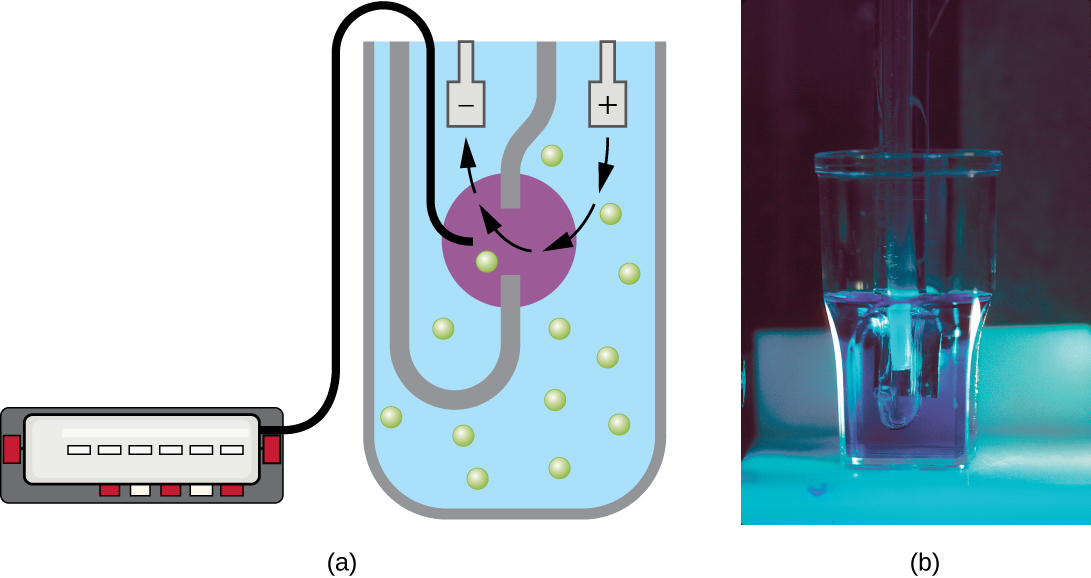
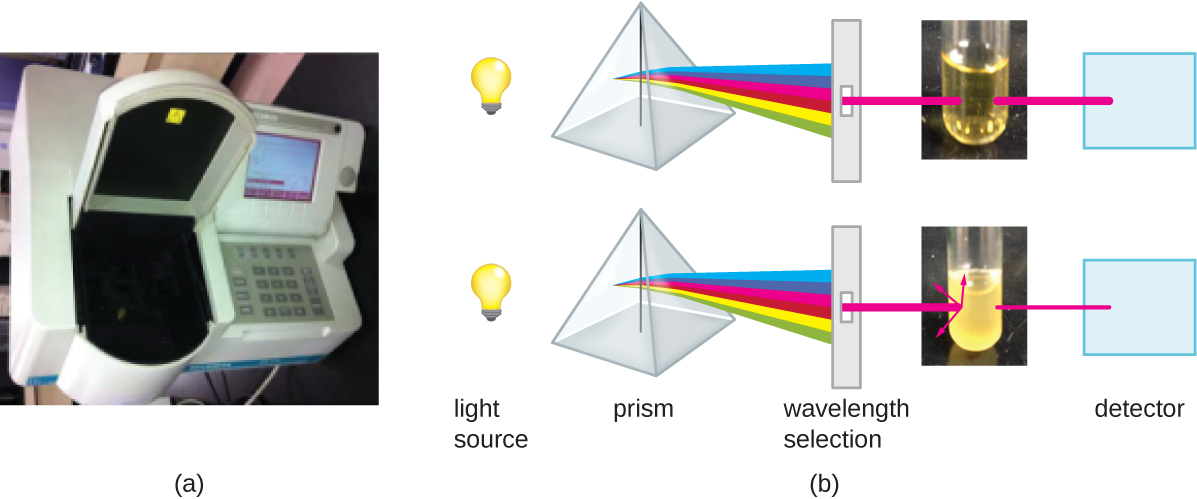
除了直接计数细胞的方法外,其他基于间接检测细胞密度的方法通常用于估计和比较培养物中的细胞密度。 最重要的方法是测量液体悬浮液中细菌样本的浊度(混浊度)。 用于测量浊度的实验室仪器称为分光光度计(图\(\PageIndex{14}\))。 在分光光度计中,光束通过细菌悬浮液透射,穿过悬浮液的光由探测器测量,穿过样品并到达探测器的光量被转换为透射百分比或称为吸光度的对数值(光学密度)。 随着悬浮液中细菌数量的增加,浊度也会增加,导致到达探测器的光线减少。 穿过样品并到达探测器的光的减少与分光光度计测得的透射百分比的降低和吸光度的增加有关。
测量浊度是估算细胞密度的快速方法,只要样品中有足够的细胞产生浊度。 通过对从具有一定吸光度值范围的培养物中采集的样品进行可行的板数计数,可以将浊度读数与实际细胞数量相关联。 使用这些值,通过将浊度绘制为细胞密度的函数来生成校准曲线。 一旦生成了校准曲线,就可以用它来估计在相似条件下获得或培养的所有样本的细胞数,并且密度在用于构造曲线的值范围内。
测量培养样本的干重是评估培养密度的另一种间接方法,无需直接测量细胞数。 用于称量的细胞悬浮液必须通过过滤或离心浓缩,洗净,然后干燥,然后再进行测量。 干燥程度必须标准化,以考虑残留水分含量。 这种方法对丝状微生物特别有用,因为丝状微生物很难通过直接或可行的板数来计数。
正如我们所看到的,估计活细胞数量的方法可能是劳动密集型的,而且需要时间,因为细胞必须生长。 最近,已经开发出既快速又易于实施的间接测量活细胞的方法。 这些方法通过跟踪代谢产物的产生或反应物的消失来测量细胞活性。 可以监测三磷酸腺苷(ATP)的形成、蛋白质和核酸的生物合成以及氧气的消耗,以估计细胞的数量。
练习\(\PageIndex{7}\)
- 根据浊度测量估算细胞数时,校准曲线的目的是什么?
- 计数活细胞的新间接方法有哪些?
细胞分裂的替代模式
二元裂变是原核生物中最常见的细胞分裂模式,但它不是唯一的模式。 其他机制通常涉及不对称分裂(如萌芽)或在空中细丝中产生孢子。
在一些蓝细菌中,许多核样体可能会积聚在扩大的圆形细胞中或沿着细丝积聚,从而同时产生许多新细胞。 新细胞通常从母丝中分离出来,然后在一个称为碎片化的过程中漂浮掉(图\(\PageIndex{15}\))。 通常在放线菌中观察到碎裂,放线菌是一组常见于土壤中的革兰氏阳性厌氧细菌。 巨型细菌 Epulopisciu m 展示了原核生物中细胞分裂的另一个奇怪例子,让人联想到动物的活产。 几个子细胞在亲本细胞中完全生长,母细胞最终会分解,将新细胞释放到环境中。 在称为萌芽的过程中,其他物种可能会在一极处形成长而狭窄的延伸部分。 延伸的尖端膨胀并形成一个较小的细胞,即最终脱离母细胞的芽。 芽在酵母中最常见(图\(\PageIndex{15}\)),但在假体细菌和一些蓝细菌中也观察到萌芽。

土壤细菌 A ctinomyces 生长在长丝中除以隔膜,类似于真菌中的菌丝体,从而产生具有多个核样体的长细胞。 环境信号可能与养分供应不足有关,会导致空中细丝的形成。 在这些空中细丝中,细长的细胞同时分裂。 含有单个核样的新细胞会发育成孢子,从而产生新的菌落。
练习\(\PageIndex{8}\)
确定碎片化和萌芽之间的至少一个区别。
生物膜
在自然界中,微生物主要生长在生物膜中,生物膜是在各种环境表面形成的复杂而动态的生态系统,从工业管道和水处理管道到河床中的岩石。 但是,生物膜不仅限于固体表面基质。 液体环境中几乎任何含有少量营养素的表面最终都会形成生物膜。 例如,漂浮在水上的微生物垫是含有大量光合微生物的生物膜。 在人口中发现的生物膜可能含有数百种细菌。 无论它们发生在什么环境,生物膜都不是微生物的随机集合;相反,它们是高度结构化的群落,为其组成微生物提供了选择性优势。
生物膜结构
使用共聚焦显微镜进行的观察表明,环境条件会影响生物膜的整体结构。 被称为飘带的丝状生物膜在快速流动的水中形成,例如淡水溪流、涡流和专门设计的实验室流通池,这些流通细胞在快速流动的流体中复制生长条件。 飘带通过 “头” 固定在基质上,“尾巴” 漂浮在潮流的下游。 在静止或缓慢移动的水中,生物膜主要呈现出蘑菇状的形状。 生物膜的结构也可能随着其他环境条件(例如养分的可用性)而变化。
在共聚焦激光和扫描电子显微镜下对生物膜的详细观测表明,嵌入基质中的微生物簇散布在开阔水域通道中。 细胞外基质由生物在生物膜中分泌的细胞外聚合物质(EPS)组成。 细胞外基质占生物膜的很大一部分,占总干质量的50%至90%。 EPS的特性因常驻生物和环境条件而异。
EPS 是一种水合凝胶,主要由多糖组成,并含有其他大分子,例如蛋白质、核酸和脂质。 它在维持生物膜的完整性和功能方面起着关键作用。 EPS 中的通道允许养分、废物和气体在整个生物膜中流动。 这样可以保持细胞水分,防止干燥。 EPS 还可以保护生物膜中的生物免受其他微生物或细胞(例如原生动物、人体中的白细胞)的捕食。
生物膜形成
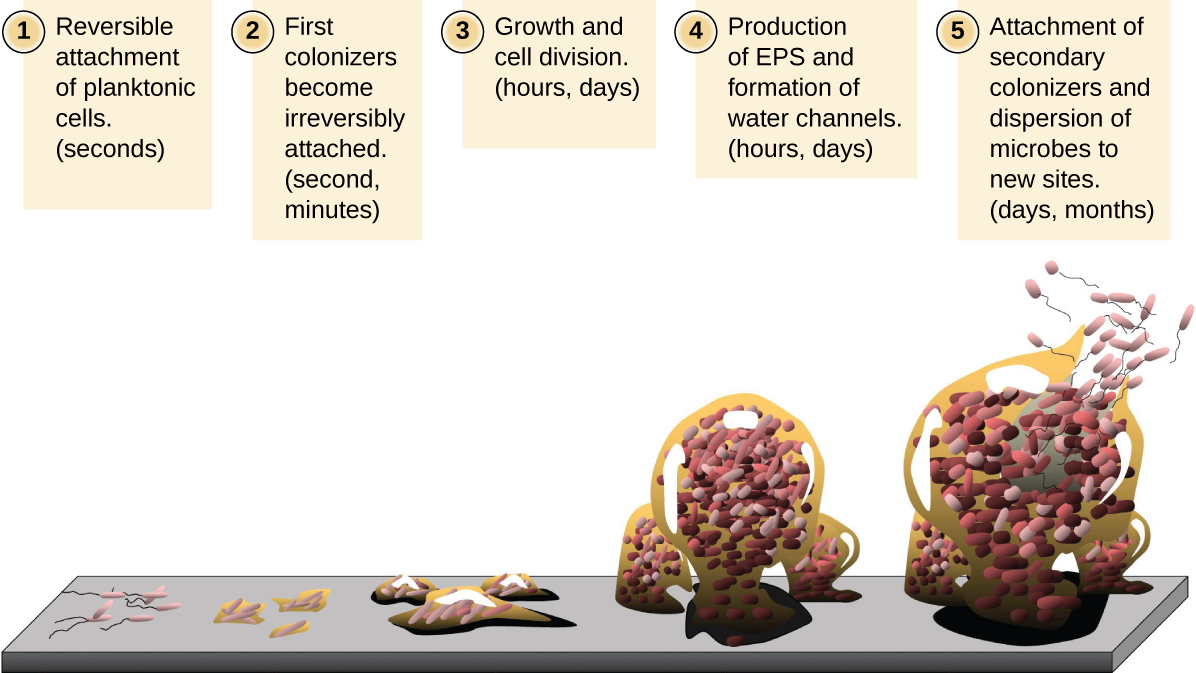
生活在水生环境中的自由漂浮微生物细胞被称为浮游细胞。 生物膜的形成本质上涉及将浮游细胞附着在基质上,在那里它们会变得无柄(附着在表面)。 这分阶段发生,如图所示\(\PageIndex{16}\)。 第一阶段涉及将浮游细胞附着在涂有有机材料调理膜的表面上。 此时,与底物的附着是可逆的,但是随着细胞表达促进EPS形成的新表型,它们会从浮游生活方式转变为无柄生活方式。 生物膜形成特征结构,包括广泛的基质和水道。 Fimbriae、pili 和 flagella 等附属物与 EPS 相互作用,显微镜和遗传分析表明,建立成熟的生物膜需要这种结构。 在生物膜生命周期的最后阶段,生物膜外围的细胞恢复到浮游生活方式,剥离成熟的生物膜,在新的地点定植。 这个阶段被称为分散。
在生物膜中,不同种类的微生物建立代谢协作,其中一种生物的废物成为另一种生物的营养素。 例如,有氧微生物消耗氧气,形成促进厌氧菌生长的厌氧区域。 这种情况发生在许多涉及有氧和厌氧病原体的多微生物感染中。
生物膜中的细胞协调其活动以响应环境刺激的机制称为群体感应。 群体感应(可能发生在生物膜中不同物种的细胞之间)使微生物能够通过释放和结合称为自诱导剂的可扩散小分子来检测其细胞密度。 当细胞群达到临界阈值(法定人数)时,这些自动诱导剂会引发一系列反应,激活与细胞功能相关的基因,这些基因只有在群体达到临界密度时才有益。 例如,在某些病原体中,只有当存在足够的细胞以压倒宿主的免疫防御时,毒力因子的合成才开始。 尽管主要在细菌群体中进行研究,但群体感应发生在细菌和真核生物之间,以及真核细胞之间,例如真菌白色念珠菌,白色念珠菌是人类微生物群的常见成员,可能导致免疫功能低下个体感染。
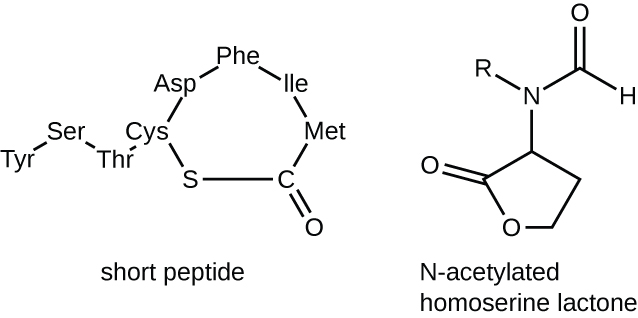
群体感应中的信号分子分为两大类。 革兰氏阴性细菌主要使用N-酰化高丝氨酸内酯进行传播,而革兰氏阳性细菌主要使用小肽(图\(\PageIndex{17}\))。 在所有情况下,群体感应的第一步都包括只有在信号分子达到阈值浓度时才将自诱导剂与其特异性受体结合。 一旦与受体结合,一连串的信号传导事件就会导致基因表达的变化。 结果是激活了与群体感应相关的生物反应,尤其是信号分子本身的产量增加,因此被称为自动诱导剂。
生物膜与人类健康
人体含有多种类型的生物膜,有些是有益的,有些是有害的。 例如,肠道和呼吸道粘膜内的正常微生物群层在抵御病原体感染方面起着作用。 但是,体内其他生物膜可能会对健康产生不利影响。 例如,牙齿上形成的牙菌斑是一种生物膜,可能导致牙齿和牙周疾病。 生物膜也可能在伤口中形成,有时会导致严重的感染并可能传播。 铜绿假单胞菌经常在囊性纤维化患者的呼吸道中定植生物膜,导致慢性、有时甚至是致命的肺部感染。 生物膜还可能在人体内或体内使用的医疗器械上形成,导致有内置导管、人工关节或隐形眼镜的患者感染。
嵌入生物膜中的病原体比自由漂浮的病原体对抗生素的耐药性更高。 已经提出了几个假设来解释原因。 生物膜深层的细胞具有新陈代谢活性,可能不太容易受到破坏代谢活动的抗生素作用的影响。 EPS 还可能减缓抗生素和防腐剂的扩散,阻止它们进入生物膜更深层的细胞。 表型变化也可能导致生物膜中细菌细胞表现出的耐药性增加。 例如,外流泵的产量增加已被证明是生物膜相关细菌抗生素耐药性的重要机制,外流泵是活性地从细菌细胞中挤出抗生素的膜包埋蛋白。 最后,生物膜为染色体外DNA的交换提供了理想的环境,染色体外DNA通常包括具有抗生素耐药性的基因。
练习\(\PageIndex{9}\)
- 生物膜的基质由什么组成?
- 群体感应在生物膜中的作用是什么?
关键概念和摘要
- 大多数细菌细胞通过二元裂变分裂。 细菌生长的@@ 生成时间定义为种群的翻倍时间。
- 封闭系统中的细胞遵循四个阶段的生长模式:滞后、对数(指数)、静止和死亡。
- 细胞可以通过直接活细胞计数来计数。 倾板法和展板法分别用于将连续稀释液浸入琼脂或琼脂上,以便对产生菌落形成单位的活细胞进行计数。 膜过滤用于计数稀释溶液中的活细胞。 最可能的细胞数 (MPN) 方法允许在不使用固体培养基的情况下估计培养物中的细胞数量。
- 间接方法可用于通过测量培养物的浊度来估计培养密度,或通过测量代谢活性来估计活细胞密度。
- 其他细胞分裂模式包括细胞中形成多个核样体;不对称分裂,如出芽;以及菌丝和末端孢子的形成。
- 生物膜是嵌入细胞外聚合物基质中的微生物群落。 当浮游细胞附着在基质上并变得无柄时,就会形成生物膜。 生物膜中的细胞通过群体感应进行通信来协调其活动。
- 生物膜通常存在于自然界和人体表面,它们可能有益或引起严重感染。 与生物膜相关的病原体通常对抗生素和消毒剂的耐药性更强。


