6.5: 酶
- Page ID
- 202608
培养技能
- 描述酶在代谢途径中的作用
- 解释酶如何起到分子催化剂的作用
- 讨论各种因素对酶的调节
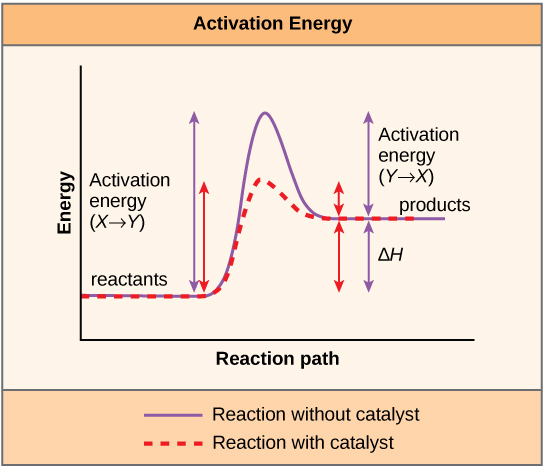
有助于发生化学反应的物质是催化剂,催化生化反应的特殊分子称为酶。 几乎所有的酶都是蛋白质,由氨基酸链组成,它们执行降低细胞内化学反应活化能的关键任务。 酶通过与反应物分子结合来做到这一点,并以这样的方式保持它们,使化学键破裂和键形成过程更容易发生。 重要的是要记住,酶不会改变反应的 ΔG。 换句话说,它们不会改变反应是外激性(自发性)还是内源性。 这是因为它们不会改变反应物或产物的自由能。 它们只会减少达到过渡状态所需的活化能(图\(\PageIndex{1}\))。
酶活位点和底物特异性
酶结合的化学反应物是酶的底物。 可能存在一种或多种底物,具体取决于特定的化学反应。 在某些反应中,单反应物底物会分解成多种产物。 在其他情况下,两个底物可能聚集在一起形成一个更大的分子。 两种反应物也可能进入反应,都经过修饰,然后将反应作为两种产物离开。 酶内底物结合的位置称为酶的活性位点。 可以说,活跃的网站是 “行动” 发生的地方。 由于酶是蛋白质,因此活性位点内存在氨基酸残基(也称为侧链或R基团)的独特组合。 每种残留物都有不同的特性。 残留物可以大也可以小,弱酸性或碱性,亲水性或疏水性,带正电荷或负电荷,或者中性。 氨基酸残基及其位置、序列、结构和性质的独特组合,在活性位点内形成了非常特殊的化学环境。 这种特定的环境适合与特定的化学底物(或基质)结合,尽管是短暂的。 由于酶与其底物之间的这种拼图游戏般的匹配(它会适应在过渡状态和活性位点之间找到最合适的匹配度),酶以其特异性而闻名。 “最合适” 来自形状和氨基酸官能团对底物的吸引力。 每种底物都有一种特别匹配的酶,因此每种化学反应都有一种特别匹配的酶;但是,也有灵活性。
活跃场地非常适合提供特定的环境条件,这一事实也意味着它们会受到当地环境的影响。 的确,提高环境温度通常会提高反应速率,无论是酶催化还是其他方式。 但是,将温度提高或降低到最佳范围之外可能会影响活性位点内的化学键,使它们不太适合结合基质。 像其他生物分子一样,高温最终会导致酶变性,这一过程会改变物质的自然特性。 同样,局部环境的pH值也会影响酶的功能。 活性位点氨基酸残基具有自身的酸性或碱性特性,最适合催化。 这些残留物对pH值的变化很敏感,pH值的变化可能会损害底物分子的结合方式。 酶适合在一定的 pH 值范围内发挥最佳作用,而且,与温度一样,环境的极端 pH 值(酸性或碱性)会导致酶变性。
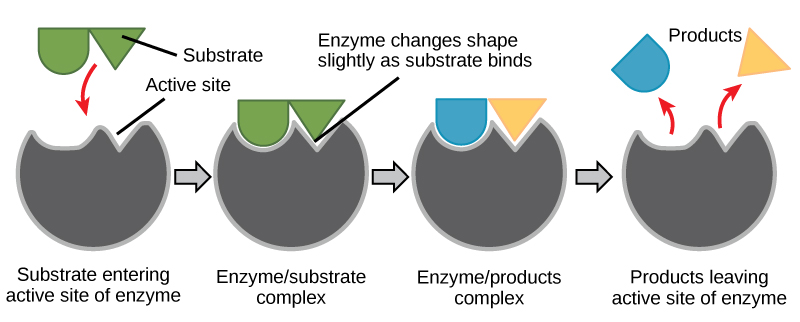
诱导拟合和酶功能
多年来,科学家们一直认为酶与底物的结合是以简单的 “锁和钥匙” 方式进行的。 该模型断言,酶和底物在一个瞬间的步骤中完美地结合在一起。 但是,当前的研究支持一种更精细的视图,称为诱导拟合(图\(\PageIndex{2}\))。 诱导拟合模型通过描述酶和底物之间更具动态性的相互作用,在锁和钥匙模型的基础上进行了扩展。 当酶和底物聚集在一起时,它们的相互作用会导致酶的结构发生轻微变化,这证实了酶与底物的过渡状态之间的理想结合安排。 这种理想的结合最大限度地提高了酶催化其反应的能力。
当酶结合其底物时,就会形成酶底物复合物。 这种复合物降低了反应的活化能,并以多种方式之一促进其快速发展。 在基本层面上,酶通过将底物以最佳方向聚集在一起,促进涉及多种底物的化学反应。 一个分子的适当区域(原子和键)与它必须与之反应的另一个分子的相应区域并列。 酶促进其底物反应的另一种方法是在活性位点内为反应的发生创造最佳环境。 某些化学反应可能在微酸性或非极性环境中进行得最好。 活性位点内氨基酸残基的特殊排列所产生的化学特性为酶的特定底物反应创造了理想的环境。
你已经了解到,许多反应所需的活化能包括操纵或稍微扭曲化学键所涉及的能量,以便它们很容易破裂并允许其他反应发生变化。 酶作用可以帮助这个过程。 酶底物复合物可以通过扭曲底物分子来降低活化能,从而促进结合,帮助达到过渡状态。 最后,酶还可以通过参与化学反应本身来降低活化能。 氨基酸残基可以提供某些离子或化学基团,这些离子或化学基团实际上与底物分子形成共价键,这是反应过程的必要步骤。 在这些情况下,重要的是要记住,反应完成后,酶将始终恢复到其原始状态。 酶的标志性特性之一是,它们所催化的反应最终保持不变。 一种酶完成催化反应后,它会释放其产物。
通过酶调节控制新陈代谢
如果有这样一种情景,即生物体基因组中编码的所有酶供应充足,并且在所有细胞条件下、所有细胞中始终发挥最佳功能,这似乎是理想的选择。 实际上,情况远非如此。 各种机制确保这种情况不会发生。 细胞的需求和条件因细胞而异,并且随着时间的推移,单个细胞内部会发生变化。 胃细胞所需的酶和能量需求与脂肪储存细胞、皮肤细胞、血细胞和神经细胞的酶和能量需求不同。 此外,与饭后的许多小时相比,消化细胞在紧接一顿饭后的时间里更难处理和分解营养。 随着这些细胞需求和条件的变化,不同酶的含量和功能也不同。
由于生化反应的速率受活化能控制,而酶降低并决定化学反应的活化能,因此细胞内各种酶的相对含量和功能最终决定了哪些反应将以何种速率进行。 这种决心受到严格控制。 在某些细胞环境中,酶活性部分受环境因素的控制,例如pH值和温度。 细胞通过其他机制控制酶的活性并决定各种生化反应的发生速率。
分子对酶的调节
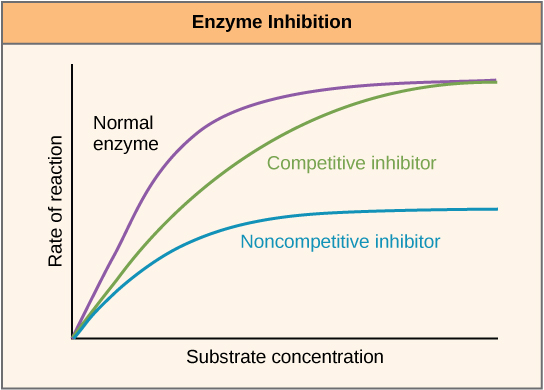
酶可以通过促进或减少其活性的方式进行调节。 有许多不同种类的分子可以抑制或促进酶的功能,而且存在着不同的机制。 例如,在某些酶抑制案例中,抑制剂分子与底物足够相似,可以与活性位点结合并简单地阻断底物的结合。 发生这种情况时,该酶会通过竞争抑制受到抑制,因为抑制剂分子与底物竞争活性位点结合(图\(\PageIndex{3}\))。 另一方面,在非竞争性抑制中,抑制剂分子在变构位点以外的位置与酶结合,并且仍然设法阻断底物与活性位点的结合。
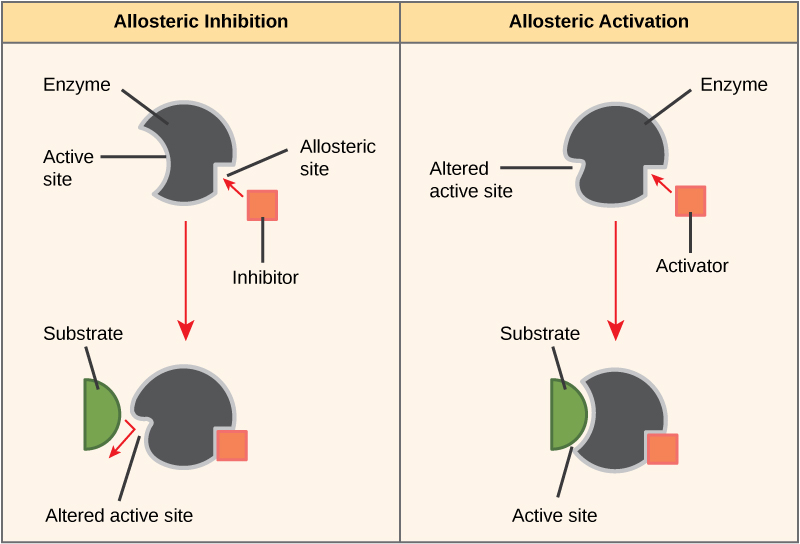
一些抑制剂分子在结合诱导构象变化的位置与酶结合,从而降低酶对其底物的亲和力。 这种类型的抑制称为变构抑制(图\(\PageIndex{4}\))。 大多数变构调节的酶由多个多肽组成,这意味着它们具有多个蛋白质亚单位。 当变构抑制剂与酶结合时,蛋白质亚基上的所有活性位点都会略有变化,因此它们以较低的效率结合底物。 有变构激活剂和抑制剂。 变构激活剂与酶上远离活性位点的位置结合,诱发构象变化,从而增加该酶活性位点对其底物的亲和力。
日常联系:通过在特定途径中寻找关键酶抑制剂来发现药物

酶是代谢途径的关键组成部分。 了解酶的工作原理以及如何对其进行调控是当今市场上许多药物开发背后的关键原则(图\(\PageIndex{5}\))。 在该领域工作的生物学家与其他科学家(通常是化学家)合作设计药物。
以他汀类药物为例,这是降低胆固醇水平的一类药物的名称。 这些化合物本质上是HMG-CoA还原酶的抑制剂。 HMG-CoA 还原酶是一种从体内脂质中合成胆固醇的酶。 通过抑制这种酶,可以降低体内合成的胆固醇水平。 同样,通常以泰诺品牌销售的对乙酰氨基酚是环氧合酶的抑制剂。 虽然它可以有效缓解发烧和炎症(疼痛),但其作用机制仍未完全了解。
药物是如何开发的? 药物研发的首要挑战之一是确定药物要靶向的特定分子。 就他汀类药物而言,HMG-CoA 还原酶是药物靶标。 药物靶点是通过实验室的艰苦研究确定的。 仅识别靶标是不够的;科学家们还需要知道靶标在细胞内是如何作用的,以及发生疾病时哪些反应会出错。 一旦确定了靶点和途径,药物设计的实际过程就开始了。 在这个阶段,化学家和生物学家共同设计和合成可以阻断或激活特定反应的分子。 但是,这仅仅是开始:无论是药物原型成功发挥其功能还是何时,它都必须经过从体外实验到临床试验的许多测试才能获得FDA的批准才能上市。
除非与其他特定的非蛋白质辅助分子结合,要么暂时通过离子键或氢键,要么通过更强的共价键永久结合,否则许多酶无法发挥最佳作用,甚至根本无法发挥作用。 两种类型的辅助分子是辅因子和辅酶。 与这些分子结合可促进其各自酶的最佳构象和功能。 辅助因子是无机离子,例如铁(Fe++)和镁(Mg++)。 需要金属离子作为辅助因子的酶的一个例子是构建 DNA 分子的酶,即 DNA 聚合酶,它需要结合锌离子 (Zn++) 才能起作用。 辅酶是有机辅助分子,其基本原子结构由碳和氢组成,是酶作用所必需的。 辅酶最常见的来源是膳食中的维生素(图\(\PageIndex{6}\))。 有些维生素是辅酶的前体,而另一些则直接起到辅酶的作用。 维生素 C 是多种酶的辅酶,这些酶参与构建重要的结缔组织成分胶原蛋白。 分解葡萄糖以产生能量的一个重要步骤是由一种叫做丙酮酸脱氢酶的多酶复合物进行催化。 丙酮酸脱氢酶是由几种酶组成的复合物,实际上需要一种辅因子(镁离子)和五种不同的有机辅酶来催化其特定的化学反应。 因此,酶的功能在一定程度上受各种辅助因子和辅酶的调节,这些辅因子和辅酶主要由大多数生物的饮食提供。
酶分隔
在真核细胞中,诸如酶之类的分子通常被划分成不同的细胞器。 这允许在另一个层次上调节酶活性。 仅用于某些细胞过程的酶可以与其底物分开存放,从而实现更有效的化学反应。 这种基于位置和距离的酶调节的例子包括参与细胞呼吸后期阶段的酶,这些阶段仅发生在线粒体中,以及参与消化溶酶体内的细胞碎片和异物的酶。
代谢途径中的反馈抑制
分子可以通过多种方式调节酶的功能。 但是,仍然存在一个主要问题:这些分子是什么,它们来自哪里? 如你所知,有些是辅助因子和辅酶、离子和有机分子。 细胞中还有哪些其他分子提供酶调节,例如变构调制以及竞争和非竞争抑制? 答案是各种各样的分子可以发挥这些作用。 其中一些分子包括药物和非药物药物、毒素和来自环境的毒素。 就细胞新陈代谢而言,酶调节分子最相关的来源可能是细胞代谢反应本身的产物。 以一种最有效和最优雅的方式,细胞已经进化为使用自身反应的产物来抑制酶活性的反馈。 反馈抑制涉及使用反应产物来调节其自身的进一步产生(图\(\PageIndex{7}\))。 细胞通过在合成代谢或分解代谢反应期间减缓产量来对特定产物的丰度做出反应。 此类反应产物可以通过上述机制抑制催化其产生的酶。
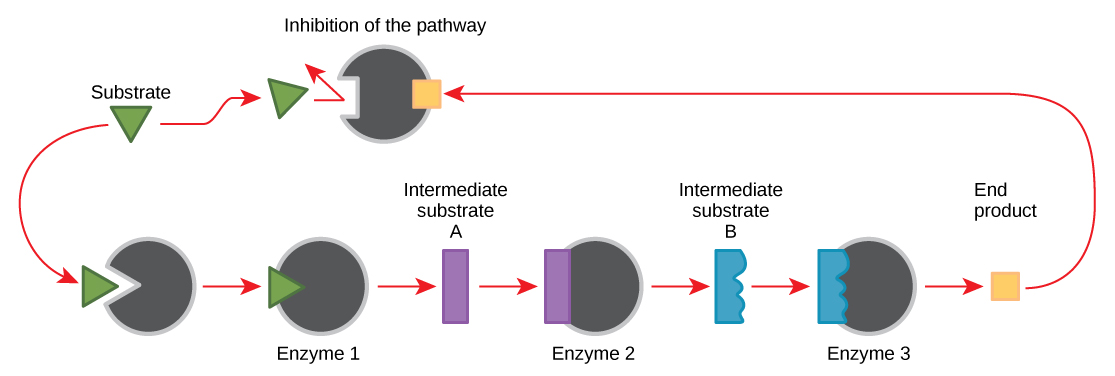
通过反馈抑制来控制氨基酸和核苷酸的产生。 此外,ATP 是糖分解代谢所涉及的一些酶的变构调节剂,糖分解是产生 ATP 的过程。 这样,当ATP丰富时,细胞可以防止其进一步产生。 请记住,ATP 是一种不稳定的分子,可以自发分解成 ADP。 如果细胞中存在过多的ATP,那么其中的大部分都会被浪费掉。 另一方面,ADP 是一些被 ATP 抑制的相同酶的正变构调节剂(变构激活剂)。 因此,当与ATP相比,当ADP的相对水平较高时,细胞会被触发通过糖的分解代谢产生更多的ATP。
摘要
酶是化学催化剂,通过降低活化能来加速生理温度下的化学反应。 酶通常是由一条或多条多肽链组成的蛋白质。 酶具有活性位点,可提供独特的化学环境,由某些氨基酸 R 基团(残留物)组成。 这种独特的环境非常适合将该酶的特定化学反应物(称为底物)转化为称为过渡态的不稳定中间体。 人们认为酶和底物会通过诱导配合结合,这意味着酶在底物接触时会进行轻微的构象调整,从而实现完全、最佳的结合。 酶与底物结合并以四种不同的方式催化反应:以最佳方向将底物聚集在一起,破坏底物的键结构以便更容易破坏键,为反应的发生提供最佳的环境条件,或者直接参与它们的化学反应是通过与底物形成瞬态共价键。
必须调节酶的作用,以便在给定时间在给定细胞中,所需的反应被催化,而不需要的反应不会被催化。 酶受细胞条件的调节,例如温度和pH。 它们还通过其在细胞内的位置受到调节,有时会被隔开,因此它们只能在某些情况下催化反应。 通过其他分子抑制和激活酶是调节酶的其他重要方式。 抑制剂可以发挥竞争作用、非竞争作用或变构作用;非竞争性抑制剂通常是变构的。 激活剂还可以通过变构增强酶的功能。 细胞调节代谢途径中酶的最常用方法是通过反馈抑制。 在反馈抑制期间,代谢途径的产物充当产生它们的途径中涉及的一种或多种酶(通常是该途径中第一个承诺的酶)的抑制剂(通常是变构的)。
词汇表
- 活跃站点
- 底物结合的酶的特定区域
- 变构抑制
- 在不同于活性位点的结合事件抑制,这会诱发构象变化并降低酶对其底物的亲和力
- 辅酶
- 小有机分子,例如维生素或其衍生物,这是增强酶活性所必需的
- 辅助因子
- 无机离子,例如铁离子和镁离子,是优化调节酶活性所必需的
- 竞争抑制
- 抑制剂通过与酶的活性位点结合而与底物分子竞争的一种抑制类型
- 改变性质
- 改变物质自然特性的过程
- 反馈抑制
- 反应序列产物通过抑制产生该序列产物的途径中第一种酶的活性来减少其进一步产生的作用
- 诱导合身
- 酶与其底物之间的动态配合,其中两种成分都会改变其结构以实现理想的结合
- 底层
- 酶作用的分子


