6.3: 热力学定律
- Page ID
- 202671
培养技能
- 讨论熵的概念
- 解释热力学的第一定律和第二定律
热力学是指研究涉及物理物质的能量和能量传递。 与特定能量传递案例相关的物质及其环境被归类为系统,该系统之外的所有事物都称为周围环境。 例如,当在炉子上加热一壶水时,系统包括炉子、锅和水。 能量在系统内传输(在炉子、锅和水之间)。 有两种类型的系统:开放式和封闭式。 开放系统是指能量可以在系统和周围环境之间传递的系统。 炉灶系统处于打开状态,因为热量可能会流失到空气中。 封闭的系统是无法将能量传递到周围环境的系统。
生物是开放系统。 能量在他们与周围环境之间交换,因为它们消耗能量储存分子,并通过工作向环境释放能量。 像物理世界中的所有事物一样,能量受物理定律的约束。 热力学定律控制着宇宙中所有系统内部和之间的能量传输。
热力学第一定律
热力学第一定律涉及宇宙中的总能量。 它指出,这个总能量是恒定的。 换句话说,宇宙中一直存在并将永远存在完全相同的能量。 能量以许多不同的形式存在。 根据热力学第一定律,能量可以从一个地方转移到另一个地方,也可以转化为不同的形式,但不能被创造或摧毁。 能量的转移和转化无时无刻不在我们的周围。 灯泡将电能转化为光能。 燃气灶将天然气中的化学能转化为热能。 植物进行地球上生物学上最有用的能量转化之一:将阳光的能量转化为储存在有机分子中的化学能(图2.3.b.1)。 一些能量转换的例子如图所示\(\PageIndex{1}\)。
所有活生物体面临的挑战是从周围环境中获取能量,这些能量可以转移或转化为可用能量来工作。 活细胞已经进化得很好,可以很好地应对这一挑战。 储存在糖和脂肪等有机分子中的化学能通过一系列细胞化学反应转化为ATP分子内的能量。 ATP 分子中的能量很容易就能起作用。 细胞需要做的工作类型的例子包括构建复杂的分子、运输材料、为纤毛或鞭毛的跳动提供动力、收缩肌肉纤维以产生运动以及繁殖。

热力学第二定律
活细胞的主要任务是获取、转化和使用能量来工作,可能看起来很简单。 但是,热力学第二定律解释了为什么这些任务比看起来更难。 我们讨论过的所有能量传递以及宇宙中的所有能量转移和转化都不是完全有效的。 在每一次能量传递中,一定数量的能量都会以无法使用的形式流失。 在大多数情况下,这种形式是热能。 从热力学上讲,热能被定义为从一个系统转移到另一个不起作用的系统的能量。 例如,当飞机在空中飞行时,由于与周围空气的摩擦,飞行飞机的某些能量会作为热能流失。 这种摩擦实际上是通过暂时提高空气分子的速度来加热空气。 同样,在细胞代谢反应过程中,一些能量会作为热能流失。 这对像我们这样的温血生物有好处,因为热能有助于维持我们的体温。 严格来说,任何能量转移都不是完全有效的,因为有些能量会以不可用的形式流失。
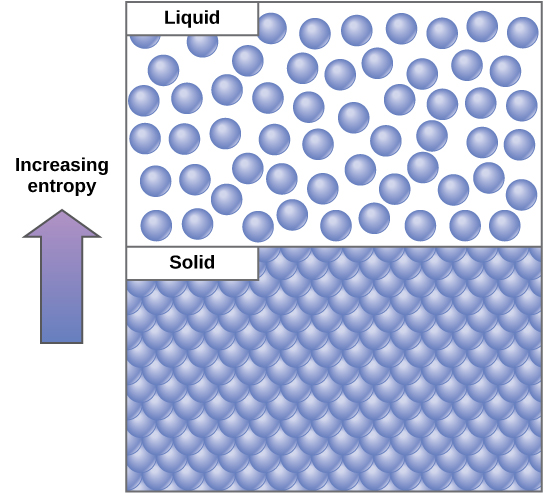
物理系统中的一个重要概念是秩序和无序(也称为随机性)。 系统向周围环境损失的能量越多,系统的秩序就越少,随机性就越强。 科学家将衡量系统内随机性或无序性的方法称为熵。 高熵意味着高混乱和低能量(图\(\PageIndex{2}\))。 为了更好地理解熵,想想学生的卧室。 如果不投入精力或工作,房间很快就会变得混乱。 它将在一种非常混乱的状态下存在,一种高熵的状态。 必须向系统注入能量,其形式是学生在做工作,把所有东西都收起来,这样才能使房间恢复到清洁和秩序的状态。 这种状态属于低熵状态。 同样,必须对汽车或房屋进行持续维护,以使其处于井然有序的状态。 不管怎么说,房屋或汽车的熵会因生锈和退化而逐渐增加。 分子和化学反应也有不同数量的熵。 例如,当化学反应达到平衡状态时,熵增加,而当一个地方的高浓度分子扩散和扩散时,熵也会增加。
科学联系:能量转移和由此产生的熵
设置一个简单的实验,以了解能量是如何传递的,以及熵的变化是如何产生的。
- 拿一块冰。 这是固体形式的水,因此它具有很高的结构顺序。 这意味着分子不能移动很多,并且处于固定位置。 冰的温度为 0°C。因此,系统的熵很低。
- 让冰在室温下融化。 现在液态水中分子的状态如何? 能量转移是如何发生的? 系统的熵是更高还是更低? 为什么?
- 将水加热至沸点。 当水被加热时,系统的熵会怎样?
所有物理系统都可以用这种方式来思考:生物是高度有序的,需要在低熵状态下保持恒定的能量输入。 当生命系统吸收能量储存分子并通过化学反应将其转化时,它们在此过程中会损失一定数量的可用能量,因为没有一种反应是完全有效的。 它们还会产生不是有用能源的废物和副产品。 这个过程增加了系统周围环境的熵。 由于所有能量转移都会导致一些可用能量的损失,因此热力学第二定律指出,每一次能量转移或转换都会增加宇宙的熵。 尽管生物井然有序并保持低熵状态,但由于每次能量转移都会损失可用能量,宇宙的总熵仍在不断增加。 从本质上讲,生物正在与宇宙熵的不断增加进行持续的艰苦战斗。
摘要
在研究能量时,科学家使用 “系统” 一词来指代参与能量转移的物质及其环境。 系统之外的一切都称为周围环境。 单细胞是生物系统。 可以认为系统有一定数量的订单。 使系统更有序需要能量。 系统越有序,其熵越低。 熵是衡量系统无序的一种方法。 随着系统变得越来越混乱,其能量越低,熵就越高。
一系列定律,称为热力学定律,描述了能量传递的特性和过程。 第一定律指出,宇宙中的总能量是恒定的。 这意味着能量不能被创造或摧毁,只能转移或转换。 热力学第二定律指出,每一次能量传递都涉及一些不可用形式的能量损失,例如热能,从而导致系统更加混乱。 换句话说,任何能量转移都不是完全有效的,而且往往会导致混乱。
词汇表
- 熵 (S)
- 测量系统内的随机性或混乱性
- 热
- 从一个系统转移到另一个系统的不起作用的能量(分子或粒子运动的能量)
- 热电学
- 研究涉及物理物质的能量和能量传递


