18.5: اللقاحات
- Page ID
- 194737
أهداف التعلم
- قارن بين الأنواع المختلفة من المناعة الاصطناعية
- فرّق بين التباين والتطعيم
- وصف الأنواع المختلفة من اللقاحات وشرح مزاياها وعيوبها
بالنسبة للعديد من الأمراض، تعتبر الوقاية أفضل شكل من أشكال العلاج، وهناك استراتيجيات قليلة للوقاية من الأمراض لا تقل فعالية عن التطعيم. التطعيم هو شكل من أشكال المناعة الاصطناعية. من خلال التحفيز الاصطناعي للدفاعات المناعية التكيفية، يحفز اللقاح إنتاج خلايا الذاكرة على غرار تلك التي قد تحدث أثناء الاستجابة الأولية. من خلال القيام بذلك، يكون المريض قادرًا على تكوين استجابة ثانوية قوية عند التعرض لمسببات الأمراض - ولكن دون الاضطرار إلى المعاناة أولاً من الإصابة الأولية. في هذا القسم، سوف نستكشف عدة أنواع مختلفة من المناعة الاصطناعية إلى جانب أنواع مختلفة من اللقاحات والآليات التي تحفز المناعة الاصطناعية.
تصنيفات المناعة التكيفية
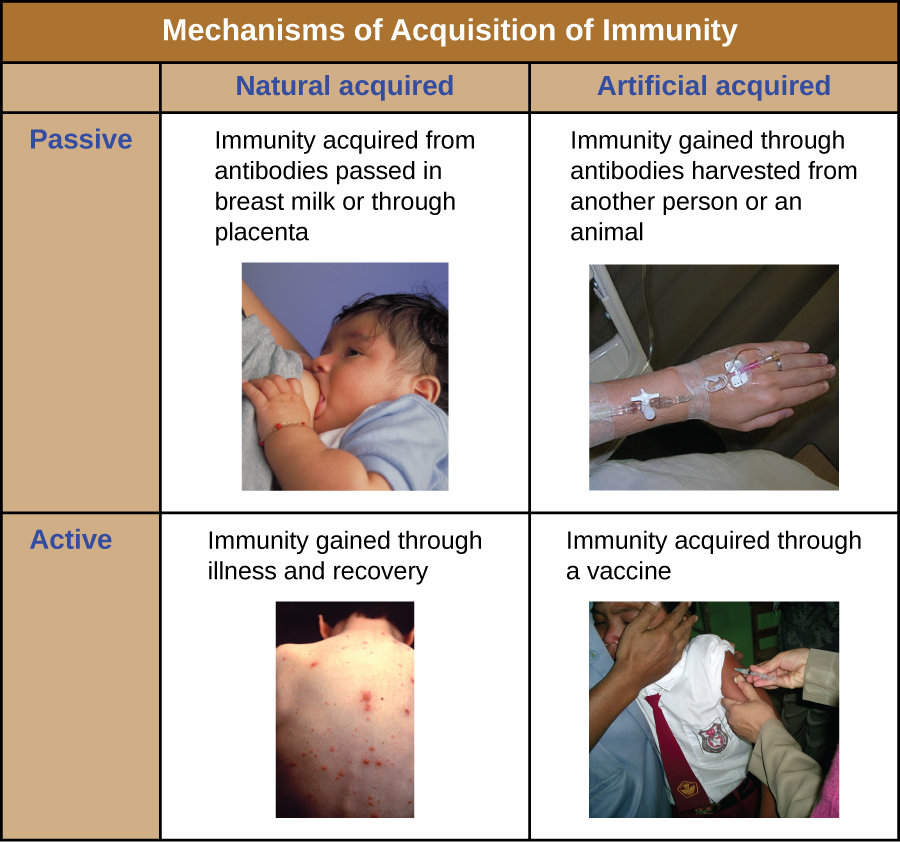
يمكن وصف جميع أشكال المناعة التكيفية بأنها نشطة أو سلبية. تشير المناعة النشطة إلى تنشيط الدفاعات المناعية التكيفية الخاصة بالفرد، بينما تشير المناعة السلبية إلى نقل الدفاعات المناعية التكيفية من فرد أو حيوان آخر. يمكن تقسيم المناعة النشطة والسلبية بشكل أكبر بناءً على ما إذا كانت الحماية يتم الحصول عليها بشكل طبيعي أو مصطنع.
المناعة النشطة الطبيعية هي المناعة التكيفية التي تتطور بعد التعرض الطبيعي لمسببات الأمراض (الشكل\(\PageIndex{1}\)). قد تشمل الأمثلة المناعة مدى الحياة التي تتطور بعد الشفاء من عدوى الجدري أو الحصبة (على الرغم من أن العدوى الحادة ليست ضرورية دائمًا لتنشيط المناعة التكيفية). يمكن أن يختلف طول الفترة الزمنية التي يتم فيها حماية الفرد بشكل كبير اعتمادًا على العامل الممرض والمستضدات المعنية. على سبيل المثال، يمكن أن يؤدي تنشيط المناعة التكيفية بواسطة هياكل ارتفاع البروتين أثناء العدوى الفيروسية داخل الخلايا إلى تنشيط المناعة مدى الحياة، في حين أن التنشيط بواسطة مستضدات كبسولات الكربوهيدرات أثناء العدوى البكتيرية خارج الخلية قد ينشط المناعة على المدى القصير.
تتضمن المناعة السلبية الطبيعية المرور الطبيعي للأجسام المضادة من الأم إلى طفلها قبل الولادة وبعدها. IgG هي فئة الأجسام المضادة الوحيدة التي يمكنها عبور المشيمة من دم الأم إلى إمدادات دم الجنين. يعد نقل IgG عن طريق المشيمة دفاعًا مناعيًا سلبيًا مهمًا للرضيع، ويستمر حتى ستة أشهر بعد الولادة. يمكن أيضًا نقل IgA الإفرازية من الأم إلى الرضيع من خلال حليب الأم.
تشير المناعة السلبية الاصطناعية إلى نقل الأجسام المضادة التي ينتجها المتبرع (الإنسان أو الحيوان) إلى شخص آخر. يمكن أن يتم نقل الأجسام المضادة كإجراء وقائي (أي للوقاية من المرض بعد التعرض لمسببات الأمراض) أو كاستراتيجية لعلاج العدوى النشطة. على سبيل المثال، تُستخدم المناعة السلبية الاصطناعية بشكل شائع للوقاية بعد التعرض ضد داء الكلب والتهاب الكبد A والتهاب الكبد B والجدري المائي (في الأفراد المعرضين لخطر كبير). تشمل العدوى النشطة التي يتم علاجها بالمناعة السلبية الاصطناعية عدوى الفيروس المضخم للخلايا في المرضى الذين يعانون من نقص المناعة وعدوى فيروس الإيبولا. في عام 1995، تم علاج ثمانية مرضى في جمهورية الكونغو الديمقراطية يعانون من عدوى الإيبولا النشطة عن طريق نقل الدم من المرضى الذين كانوا يتعافون من الإيبولا. توفي واحد فقط من المرضى الثمانية (معدل وفيات 12.5٪)، وهو أقل بكثير من معدل الوفيات المتوقع بنسبة 80٪ للإيبولا في المرضى غير المعالجين. 1 تستخدم المناعة السلبية الاصطناعية أيضًا لعلاج الأمراض التي تسببها السموم البكتيرية، بما في ذلك الكزاز والتسمم الغذائي والدفتيريا.
المناعة النشطة الاصطناعية هي أساس التطعيم. وهو ينطوي على تنشيط المناعة التكيفية من خلال التعرض المتعمد للفرد لمسببات الأمراض الضعيفة أو المعطلة، أو المستحضرات التي تتكون من مستضدات مسببات الأمراض الرئيسية.
التمارين\(\PageIndex{1}\)
- ما الفرق بين المناعة النشطة والسلبية؟
- ما نوع المناعة التي يمنحها اللقاح؟
مناعة القطيع
تنتج الأنواع الأربعة من المناعة الموصوفة للتو عن نظام المناعة التكيفي للفرد. بالنسبة لأي مرض معين، يمكن اعتبار الفرد محصنًا أو حساسًا اعتمادًا على قدرته على تكوين استجابة مناعية فعالة عند التعرض. وبالتالي، من المرجح أن يكون لدى أي مجموعة سكانية معينة بعض الأفراد الذين يتمتعون بالحصانة والأفراد الآخرين المعرضين للإصابة. إذا كان لدى السكان عدد قليل جدًا من الأفراد المعرضين للإصابة، فحتى هؤلاء الأفراد المعرضين للإصابة ستتم حمايتهم من خلال ظاهرة تسمى مناعة القطيع. لا علاقة لمناعة القطيع بقدرة الفرد على تكوين استجابة مناعية فعالة؛ بل يحدث ذلك بسبب وجود عدد قليل جدًا من الأفراد المعرضين للإصابة بالمرض في السكان حتى ينتشر المرض بشكل فعال.
تخلق برامج التطعيم مناعة القطيع من خلال تقليل عدد الأفراد المعرضين للإصابة بشكل كبير في السكان. حتى إذا لم يتم تطعيم بعض الأفراد من السكان، طالما أن نسبة معينة من السكان محصنة (إما بشكل طبيعي أو اصطناعي)، فمن غير المرجح أن يتعرض عدد قليل من الأفراد المعرضين للمرض. ومع ذلك، نظرًا لأن الأفراد الجدد يدخلون السكان باستمرار (على سبيل المثال، من خلال الولادة أو الانتقال)، فإن برامج التطعيم ضرورية للحفاظ على مناعة القطيع.
التطعيم: الالتزام أو الاختيار
يختار عدد متزايد من الآباء عدم تطعيم أطفالهم. يطلق عليها اسم «مضادات الفيروسات»، ويعتقد معظمهم أن اللقاحات هي سبب التوحد (أو حالات مرضية أخرى)، وهو رابط تم دحضه تمامًا الآن. يعترض آخرون على اللقاحات لأسباب دينية أو أخلاقية (على سبيل المثال، الحجة القائلة بأن تطعيم غارداسيل ضد فيروس الورم الحليمي البشري قد يعزز الاختلاط الجنسي)، أو لأسباب أخلاقية شخصية (على سبيل المثال، الاستنكاف الضميري من أي تدخل طبي)، أو لأسباب سياسية (على سبيل المثال، فكرة أن اللقاحات الإلزامية هي انتهاك الحريات الفردية). 2
يُعتقد أن هذا العدد المتزايد من الأفراد غير الملقحين قد أدى إلى تفشي جديد للسعال الديكي والحصبة. نتوقع أن تحمي مناعة القطيع أولئك الذين لم يتم تطعيمهم بين سكاننا، ولكن لا يمكن الحفاظ على مناعة القطيع إلا إذا تم تطعيم عدد كافٍ من الأفراد.
من الواضح أن التطعيم مفيد للصحة العامة. ولكن من منظور الوالدين الفرديين، يمكن أن تكون وجهة النظر أكثر غموضاً. اللقاحات، مثل جميع التدخلات الطبية، لها مخاطر مرتبطة بها، وفي حين أن مخاطر التطعيم قد تكون منخفضة للغاية مقارنة بمخاطر العدوى، فقد لا يفهم الآباء دائمًا أو يقبلون إجماع المجتمع الطبي. هل يحق لهؤلاء الآباء منع التطعيم من أطفالهم؟ هل ينبغي السماح لهم بتعريض أطفالهم - والمجتمع ككل - للخطر؟
تصر العديد من الحكومات على لقاحات الأطفال كشرط لدخول المدارس العامة، ولكن أصبح من السهل في معظم الولايات الانسحاب من المتطلبات أو إبقاء الأطفال خارج النظام العام. منذ سبعينيات القرن الماضي، وضعت فرجينيا الغربية وميسيسيبي متطلبات صارمة لتطعيم الأطفال، دون استثناءات، ولم تسجل أي من الولايتين حالة إصابة بالحصبة منذ أوائل التسعينيات. أقر المشرعون في كاليفورنيا مؤخرًا قانونًا مشابهًا استجابة لتفشي الحصبة في عام 2015، مما يجعل من الصعب جدًا على الآباء الانسحاب من اللقاحات إذا كان أطفالهم يذهبون إلى المدارس العامة. بالنظر إلى هذا السجل الحافل والجهود التشريعية المتجددة، هل يجب على الدول الأخرى اعتماد متطلبات صارمة مماثلة؟
ما الدور الذي يجب أن يلعبه مقدمو الرعاية الصحية في تعزيز التطعيم الشامل أو إنفاذه؟ أظهرت الدراسات أنه يمكن تغيير عقول العديد من الآباء استجابة للمعلومات التي يقدمها العاملون في مجال الرعاية الصحية، ولكن هل هو المكان المناسب للعاملين في مجال الرعاية الصحية لمحاولة إقناع الآباء بتطعيم أطفالهم؟ من المفهوم أن بعض مقدمي الرعاية الصحية يترددون في علاج المرضى غير الملقحين. هل لديهم الحق في رفض الخدمة للمرضى الذين يرفضون اللقاحات؟ هل يحق لشركات التأمين رفض التغطية لمضادات الفيروسات؟ هذه كلها أسئلة أخلاقية قد يضطر صانعو السياسات إلى معالجتها مع تجنب المزيد من الآباء لمعايير التطعيم.
التباين والتطعيم
منذ آلاف السنين، تم التعرف لأول مرة على أن الأفراد الذين نجوا من عدوى الجدري كانوا محصنين ضد العدوى اللاحقة. يبدو أن ممارسة تلقيح الأفراد لحمايتهم بشكل فعال من الجدري قد نشأت في القرن العاشر في الصين، عندما تم وصف ممارسة التباين (الشكل\(\PageIndex{2}\)). يشير التباين إلى التلقيح المتعمد للأفراد بمواد معدية من قشور أو بثرات ضحايا الجدري. تم حقن المواد المعدية في الجلد أو إدخالها عبر الطريق الأنفي. كانت العدوى التي تطورت عادةً أقل من الجدري المكتسب طبيعيًا، وقد وفر التعافي من العدوى الخفيفة الحماية ضد المرض الأكثر خطورة.
على الرغم من أن غالبية الأفراد الذين تم علاجهم بالتغيير أصيبوا بعدوى خفيفة فقط، إلا أن هذه الممارسة لم تخلو من المخاطر. حدثت حالات عدوى أكثر خطورة ومميتة في بعض الأحيان، ولأن الجدري كان معديًا، فإن العدوى الناتجة عن التباين يمكن أن تؤدي إلى الأوبئة. ومع ذلك، انتشرت ممارسة التباين للوقاية من الجدري إلى مناطق أخرى، بما في ذلك الهند وأفريقيا وأوروبا.

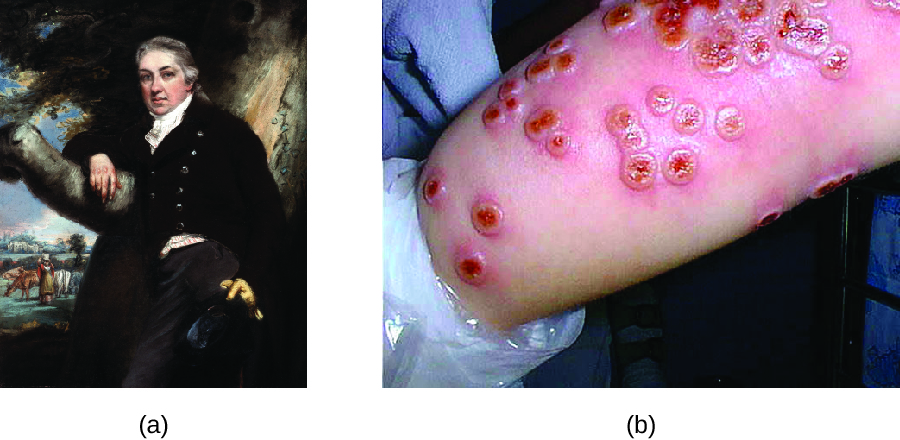
على الرغم من أن التلقيح كان يُمارس لعدة قرون، إلا أن الطبيب الإنجليزي إدوارد جينر (1749-1823) يُنسب إليه عمومًا الفضل في تطوير عملية التطعيم الحديثة. لاحظ جينر أن الخادمات اللواتي أصبن بجدري البقر، وهو مرض يشبه الجدري ولكنه أكثر اعتدالًا، كن محصنات ضد الجدري الأكثر خطورة. أدى ذلك إلى افتراض جينر أن التعرض لمسببات الأمراض الأقل ضراوة يمكن أن يوفر حماية مناعية ضد مسببات الأمراض الأكثر ضراوة، مما يوفر بديلاً أكثر أمانًا للتغير. في عام 1796، اختبر جينر فرضيته من خلال الحصول على عينات معدية من آفة جدري الأبقار النشطة لخادمة الحليب وحقن المواد في صبي صغير (الشكل\(\PageIndex{3}\)). أصيب الصبي بعدوى خفيفة شملت حمى منخفضة الدرجة وعدم الراحة في الإبطين (الإبط) وفقدان الشهية. عندما أصيب الصبي لاحقًا بعينات معدية من آفات الجدري، لم يصاب بالجدري. 3 أُطلق على هذا النهج الجديد اسم التطعيم، وهو اسم مشتق من استخدام جدري البقر (كلمة فاكا لاتينية تعني «البقرة») للحماية من الجدري. نعلم اليوم أن لقاح جينر نجح لأن فيروس جدري البقر مرتبط وراثيًا ومستضديًا بفيروسات فاريولا التي تسببت في الجدري. أدى التعرض لمستضدات جدري البقر إلى استجابة أولية وإنتاج خلايا ذاكرة تتطابق أو ترتبط مع مجموعات فيروس فاريولا عند التعرض لاحقًا للجدري.
أدى نجاح تطعيم جينر للجدري إلى قيام علماء آخرين بتطوير لقاحات لأمراض أخرى. ولعل أبرزها لويس باستور، الذي طور لقاحات داء الكلب والكوليرا والجمرة الخبيثة. خلال القرنين العشرين والحادي والعشرين، تم تطوير لقاحات فعالة للوقاية من مجموعة واسعة من الأمراض التي تسببها الفيروسات (مثل الجدري المائي والهربس النطاقي والتهاب الكبد والحصبة والنكاف وشلل الأطفال والحمى الصفراء) والبكتيريا (مثل الدفتيريا والالتهاب الرئوي بالمكورات الرئوية والكزاز والديكي) سعال،).
التمارين\(\PageIndex{2}\)
- ما الفرق بين التباين والتطعيم ضد الجدري؟
- اشرح لماذا يكون التطعيم أقل خطورة من التباين.
فئات اللقاحات
لكي يوفر اللقاح الحماية ضد المرض، يجب أن يعرض الفرد لمستضدات خاصة بمسببات الأمراض والتي ستحفز الاستجابة المناعية التكيفية الواقية. وينطوي ذلك بطبيعته على بعض المخاطر. كما هو الحال مع أي دواء صيدلاني، يمكن للقاحات أن تسبب آثارًا ضارة. ومع ذلك، فإن اللقاح المثالي لا يسبب أي آثار ضارة شديدة ولا يشكل أي خطر الإصابة بالمرض الذي يهدف إلى الوقاية منه. تم تطوير أنواع مختلفة من اللقاحات مع وضع هذه الأهداف في الاعتبار. يتم وصف هذه الفئات المختلفة من اللقاحات في القسم التالي وتلخيصها في الجدول\(\PageIndex{1}\).
اللقاحات الحية الموهنة
تعرض اللقاحات الحية الموهنة الفرد لسلالة ضعيفة من مسببات الأمراض بهدف إنشاء عدوى دون سريرية من شأنها تنشيط الدفاعات المناعية التكيفية. يتم تخفيف مسببات الأمراض لتقليل ضراوتها باستخدام طرق مثل التلاعب الجيني (للقضاء على عوامل الفوعة الرئيسية) أو الزراعة طويلة الأجل في مضيف أو بيئة غير طبيعية (لتعزيز الطفرات وتقليل الفوعة).
من خلال إثبات وجود عدوى نشطة، تحفز اللقاحات الحية الموهنة استجابة مناعية أكثر شمولاً من بعض أنواع اللقاحات الأخرى. تعمل اللقاحات الحية الموهنة على تنشيط المناعة الخلوية والخلطية وتحفيز نمو الذاكرة لمناعة طويلة الأمد. في بعض الحالات، يمكن أن يؤدي تطعيم فرد واحد بمسببات الأمراض الحية الموهنة إلى انتقال طبيعي للممرض الموهن إلى أفراد آخرين. يمكن أن يتسبب ذلك في إصابة الأفراد الآخرين أيضًا بعدوى شبه سريرية نشطة تنشط دفاعاتهم المناعية التكيفية.
تشمل العيوب المرتبطة باللقاحات الحية الموهنة التحديات المرتبطة بالتخزين والنقل على المدى الطويل بالإضافة إلى إمكانية ظهور علامات وأعراض المرض على المريض أثناء العدوى النشطة (خاصة في المرضى الذين يعانون من نقص المناعة). هناك أيضًا خطر عودة العامل الممرض الموهن إلى الفوعة الكاملة. \(\PageIndex{1}\)يسرد الجدول أمثلة اللقاحات الحية الموهنة.
اللقاحات المعطلة
تحتوي اللقاحات المعطلة على مسببات أمراض كاملة تم قتلها أو تعطيلها بالحرارة أو المواد الكيميائية أو الإشعاع. لكي تكون اللقاحات المعطلة فعالة، يجب ألا تؤثر عملية التعطيل على بنية المستضدات الرئيسية على العامل الممرض.
نظرًا لقتل العامل الممرض أو عدم نشاطه، فإن اللقاحات المعطلة لا تنتج عدوى نشطة، وتكون الاستجابة المناعية الناتجة أضعف وأقل شمولاً من تلك التي يسببها اللقاح الحي الموهن. عادةً ما تتضمن الاستجابة المناعة الخلطية فقط، ولا يمكن نقل العامل الممرض إلى أفراد آخرين. بالإضافة إلى ذلك، تتطلب اللقاحات المعطلة عادة جرعات أعلى ومعززات متعددة، مما قد يتسبب في تفاعلات التهابية في موقع الحقن.
على الرغم من هذه العيوب، تتمتع اللقاحات المعطلة بمزايا استقرار التخزين على المدى الطويل وسهولة النقل. أيضًا، لا يوجد خطر التسبب في عدوى نشطة شديدة. ومع ذلك، فإن اللقاحات المعطلة لا تخلو من آثارها الجانبية. \(\PageIndex{1}\)يسرد الجدول أمثلة اللقاحات المعطلة.
لقاحات الوحدة الفرعية
في حين أن اللقاحات الحية الموهنة وغير النشطة تعرض الفرد لمسببات الأمراض الضعيفة أو الميتة، فإن لقاحات الوحدة الفرعية تعرض المريض فقط للمستضدات الرئيسية لمسببات الأمراض - وليس الخلايا الكاملة أو الفيروسات. يمكن إنتاج لقاحات الوحدة الفرعية إما عن طريق التحلل الكيميائي لمسببات الأمراض وعزل المستضدات الرئيسية أو عن طريق إنتاج المستضدات من خلال الهندسة الوراثية. نظرًا لأن هذه اللقاحات تحتوي فقط على المستضدات الأساسية لمسببات الأمراض، فإن خطر الآثار الجانبية منخفض نسبيًا. \(\PageIndex{1}\)يسرد الجدول أمثلة لقاحات الوحدة الفرعية.
لقاحات التوكسويد
مثل لقاحات الوحدات الفرعية، لا تقدم لقاحات التوكسويد مسببًا كاملًا للمريض؛ فهي تحتوي على سموم بكتيرية معطلة تسمى السموم. تستخدم لقاحات التوكسويد للوقاية من الأمراض التي تلعب فيها السموم البكتيرية دورًا مهمًا في التسبب في المرض. تعمل هذه اللقاحات على تنشيط المناعة الخلطية التي تعمل على تحييد السموم. \(\PageIndex{1}\)يسرد الجدول أمثلة لقاحات التوكسويد.
اللقاحات المترافقة
اللقاح المترافق هو نوع من لقاح الوحدة الفرعية الذي يتكون من بروتين مترافق مع سكاريد كبسولة. تم تطوير اللقاحات المترافقة لتعزيز فعالية لقاحات الوحدات الفرعية ضد مسببات الأمراض التي تحتوي على كبسولات السكريات الواقية التي تساعدها على تجنب البلعمة، مما يسبب التهابات غازية يمكن أن تؤدي إلى التهاب السحايا وحالات خطيرة أخرى. تقدم لقاحات الوحدة الفرعية ضد مسببات الأمراض هذه مستضدات السكاريد الكبسولة المستقلة عن T والتي تؤدي إلى إنتاج أجسام مضادة يمكنها تأليب الكبسولة وبالتالي مكافحة العدوى؛ ومع ذلك، لا يستجيب الأطفال دون سن السنتين بفعالية لهذه اللقاحات. يستجيب الأطفال بشكل فعال عند تلقيحهم باللقاح المترافق، حيث يتم ربط البروتين الذي يحتوي على مستضدات تعتمد على T بسكر الكبسولة. يحفز مستضد البروتين متعدد السكاريد المترافق إنتاج الأجسام المضادة ضد كل من البروتين والسكاريد الكبسولة. \(\PageIndex{1}\)يسرد الجدول أمثلة اللقاحات المترافقة.
| فئة | وصف | المزايا | العيوب | أمثلة |
|---|---|---|---|---|
| الحية الموهنة | سلالة ضعيفة من مسببات الأمراض بأكملها | المناعة الخلوية والخلطية | من الصعب تخزينها ونقلها | الجدري، الحصبة الألمانية، الحصبة، النكاف، السل، حمى التيفوئيد، الحمى الصفراء |
| مناعة طويلة الأمد | خطر العدوى في المرضى الذين يعانون من نقص المناعة | |||
| الإرسال إلى جهات الاتصال | خطر الارتداد | |||
| معطل | قتل العامل الممرض الكامل أو تعطيله بالحرارة أو المواد الكيميائية أو الإشعاع | سهولة التخزين والنقل | ضعف المناعة (الخلطية فقط) | الكوليرا والتهاب الكبد A والأنفلونزا والطاعون وداء الكلب |
| لا يوجد خطر العدوى النشطة الشديدة | جرعات أعلى والمزيد من المعززات المطلوبة | |||
| فرعية | المستضدات المناعية | انخفاض خطر الآثار الجانبية | طول عمر محدود | الجمرة الخبيثة والتهاب الكبد B والأنفلونزا والتهاب السحايا وفيروس الورم الحليمي والالتهاب الرئوي بالمكورات الرئوية والسعال الديكي |
| الجرعات المتعددة المطلوبة | ||||
| لا توجد حماية ضد التباين المستضدي | ||||
| توكسيد | السم البكتيري المعطل | المناعة الخلطية لتحييد السم | لا تمنع العدوى | التسمم الوشيقي والدفتيريا والسعال الديكي والكزاز |
| مترافق | سكاريد الكبسولة المقترن بالبروتين | استجابة تعتمد على T للكبسولة | إنتاج مكلف |
التهاب السحايا (المستدمية النزلية، المكورات العقدية الرئوية، النيسرية السحائية) |
| لا توجد حماية ضد التباين المستضدي | ||||
| استجابة أفضل عند الأطفال الصغار | قد تتداخل مع اللقاحات الأخرى |
التمارين\(\PageIndex{3}\)
- ما هي المخاطر المرتبطة باللقاح الحي الموهن؟
- لماذا يعتبر اللقاح المترافق ضروريًا في بعض الحالات؟
تمثل لقاحات الحمض النووي نهجًا جديدًا وواعدًا نسبيًا للتطعيم. يتم إنتاج لقاح الحمض النووي من خلال دمج جينات المستضدات في لقاح البلازميد المؤتلف. يؤدي إدخال لقاح الحمض النووي إلى المريض إلى امتصاص البلازميد المؤتلف من قبل بعض خلايا المريض، يليه نسخ وترجمة المستضدات وعرض هذه المستضدات باستخدام MHC I لتنشيط المناعة التكيفية. يؤدي هذا إلى تحفيز كل من المناعة الخلطية والخلوية دون خطر الإصابة بأمراض نشطة مرتبطة باللقاحات الحية الموهنة.
على الرغم من أن معظم لقاحات الحمض النووي للبشر لا تزال قيد التطوير، فمن المحتمل أن تصبح أكثر انتشارًا في المستقبل القريب حيث يعمل الباحثون على لقاحات الحمض النووي الهندسية التي ستنشط المناعة التكيفية ضد العديد من مسببات الأمراض المختلفة في وقت واحد. بدت لقاحات الجيل الأول من الحمض النووي التي تم اختبارها في التسعينيات واعدة في النماذج الحيوانية ولكنها كانت مخيبة للآمال عند اختبارها على البشر. كان ضعف الامتصاص الخلوي لبلازميدات الحمض النووي أحد المشاكل الرئيسية التي تؤثر على فعاليتها. كانت تجارب لقاحات الحمض النووي من الجيل الثاني واعدة أكثر بفضل التقنيات الجديدة لتعزيز امتصاص الخلايا وتحسين المستضدات. يجري حاليًا تطوير لقاحات الحمض النووي لمختلف أنواع السرطان ومسببات الأمراض الفيروسية مثل فيروس نقص المناعة البشرية وفيروس الورم الحليمي البشري والتهاب الكبد B و C.
بعض لقاحات الحمض النووي قيد الاستخدام بالفعل. في عام 2005، تمت الموافقة على لقاح DNA ضد فيروس غرب النيل للاستخدام في الخيول في الولايات المتحدة. وافقت كندا أيضًا على لقاح DNA لحماية الأسماك من فيروس النخر المكون للدم المعدي. 4 تمت الموافقة على لقاح DNA ضد فيروس التهاب الدماغ الياباني للاستخدام في البشر في عام 2010 في أستراليا.
التركيز السريري: القرار
بناءً على أعراض أوليفيا، أجرى طبيبها تشخيصًا أوليًا لالتهاب السحايا البكتيري دون انتظار تحديد إيجابي من عينات الدم والسائل النخاعي المرسلة إلى المختبر. تم إدخال أوليفيا إلى المستشفى وعلاجها بالمضادات الحيوية الوريدية واسعة الطيف والعلاج بالإماهة. على مدى الأيام العديدة التالية، بدأت حالتها تتحسن، وأظهرت عينات الدم الجديدة وعينات البزل القطني غياب الميكروبات في الدم والسائل النخاعي مع عودة مستويات خلايا الدم البيضاء إلى وضعها الطبيعي. خلال هذه الفترة، أنتج المختبر تعريفًا إيجابيًا للنيسرية السحائية، العامل المسبب لالتهاب السحايا بالمكورات السحائية، في عينة السائل النخاعي الأصلية.
ينتج N. meningitidis كبسولة السكاريد التي تعمل كعامل ضراوة. يميل التهاب السحايا إلى التأثير على الرضع بعد أن يبدأوا في فقدان المناعة السلبية الطبيعية التي توفرها الأجسام المضادة للأم. في عمر عام واحد، كانت الأجسام المضادة IgG للأم لأوليفيا قد اختفت، ولن تكون قد طورت خلايا ذاكرة قادرة على التعرف على المستضدات المرتبطة بكبسولة السكاريد في N. minetitidis. ونتيجة لذلك، لم يكن جهازها المناعي التكيفي قادرًا على إنتاج أجسام مضادة واقية لمكافحة العدوى، وبدون المضادات الحيوية ربما لم تنجو. كان من المحتمل تجنب عدوى أوليفيا تمامًا لو تم تطعيمها. يتوفر لقاح مترافق للوقاية من التهاب السحايا بالمكورات السحائية ومعتمد للرضع الذين لا يتجاوز عمرهم شهرين. ومع ذلك، توصي جداول التطعيم الحالية في الولايات المتحدة بإعطاء اللقاح في سن 11-12 مع جرعة معززة في سن 16.
في البلدان ذات أنظمة الصحة العامة المتطورة، يتم إعطاء العديد من اللقاحات بشكل روتيني للأطفال والبالغين. يتم تغيير جداول اللقاحات بشكل دوري، بناءً على المعلومات الجديدة ونتائج الأبحاث التي جمعتها وكالات الصحة العامة. في الولايات المتحدة، تنشر مراكز مكافحة الأمراض والوقاية منها (CDC) جداول ومعلومات محدثة أخرى حول اللقاحات.
المفاهيم الأساسية والملخص
- يمكن تقسيم المناعة التكيفية إلى أربعة تصنيفات متميزة: المناعة النشطة الطبيعية، والمناعة السلبية الطبيعية، والمناعة السلبية الاصطناعية، والمناعة النشطة الاصطناعية.
- المناعة النشطة الاصطناعية هي الأساس للتطعيم وتطوير اللقاح. لا تمنح برامج التطعيم المناعة الاصطناعية للأفراد فحسب، بل تعزز أيضًا مناعة القطيع لدى السكان.
- نشأت عملية التلقيح ضد الجدري في القرن العاشر في الصين، ولكن الإجراء كان محفوفًا بالمخاطر لأنه يمكن أن يسبب المرض الذي كان من المفترض الوقاية منه. تم تطوير التطعيم الحديث من قبل إدوارد جينر، الذي طور ممارسة تلقيح المرضى بالمواد المعدية من آفات الجدري للوقاية من الجدري.
- تحتوي اللقاحات الحية الموهنة واللقاحات المعطلة على مسببات الأمراض الكاملة الضعيفة أو القاتلة أو المعطلة. تحتوي لقاحات الوحدة الفرعية ولقاحات التوكسويد واللقاحات المترافقة على مكونات غير خلوية مع مستضدات تحفز الاستجابة المناعية.
الحواشي
- (1) ك. موبابا و السيد ماسامبا و ك. كيبادي و ك. كيفولا و أ. بواكا و السيد كيباسا و ر. كوليبوندرز و ج. مويمبي - تامفوم. «علاج حمى الإيبولا النزفية بنقل الدم من مرضى النقاهة». مجلة الأمراض المعدية 179 الملحق (1999): S18-S23.
- 2 إليزابيث ييل. «لماذا لا يمكن أبدًا ترويض الحركات المضادة للتطعيم.» الدين والسياسة، 22 يوليو 2014. religionandpolitics.org/2014/... لن يتم ترويضه أبدًا.
- 3. ن. ج. ويليس. «إدوارد جينر والقضاء على الجدري». المجلة الطبية الاسكتلندية 42 (1997): 118-121.
- 4 - السيد ألونسو وجي سي ليونغ. «لقاحات الحمض النووي المرخصة ضد فيروس النخر المكون للدم المعدي (IHNV).» براءات الاختراع الحديثة حول الحمض النووي والتسلسلات الجينية (تم إيقاف تشغيلها) رقم 7 رقم 1 (2013): 62-65، issn 1872-2156/2212-3431. doi 10.2174/1872215611307010009.
- 5 إس بي هالستيد و إس جيه توماس. «لقاحات التهاب الدماغ اليابانية الجديدة: بدائل الإنتاج في دماغ الفأر». مراجعة الخبراء للقاحات 10 رقم 3 (2011): 355-64.


