18.3: الخلايا اللمفاوية التائية
- Page ID
- 194707
أهداف التعلم
- وصف عملية نضج الخلايا التائية واختيار الغدة الصعترية
- شرح الأحداث الجينية التي تؤدي إلى تنوع مستقبلات الخلايا التائية
- قارن وقارن بين الفئات والأنواع الفرعية المختلفة للخلايا التائية من حيث التنشيط والوظيفة
- اشرح الآلية التي تؤثر بها المستضدات الفائقة على تنشيط الخلايا التائية غير المنظم
كما هو موضح في نظرة عامة على المناعة التكيفية المحددة، غالبًا ما تربط الأجسام المضادة المشاركة في المناعة الخلطية مسببات الأمراض والسموم قبل أن تتمكن من الالتصاق بالخلايا المضيفة وغزوها. وبالتالي، فإن المناعة الخلطية تهتم في المقام الأول بمكافحة مسببات الأمراض في المساحات خارج الخلية. ومع ذلك، فإن مسببات الأمراض التي دخلت بالفعل إلى الخلايا المضيفة محمية إلى حد كبير من الدفاعات التي تتوسطها الأجسام المضادة الخلطية. من ناحية أخرى، تستهدف المناعة الخلوية مسببات الأمراض داخل الخلايا وتزيلها من خلال عمل الخلايا اللمفاوية التائية أو الخلايا التائية (الشكل\(\PageIndex{1}\)). تلعب الخلايا التائية أيضًا دورًا مركزيًا في تنظيم الاستجابة المناعية التكيفية الشاملة (الخلطية والخلوية) جنبًا إلى جنب مع الدفاعات الخلوية للمناعة الفطرية.

إنتاج الخلايا التائية ونضجها
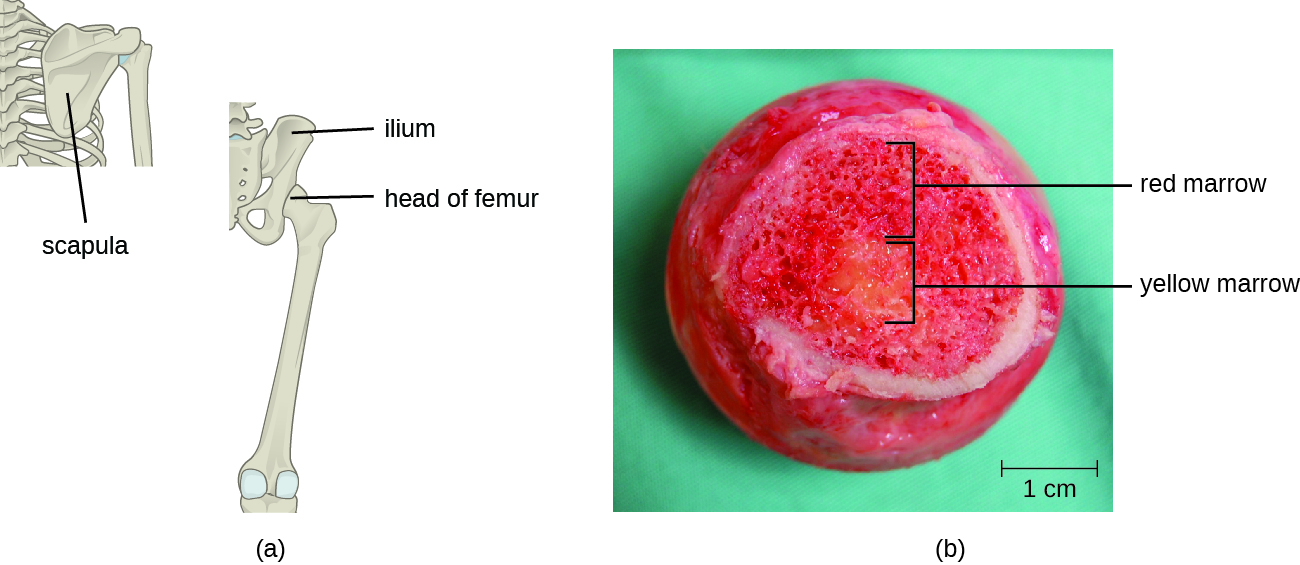
تتكون الخلايا التائية، مثل جميع خلايا الدم البيضاء الأخرى المشاركة في المناعة الفطرية والتكيفية، من الخلايا الجذعية المكونة للدم متعددة القدرات (HSCs) في نخاع العظام (انظر الشكل 17.3.1). ومع ذلك، على عكس خلايا الدم البيضاء ذات المناعة الفطرية، تفرق الخلايا التائية النهائية أولاً إلى الخلايا الجذعية اللمفاوية التي تصبح بعد ذلك خلايا ليمفاوية صغيرة غير ناضجة، تسمى أحيانًا الخلايا الليمفاوية. تحدث الخطوات الأولى للتمايز في النخاع الأحمر للعظام (الشكل\(\PageIndex{2}\))، وبعد ذلك تدخل الخلايا الليمفاوية التائية غير الناضجة إلى مجرى الدم وتنتقل إلى الغدة الصعترية للخطوات النهائية للنضج (الشكل\(\PageIndex{3}\)). بمجرد دخول الغدة الصعترية، يُشار إلى الخلايا اللمفاوية التائية غير الناضجة باسم خلايا الغدة الصعترية.
يمكن تقسيم نضج خلايا الغدة الصعترية داخل الغدة الصعترية إلى ثلاث خطوات حاسمة للاختيار الإيجابي والسلبي، ويشار إليها مجتمعة باسم اختيار الغدة الصعترية. تحدث الخطوة الأولى من اختيار الغدة الصعترية في قشرة الغدة الصعترية وتتضمن تطوير مستقبل وظيفي للخلايا التائية (TCR) مطلوب للتنشيط بواسطة APCs. تتم إزالة خلايا الغدة الصعترية ذات TCRs المعيبة عن طريق الانتقاء السلبي من خلال تحريض موت الخلايا المبرمج (موت الخلايا الخاضعة للرقابة المبرمجة). تحدث الخطوة الثانية من اختيار الغدة الصعترية أيضًا في القشرة وتتضمن الاختيار الإيجابي لخلايا الغدة الصعترية التي ستتفاعل بشكل مناسب مع جزيئات MHC. تتلقى خلايا الغدة الصعترية التي يمكن أن تتفاعل بشكل مناسب مع جزيئات MHC تحفيزًا إيجابيًا يحركها أكثر خلال عملية النضج، في حين أن خلايا الغدة الصعترية التي لا تتفاعل بشكل مناسب لا يتم تحفيزها ويتم التخلص منها عن طريق موت الخلايا المبرمج. تحدث الخطوة الثالثة والأخيرة من اختيار الغدة الصعترية في كل من القشرة والنخاع وتتضمن الاختيار السلبي لإزالة خلايا الغدة الصعترية ذاتية التفاعل، تلك التي تتفاعل مع المستضدات الذاتية، عن طريق موت الخلايا المبرمج. يشار إلى هذه الخطوة الأخيرة أحيانًا باسم التحمل المركزي لأنها تمنع الخلايا التائية ذات التفاعل الذاتي من الوصول إلى مجرى الدم واحتمال التسبب في أمراض المناعة الذاتية، والتي تحدث عندما يهاجم الجهاز المناعي الخلايا «الذاتية» الصحية.
على الرغم من التحمل المركزي، فإن بعض الخلايا التائية ذاتية التفاعل تخرج عمومًا من الغدة الصعترية وتدخل مجرى الدم المحيطي. لذلك، هناك حاجة إلى خط دفاع ثانٍ يسمى التسامح المحيطي للحماية من أمراض المناعة الذاتية. يتضمن التحمل المحيطي آليات الطاقة وتثبيط الخلايا التائية الذاتية التفاعل بواسطة الخلايا التائية التنظيمية. تشير الطاقة إلى حالة عدم الاستجابة لتحفيز المستضد. في حالة الخلايا التائية ذاتية التفاعل التي تخرج من الغدة الصعترية، فإن عدم وجود إشارة التحفيز المشتركة الأساسية المطلوبة للتنشيط يسبب الطاقة ويمنع تنشيط المناعة الذاتية. تشارك الخلايا التائية التنظيمية في التحمل المحيطي عن طريق تثبيط تنشيط ووظيفة الخلايا التائية ذاتية التفاعل وإفراز السيتوكينات المضادة للالتهابات.
ليس من المفهوم تمامًا ما هي الأحداث التي توجه نضوج خلايا الغدة الصعترية على وجه التحديد إلى خلايا T التنظيمية. تشير النظريات الحالية إلى أن الأحداث الحرجة قد تحدث خلال الخطوة الثالثة من اختيار الغدة الصعترية، عندما يتم التخلص من معظم الخلايا التائية ذاتية التفاعل. قد تتلقى الخلايا التائية التنظيمية إشارة فريدة أقل من الحد المطلوب لاستهدافها للاختيار السلبي وموت الخلايا المبرمج. وبالتالي، تستمر هذه الخلايا في النضج ثم تخرج من الغدة الصعترية، مسلحة لمنع تنشيط الخلايا التائية ذاتية التفاعل.
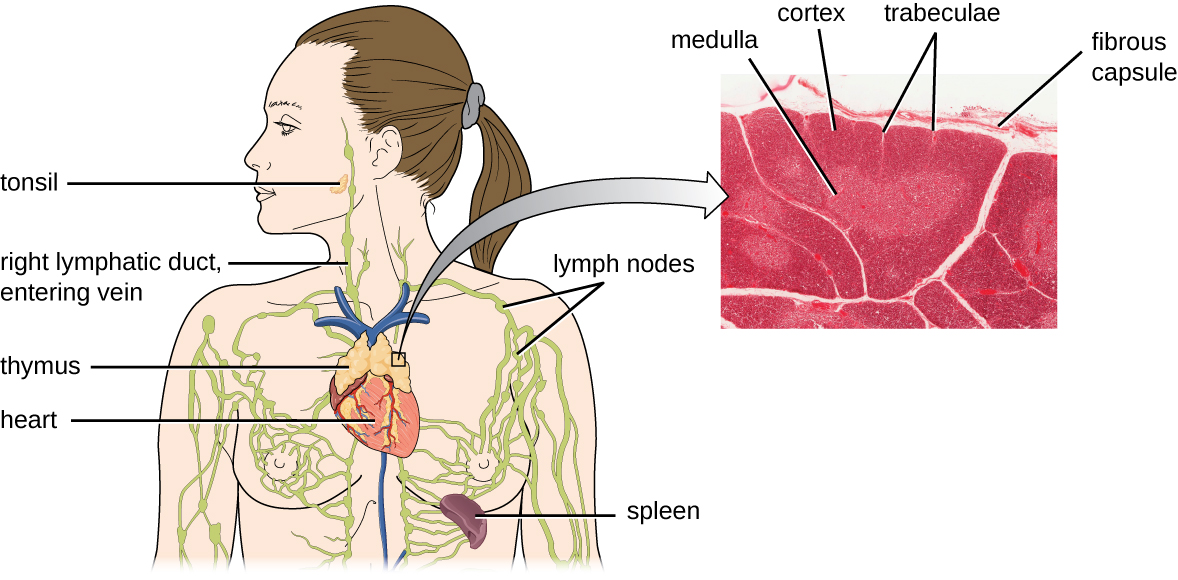
تشير التقديرات إلى أن الخطوات الثلاث لاختيار الغدة الصعترية تقضي على 98٪ من خلايا الغدة الصعترية. أما نسبة الـ 2% المتبقية التي تخرج من الغدة الصعترية فتهاجر عبر مجرى الدم والجهاز الليمفاوي إلى مواقع الأعضاء/الأنسجة اللمفاوية الثانوية، مثل العقد الليمفاوية والطحال واللوزتين (الشكل\(\PageIndex{3}\))، حيث تنتظر التنشيط من خلال عرض مستضدات محددة بواسطة مركبات APCs. حتى يتم تنشيطها، تُعرف باسم الخلايا التائية الساذجة الناضجة.
التمارين\(\PageIndex{1}\)
- ما المواقع التشريحية التي تشارك في إنتاج الخلايا التائية ونضجها؟
- ما الخطوات الثلاث التي ينطوي عليها اختيار الغدة الصعترية؟
- لماذا يعتبر التسامح المركزي والتسامح المحيطي مهمين؟ ما الذي يمنعونه؟
فئات الخلايا التائية
يمكن تصنيف الخلايا التائية إلى ثلاث فئات متميزة: الخلايا التائية المساعدة والخلايا التائية التنظيمية والخلايا التائية السامة للخلايا. يتم تمييز هذه الفئات بناءً على تعبيرها عن جزيئات سطحية معينة وطريقة تنشيطها وأدوارها الوظيفية في المناعة التكيفية (الجدول\(\PageIndex{1}\)).
تنتج جميع الخلايا التائية مجموعة من جزيئات التمايز (CD)، وهي بروتينات سكرية لسطح الخلية يمكن استخدامها لتحديد الأنواع المختلفة من خلايا الدم البيضاء والتمييز بينها. على الرغم من أن الخلايا التائية يمكن أن تنتج مجموعة متنوعة من جزيئات CD، فإن CD4 و CD8 هما أهم نوعين يستخدمان للتمييز بين الفئات. تتميز الخلايا التائية المساعدة والخلايا التائية التنظيمية بالتعبير عن CD4 على سطحها، بينما تتميز الخلايا التائية السامة للخلايا بالتعبير عن CD8.
يمكن أيضًا تمييز فئات الخلايا التائية بجزيئات MHC المحددة و APCs التي تتفاعل معها من أجل التنشيط. لا يمكن تنشيط الخلايا التائية المساعدة والخلايا التائية التنظيمية إلا من خلال APCs التي تقدم مستضدات مرتبطة بـ MHC II. في المقابل، تتعرف الخلايا التائية السامة للخلايا على المستضدات المقدمة بالاشتراك مع MHC I، إما عن طريق APCs أو عن طريق الخلايا النووية المصابة بمسببات الأمراض داخل الخلايا.
تلعب الفئات المختلفة من الخلايا التائية أيضًا أدوارًا وظيفية مختلفة في جهاز المناعة. تعمل الخلايا التائية المساعدة كمنظم مركزي يساعد على تنشيط وتوجيه وظائف المناعة الخلطية والخلوية. بالإضافة إلى ذلك، تعمل الخلايا التائية المساعدة على تعزيز وظائف قتل مسببات الأمراض في البلاعم وخلايا NK للمناعة الفطرية. في المقابل، يتمثل الدور الأساسي للخلايا التائية التنظيمية في منع الاستجابات المناعية غير المرغوب فيها والتي قد تكون ضارة. دورها في التحمل المحيطي، على سبيل المثال، يحمي من اضطرابات المناعة الذاتية، كما تمت مناقشته سابقًا. أخيرًا، الخلايا التائية السامة للخلايا هي الخلايا المؤثرة الأساسية للمناعة الخلوية. فهي تتعرف على الخلايا المصابة بمسببات الأمراض داخل الخلايا وتستهدفها، وتدمر الخلايا المصابة إلى جانب مسببات الأمراض الموجودة بداخلها.
| فئة | جزيئات القرص المضغوط السطحية | التنشيط | الوظائف |
|---|---|---|---|
| الخلايا التائية المساعدة | CD4 | تقدم مركبات APCs المستضدات المرتبطة بـ MHC II | تنسيق المناعة الخلطية والخلوية |
| يشارك في تنشيط البلاعم وخلايا NK | |||
| الخلايا التائية التنظيمية | CD4 | تقدم مركبات APCs المستضدات المرتبطة بـ MHC II | يشارك في التحمل المحيطي والوقاية من استجابات المناعة الذاتية |
| الخلايا التائية السامة للخلايا | CD8 | APCs أو الخلايا النووية المصابة التي تقدم مستضدات مرتبطة بـ MHC I | تدمير الخلايا المصابة بمسببات الأمراض داخل الخلايا |
التمارين\(\PageIndex{2}\)
- ما هي الوظائف الفريدة للفئات الثلاث من الخلايا التائية؟
- ما الخلايا التائية التي يمكن تنشيطها بواسطة المستضدات التي تقدمها خلايا أخرى غير APCs؟
مستقبلات الخلايا التائية
بالنسبة لكل من الخلايا التائية المساعدة والخلايا التائية السامة للخلايا، يعد التنشيط عملية معقدة تتطلب تفاعلات جزيئات متعددة والتعرض للسيتوكينات. يشارك مستقبل الخلايا التائية (TCR) في الخطوة الأولى للتعرف على مثارة العامل الممرض أثناء عملية التنشيط.
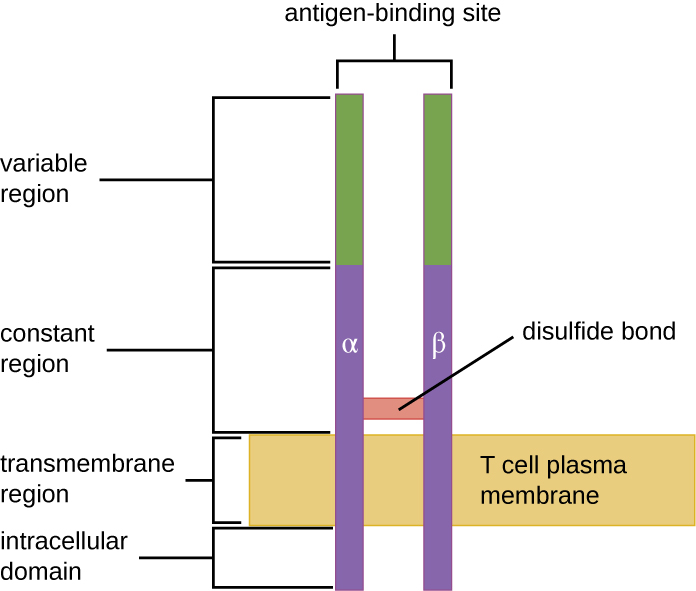
يأتي TCR من نفس عائلة المستقبلات مثل الأجسام المضادة IgD و IgM، مستقبلات المستضد على سطح غشاء الخلية B، وبالتالي يشترك في العناصر الهيكلية المشتركة. على غرار الأجسام المضادة، يحتوي TCR على منطقة متغيرة ومنطقة ثابتة، وتوفر المنطقة المتغيرة موقع ربط المستضد (الشكل\(\PageIndex{4}\)). ومع ذلك، فإن بنية TCR أصغر وأقل تعقيدًا من جزيئات الغلوبولين المناعي (الشكل 18.1.4). في حين أن الغلوبولين المناعي يحتوي على أربع سلاسل ببتيد وهياكل على شكل Y، فإن TCR يتكون من سلسلتين ببتيد فقط (سلسلتي ألفا وبيتا)، وكلاهما يمتد على الغشاء السيتوبلازمي للخلية التائية.
إن TCRs خاصة بالفتحة، وتشير التقديرات إلى أن هناك حاجة إلى 25 مليون خلية تائية مزودة بـ TCRs فريدة من نوعها تربط المثبتات لحماية الفرد من مجموعة واسعة من مسببات الأمراض الميكروبية. نظرًا لأن الجينوم البشري يحتوي فقط على حوالي 25000 جين، فإننا نعلم أنه لا يمكن ترميز كل TCR محدد بواسطة مجموعة الجينات الخاصة به. هذا يثير التساؤل حول كيفية تحقيق مثل هذه المجموعة الهائلة من الخلايا التائية التي تحتوي على ملايين من TCRs المحددة. الإجابة هي عملية تسمى إعادة الترتيب الجيني، والتي تحدث في الغدة الصعترية خلال الخطوة الأولى من اختيار الغدة الصعترية.
تنقسم الجينات التي ترمز للمناطق المتغيرة من TCR إلى شرائح جينية متميزة تسمى قطاعات المتغير (V) والتنوع (D) والانضمام (J). تتكون مقاطع الجينات المرتبطة بسلسلة ألفا من TCR من 70 مقطعًا مختلفًا أو أكثر من مقاطع V α و 61 مقطعًا مختلفًا من J α. تتكون شرائح الجينات المرتبطة بسلسلة β من TCR من 52 مقطعًا مختلفًا من V β، وقسمين مختلفين من D β، و 13 مقطعًا مختلفًا من J β. أثناء تطوير TCR الوظيفي في الغدة الصعترية، تجمع إعادة الترتيب الجيني في الخلية التائية بين مقطع V α واحد ومقطع J α لترميز المنطقة المتغيرة من سلسلة ألفا. وبالمثل، فإن إعادة الترتيب الجيني تجمع أحد مقاطع V β مع أحد مقاطع D β وأحد مقاطع TJ β لترميز المنطقة المتغيرة من سلسلة β. توفر جميع التوليفات الممكنة من عمليات إعادة الترتيب بين أجزاء مختلفة من V و D و J التنوع الجيني المطلوب لإنتاج الملايين من TCRs مع مناطق متغيرة فريدة خاصة بالمرقط.
التمارين\(\PageIndex{3}\)
- ما هي أوجه التشابه والاختلاف بين TCRs والغلوبولين المناعي؟
- ما هي العملية المستخدمة لتوفير الملايين من مواقع ربط TCR الفريدة؟
تنشيط وتمايز الخلايا التائية المساعدة
لا يمكن تنشيط الخلايا التائية المساعدة إلا من خلال APCs التي تقدم مثبتات أجنبية تمت معالجتها بالاشتراك مع MHC II. الخطوة الأولى في عملية التنشيط هي التعرف على TCR على الظهارة الأجنبية المحددة المقدمة في شق ربط المستضد MHC II. تتضمن الخطوة الثانية تفاعل CD4 على الخلية التائية المساعدة مع منطقة من جزيء MHC II منفصلة عن الشق المرتبط بالمستضد. يعمل هذا التفاعل الثاني على ترسيخ مجمع MHC II-TCR ويضمن أن الخلية التائية المساعدة تتعرف على كل من الظهارة الأجنبية («غير الذاتية») والمستضد «الذاتي» لـ APC؛ كلا التعريفين مطلوبان لتنشيط الخلية. في الخطوة الثالثة، تفرز خلية APC و T السيتوكينات التي تنشط الخلية التائية المساعدة. ثم تتكاثر الخلية التائية المساعدة المنشطة، وتنقسم عن طريق الانقسام الفتيلي لإنتاج الخلايا التائية المساعدة النسيلة الساذجة التي تفرق إلى أنواع فرعية ذات وظائف مختلفة (الشكل\(\PageIndex{5}\)).
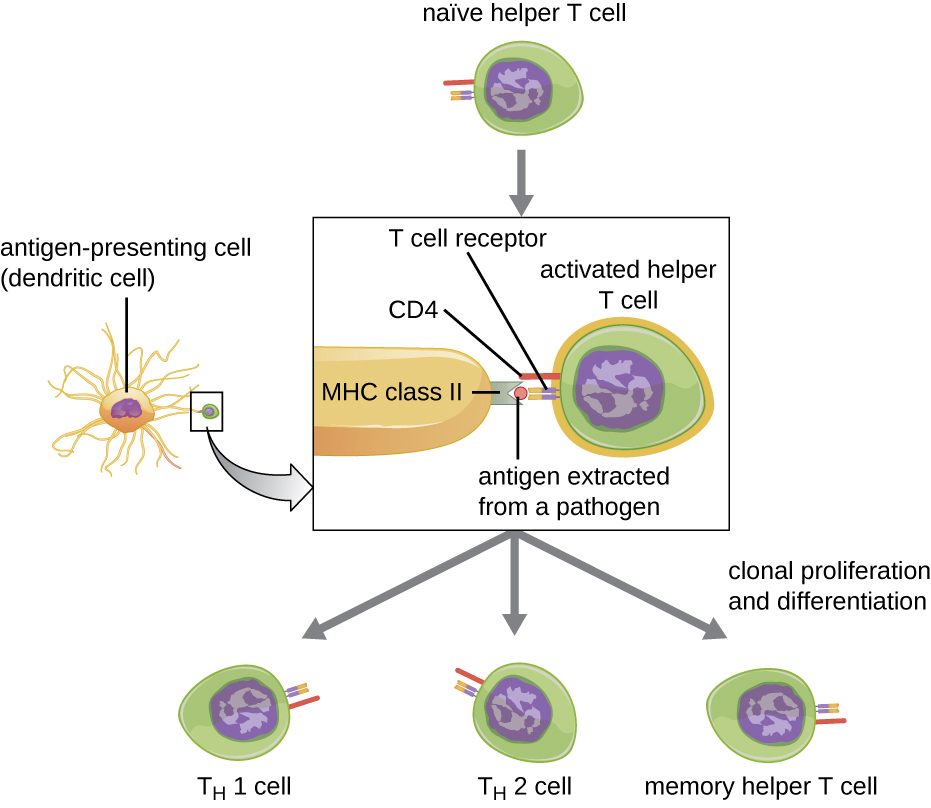
يمكن للخلايا التائية المساعدة النشطة أن تفرق إلى واحد من أربعة أنواع فرعية متميزة، ملخصة في الجدول\(\PageIndex{2}\). يتم توجيه عملية التمايز بواسطة السيتوكينات التي يفرزها APC. اعتمادًا على السيتوكينات التي يفرزها APC تتفاعل مع الخلية التائية المساعدة النشطة، قد تتمايز الخلية إلى خلية T مساعد 1 (T H 1) أو خلية مساعد T 2 (T H 2) أو خلية T مساعدة للذاكرة. النوعان من الخلايا التائية المساعدة هما الخلايا المؤثرة قصيرة العمر نسبيًا، مما يعني أنها تؤدي وظائف مختلفة للاستجابة المناعية الفورية. على النقيض من ذلك، فإن الخلايا التائية المساعدة للذاكرة طويلة العمر نسبيًا؛ فهي مبرمجة «لتذكر» مستضد معين أو مثبيتًا معينًا من أجل تكوين استجابة ثانوية سريعة وقوية للتعرض اللاحق.
تفرز خلايا T H 1 السيتوكينات الخاصة بها التي تشارك في تحفيز وتنظيم الخلايا الأخرى المشاركة في المناعة التكيفية والفطرية. على سبيل المثال، فإنها تحفز الخلايا التائية السامة للخلايا، وتعزز قتلها للخلايا المصابة وتعزز التمايز في الخلايا التائية السامة للخلايا في الذاكرة. تحفز خلايا T H 1 أيضًا البلاعم والعدلات لتصبح أكثر فعالية في قتل البكتيريا داخل الخلايا. يمكنها أيضًا تحفيز خلايا NK لتصبح أكثر فعالية في قتل الخلايا المستهدفة.
تلعب خلايا T H 2 دورًا مهمًا في تنظيم الاستجابة المناعية الخلطية من خلال إفرازها للسيتوكينات التي تنشط الخلايا البائية وتوجه تمايز الخلايا البائية وإنتاج الأجسام المضادة. تعمل السيتوكينات المختلفة التي تنتجها خلايا T H 2 على تنظيم تبديل فئة الأجسام المضادة، مما يسمح للخلايا B بالتبديل بين إنتاج IgM و IgG و IgA و IgE حسب الحاجة لتنفيذ وظائف معينة من الأجسام المضادة ولتوفير استجابات مناعية خلطية خاصة بمسببات الأمراض.
تم اكتشاف نوع فرعي ثالث من الخلايا التائية المساعدة يسمى خلايا T H 17 من خلال الملاحظات التي تفيد بأن المناعة ضد بعض الإصابات لا ترتبط بخلايا T H 1 أو T H 2. يبدو أن خلايا T H 17 والسيتوكينات التي تنتجها مسؤولة بشكل خاص عن دفاع الجسم ضد الالتهابات الجلدية المخاطية المزمنة. قد يكون المرضى الذين يفتقرون إلى خلايا T H 17 الكافية في الغشاء المخاطي (مثل مرضى فيروس نقص المناعة البشرية) أكثر عرضة للإصابة بتجرثم الدم والتهابات الجهاز الهضمي. 1
| نوع فرعي | الوظائف |
|---|---|
| خلايا تي إتش 1 | تحفيز الخلايا التائية السامة للخلايا وإنتاج خلايا الذاكرة التائية السامة للخلايا |
| تحفيز البلاعم والعدلات (PMNs) لمزيد من القتل الفعال داخل الخلايا لمسببات الأمراض | |
| تحفيز خلايا NK للقتل بشكل أكثر فعالية | |
| خلايا تي إتش 2 | تحفيز تنشيط الخلايا البائية وتمايزها في خلايا البلازما وخلايا الذاكرة B |
| التبديل المباشر لفئة الأجسام المضادة في الخلايا البائية | |
| خلايا تي اتش 17 | تحفيز المناعة ضد التهابات معينة مثل الالتهابات المخاطية الجلدية المزمنة |
| الخلايا التائية المساعدة للذاكرة | «تذكر» مسببًا معينًا وقم بإجراء استجابة ثانوية قوية وسريعة عند إعادة التعرض |
تنشيط وتمايز الخلايا التائية السامة للخلايا
يتم تنشيط الخلايا التائية السامة للخلايا (والتي يشار إليها أيضًا باسم الخلايا اللمفاوية التائية السامة للخلايا، أو CTLs) بواسطة APCs في عملية من ثلاث خطوات مماثلة لتلك الخاصة بالخلايا التائية المساعدة. والفرق الرئيسي هو أن تنشيط الخلايا التائية السامة للخلايا يتضمن التعرف على المستضد المقدم مع MHC I (على عكس MHC II) وتفاعل CD8 (على عكس CD4) مع مجمع المستقبلات. بعد التعرف المشترك الناجح على الظهارة الأجنبية والمستضد الذاتي، يعمل إنتاج السيتوكينات بواسطة APC والخلية التائية السامة للخلايا على تنشيط التكاثر النسيلي والتمايز. يمكن للخلايا التائية المنشطة السامة للخلايا أن تتمايز إلى خلايا T المؤثرة السامة للخلايا التي تستهدف مسببات الأمراض للتدمير أو خلايا الذاكرة الجاهزة للاستجابة لحالات التعرض اللاحقة.
كما لوحظ، يتم تحفيز تكاثر وتمايز الخلايا التائية السامة للخلايا أيضًا بواسطة السيتوكينات التي تفرز من خلايا T H 1 التي يتم تنشيطها بواسطة نفس الظهارة الأجنبية. يتم توفير التحفيز المشترك الذي يأتي من خلايا T H 1 بواسطة السيتوكينات المفرزة. على الرغم من أنه من الممكن تنشيط الخلايا التائية السامة للخلايا دون تحفيز خلايا T H 1، إلا أن التنشيط ليس فعالًا أو طويل الأمد.
بمجرد تنشيطها، تعمل الخلايا التائية السامة للخلايا كخلايا مستجيبة للمناعة الخلوية، حيث تتعرف على الخلايا المصابة بمسببات الأمراض داخل الخلايا وتقتلها من خلال آلية مشابهة جدًا لتلك الموجودة في خلايا NK. ومع ذلك، في حين أن الخلايا القاتلة الطبيعية تتعرف على الإشارات غير المحددة لإجهاد الخلية أو شذوذها، فإن الخلايا التائية السامة للخلايا تتعرف على الخلايا المصابة من خلال عرض المستضد للمسببات الخاصة بمسببات الأمراض المرتبطة بـ MHC I. بمجرد التعرف على الخلية المصابة، يرتبط TCR للخلية التائية السامة للخلايا بالظهارة ويطلق البيرفيرين والجرانزيمات التي تدمر الخلية المصابة (الشكل\(\PageIndex{6}\)). بيرفورين هو بروتين يخلق المسام في الخلية المستهدفة، والجرانزيمات هي البروتياز الذي يدخل المسام ويحفز موت الخلايا المبرمج. هذه الآلية لموت الخلايا المبرمج هي وسيلة مضبوطة وفعالة لتدمير وإزالة الخلايا المصابة دون إطلاق مسببات الأمراض في الداخل لإصابة الخلايا المجاورة، كما قد يحدث إذا تم تحلل الخلايا المصابة ببساطة.
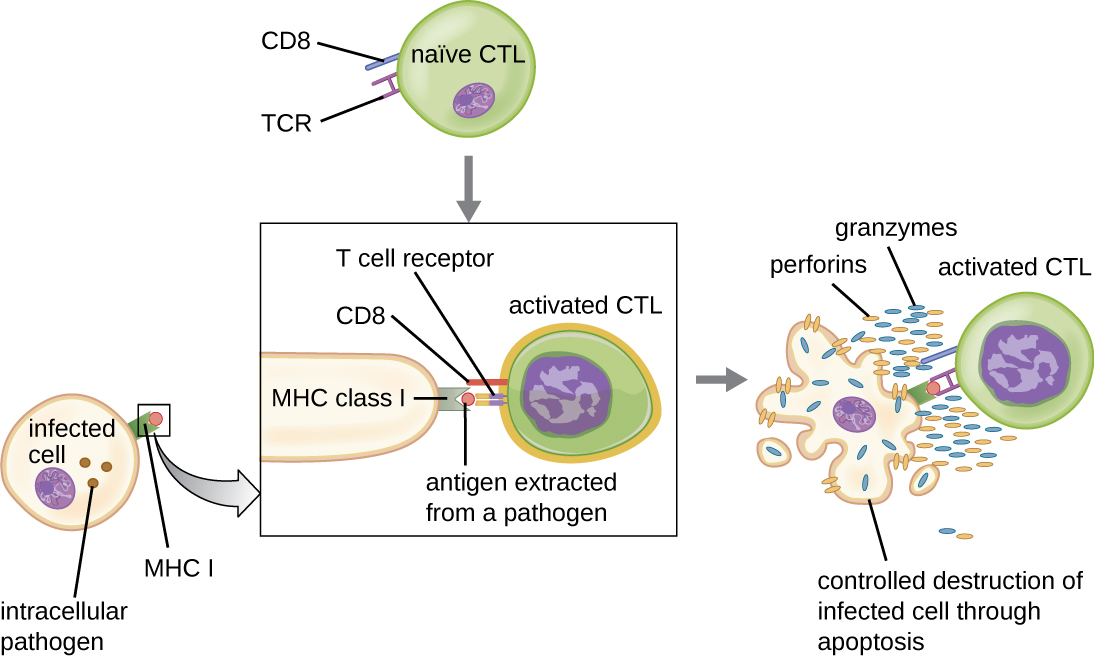
في هذا الفيديو، يمكنك رؤية خلية T سامة للخلايا تحفز موت الخلايا المبرمج في الخلية المستهدفة.
التمارين\(\PageIndex{4}\)
- قارن وقارن بين تنشيط الخلايا التائية المساعدة والخلايا التائية السامة للخلايا.
- ما هي الوظائف المختلفة للأنواع الفرعية للخلايا التائية المساعدة؟
- ما هي آلية تدمير الخلايا المصابة بوساطة CTL؟
المستضدات الفائقة والتنشيط غير المنظم للخلايا التائية
عندما يتم التحكم في تنشيط الخلايا التائية وتنظيمه، تكون النتيجة استجابة وقائية فعالة في مكافحة العدوى. ومع ذلك، إذا كان تنشيط الخلايا التائية غير منظم ومفرط، فقد تكون النتيجة مهددة للحياة. تنتج بعض مسببات الأمراض البكتيرية والفيروسية السموم المعروفة باسم المستضدات الفائقة (انظر عوامل ضراوة مسببات الأمراض البكتيرية والفيروسية) التي يمكن أن تؤدي إلى مثل هذه الاستجابة غير المنظمة. تشمل المستضدات البكتيرية الفائقة المعروفة توكسين متلازمة الصدمة السامة (TSST)، والسموم المعوية للمكورات العنقودية، والسموم البيروجينية للمكورات العقدية، والمستضد الفائق للمكورات العقدية، والسموم الخارجية الميتوجينية للمكورات العقدية. تشمل الفيروسات المعروفة بإنتاج المستضدات الفائقة فيروس Epstein-Barr (فيروس الهربس البشري 4) والفيروس المضخم للخلايا (فيروس الهربس البشري 5) وغيرها.
تتضمن آلية تنشيط الخلايا التائية بواسطة المستضدات الفائقة ارتباطها المتزامن بجزيئات MHC II من APCs والمنطقة المتغيرة من سلسلة TCR β. يحدث هذا الارتباط خارج الشق المرتبط بالمستضد لـ MHC II، لذلك سوف يترابط المستضد الفائق معًا وينشط MHC II و TCR دون التعرف على المثبتات الأجنبية المحددة (الشكل\(\PageIndex{7}\)). والنتيجة هي إطلاق مفرط وغير متحكم فيه للسيتوكينات، والتي غالبًا ما تسمى عاصفة السيتوكين، والتي تحفز الاستجابة الالتهابية المفرطة. يمكن أن يؤدي ذلك إلى انخفاض خطير في ضغط الدم والصدمة وفشل الأعضاء المتعددة وربما الموت.
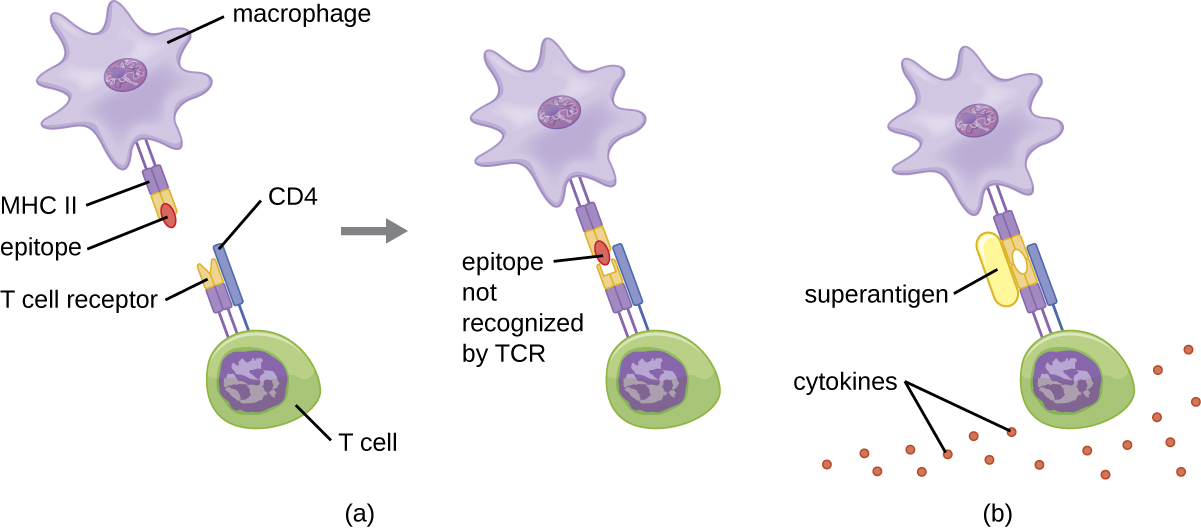
التمارين\(\PageIndex{5}\)
- ما هي أمثلة المستضدات الفائقة؟
- كيف يقوم المستضد الفائق بتنشيط خلية T المساعدة؟
- ما تأثير المستضد الفائق على الخلية التائية؟
مثال على ذلك: المستضدات الفائقة
ميليسا، وهي امرأة تتمتع بصحة جيدة تبلغ من العمر 22 عامًا، يتم إحضارها إلى غرفة الطوارئ من قبل صديقها المعني. تشكو من ظهور مفاجئ للحمى الشديدة والقيء والإسهال وآلام العضلات. في مقابلتها الأولية، تخبر الطبيب المعالج أنها تخضع لتحديد النسل الهرموني وأيضًا بعد يومين من فترة الحيض من دورتها. لا تتناول أي أدوية أخرى ولا تتعاطى أي مخدرات أو كحول. إنها ليست مدخنة. إنها ليست مصابة بالسكري ولا تعاني حاليًا من أي نوع من العدوى على حد علمها.
أثناء الانتظار في غرفة الطوارئ، يبدأ ضغط دم ميليسا في الانخفاض بشكل كبير وتتدهور حالتها العقلية إلى حالة من الارتباك العام. يعتقد الطبيب أنها تعاني على الأرجح من متلازمة الصدمة السامة (TSS). يحدث TSS بسبب السم TS-1، وهو مستضد فائق مرتبط بالمكورات العنقودية الذهبية، والاستخدام غير السليم للسدادات القطنية هو سبب شائع للعدوى التي تؤدي إلى TSS. يحفز المستضد الفائق بشكل غير لائق تنشيط الخلايا التائية على نطاق واسع والإفراز المفرط للسيتوكين، مما يؤدي إلى استجابة التهابية ضخمة ونظامية يمكن أن تكون قاتلة.
يمكن أخذ مسحات المهبل أو عنق الرحم لتأكيد وجود الميكروب، ولكن هذه الاختبارات ليست ضرورية لإجرائها بناءً على أعراض ميليسا وتاريخها الطبي. يصف الطبيب الإماهة والعلاج الداعم والمضادات الحيوية لوقف العدوى البكتيرية. كما أنها تصف أدوية لزيادة ضغط دم ميليسا. تقضي ميليسا ثلاثة أيام في المستشفى تخضع للعلاج؛ بالإضافة إلى ذلك، تتم مراقبة وظائف الكلى لديها بسبب ارتفاع خطر الفشل الكلوي المرتبط بـ TSS. بعد 72 ساعة، أصبحت ميليسا في حالة جيدة بما يكفي لتخرج من المستشفى لمواصلة تعافيها في المنزل.
التمارين\(\PageIndex{6}\)
بأي طريقة يمكن أن يساعد العلاج بالمضادات الحيوية في مكافحة المستضد الفائق؟
التركيز السريري: الجزء 2
تشير الغدد الليمفاوية المتورمة والبطن والطحال في أوليفيا إلى استجابة مناعية قوية للعدوى الجهازية الجارية. بالإضافة إلى ذلك، فإن أوليفيا الصغيرة مترددة في إدارة رأسها ويبدو أنها تعاني من آلام شديدة في الرقبة. يطلب الطبيب تعداد الدم الكامل وثقافة الدم والبزل القطني. يبدو السائل النخاعي (CSF) الذي تم الحصول عليه غائمًا ويتم تقييمه بشكل إضافي من خلال تقييم بقع الجرام وزراعة مسببات الأمراض البكتيرية المحتملة. يشير تعداد الدم الكامل إلى أعداد مرتفعة من خلايا الدم البيضاء في مجرى دم أوليفيا. يتم تسجيل زيادات خلايا الدم البيضاء عند 28.5 كيلومتر/ميكرولتر (النطاق الطبيعي: 6.0-17.5 ك/ميكرولتر). تم تسجيل نسبة العدلات بنسبة 60٪ (المعدل الطبيعي: 23-45٪). تم تسجيل مستويات الجلوكوز في CSF عند 30 مجم/100 مل (المعدل الطبيعي: 50-80 مجم/100 مل). كان عدد WBC في CSF 1.63/مم 3 (النطاق الطبيعي: 5-20/مم 3).
التمارين\(\PageIndex{7}\)
- بناءً على هذه النتائج، هل لديك تشخيص أولي؟
- ما العلاج الموصى به بناءً على هذا التشخيص الأولي؟
المفاهيم الأساسية والملخص
- يتم إنتاج الخلايا اللمفاوية التائية غير الناضجة في نخاع العظم الأحمر وتنتقل إلى الغدة الصعترية للنضج.
- اختيار الغدة الصعترية عبارة عن عملية من ثلاث خطوات للاختيار السلبي والإيجابي تحدد الخلايا التائية التي ستنضج وتخرج من الغدة الصعترية إلى مجرى الدم المحيطي.
- يتضمن التسامح المركزي الاختيار السلبي للخلايا التائية ذاتية التفاعل في الغدة الصعترية، وينطوي التحمل المحيطي على خلايا التائية العصبية والتنظيمية التي تمنع الاستجابات المناعية الذاتية التفاعلية والمناعة الذاتية.
- يتشابه TCR في هيكله مع الغلوبولين المناعي، ولكنه أقل تعقيدًا. يتم ترميز الملايين من TCRs الفريدة المرتبطة بالمثبتات من خلال عملية إعادة الترتيب الجيني لشرائح الجينات V و D و J.
- يمكن تقسيم الخلايا التائية إلى ثلاث فئات - الخلايا التائية المساعدة والخلايا التائية السامة للخلايا والخلايا التائية التنظيمية - بناءً على تعبيرها عن CD4 أو CD8 وجزيئات MHC التي تتفاعل معها من أجل التنشيط ووظائف كل منها.
- تفرق الخلايا التائية المساعدة النشطة إلى أنواع فرعية من خلايا T H 1 أو T H 2 أو T H 17 أو خلايا الذاكرة T. يتم توجيه التمايز بواسطة السيتوكينات المحددة التي يتعرضون لها. تؤدي T H 1 و T H 2 و T H 17 وظائف مختلفة تتعلق بتحفيز الدفاعات المناعية التكيفية والفطرية. خلايا الذاكرة T هي خلايا طويلة العمر يمكنها الاستجابة بسرعة للتعرض الثانوي.
- بمجرد تنشيطها، تستهدف الخلايا التائية السامة للخلايا الخلايا المصابة بمسببات الأمراض داخل الخلايا وتقتلها. يتطلب القتل التعرف على مثيلات مسببات الأمراض المحددة المعروضة على سطح الخلية باستخدام جزيئات MHC I. يتم التوسط في القتل عن طريق الإيفرين والجرانزيمات التي تحفز موت الخلايا المبرمج.
- المستضدات الفائقة هي بروتينات بكتيرية أو فيروسية تسبب تنشيطًا غير محدد للخلايا التائية المساعدة، مما يؤدي إلى إطلاق مفرط للسيتوكينات (عاصفة السيتوكين) واستجابة التهابية جهازية قد تكون قاتلة.
الحواشي
- 1 Blaschitz C.، Raffatello M. «السيتوكينات Th17 والحاجز المخاطي للأمعاء.» جي كلين إمونوول. 2010 مارس؛ 30 (2): 196-203. الرقم: 10.1007/s10875-010-9368-7.


