17.2: الدفاعات الكيميائية
- Page ID
- 194497
أهداف التعلم
- وصف كيف توفر الإنزيمات الموجودة في سوائل الجسم الحماية ضد العدوى أو المرض
- سرد ووصف وظيفة الببتيدات المضادة للميكروبات والمكونات التكميلية والسيتوكينات وبروتينات المرحلة الحادة
- وصف أوجه التشابه والاختلاف بين المسارات الكلاسيكية والبديلة والمكمِّلة للكتين
بالإضافة إلى الدفاعات الفيزيائية، يستخدم الجهاز المناعي الفطري غير النوعي عددًا من الوسطاء الكيميائيين الذين يثبطون الغزاة الميكروبيين. يشمل مصطلح «الوسطاء الكيميائيون» مجموعة واسعة من المواد الموجودة في سوائل وأنسجة الجسم المختلفة في جميع أنحاء الجسم. قد يعمل الوسطاء الكيميائيون بمفردهم أو بالاشتراك مع بعضهم البعض لمنع الاستعمار الميكروبي والعدوى.
يتم إنتاج بعض المواد الكيميائية الوسيطة داخليًا، مما يعني أنها تنتجها خلايا جسم الإنسان؛ بينما يتم إنتاج البعض الآخر خارجيًا، مما يعني أنه يتم إنتاجها بواسطة ميكروبات معينة تشكل جزءًا من الميكروبيوم. يتم إنتاج بعض المواد الوسيطة باستمرار، حيث يتم غسل المنطقة بالمواد المضادة للميكروبات؛ بينما يتم إنتاج البعض الآخر أو تنشيطه بشكل أساسي استجابة لبعض المحفزات، مثل وجود الميكروبات.
الوسطاء الكيميائيون والإنزيميون الموجودون في سوائل الجسم
تشمل السوائل التي ينتجها الجلد أمثلة على كل من الوسطاء الداخليين والخارجيين. تفرز الغدد الدهنية في الأدمة زيتًا يسمى الزهم الذي يتم إطلاقه على سطح الجلد من خلال بصيلات الشعر. هذا الزهم هو وسيط داخلي، يوفر طبقة إضافية من الدفاع عن طريق المساعدة في إغلاق مسام بصيلات الشعر، ومنع البكتيريا الموجودة على سطح الجلد من غزو الغدد العرقية والأنسجة المحيطة (الشكل\(\PageIndex{1}\)). يمكن لبعض أعضاء الميكروبيوم، مثل بكتيريا Propionibacterium acnes وفطر Malassezia، من بين آخرين، استخدام إنزيمات الليباز لتحلل الزهم، باستخدامه كمصدر للغذاء. ينتج هذا حمض الأوليك، الذي يخلق بيئة حمضية معتدلة على سطح الجلد غير مضيافة للعديد من الميكروبات المسببة للأمراض. حمض الأوليك هو مثال للوسيط المنتج خارجيًا لأنه ينتج عن طريق الميكروبات المقيمة وليس مباشرة بواسطة خلايا الجسم.
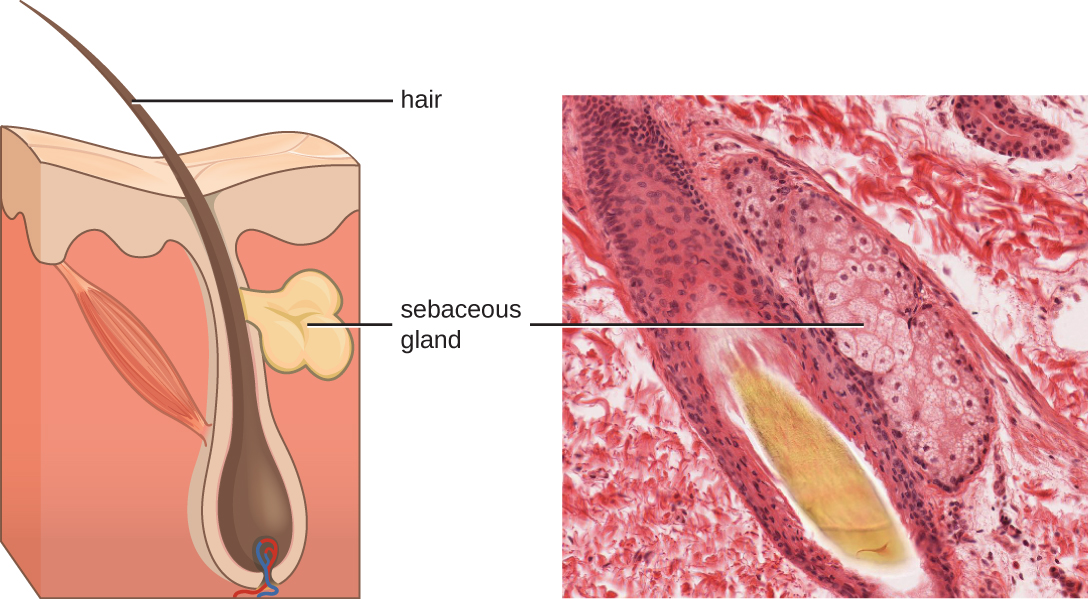
يمكن أن يكون للعوامل البيئية التي تؤثر على الميكروبات في الجلد تأثير مباشر على إنتاج الوسطاء الكيميائيين. على سبيل المثال، يمكن أن يؤدي انخفاض الرطوبة أو انخفاض إنتاج الزهم إلى جعل الجلد أقل ملاءمة للميكروبات التي تنتج حمض الأوليك، مما يجعل الجلد أكثر عرضة لمسببات الأمراض التي تثبطها عادة درجة الحموضة المنخفضة للجلد. تم تصميم العديد من مرطبات البشرة لمواجهة هذه الآثار من خلال استعادة الرطوبة والزيوت الأساسية للبشرة.
ينتج الجهاز الهضمي أيضًا عددًا كبيرًا من الوسطاء الكيميائيين الذين يثبطون الميكروبات أو يقتلونها. في تجويف الفم، يحتوي اللعاب على وسطاء مثل إنزيمات اللاكتوبيروكسيديز، والمخاط الذي يفرزه المريء يحتوي على إنزيم الليزوزيم المضاد للبكتيريا. في المعدة، يقتل سائل المعدة عالي الحموضة معظم الميكروبات. في الجهاز الهضمي السفلي، تحتوي الأمعاء على إنزيمات البنكرياس والأمعاء، والببتيدات المضادة للبكتيريا (الكريبتينات)، والصفراء المنتجة من الكبد، وخلايا بانيث المتخصصة التي تنتج الليزوزيم. يستطيع هؤلاء الوسطاء معًا القضاء على معظم مسببات الأمراض التي تتمكن من البقاء على قيد الحياة في البيئة الحمضية للمعدة.
في المسالك البولية، يقوم البول بطرد الميكروبات من الجسم أثناء التبول. علاوة على ذلك، فإن الحموضة الطفيفة للبول (متوسط درجة الحموضة حوالي 6) تمنع نمو العديد من الميكروبات ومسببات الأمراض المحتملة في المسالك البولية.
يستخدم الجهاز التناسلي الأنثوي اللاكتات، وهو وسيط كيميائي ينتج من الخارج، لمنع نمو الميكروبات. تنتج الخلايا وطبقات الأنسجة المكونة للمهبل الجليكوجين، وهو بوليمر متفرّع وأكثر تعقيدًا من الجلوكوز. تقوم العصيات اللبنية في المنطقة بتخمير الجليكوجين لإنتاج اللاكتات وخفض درجة الحموضة في المهبل وتثبيط الميكروبات العابرة ومسببات الأمراض الانتهازية مثل المبيضات (خميرة مرتبطة بالتهابات المهبل) ومسببات الأمراض الأخرى المسؤولة عن الأمراض المنقولة جنسياً.
في العيون، تحتوي الدموع على الوسطاء الكيميائيين الليزوزيم واللاكتوفيرين، وكلاهما قادر على القضاء على الميكروبات التي وجدت طريقها إلى سطح العينين. يشق الليزوزيم الرابطة بين NAG و NAM في الببتيدوغليكان، وهو أحد مكونات جدار الخلية في البكتيريا. وهو أكثر فعالية ضد البكتيريا إيجابية الجرام، والتي تفتقر إلى الغشاء الخارجي الواقي المرتبط بالبكتيريا سالبة الجرام. يمنع اللاكتوفيرين نمو الميكروبات عن طريق الربط الكيميائي وعزل الحديد. يؤدي هذا بشكل فعال إلى تجويع العديد من الميكروبات التي تتطلب الحديد للنمو.
في الأذنين، يُظهر السيرامين (شمع الأذن) خصائص مضادة للميكروبات بسبب وجود الأحماض الدهنية، التي تخفض درجة الحموضة إلى ما بين 3 و5.
يستخدم الجهاز التنفسي العديد من الوسطاء الكيميائيين في الممرات الأنفية والقصبة الهوائية والرئتين. يحتوي المخاط المنتج في الممرات الأنفية على مزيج من الجزيئات المضادة للميكروبات المشابهة لتلك الموجودة في الدموع واللعاب (مثل الليزوزيم واللاكتوفيرين واللاكتوبروكسيديز). تحتوي الإفرازات في القصبة الهوائية والرئتين أيضًا على الليزوزيم واللاكتوفيرين، بالإضافة إلى مجموعة متنوعة من الوسطاء الكيميائيين الإضافيين، مثل مركب البروتين الدهني المسمى بالسطح السطحي، والذي له خصائص مضادة للبكتيريا.
التمارين\(\PageIndex{1}\)
- اشرح الفرق بين الوسطاء داخليين وخارجيين
- وصف كيفية تأثير درجة الحموضة على الدفاعات المضادة
الببتيدات المضادة للميكروبات
الببتيدات المضادة للميكروبات (AMPs) هي فئة خاصة من الوسطاء غير المحددين المشتقين من الخلايا مع خصائص مضادات الميكروبات واسعة الطيف. يتم إنتاج بعض AMPs بشكل روتيني من قبل الجسم، في حين يتم إنتاج البعض الآخر بشكل أساسي (أو إنتاجه بكميات أكبر) استجابة لوجود مسببات الأمراض الغازية. بدأ البحث في استكشاف كيفية استخدام AMPs في تشخيص وعلاج الأمراض.
قد تتسبب AMPs في تلف الخلايا في الكائنات الحية الدقيقة بعدة طرق، بما في ذلك عن طريق إلحاق الضرر بالأغشية، وتدمير الحمض النووي والحمض النووي الريبي، أو التدخل في تخليق جدار الخلية. اعتمادًا على الآلية المحددة المضادة للميكروبات، قد يثبط AMP معين مجموعات معينة فقط من الميكروبات (على سبيل المثال، البكتيريا إيجابية الجرام أو سالبة الجرام) أو قد يكون أكثر فعالية على نطاق واسع ضد البكتيريا والفطريات والبروتوزوا والفيروسات. توجد العديد من AMPs على الجلد، ولكن يمكن العثور عليها أيضًا في مناطق أخرى من الجسم.
يمكن إنتاج عائلة من AMPs تسمى defensins بواسطة الخلايا الظهارية في جميع أنحاء الجسم وكذلك عن طريق الدفاعات الخلوية مثل البلاعم والعدلات (انظر الدفاعات الخلوية). قد يتم إفراز الديفينسينات أو العمل داخل الخلايا المضيفة؛ فهي تحارب الكائنات الحية الدقيقة عن طريق إتلاف أغشية البلازما. يتم إنتاج AMPs المسماة الباكتريوسين خارجيًا بواسطة أعضاء معينين من الميكروبات المقيمة داخل الجهاز الهضمي. غالبًا ما يتم نقل الجينات المشفرة لهذه الأنواع من AMPs على البلازميدات ويمكن أن تنتقل بين الأنواع المختلفة داخل الميكروبات المقيمة من خلال نقل الجينات الجانبي أو الأفقي.
هناك العديد من AMPs الأخرى في جميع أنحاء الجسم. يتم تلخيص خصائص عدد قليل من AMPs الأكثر أهمية في الجدول\(\PageIndex{1}\).
| أمبير | تم إفرازها بواسطة | موقع الجسم | تم تثبيط مسببات الأمراض | طريقة العمل |
|---|---|---|---|---|
| مركبات الباكتريوسين | ميكروبيوتا مقيمة | الجهاز الهضمي | بكتيريا | تعطيل الغشاء |
| الكاثيليسيدين | الخلايا الظهارية والبلاعم وأنواع الخلايا الأخرى | الجلد | البكتيريا والفطريات | يعطل الغشاء |
| الدفاعات | الخلايا الظهارية، البلاعم، العدلات | في جميع أنحاء الجسم | الفطريات والبكتيريا والعديد من الفيروسات | تعطيل الغشاء |
| ديرميسيدين | غدد عرقية | الجلد | البكتيريا والفطريات | يعطل سلامة الغشاء والقنوات الأيونية |
| هيستاتين | الغدد اللعابية | تجويف الفم | فطريات | تعطيل الوظيفة داخل الخلايا |
التمارين\(\PageIndex{2}\)
لماذا تعتبر الببتيدات المضادة للميكروبات (AMPs) دفاعات غير محددة؟
وسطاء بروتين البلازما
توجد العديد من عوامل المناعة الفطرية غير المحددة في البلازما، وهي الجزء السائل من الدم. تحتوي البلازما على الإلكتروليتات والسكريات والدهون والبروتينات، كل منها يساعد في الحفاظ على التوازن (أي استقرار أداء الجسم الداخلي)، وتحتوي على البروتينات المشاركة في تخثر الدم. تشارك البروتينات الإضافية الموجودة في بلازما الدم، مثل بروتينات المرحلة الحادة والبروتينات التكميلية والسيتوكينات، في الاستجابة المناعية الفطرية غير النوعية.
البلازما مقابل المصل
هناك مصطلحان للجزء السائل من الدم: البلازما والمصل. كيف تختلف إذا كانت سائلة وتفتقر إلى الخلايا؟ الجزء السائل من الدم المتبقي بعد حدوث التخثر (تخثر خلايا الدم) هو المصل. على الرغم من أن الجزيئات مثل العديد من الفيتامينات والإلكتروليتات وبعض السكريات والبروتينات التكميلية والأجسام المضادة لا تزال موجودة في المصل، إلا أن عوامل التخثر تستنفد إلى حد كبير. على العكس من ذلك، لا تزال البلازما تحتوي على جميع عناصر التخثر. للحصول على البلازما من الدم، يجب استخدام مضاد التخثر لمنع التخثر. تشمل أمثلة مضادات التخثر الهيبارين وحمض الإيثيلين ديامين رباعي الأسيتيك (EDTA). نظرًا لتثبيط التخثر، بمجرد الحصول عليها، يجب سحب العينة برفق في جهاز طرد مركزي. تشكل خلايا الدم الأثقل والأكثر كثافة حبيبة في الجزء السفلي من أنبوب الطرد المركزي، بينما يظل جزء البلازما السائل، وهو أخف وأقل كثافة، فوق حبيبات الخلية.
بروتينات المرحلة الحادة
بروتينات المرحلة الحادة هي فئة أخرى من وسطاء مضادات الميكروبات. يتم إنتاج بروتينات المرحلة الحادة بشكل أساسي في الكبد ويتم إفرازها في الدم استجابة للجزيئات الالتهابية من جهاز المناعة. تشمل أمثلة بروتينات المرحلة الحادة البروتين التفاعلي C، وأميلويد المصل A، والفيريتين، والترانسفيرين، والفيبرينوجين، والليكتين المرتبط بالمانوز. كل من هذه البروتينات لها بنية كيميائية مختلفة وتمنع أو تدمر الميكروبات بطريقة ما (الجدول\(\PageIndex{1}\)).
| بعض بروتينات المرحلة الحادة ووظائفها | |
|---|---|
| بروتين سي التفاعلي | يقوم بتطهير البكتيريا (التسمم) وإعدادها للابتلاع بواسطة الخلايا البلعمية |
| مصل أميلويد A | |
| فيريتين | ربط الحديد وعزله، وبالتالي تثبيط نمو مسببات الأمراض |
| ترانسفيرين | |
| الفيبرينوجين | يشارك في تكوين جلطات الدم التي تحبس مسببات الأمراض البكتيرية |
| الليكتين المرتبط بالمانوز | ينشط السلسلة المكملة |
نظام المكمل
النظام التكميلي عبارة عن مجموعة من وسطاء بروتين البلازما الذين يمكن أن يكونوا بمثابة دفاع فطري غير محدد بينما يعملون أيضًا على ربط المناعة الفطرية والتكيفية (تمت مناقشتها في الفصل التالي). يتكون النظام التكميلي من أكثر من 30 بروتينًا (بما في ذلك C1 إلى C9) التي تنتشر عادة كبروتينات أولية في الدم. يتم تنشيط هذه البروتينات الأولية عند تحفيزها أو تحفيزها بواسطة مجموعة متنوعة من العوامل، بما في ذلك وجود الكائنات الحية الدقيقة. تعتبر البروتينات التكميلية جزءًا من المناعة الفطرية غير النوعية لأنها موجودة دائمًا في الدم وسوائل الأنسجة، مما يسمح بتفعيلها بسرعة. أيضًا، عند تنشيطها من خلال المسار البديل (الموصوف لاحقًا في هذا القسم)، تستهدف البروتينات التكميلية مسببات الأمراض بطريقة غير محددة.
تسمى العملية التي تعمل من خلالها السلائف التكميلية المتداولة بالتفعيل التكميلي. هذه العملية عبارة عن سلسلة يمكن تشغيلها بواسطة واحدة من ثلاث آليات مختلفة، تُعرف باسم المسارات البديلة والكلاسيكية والليكتين.
يبدأ المسار البديل من خلال التنشيط التلقائي للبروتين التكميلي C3. ينتج التحلل المائي لـ C3 منتجين هما C3a و C3b. في حالة عدم وجود ميكروبات غازية، يتحلل C3b بسرعة كبيرة في تفاعل التحلل المائي باستخدام الماء الموجود في الدم. ومع ذلك، في حالة وجود ميكروبات غازية، فإن C3b تلتصق بسطح هذه الميكروبات. بمجرد إرفاقه، سيقوم C3b بتجنيد بروتينات تكميلية أخرى في سلسلة (الشكل\(\PageIndex{2}\)).
يوفر المسار الكلاسيكي آلية أكثر كفاءة لتنشيط السلسلة التكميلية، ولكنه يعتمد على إنتاج الأجسام المضادة بواسطة الدفاعات المناعية التكيفية المحددة. لبدء المسار الكلاسيكي، يجب أن يرتبط جسم مضاد معين أولاً بمسببات الأمراض لتشكيل مركب مستضد الأجسام المضادة. يعمل هذا على تنشيط البروتين الأول في السلسلة التكميلية، وهو مركب C1. مجمع C1 عبارة عن مركب بروتيني متعدد الأجزاء، ويشارك كل مكون في التنشيط الكامل للمجمع العام. بعد توظيف وتفعيل مركب C1، يتم توظيف البروتينات التكميلية للمسار الكلاسيكي المتبقية وتنشيطها في تسلسل متتالي (الشكل\(\PageIndex{2}\)).
يشبه مسار تنشيط الليكتين المسار الكلاسيكي، ولكن يتم تشغيله عن طريق ربط الليكتين المرتبط بالمانوز، وهو بروتين المرحلة الحادة، بالكربوهيدرات على السطح الميكروبي. مثل بروتينات المرحلة الحادة الأخرى، يتم إنتاج الليكتين بواسطة خلايا الكبد وعادة ما يتم تنظيمه استجابة للإشارات الالتهابية التي يتلقاها الجسم أثناء العدوى (الشكل\(\PageIndex{2}\)).
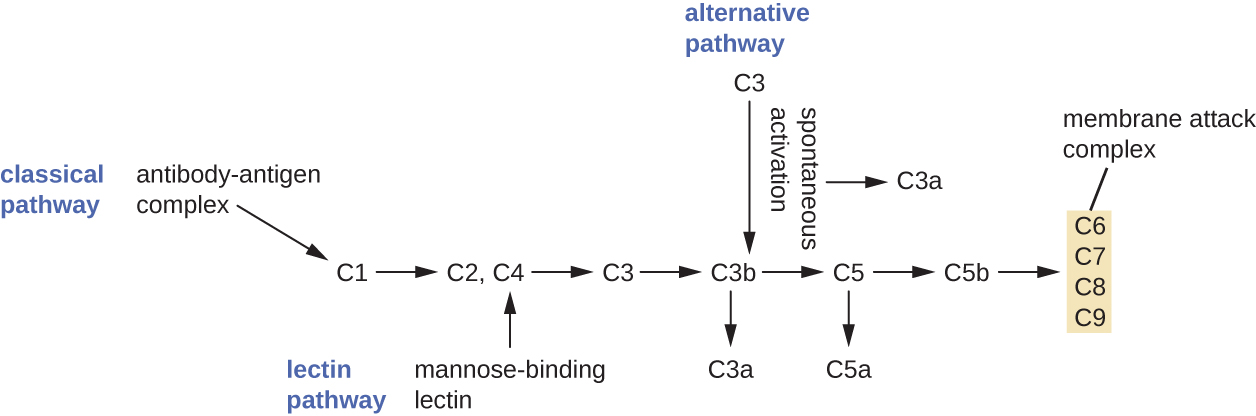
على الرغم من أن كل مسار من مسارات التنشيط التكميلية يبدأ بطريقة مختلفة، إلا أنها توفر جميعها نفس النتائج الوقائية: التسمم والالتهاب والتسمم الكيميائي والتحلل الخلوي. يشير مصطلح التسمم إلى طلاء العامل الممرض بمادة كيميائية (تسمى الأوبسونين) تسمح للخلايا البلعمية بالتعرف عليها وابتلاعها وتدميرها بسهولة أكبر. تشمل الخيارات من السلسلة التكميلية C1q و C3b و C4b. تشمل الأوبسونين المهمة الإضافية بروتينات ربط المانوز والأجسام المضادة. تعتبر الشظايا التكميلية C3a و C5a من مواد الحساسية المفرطة ذات الخصائص المميزة مع وظائف قوية مضادة للالتهاب. تعمل الحساسية المفرطة على تنشيط الخلايا البدينة، مما يتسبب في تدهور التحبيب وإطلاق الإشارات الكيميائية الالتهابية، بما في ذلك الوسطاء الذين يسببون توسع الأوعية وزيادة نفاذية الأوعية الدموية. C5a هي أيضًا واحدة من أقوى عوامل الجذب الكيميائي للعدلات وخلايا الدم البيضاء الأخرى، والدفاعات الخلوية التي ستتم مناقشتها في القسم التالي.
تتجمع البروتينات التكميلية C6 و C7 و C8 و C9 في مركب هجوم غشائي (MAC)، مما يسمح لـ C9 بالتبلمر في المسام في أغشية البكتيريا سالبة الجرام. تسمح هذه المسام للماء والأيونات والجزيئات الأخرى بالتحرك بحرية داخل وخارج الخلايا المستهدفة، مما يؤدي في النهاية إلى تحلل الخلايا وموت العامل الممرض (الشكل\(\PageIndex{2}\)). ومع ذلك، فإن MAC فعال فقط ضد البكتيريا سالبة الجرام؛ ولا يمكنه اختراق الطبقة السميكة من الببتيدوجليكان المرتبطة بجدران خلايا البكتيريا الإيجابية للجرام. نظرًا لأن MAC لا يشكل تهديدًا مميتًا لمسببات الأمراض البكتيرية المصابة بالجرام، فإن التسمم بوساطة المكملات يعد أكثر أهمية لإزالتها.
السيتوكينات
السيتوكينات هي بروتينات قابلة للذوبان تعمل كإشارات اتصال بين الخلايا. في الاستجابة المناعية الفطرية غير المحددة، قد يتم إطلاق العديد من السيتوكينات لتحفيز إنتاج الوسطاء الكيميائيين أو وظائف الخلية الأخرى، مثل تكاثر الخلايا، وتمايز الخلايا، وتثبيط انقسام الخلايا، وموت الخلايا المبرمج، والتاكسيس الكيميائي.
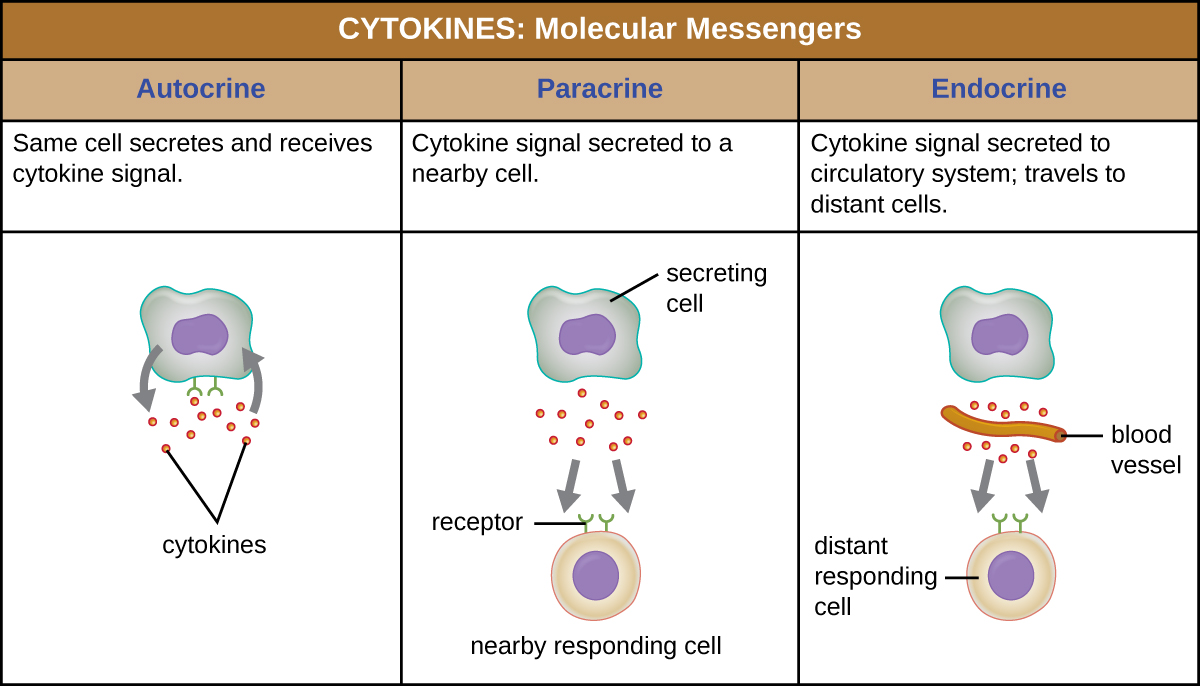
عندما يرتبط السيتوكين بمستقبله المستهدف، يمكن أن يختلف التأثير بشكل كبير اعتمادًا على نوع السيتوكين ونوع الخلية أو المستقبل الذي يرتبط به. يمكن وصف وظيفة سيتوكين معين بأنها الأوتوكرين أو الباراكرين أو الغدد الصماء (الشكل\(\PageIndex{3}\)). في وظيفة الأوتوكرين، تكون نفس الخلية التي تطلق السيتوكين هي متلقي الإشارة؛ بمعنى آخر، وظيفة الأوتوكرين هي شكل من أشكال التحفيز الذاتي بواسطة الخلية. في المقابل، تتضمن وظيفة الباراكرين إطلاق السيتوكينات من خلية إلى خلايا أخرى قريبة، مما يحفز بعض الاستجابة من الخلايا المتلقية. أخيرًا، تحدث وظيفة الغدد الصماء عندما تطلق الخلايا السيتوكينات في مجرى الدم لنقلها إلى الخلايا المستهدفة بعيدًا.
ثلاث فئات مهمة من السيتوكينات هي الإنترلوكين والكيموكين والإنترفيرون. كان يُعتقد في الأصل أن الإنترلوكين يتم إنتاجه فقط بواسطة كريات الدم البيضاء (خلايا الدم البيضاء) وأنه يحفز كريات الدم البيضاء فقط، وبالتالي أسباب تسميتها. على الرغم من أن الإنترلوكين تشارك في تعديل كل وظيفة من وظائف الجهاز المناعي تقريبًا، إلا أن دورها في الجسم لا يقتصر على المناعة. يتم إنتاج الإنترلوكين أيضًا بواسطة وتحفيز مجموعة متنوعة من الخلايا غير المرتبطة بالدفاعات المناعية.
الكيموكينات هي عوامل كيميائية تعمل على تجنيد كريات الدم البيضاء إلى مواقع العدوى وتلف الأنسجة والالتهابات. على عكس العوامل الكيميائية الأكثر عمومية، مثل العامل التكميلي C5a، فإن الكيموكينات محددة جدًا في المجموعات الفرعية من كريات الدم البيضاء التي تجندها.
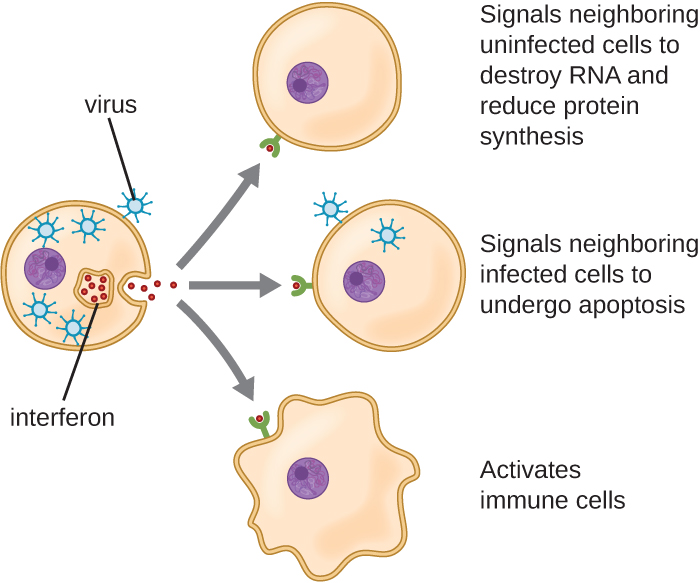
الإنترفيرون عبارة عن مجموعة متنوعة من جزيئات الإشارات المناعية وهي مهمة بشكل خاص في دفاعنا ضد الفيروسات. يتم إنتاج وإفراز الإنترفيرون من النوع الأول (الإنترفيرون ألفا والإنترفيرون) بواسطة الخلايا المصابة بالفيروس. تحفز هذه الإنترفيرون الخلايا المجاورة لوقف إنتاج الحمض النووي الريبي، وتدمير الحمض النووي الريبي المنتج بالفعل، وتقليل تخليق البروتين. تمنع هذه التغيرات الخلوية تكاثر الفيروس وإنتاج الفيروس الناضج، مما يبطئ انتشار الفيروس. يحفز الإنترفيرون من النوع الأول أيضًا الخلايا المناعية المختلفة المشاركة في التصفية الفيروسية لمهاجمة الخلايا المصابة بالفيروسات بقوة أكبر. يعتبر الإنترفيرون من النوع الثاني (Interferon-ã) منشطًا مهمًا للخلايا المناعية (الشكل\(\PageIndex{4}\)).
الوسطاء المثيرون للالتهابات
يساهم العديد من الوسطاء الكيميائيين الذين تمت مناقشتهم في هذا القسم بطريقة ما في الالتهاب والحمى، وهي استجابات مناعية غير محددة تمت مناقشتها بمزيد من التفصيل في الالتهاب والحمى. تحفز السيتوكينات إنتاج بروتينات المرحلة الحادة مثل البروتين التفاعلي C والليكتين المرتبط بالمانوز في الكبد. تعمل بروتينات المرحلة الحادة هذه كأوبسونين، حيث تنشط شلالات المكملات من خلال مسار الليكتين.
تربط بعض السيتوكينات أيضًا الخلايا البدينة والخلايا القاعدية، مما يحفزها على إطلاق الهيستامين، وهو مركب محفز للالتهاب. توجد مستقبلات الهيستامين في مجموعة متنوعة من الخلايا وتتوسط الأحداث المسببة للالتهابات، مثل تضيق القصبات الهوائية (شد الشعب الهوائية) وتقلص العضلات الملساء.
بالإضافة إلى الهيستامين، قد تطلق الخلايا البدينة وسطاء كيميائيين آخرين، مثل الليكوترين. الليكوترين عبارة عن وسطاء مؤيدين للالتهابات يعتمدون على الدهون ويتم إنتاجهم من عملية التمثيل الغذائي لحمض الأراكيدوميك في الغشاء الخلوي للكريات البيضاء وخلايا الأنسجة. بالمقارنة مع التأثيرات الالتهابية للهستامين، فإن تأثيرات الليكوترين أكثر فعالية وتدوم لفترة أطول. يمكن لهذه المواد الكيميائية الوسيطة معًا أن تحفز السعال والقيء والإسهال، والتي تعمل على طرد مسببات الأمراض من الجسم.
تحفز بعض السيتوكينات أيضًا إنتاج البروستاجلاندين والوسطاء الكيميائيين الذين يعززون التأثيرات الالتهابية للكينين والهستامين. يمكن أن يساعد البروستاجلاندين أيضًا في رفع درجة حرارة الجسم، مما يؤدي إلى الحمى، مما يعزز أنشطة خلايا الدم البيضاء ويمنع نمو الميكروبات المسببة للأمراض بشكل طفيف (انظر الالتهاب والحمى).
يساهم وسيط التهابي آخر، البراديكينين، في الوذمة، التي تحدث عندما تتسرب السوائل والكريات البيضاء من مجرى الدم إلى الأنسجة. وهو يرتبط بالمستقبلات الموجودة على الخلايا في جدران الشعيرات الدموية، مما يتسبب في تمدد الشعيرات الدموية وتصبح أكثر نفاذية للسوائل.
التمارين\(\PageIndex{3}\)
- ما الذي تشترك فيه مسارات التنشيط التكميلية الثلاثة؟
- اشرح إشارات الأوتوكرين والباراكرين والغدد الصماء.
- اذكر اثنين من الوسطاء المهمين في إثارة الالتهاب.
التركيز السريري: الجزء 2
للتخفيف من انقباض مجاريها الهوائية، يتم علاج أنجيلا على الفور بمضادات الهيستامين ويتم إعطاء الكورتيكوستيرويدات من خلال جهاز الاستنشاق، ثم تتم مراقبتها لفترة من الوقت. على الرغم من أن حالتها لا تزداد سوءًا، لا يبدو أن الأدوية تخفف من حالتها. يتم إدخالها إلى المستشفى لمزيد من المراقبة والاختبار والعلاج.
بعد دخول المستشفى، يُجري الطبيب اختبار الحساسية لمحاولة تحديد ما إذا كان هناك شيء في بيئتها قد يؤدي إلى استجابة التهابية تحسسية. يطلب الطبيب تحليل الدم للتحقق من مستويات السيتوكينات المعينة. يتم أيضًا أخذ عينة من البلغم وإرسالها إلى المختبر للتلطيخ الميكروبي والزراعة وتحديد مسببات الأمراض التي يمكن أن تسبب العدوى.
التمارين\(\PageIndex{4}\)
- ما هي جوانب الجهاز المناعي الفطري التي يمكن أن تساهم في انقباض مجرى الهواء لدى أنجيلا؟
- لماذا تم علاج أنجيلا بمضادات الهيستامين؟
- لماذا يهتم الطبيب بمستويات السيتوكينات في دم أنجيلا؟
\(\PageIndex{3}\)يقدم الجدول ملخصًا للدفاعات الكيميائية التي تمت مناقشتها في هذا القسم.
| دفاع | أمثلة | وظيفة |
|---|---|---|
| المواد الكيميائية والإنزيمات في سوائل الجسم | الزهم من الغدد الدهنية | يوفر حاجزًا زيتيًا يحمي مسام بصيلات الشعر من مسببات |
| حمض الأوليك من الزهم والميكروبات الجلدية | يخفض درجة الحموضة لتثبيط مسببات الأمراض | |
| الليزوزيم في الإفرازات | يقتل البكتيريا عن طريق مهاجمة جدار الخلية | |
| حمض في المعدة والبول والمهبل | يمنع أو يقتل البكتيريا | |
| الإنزيمات الهضمية والصفراء | اقتل البكتيريا | |
| اللاكتوفيرين والترانسفيرين | ربط الحديد وعزله، مما يمنع نمو البكتيريا | |
| خافض التوتر السطحي في الرئتين | يقتل البكتيريا | |
| الببتيدات المضادة للميكروبات | ديفينسينز، باكتيريوسين، ديرميسيدين، كاثليسيدين، هيستاتين، | اقتل البكتيريا عن طريق مهاجمة الأغشية أو التدخل في وظائف الخلية |
| وسطاء بروتين البلازما | بروتينات المرحلة الحادة (البروتين التفاعلي C، مصل الأميلويد A، الفيريتين، الفيبرينوجين، الترانسفيرين، والليكتين المرتبط بالمانوز) | تمنع نمو البكتيريا وتساعد في محاصرة البكتيريا وقتلها |
| يكمل C3b و C4b | إضفاء الطابع الشخصي على مسببات الأمراض للمساعدة في البلعمة | |
| مكمل C5a | جاذب كيميائي لخلايا البلعمات | |
| يكمل C3a و C5a | الحساسية التأقانية المؤيدة للالتهابات | |
| السيتوكينات | إنترلوكينز | تحفيز وتعديل معظم وظائف الجهاز المناعي |
| الكيموكينات | قم بتجنيد خلايا الدم البيضاء إلى المنطقة المصابة | |
| إنترفيرون | تنبيه الخلايا للعدوى الفيروسية، وتحفيز موت الخلايا المبرمج للخلايا المصابة بالفيروس، وتحفيز الدفاعات المضادة للفيروسات في الخلايا المصابة والقريبة غير المصابة، وتحفيز الخلايا المناعية لمهاجمة الخلايا المصابة بالفيروسات | |
| الوسطاء المثيرون للالتهاب | الهيستامين | يعزز توسع الأوعية وتضيق القصبات وتقلص العضلات الملساء وزيادة الإفراز وإنتاج المخاط |
| الليكوترين | يعزز الالتهاب؛ أقوى ويدوم لفترة أطول من الهيستامين | |
| البروستاجلاندين | تعزيز الالتهاب والحمى | |
| البراديكينين | يزيد من توسع الأوعية ونفاذية الأوعية الدموية، مما يؤدي إلى الوذمة |
المفاهيم الأساسية والملخص
- يُظهر العديد من الوسطاء الكيميائيين الذين يتم إنتاجهم داخليًا وخارجيًا وظائف غير محددة مضادة للميكروبات.
- توجد العديد من المواد الكيميائية الوسيطة في سوائل الجسم مثل الزهم واللعاب والمخاط وسوائل المعدة والأمعاء والبول والدموع والصمغ والإفرازات المهبلية.
- يتم إنتاج الببتيدات المضادة للميكروبات (AMPs) الموجودة على الجلد وفي مناطق أخرى من الجسم إلى حد كبير استجابة لوجود مسببات الأمراض. وتشمل هذه الأدوية الديرمسيدين والكاثيليسيدين والديفينسينات والهيستاتين والبكتريوسين.
- تحتوي البلازما على العديد من البروتينات التي تعمل كوسيط كيميائي، بما في ذلك بروتينات المرحلة الحادة والبروتينات التكميلية والسيتوكينات.
- يتضمن النظام التكميلي العديد من البروتينات الأولية التي تدور في البلازما. يتم تنشيط هذه البروتينات في تسلسل متتالي في وجود الميكروبات، مما يؤدي إلى تسمم مسببات الأمراض، والجاذبية الكيميائية للكريات البيضاء، وتحريض الالتهاب، والتحلل الخلوي من خلال تكوين مركب هجوم غشائي (MAC).
- السيتوكينات هي بروتينات تسهل الاستجابات غير المحددة المختلفة للخلايا المناعية الفطرية، بما في ذلك إنتاج وسطاء كيميائيين آخرين، وانتشار الخلايا، وموت الخلايا، والتمايز.
- تلعب السيتوكينات دورًا رئيسيًا في الاستجابة الالتهابية، حيث تحفز إنتاج المواد الوسيطة المسببة للالتهابات مثل بروتينات المرحلة الحادة والهستامين والليكوترين والبروستاجلاندين والبراديكينين.


