10.1: استخدام علم الأحياء الدقيقة لاكتشاف أسرار الحياة
- Page ID
- 194590
أهداف التعلم
- وصف اكتشاف الحمض النووي والنيوكليوتيدات
- شرح التجارب التاريخية التي أدت إلى توصيف الحمض النووي
- وصف كيفية استخدام الأحياء الدقيقة والكائنات الدقيقة لاكتشاف الكيمياء الحيوية للجينات
- اشرح كيف أثبت العلماء العلاقة بين الحمض النووي والوراثة
التركيز السريري: الجزء الأول
أليكس طالب جامعي يبلغ من العمر 22 عامًا قضى إجازته في بويرتا فالارتا بالمكسيك لقضاء عطلة الربيع. لسوء الحظ، بعد يومين من عودته إلى أوهايو، بدأ يعاني من تقلصات في البطن وإسهال مائي واسع النطاق. بسبب عدم ارتياحه، سعى للحصول على رعاية طبية في مستشفى سينسيناتي الكبير القريب.
التمارين\(\PageIndex{1}\)
ما أنواع العدوى أو الحالات الأخرى التي قد تكون مسؤولة؟
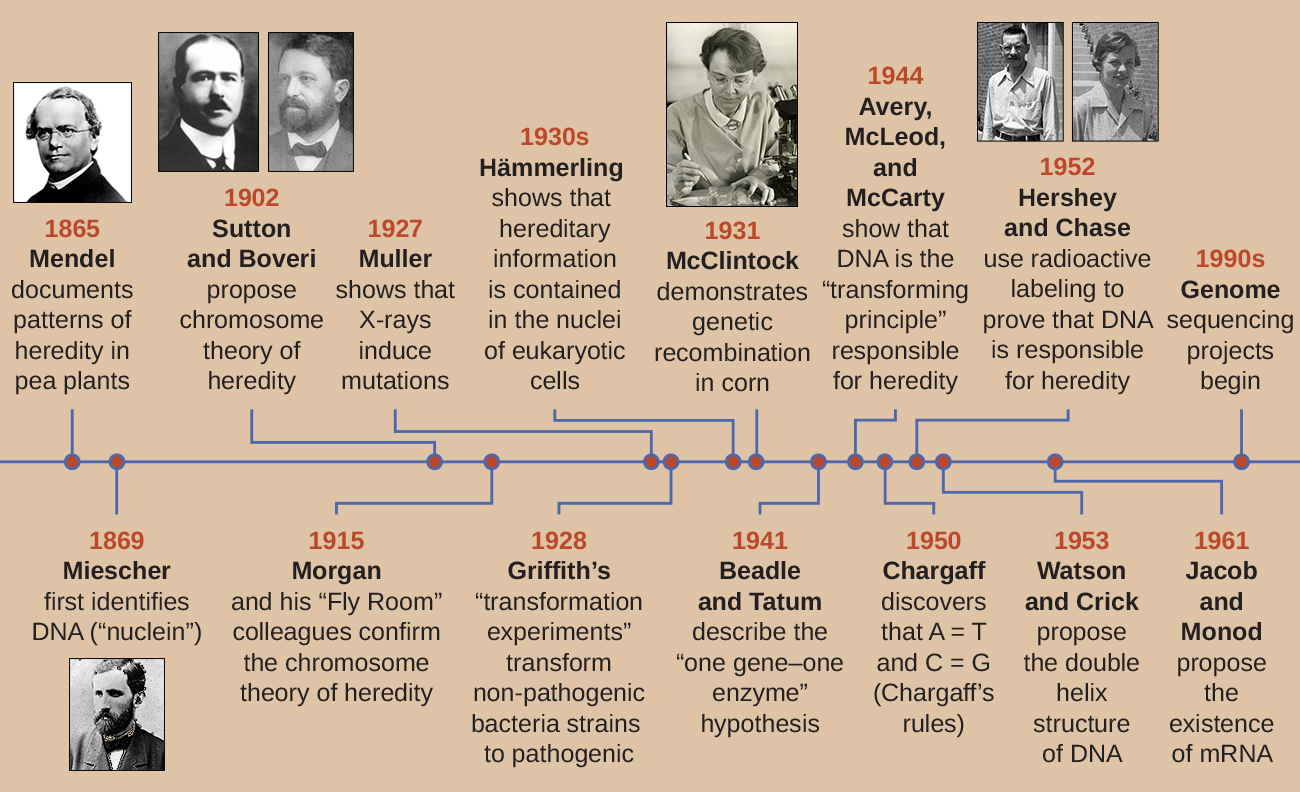
خلال أوائل القرن العشرين، لم يتم التعرف على الحمض النووي بعد باعتباره المادة الوراثية المسؤولة عن الوراثة، وانتقال الصفات من جيل إلى آخر. في الواقع، تم رفض الكثير من الأبحاث حتى منتصف القرن العشرين. اعتقد المجتمع العلمي، بشكل غير صحيح، أن عملية الميراث تنطوي على مزج الصفات الأبوية التي أنتجت مظهرًا جسديًا متوسطًا في النسل؛ بدت هذه العملية الافتراضية صحيحة بسبب ما نعرفه الآن باسم الاختلاف المستمر، والذي ينتج عن الفعل للعديد من الجينات لتحديد خاصية معينة، مثل ارتفاع الإنسان. يبدو أن النسل هو «مزيج» من سمات والديهم عندما ننظر إلى الخصائص التي تظهر تباينًا مستمرًا. أكدت نظرية المزج في الميراث أن الصفات الأبوية الأصلية فقدت أو استوعبت عن طريق المزج في النسل، لكننا نعلم الآن أن الأمر ليس كذلك.
أدى خطان منفصلان من البحث، بدأهما في منتصف القرن التاسع عشر وحتى أواخره، في النهاية إلى اكتشاف وتوصيف الحمض النووي وأسس علم الوراثة، علم الوراثة. بدأت خطوط البحث هذه في التقارب في عشرينيات القرن الماضي، وأدت الأبحاث التي تستخدم الأنظمة الميكروبية في النهاية إلى مساهمات كبيرة في توضيح الأساس الجزيئي لعلم الوراثة.
اكتشاف وتوصيف الحمض النووي
تطور الفهم الحديث للحمض النووي من اكتشاف الحمض النووي إلى تطوير نموذج الحلزون المزدوج. في ستينيات القرن التاسع عشر، كان فريدريش ميشر (1844-1895)، وهو طبيب مهني، أول شخص يقوم بعزل المواد الكيميائية الغنية بالفوسفور عن الكريات البيضاء (خلايا الدم البيضاء) من القيح الموجود على الضمادات المستخدمة في عيادة جراحية محلية. أطلق على هذه المواد الكيميائية (التي ستعرف في النهاية باسم RNA و DNA) اسم «nuclein» لأنها كانت معزولة عن نوى الخلايا. أطلق عليه تلميذه ريتشارد ألتمان (1852-1900) لاحقًا اسم «الحمض النووي» بعد 20 عامًا عندما اكتشف الطبيعة الحمضية للنوكلين. في العقدين الأخيرين من القرن التاسع عشر، قام عالم الكيمياء الحيوية الألماني ألبرشت كوسيل (1853-1927) بعزل وتوصيف قواعد النيوكليوتيدات الخمس المختلفة التي يتكون منها الحمض النووي. هذه هي الأدينين والجيوانين والسيتوزين والثايمين (في الحمض النووي) واليوراسيل (في الحمض النووي الريبي). حصل كوسيل على جائزة نوبل في علم وظائف الأعضاء أو الطب عام 1910 لعمله على الأحماض النووية وعمله الكبير على البروتينات، بما في ذلك اكتشاف الهيستيدين.
أسس علم الوراثة
على الرغم من اكتشاف الحمض النووي في أواخر القرن التاسع عشر، لم يرتبط العلماء بالوراثة لعدة عقود أخرى. لإجراء هذا الاتصال، أجرى العلماء، بما في ذلك عدد من علماء الأحياء الدقيقة، العديد من التجارب على النباتات والحيوانات والبكتيريا.
نباتات البازلاء من مندل
بينما كان ميشر يعزل ويكتشف الحمض النووي في ستينيات القرن التاسع عشر، كان الراهب النمساوي وعالم النبات يوهان جريجور مندل (1822-1884) يجرب البازلاء في الحديقة، ويوضح ويوثق الأنماط الأساسية للميراث، المعروفة الآن باسم قوانين مندل.
في عام 1856، بدأ مندل بحثه الذي استمر عشر سنوات في أنماط الميراث. استخدم بازلاء الحديقة ثنائية الصبغيات، Pisum sativum، كنظام نموذجي أساسي له لأنه يقوم بالتخصيب الذاتي بشكل طبيعي وهو متأصل للغاية، وينتج خطوط نباتات البازلاء «القابلة للتكاثر الحقيقي» - وهي نباتات تنتج دائمًا نسلًا يشبه الوالد. من خلال تجربة نباتات البازلاء ذات التكاثر الحقيقي، تجنب مندل ظهور سمات غير متوقعة في النسل قد تحدث إذا استخدم نباتات غير قابلة للتكاثر الحقيقي. أجرى مندل عمليات التهجين، التي تضمنت تزاوج فردين يتكاثران حقيقيان (جيل P) لهما سمات مختلفة، وفحص خصائص نسلهما (الجيل الأول من الأبناء، F 1) بالإضافة إلى نسل الإخصاب الذاتي لجيل F 1 (الثاني الجيل الأبوي، F 2) (الشكل 2\(\PageIndex{1}\)).
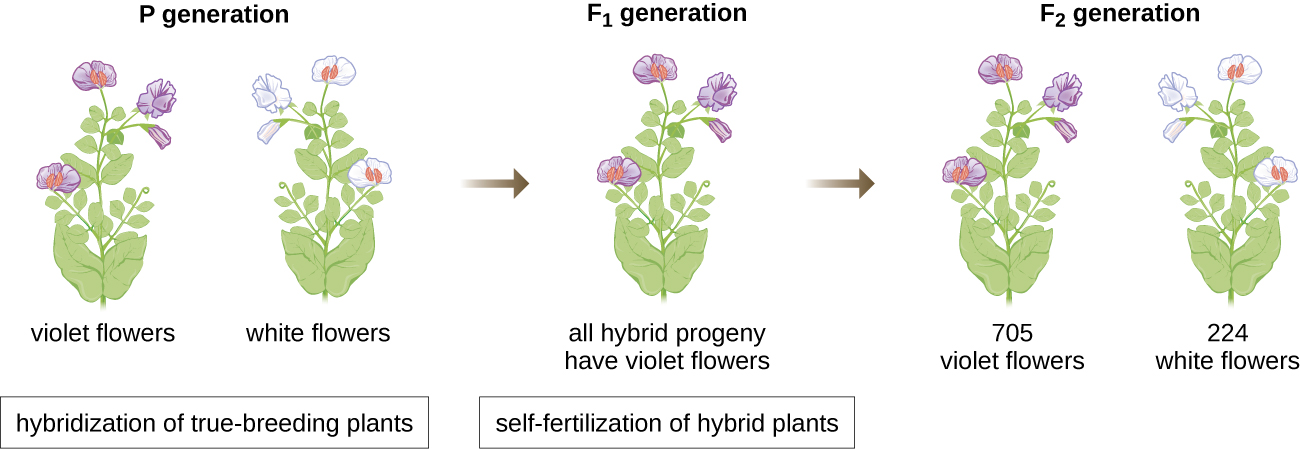
في عام 1865، قدم مندل نتائج تجاربه مع ما يقرب من 30000 نبتة بازلاء إلى جمعية التاريخ الطبيعي المحلية. لقد أظهر أن السمات تنتقل بأمانة من الآباء إلى الأبناء بشكل مستقل عن السمات الأخرى. وفي عام 1866، نشر عمله «تجارب في تهجين النباتات» (1) في وقائع جمعية التاريخ الطبيعي ببروين. لم يُلاحظ عمل مندل تقريبًا من قبل المجتمع العلمي، الذي آمن، بشكل غير صحيح، بنظرية مزج السمات في الاختلاف المستمر.
لم يتم الاعتراف به لمساهماته العلمية غير العادية خلال حياته. في الواقع، لم يتم إعادة اكتشاف عمله وإعادة إنتاجه وتنشيطه من قبل العلماء حتى عام 1900 على وشك اكتشاف الأساس الكروموسومي للوراثة.
نظرية الكروموسومات في الميراث
أجرى مندل تجاربه قبل وقت طويل من تصوير الكروموسومات تحت المجهر. ومع ذلك، مع تحسين التقنيات المجهرية في أواخر القرن التاسع عشر، تمكن علماء الأحياء الخلوية من تلوين وتصوير الهياكل تحت الخلوية باستخدام الأصباغ ومراقبة تصرفاتها أثناء الانقسام الاختزالي. تمكنوا من ملاحظة تكاثر الكروموسومات وتكثيفها من كتلة نووية غير متبلورة إلى أجسام مميزة على شكل X والانتقال إلى أقطاب خلوية منفصلة. أدت التكهنات بأن الكروموسومات قد تكون المفتاح لفهم الوراثة إلى قيام العديد من العلماء بفحص منشورات مندل وإعادة تقييم نموذجه من حيث سلوك الكروموسومات أثناء الانقسام والانقسام الاختزالي.
في عام 1902، لاحظ ثيودور بوفيري (1862-1915) أنه في قنافذ البحر، حددت المكونات النووية (الكروموسومات) التطور الجنيني المناسب. في نفس العام، لاحظ والتر ساتون (1877-1916) فصل الكروموسومات إلى خلايا ابنة أثناء الانقسام الاختزالي. أدت هذه الملاحظات معًا إلى تطوير نظرية الكروموسومات للوراثة، والتي حددت الكروموسومات باعتبارها المادة الوراثية المسؤولة عن الوراثة المندلية.
على الرغم من الارتباطات المقنعة بين سلوك الكروموسومات أثناء الانقسام الاختزالي وملاحظات مندل، فقد تم اقتراح نظرية الكروموسومات في الميراث قبل وقت طويل من وجود أي دليل مباشر على أن الصفات كانت تحمل على الكروموسومات. أمضى توماس هانت مورغان (1866-1945) وزملاؤه عدة سنوات في صنع الصلبان باستخدام ذبابة الفاكهة، Drosophila melanogaster. لقد أجروا ملاحظات مجهرية دقيقة لكروموسومات الذباب وربطوا هذه الملاحظات بخصائص الذباب الناتجة. قدم عملهم أول دليل تجريبي لدعم نظرية الكروموسومات في الميراث في أوائل القرن العشرين. في عام 1915، نشر مورجان وزملاؤه في «غرفة الطيران» آلية الوراثة المندلية، والتي حددت الكروموسومات على أنها الهياكل الخلوية المسؤولة عن الوراثة. لمساهماته العديدة المهمة في علم الوراثة، حصل مورغان على جائزة نوبل في علم وظائف الأعضاء أو الطب في عام 1933.
في أواخر عشرينيات القرن الماضي، طورت باربرا مكلينتوك (1902-1992) تقنيات تلوين الكروموسومات لتصور الكروموسومات المختلفة في الذرة والتمييز بينها. في الأربعينيات والخمسينيات من القرن الماضي، حددت حدث كسر في الكروموسوم 9، والذي أطلقت عليه اسم موضع التفكك (Ds). يمكن لـ Ds تغيير موضعه داخل الكروموسوم. كما حددت موضع المنشط (Ac). يمكن تنشيط كسر كروموسوم Ds بواسطة عنصر Ac (إنزيم transposase). في البداية، لم يكن اكتشاف مكلينتوك لهذه الجينات القافزة، والتي نسميها الآن الترانسبوزون، مقبولاً من قبل المجتمع العلمي. لم يتم اكتشاف عمليات النقل في البكتيريا والبكتيريا والدروسوفيلا حتى الستينيات وما بعدها. اليوم، نعلم أن الترانزبوسات هي أجزاء متحركة من الحمض النووي يمكن أن تتحرك داخل جينوم الكائن الحي. يمكنهم تنظيم التعبير الجيني والتعبير البروتيني والضراوة (القدرة على التسبب في المرض).
الميكروبات والفيروسات في البحث الجيني
لعب علماء الأحياء الدقيقة أيضًا دورًا مهمًا في فهمنا لعلم الوراثة. تم بالفعل استخدام الكائنات الحية التجريبية مثل بازلاء حديقة مندل وذباب فاكهة مورغان وذرة مكلينتوك بنجاح لتمهيد الطريق لفهم علم الوراثة. ومع ذلك، كانت الميكروبات والفيروسات (ولا تزال) أنظمة نموذجية ممتازة لدراسة علم الوراثة لأنها، على عكس البازلاء وذباب الفاكهة والذرة، يتم نشرها بسهولة أكبر في المختبر، وتنمو إلى كثافة سكانية عالية في مساحة صغيرة وفي وقت قصير. بالإضافة إلى ذلك، بسبب بساطتها الهيكلية، يتم التلاعب بالميكروبات والفيروسات بسهولة أكبر وراثيًا.
لحسن الحظ، على الرغم من الاختلافات الكبيرة في الحجم والبنية واستراتيجيات التكاثر والخصائص البيولوجية الأخرى، هناك وحدة كيميائية حيوية بين جميع الكائنات الحية؛ تشترك في نفس الجزيئات الأساسية المسؤولة عن الوراثة واستخدام المواد الوراثية لإعطاء الخلايا تنوعها الخصائص. على حد تعبير العالم الفرنسي جاك مونود، «ما ينطبق على E. coli ينطبق أيضًا على الفيل»، مما يعني أنه تم الحفاظ على الكيمياء الحيوية للحياة طوال التطور وتم تقاسمها في جميع أشكال الحياة، من الكائنات أحادية الخلية البسيطة إلى الكائنات الحية الكبيرة والمعقدة. هذه الاستمرارية البيوكيميائية تجعل الميكروبات نماذج ممتازة لاستخدامها في الدراسات الجينية.
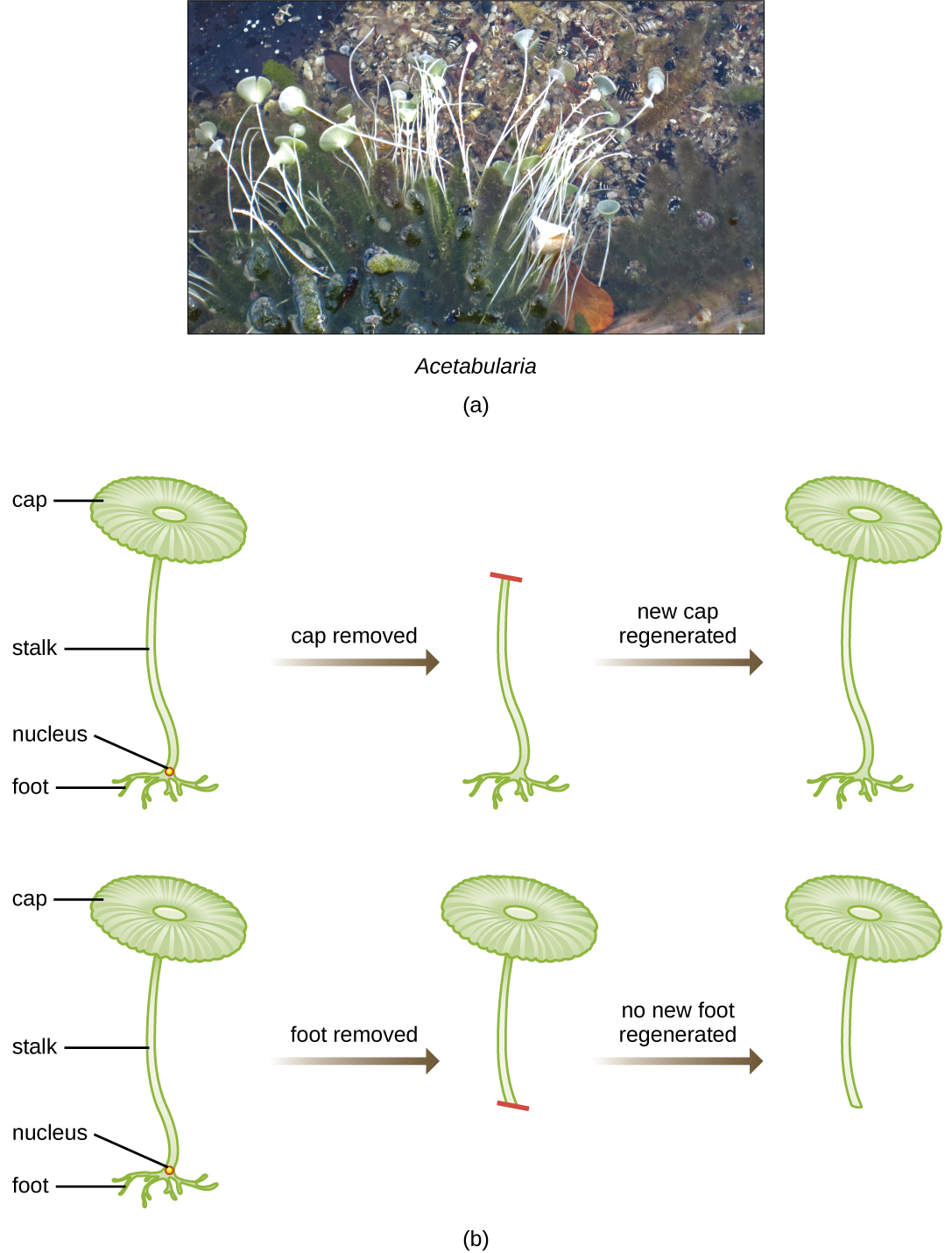
في مجموعة ذكية من التجارب في الثلاثينيات والأربعينيات، أثبت العالم الألماني يواكيم هاميرلينغ (1901-1980)، باستخدام الطحالب أحادية الخلية أسيتابولاريا كنموذج ميكروبي، أن المعلومات الجينية في الخلية حقيقية النواة موجودة داخل النواة. Acetabularia spp. هي خلايا طحالب كبيرة بشكل غير عادي تنمو بشكل غير متماثل، وتشكل «قدمًا» تحتوي على النواة، والتي تُستخدم لربط الركيزة؛ والساق؛ وغطاء يشبه المظلة - هياكل يمكن رؤيتها جميعًا بسهولة بالعين المجردة. في مجموعة مبكرة من التجارب، قام Hämmerling بإزالة الغطاء أو سفح الخلايا ولاحظ ما إذا كان قد تم تجديد القبعات أو الأقدام الجديدة (الشكل\(\PageIndex{2}\)). ووجد أنه عند إزالة قدم هذه الخلايا، لم تنمو أقدام جديدة؛ ومع ذلك، عندما تمت إزالة القبعات من الخلايا، تم تجديد أغطية جديدة. يشير هذا إلى أن المعلومات الوراثية كانت موجودة في القدم المحتوية على النواة لكل خلية.
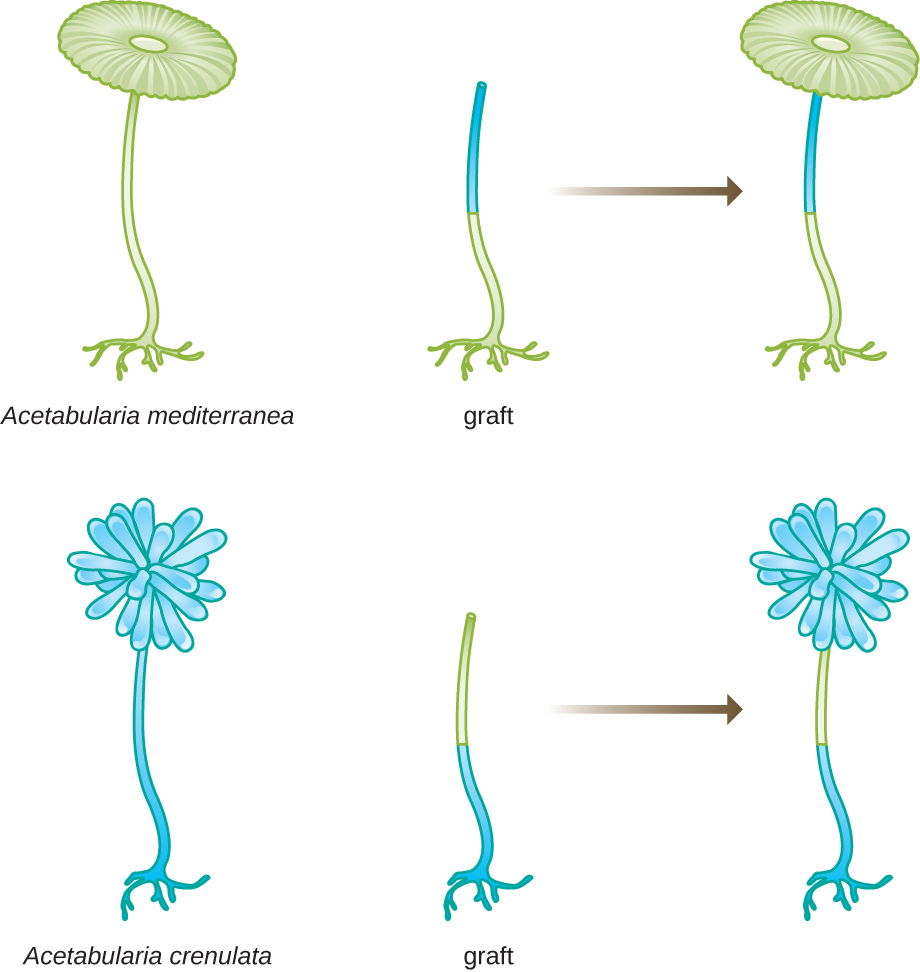
في مجموعة أخرى من التجارب، استخدم Hämmerling نوعين من أسيتابولاريا لهما أشكال مختلفة للغطاء، A. crenulata و A. meditranea (الشكل\(\PageIndex{3}\)). قام بقطع القبعات من كلا النوعين من الخلايا ثم قام بتطعيم الساق من A. crenulata على قدم A. mediterranea، والعكس صحيح. ومع مرور الوقت، لاحظ أن الخلية الملقحة بقدم A. crenulata وساق A. mediterranea طورت غطاءً باستخدام مورفولوجيا A. crenulata. على العكس من ذلك، طورت الخلية الملقحة بقدم A. mediterranea وساق A. crenulata غطاءًا باستخدام مورفولوجيا A. meditranea أكد مجهريًا وجود نوى في أقدام هذه الخلايا وعزا تطور أشكال الغطاء هذه إلى نواة كل خلية مطعمة. وهكذا أظهر بشكل تجريبي أن النواة هي موقع المادة الجينية التي تملي خصائص الخلية.
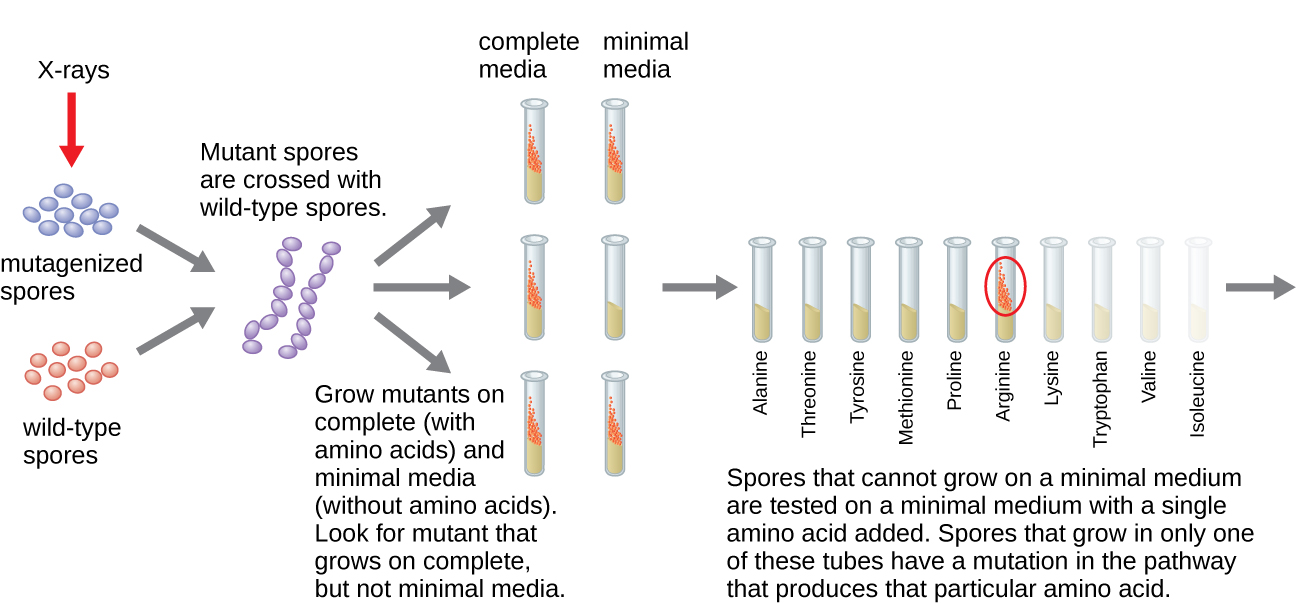
استخدم جورج بيدل وإدوارد تاتوم نموذجًا ميكروبيًا آخر، وهو قالب الخبز الأحمر Neurospora crassa، لإثبات العلاقة بين الجينات والبروتينات التي تقوم بترميزها. عملت Beadle مع ذباب الفاكهة في مختبر Morgan ولكنها وجدت أنها معقدة للغاية لإجراء أنواع معينة من التجارب. N. crassa، من ناحية أخرى، هو كائن حي أبسط ولديه القدرة على النمو على وسط ضئيل لأنه يحتوي على مسارات إنزيمية تسمح له باستخدام الوسيط لإنتاج الفيتامينات والأحماض الأمينية الخاصة به.
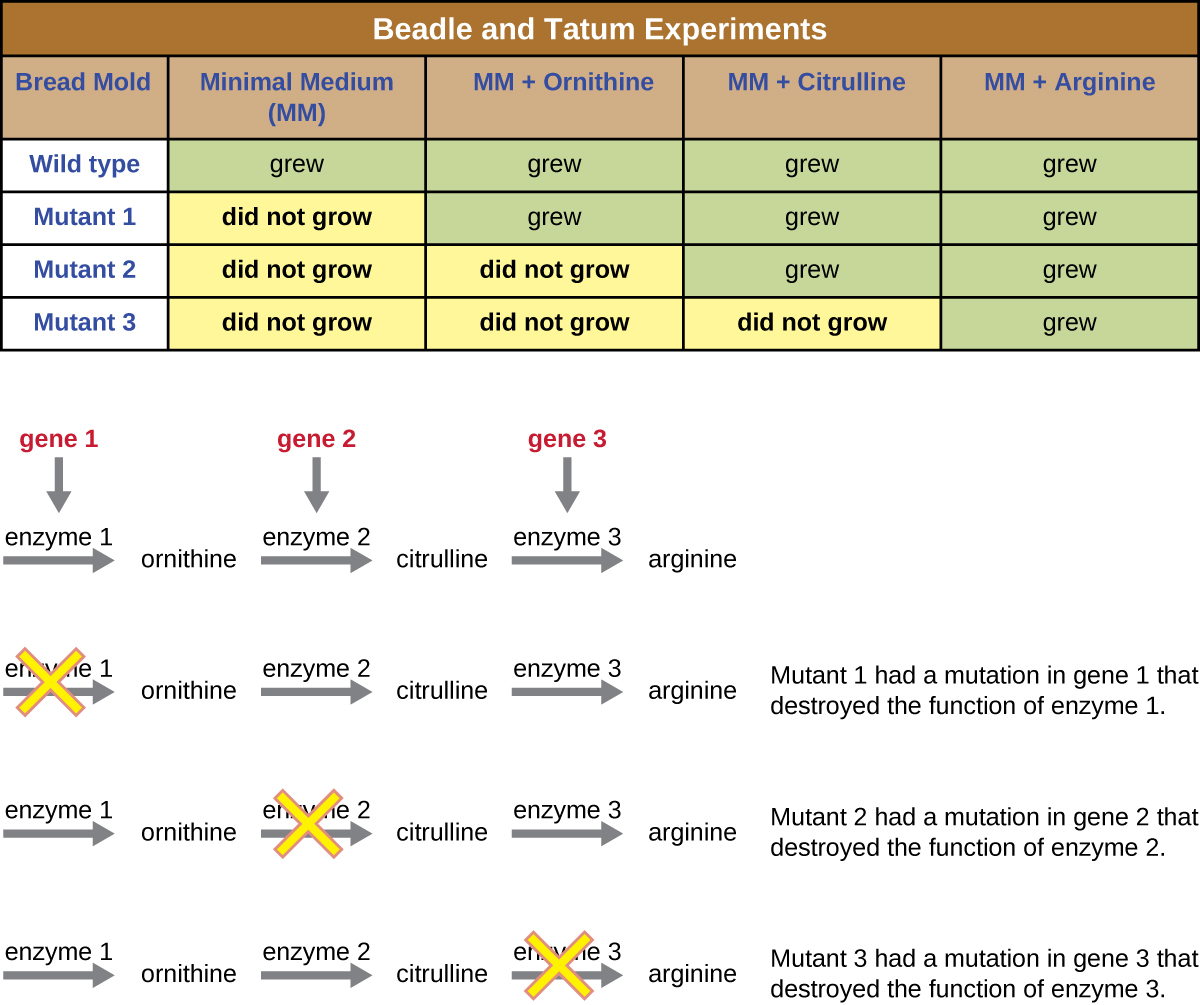
قام Beadle و Tatum بإشعاع القالب بالأشعة السينية لإحداث تغييرات في سلسلة من الأحماض النووية تسمى الطفرات. لقد تزاوجوا جراثيم العفن المشع وحاولوا زراعتها على كل من الوسط الكامل والوسيط الأدنى. لقد بحثوا عن الطفرات التي نمت على وسط كامل، مكمّلة بالفيتامينات والأحماض الأمينية، لكنها لم تنمو على الحد الأدنى من الوسط الذي يفتقر إلى هذه المكملات. احتوت هذه القوالب نظريًا على طفرات في الجينات التي قامت بترميز مسارات التخليق الحيوي. عند العثور على مثل هذه الطفرات، قاموا باختبار كل منها بشكل منهجي لتحديد الفيتامينات أو الأحماض الأمينية التي لم تتمكن من إنتاجها (الشكل\(\PageIndex{4}\)) ونشروا هذا العمل في عام 1941.
أظهر العمل اللاحق الذي قام به Beadle و Tatum وزملاؤه أنه يمكنهم عزل فئات مختلفة من المسوخ التي تتطلب مكملًا معينًا، مثل الحمض الأميني أرجينين (الشكل\(\PageIndex{5}\)). مع بعض المعرفة بمسار التخليق الحيوي للأرجينين، حددوا ثلاث فئات من طفرات الأرجينين عن طريق استكمال الحد الأدنى من الوسط بمواد وسيطة (سيترولين أو أورنيثين) في المسار. اختلفت المتحولات الثلاثة في قدراتها على النمو في كل من الوسائط، مما دفع مجموعة العلماء إلى اقتراح، في عام 1945، أن كل نوع من أنواع المتحولين له عيب في جين مختلف في مسار التخليق الحيوي للأرجينين. أدى ذلك إلى ما يسمى بفرضية الجين الواحد والإنزيم الواحد، والتي اقترحت أن كل جين يشفر إنزيمًا واحدًا.
أدت المعرفة اللاحقة حول عمليات النسخ والترجمة إلى قيام العلماء بمراجعة ذلك إلى فرضية «جين واحد - بولي ببتيد واحد». على الرغم من وجود بعض الجينات التي لا تقوم بتشفير الببتيدات المتعددة (بل تقوم بترميزها لنقل الحمض النووي الريبي [trNAs] أو RNAs الريبوسومية [rNAs]، والتي سنناقشها لاحقًا)، فإن فرضية الجين الواحد - الإنزيم الواحد صحيحة في كثير من الحالات، خاصة في الميكروبات. أكسب اكتشاف Beadle و Tatum للعلاقة بين الجينات والخصائص المقابلة لهما جائزة نوبل لعام 1958 في علم وظائف الأعضاء والطب وأصبح منذ ذلك الحين أساسًا لعلم الوراثة الجزيئي الحديث.
لمعرفة المزيد عن تجارب Beadle و Tatum، قم بزيارة هذا الموقع من مركز DNA Learning Center.
التمارين\(\PageIndex{2}\)
- ما الكائن الحي الذي استخدمه مورغان وزملاؤه لتطوير نظرية الكروموسومات في الميراث؟ ما هي السمات التي قاموا بتتبعها؟
- ما الذي أثبته Hämmerling من خلال تجاربه على Acetabularia؟
الحمض النووي باعتباره الجزيء المسؤول عن الوراثة
بحلول بداية القرن العشرين، كان قد تم بالفعل إنجاز قدر كبير من العمل على توصيف الحمض النووي وإرساء أسس علم الوراثة، بما في ذلك عزو الوراثة إلى الكروموسومات الموجودة داخل النواة. على الرغم من كل هذه الأبحاث، لم تتلاقى خطوط البحث هذه حتى وقت طويل من القرن العشرين وبدأ العلماء في التفكير في أن الحمض النووي يمكن أن يكون المادة الوراثية التي ورثها النسل من والديهم. كان يُعتقد أن الحمض النووي، الذي يحتوي على أربعة نيوكليوتيدات مختلفة فقط، بسيط جدًا من الناحية الهيكلية لترميز مثل هذه المعلومات الجينية المعقدة. بدلاً من ذلك، كان يُعتقد أن البروتين له التعقيد المطلوب ليكون بمثابة معلومات وراثية خلوية لأنه يتكون من 20 حمضًا أمينيًا مختلفًا يمكن دمجها في مجموعة كبيرة ومتنوعة من التركيبات. لعب علماء الأحياء الدقيقة دورًا محوريًا في البحث الذي حدد أن الحمض النووي هو الجزيء المسؤول عن الوراثة.
تجارب التحول التي أجراها جريفيث
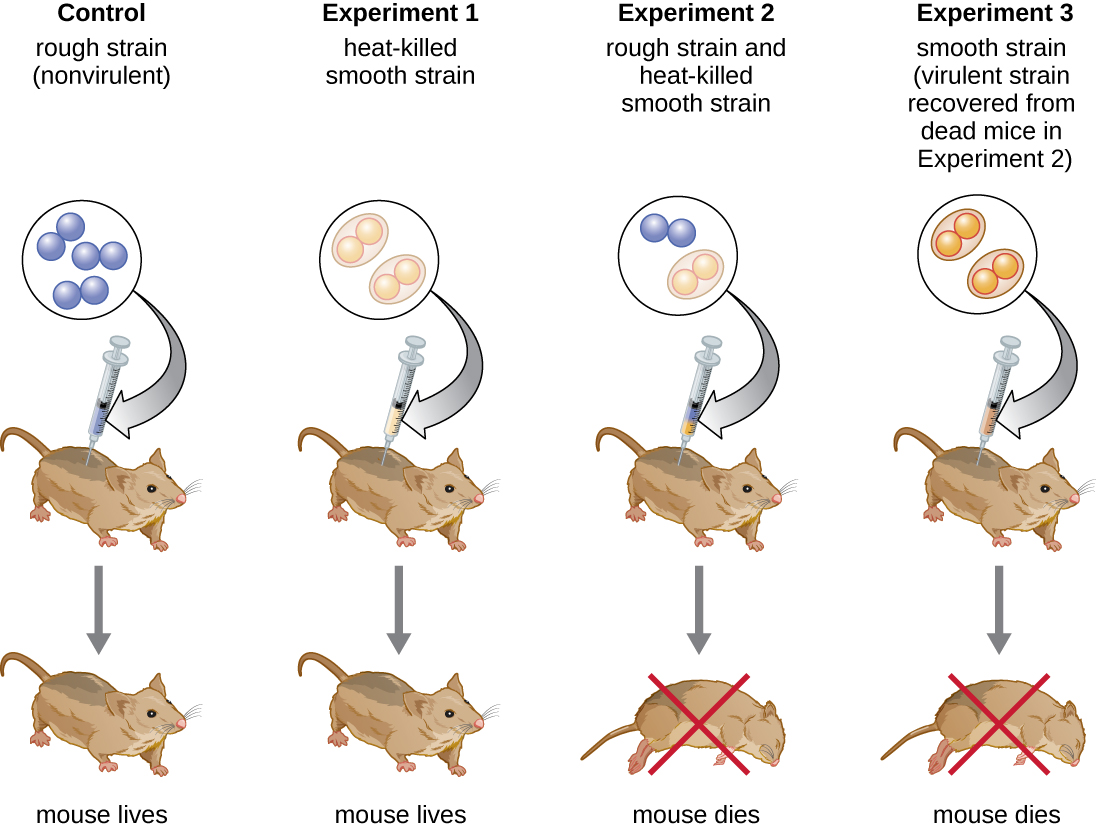
ربما كان عالم البكتيريا البريطاني فريدريك جريفيث (1879-1941) أول شخص أظهر أن المعلومات الوراثية يمكن نقلها من خلية إلى أخرى «أفقيًا» (بين أفراد من نفس الجيل)، بدلاً من «عموديًا» (من الوالد إلى النسل). في عام 1928، أبلغ عن أول عرض توضيحي للتحول البكتيري، وهي عملية يتم فيها امتصاص الحمض النووي الخارجي بواسطة خلية، وبالتالي تغيير خصائصها. 3 كان يعمل مع سلالتين من المكورات العقدية الرئوية، وهي بكتيريا تسبب الالتهاب الرئوي: سلالة خشنة (R) وسلالة (S) ناعمة. سلالة R غير مسببة للأمراض وتفتقر إلى كبسولة على سطحها الخارجي؛ ونتيجة لذلك، تبدو المستعمرات من سلالة R خشنة عند نموها على ألواح. تعتبر سلالة S مسببة للأمراض وتحتوي على كبسولة خارج جدار الخلية، مما يسمح لها بالهروب من البلعمة بواسطة جهاز المناعة المضيف. تتسبب الكبسولات في ظهور المستعمرات من سلالة S بشكل سلس عند نموها على أطباق.
في سلسلة من التجارب، حلل جريفيث تأثيرات سلالات R الحية و S الحية و S القاتلة للحرارة من S. pneumoniae على الفئران الحية (الشكل\(\PageIndex{6}\)). عندما تم حقن الفئران بسلالة S الحية، ماتت الفئران. عندما قام بحقن الفئران بسلالة R الحية أو سلالة S القاتلة بالحرارة، نجت الفئران. ولكن عندما قام بحقن الفئران بمزيج من سلالة R الحية وسلالة S القاتلة بالحرارة، ماتت الفئران. عند عزل البكتيريا الحية عن الفأر الميت، استعاد فقط سلالة S من البكتيريا. عندما قام بعد ذلك بحقن سلالة S المعزولة هذه في الفئران الطازجة، ماتت الفئران. وخلص غريفيث إلى أن شيئًا ما قد انتقل من سلالة S القاتلة بالحرارة إلى سلالة R الحية و «حولها» إلى سلالة S المسببة للأمراض؛ وأطلق على هذا «مبدأ التحويل». تُعرف هذه التجارب الآن باسم تجارب التحول التي أجراها جريفيث.
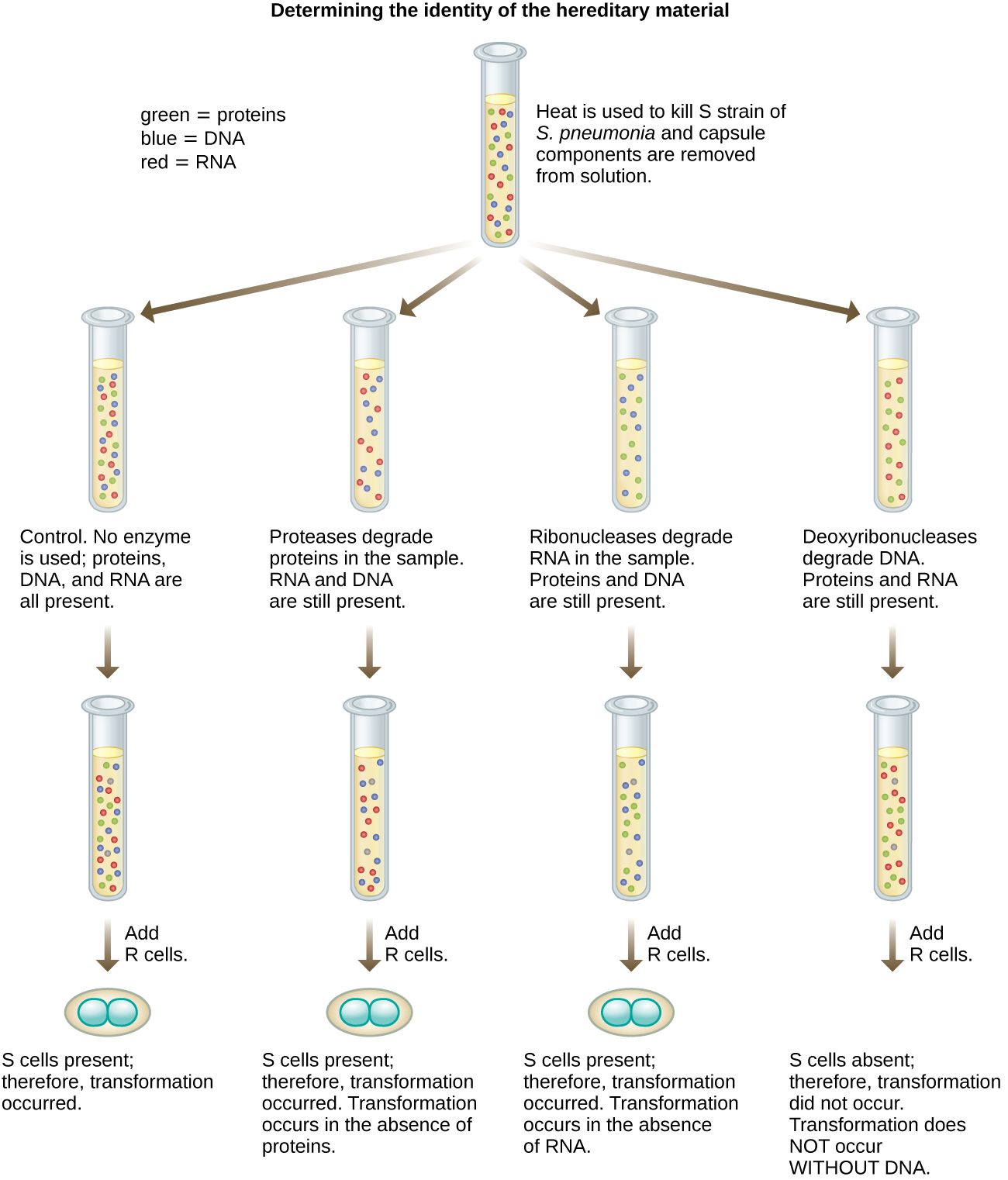
في عام 1944، كان أوزوالد أفيري وكولين ماكلويد وماكلين مكارتي مهتمين باستكشاف مبدأ التحول لغريفيث بشكل أكبر. قاموا بعزل سلالة S عن الفئران الميتة المصابة، وقتلوها بالحرارة، وتعطيل المكونات المختلفة لمستخلص S، وإجراء دراسة منهجية للتخلص منها (الشكل\(\PageIndex{7}\)). استخدموا الإنزيمات التي أدت على وجه التحديد إلى تدهور البروتينات والحمض النووي الريبي والحمض النووي ومزج مستخلص S مع كل من هذه الإنزيمات الفردية. ثم قاموا باختبار القدرة الناتجة لكل مزيج من المستخلص/الإنزيم على تحويل سلالة R، كما لوحظ من خلال النمو المنتشر لسلالة S في وسائط الاستزراع وتأكد ذلك بصريًا من خلال النمو على الصفائح. ووجدوا أنه عندما يتحلل الحمض النووي، لم يعد الخليط الناتج قادرًا على تحويل بكتيريا سلالة R، في حين لم يكن هناك علاج إنزيمي آخر قادر على منع التحول. قادهم هذا إلى استنتاج أن الحمض النووي هو مبدأ التحويل. على الرغم من نتائجهم، لم يقبل العديد من العلماء استنتاجهم، وبدلاً من ذلك اعتقدوا أن هناك ملوثات بروتينية داخل خلاصاتهم.
التمارين\(\PageIndex{3}\)
كيف أظهرت تجارب أفيري وماكلويد ومكارتي أن الحمض النووي هو مبدأ التحويل الذي وصفه جريفيث لأول مرة؟
دليل هيرشي وتشيس على الحمض النووي كمادة وراثية
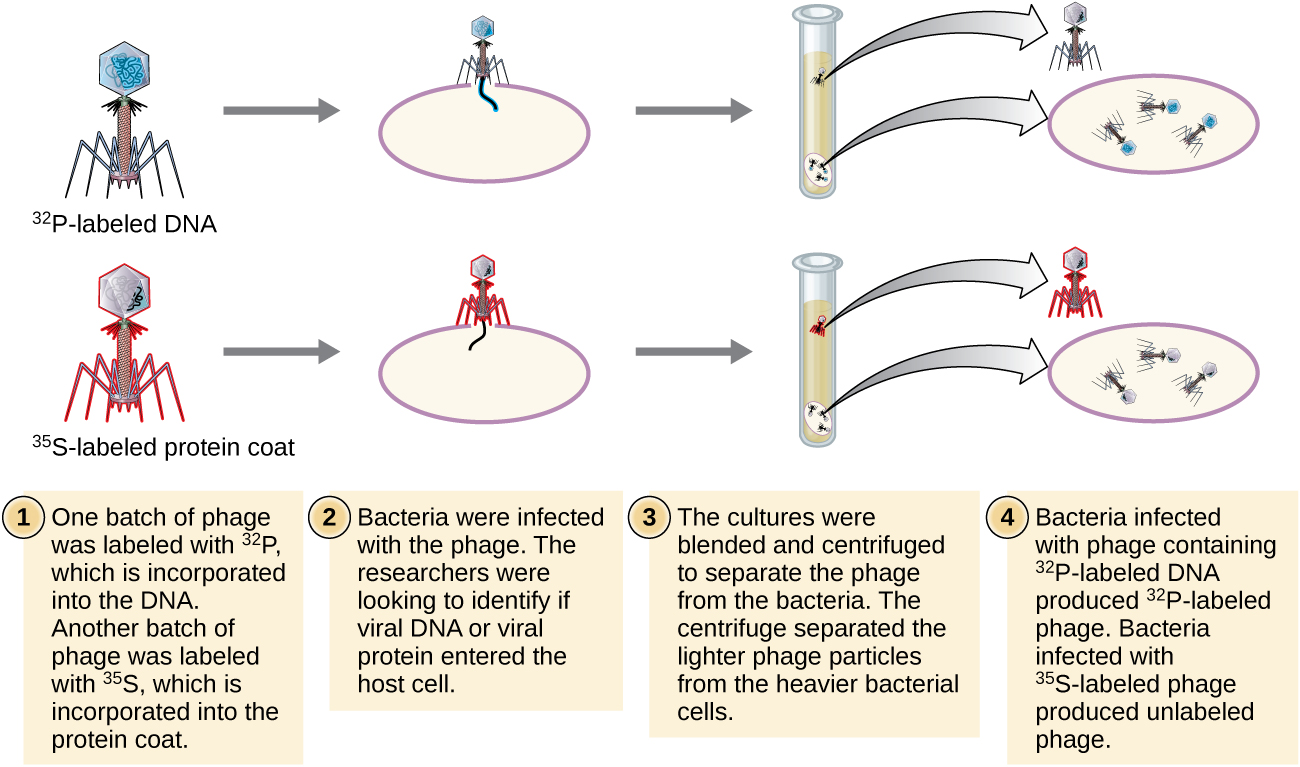
أجرى ألفريد هيرشي ومارثا تشيس تجاربهما الخاصة في عام 1952 وتمكنا من تقديم أدلة تأكيدية على أن الحمض النووي، وليس البروتين، هو المادة الوراثية (الشكل\(\PageIndex{8}\)). 4 كان هيرشي وتشيس يدرسان البكتيريا، وهو فيروس يصيب البكتيريا. عادةً ما تحتوي الفيروسات على بنية بسيطة: طبقة بروتينية تسمى القفيصة، ونواة الحمض النووي التي تحتوي على المادة الوراثية، إما DNA أو RNA (انظر الفيروسات). كانت المرحلة البكتيرية الخاصة التي كانوا يدرسونها هي البكتيريا T2، التي تصيب خلايا E. coli. كما نعلم الآن، يتصل T2 بسطح الخلية البكتيرية ثم يحقن الأحماض النووية داخل الخلية. يقوم الحمض النووي للعاثية بعمل نسخ متعددة من نفسه باستخدام الآلة المضيفة، وفي النهاية تنفجر الخلية المضيفة، مما يؤدي إلى إطلاق عدد كبير من البكتيريا.
قام هيرشي وتشيس بتسمية طبقة البروتين في دفعة واحدة من العاثية باستخدام الكبريت المشع، 35 S، لأن الكبريت موجود في الأحماض الأمينية الميثيونين والسيستين ولكن ليس في الأحماض النووية. قاموا بتسمية الحمض النووي في دفعة أخرى باستخدام الفوسفور المشع، 32 P، لأن الفوسفور موجود في الحمض النووي والحمض النووي الريبي ولكن ليس عادةً في البروتين.
تم السماح لكل دفعة من العاهرات بإصابة الخلايا بشكل منفصل. بعد الإصابة، وضع هيرشي وتشيس كل معلق بكتيري عاجي في الخلاط، مما أدى إلى فصل طبقات العاثية عن الخلية المضيفة، وإزالة التعليق الناتج في جهاز طرد مركزي. استقرت الخلايا البكتيرية الثقيلة وشكلت حبيبة، بينما بقيت جزيئات العاثية الأخف في المادة الطافية. في الأنبوب الذي يحمل علامة البروتين، بقي النشاط الإشعاعي فقط في المادة الطافية. في الأنبوب الذي يحمل اسم الحمض النووي، تم اكتشاف النشاط الإشعاعي فقط في الخلايا البكتيرية. استنتج هيرشي وتشيس أن الحمض النووي للعاثية الذي تم حقنه في الخلية هو الذي حمل المعلومات لإنتاج المزيد من جزيئات العاثية، مما يثبت أن الحمض النووي، وليس البروتينات، هو مصدر المادة الوراثية. نتيجة لعملهم، قبل المجتمع العلمي على نطاق واسع الحمض النووي باعتباره الجزيء المسؤول عن الوراثة.
في الوقت الذي نشر فيه هيرشي وتشيس تجربتهما في أوائل الخمسينيات من القرن الماضي، كان علماء الأحياء الدقيقة وغيرهم من العلماء يبحثون في الوراثة لأكثر من 80 عامًا. البناء على أبحاث بعضهم البعض خلال تلك الفترة بلغ ذروته في الاتفاق العام على أن الحمض النووي هو المادة الوراثية المسؤولة عن الوراثة (الشكل\(\PageIndex{9}\)). مهدت هذه المعرفة الطريق لعصر البيولوجيا الجزيئية القادم والتقدم الكبير في التكنولوجيا الحيوية وبيولوجيا الأنظمة التي نشهدها اليوم.
لمعرفة المزيد عن التجارب المتضمنة في تاريخ علم الوراثة واكتشاف الحمض النووي كمادة وراثية للخلايا، قم بزيارة هذا الموقع من مركز DNA Learning Center.
التمارين\(\PageIndex{4}\)
كيف استخدم هيرشي وتشيس الميكروبات لإثبات أن الحمض النووي مادة وراثية؟
المفاهيم الأساسية والملخص
- تم اكتشاف الحمض النووي وتمييزه قبل وقت طويل من فهم دوره في الوراثة. لعب علماء الأحياء الدقيقة أدوارًا مهمة في إثبات أن الحمض النووي هو المعلومات الوراثية الموجودة داخل الخلايا.
- في خمسينيات وستينات القرن التاسع عشر، قام جريجور مندل بتجربة بازلاء الحدائق التي يتم تربيتها بشكل حقيقي لإثبات وراثة سمات محددة يمكن ملاحظتها.
- في عام 1869، قام فريدريش ميشر بعزل وتطهير مركب غني بالفوسفور من نواة خلايا الدم البيضاء؛ وأطلق على المركب اسم النوكلين. اكتشف ريتشارد ألتمان، طالب ميشر، طبيعته الحمضية، وأعاد تسميته بالحمض النووي. وصف ألبرشت كوسيل قواعد النوكليوتيد الموجودة داخل الأحماض النووية.
- على الرغم من أن والتر ساتون وثيودور بوفيري اقترحا نظرية الكروموسومات في الميراث في عام 1902، إلا أنه لم يتم إثباتها علميًا حتى نشر أعمال توماس هانت مورغان وزملائه عام 1915.
- باستخدام أسيتابولاريا، وهي خلية طحالب كبيرة، كنظام نموذجي له، أظهر يواكيم هاميرلينغ في الثلاثينيات والأربعينيات أن النواة كانت موقع المعلومات الوراثية في هذه الخلايا.
- في الأربعينيات من القرن الماضي، استخدم جورج بيدل وإدوارد تاتوم قالب Neurospora crassa لإظهار أن إنتاج كل بروتين كان تحت سيطرة جين واحد، مما يدل على فرضية «جين واحد - إنزيم واحد».
- في عام 1928، أظهر فريدريك غريفيث أن البكتيريا المغلفة الميتة يمكنها نقل المعلومات الجينية إلى البكتيريا الحية غير المغلفة وتحويلها إلى سلالات ضارة. في عام 1944، حدد أوزوالد أفيري وكولين ماكليود وماكلين مكارتي المركب على أنه DNA.
- تم إثبات طبيعة الحمض النووي كجزيء يخزن المعلومات الجينية بشكل لا لبس فيه في تجربة ألفريد هيرشي ومارثا تشيس التي نُشرت في عام 1952. دخل الحمض النووي المسمى من الفيروسات البكتيرية وأصاب الخلايا البكتيرية، مما أدى إلى ظهور المزيد من الجسيمات الفيروسية. لم تشارك طبقات البروتين المصنفة في نقل المعلومات الجينية.
الحواشي
- 1 جي جي ميندل. «مقابل عائلة فلانزينهايبرد.» معرض العلوم الطبيعية في مدينة بروين بولاية بنسلفانيا أبهاندلونغن (41865): 3—7. (للترجمة الإنجليزية، انظر http://www.mendelweb.org/Mendel.plain.html)
- 2 جي دبليو بيدل، إي إل تاتوم. «التحكم الجيني للتفاعلات البيوكيميائية في Neurospora.» وقائع الأكاديمية الوطنية للعلوم 27 رقم 11 (1941): 499-506.
- 3 إف جريفيث. «أهمية أنواع المكورات الرئوية». مجلة النظافة 27 رقم 2 (1928): 8-159.
- 4 أ. د. هيرشي، السيد تشيس. «الوظائف المستقلة للبروتين الفيروسي والحمض النووي في نمو البكتيريا». مجلة علم وظائف الأعضاء العامة 36 رقم 1 (1952): 39-56.


