35.2: كيف تتواصل الخلايا العصبية
- Page ID
- 196417
المهارات اللازمة للتطوير
- وصف أساس إمكانات غشاء الراحة
- شرح مراحل إمكانات الإجراء وكيفية نشر إمكانات العمل
- شرح أوجه التشابه والاختلاف بين نقاط الاشتباك العصبي الكيميائية والكهربائية
- وصف التقوية طويلة المدى والاكتئاب طويل الأمد
تتطلب جميع الوظائف التي يؤديها الجهاز العصبي - من رد الفعل الحركي البسيط إلى الوظائف الأكثر تقدمًا مثل صنع الذاكرة أو اتخاذ القرار - الخلايا العصبية للتواصل مع بعضها البعض. بينما يستخدم البشر الكلمات ولغة الجسد للتواصل، تستخدم الخلايا العصبية الإشارات الكهربائية والكيميائية. تمامًا مثل أي شخص في اللجنة، عادةً ما تتلقى إحدى الخلايا العصبية وتجمع الرسائل من عدة خلايا عصبية أخرى قبل «اتخاذ القرار» لإرسال الرسالة إلى الخلايا العصبية الأخرى.
انتقال النبض العصبي داخل الخلايا العصبية
لكي يعمل الجهاز العصبي، يجب أن تكون الخلايا العصبية قادرة على إرسال الإشارات واستقبالها. هذه الإشارات ممكنة لأن كل خلية عصبية تحتوي على غشاء خلوي مشحون (فرق الجهد بين الداخل والخارج)، ويمكن أن تتغير شحنة هذا الغشاء استجابة لجزيئات الناقل العصبي المنبعثة من الخلايا العصبية الأخرى والمحفزات البيئية. لفهم كيفية تواصل الخلايا العصبية، يجب على المرء أولاً أن يفهم أساس خط الأساس أو شحنة الغشاء «المستريح».
الأغشية العصبية المشحونة
الغشاء الدهني ثنائي الطبقة الذي يحيط بالخلايا العصبية غير منفذ للجزيئات أو الأيونات المشحونة. لدخول العصبون أو الخروج منه، يجب أن تمر الأيونات عبر بروتينات خاصة تسمى القنوات الأيونية التي تمتد عبر الغشاء. تحتوي القنوات الأيونية على تكوينات مختلفة: مفتوحة ومغلقة وغير نشطة، كما هو موضح في الشكل\(\PageIndex{1}\). يجب تنشيط بعض القنوات الأيونية من أجل فتح الأيونات والسماح لها بالمرور داخل الخلية أو خارجها. هذه القنوات الأيونية حساسة للبيئة ويمكنها تغيير شكلها وفقًا لذلك. تسمى القنوات الأيونية التي تغير هيكلها استجابة لتغيرات الجهد بالقنوات الأيونية ذات الجهد. تنظم القنوات الأيونية ذات الجهد التركيزات النسبية للأيونات المختلفة داخل وخارج الخلية. يُطلق على الفرق في إجمالي الشحنة بين داخل وخارج الخلية اسم إمكانات الغشاء.
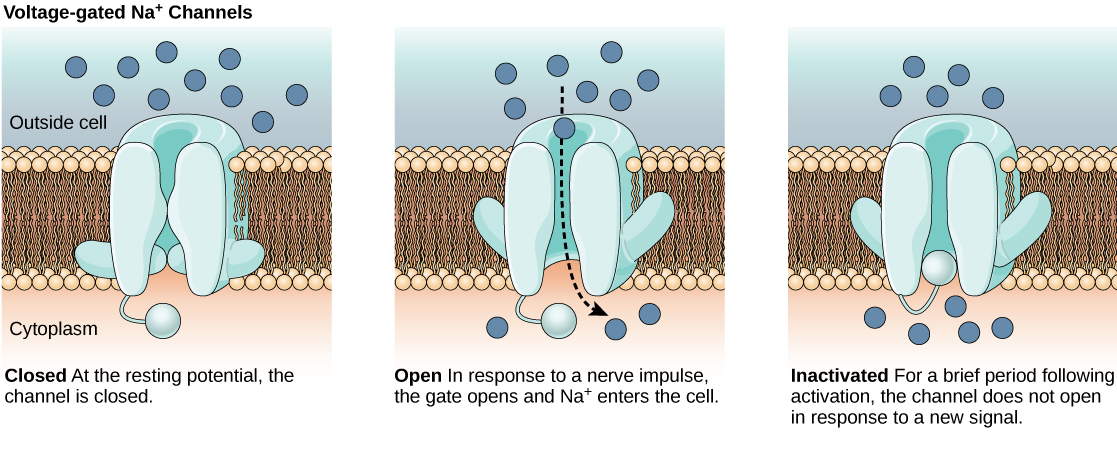
رابط إلى التعلم
يناقش هذا الفيديو أساس إمكانات غشاء الراحة.
إمكانات غشاء الراحة
تكون الخلية العصبية أثناء الراحة سالبة الشحنة: يزيد سالب الخلية من الداخل بمقدار 70 مليفولت تقريبًا عن الخارج (−70 mV، لاحظ أن هذا الرقم يختلف باختلاف نوع الخلايا العصبية والأنواع). ويُطلق على هذا الجهد جهد غشاء الراحة؛ وهو ناتج عن الاختلافات في تركيزات الأيونات داخل وخارج الخلية. إذا كان الغشاء متساويًا في النفاذية لجميع الأيونات، فسوف يتدفق كل نوع من الأيونات عبر الغشاء وسيصل النظام إلى التوازن. نظرًا لأن الأيونات لا يمكنها ببساطة عبور الغشاء حسب الرغبة، فهناك تركيزات مختلفة للعديد من الأيونات داخل الخلية وخارجها، كما هو موضح في الجدول أدناه. يهيمن الفرق في عدد أيونات البوتاسيوم المشحونة إيجابًا (K +) داخل وخارج الخلية على إمكانات الغشاء الباقي (الشكل\(\PageIndex{2}\)). عندما يكون الغشاء في حالة راحة، تتراكم أيونات K + داخل الخلية بسبب الحركة الصافية مع تدرج التركيز. يتم إنشاء إمكانات غشاء الراحة السلبية والحفاظ عليها عن طريق زيادة تركيز الكاتيونات خارج الخلية (في السائل خارج الخلية) بالنسبة إلى داخل الخلية (في السيتوبلازم). يتم إنشاء الشحنة السالبة داخل الخلية من خلال كون غشاء الخلية أكثر نفاذية لحركة أيون البوتاسيوم من حركة أيون الصوديوم. في الخلايا العصبية، يتم الاحتفاظ بأيونات البوتاسيوم بتركيزات عالية داخل الخلية بينما يتم الحفاظ على أيونات الصوديوم بتركيزات عالية خارج الخلية. تمتلك الخلية قنوات تسرب البوتاسيوم والصوديوم التي تسمح للكاتيونين بالانتشار في تدرج تركيزهم. ومع ذلك، تحتوي الخلايا العصبية على قنوات تسرب البوتاسيوم أكثر بكثير من قنوات تسرب الصوديوم. لذلك، ينتشر البوتاسيوم خارج الخلية بمعدل أسرع بكثير من تسرب الصوديوم إليها. نظرًا لأن عدد الكاتيونات التي تغادر الخلية أكثر من تلك التي تدخل، فإن هذا يؤدي إلى شحن الجزء الداخلي من الخلية بشكل سلبي بالنسبة إلى خارج الخلية. تساعد إجراءات مضخة الصوديوم والبوتاسيوم في الحفاظ على إمكانات الراحة بمجرد إنشائها. تذكر أن مضخات الصوديوم والبوتاسيوم تجلب اثنين من أيونات K + إلى الخلية مع إزالة ثلاثة أيونات Na + لكل ATP يتم استهلاكه. مع طرد الكاتيونات من الخلية أكثر من تلك التي يتم أخذها، يظل الجزء الداخلي من الخلية مشحونًا سلبًا بالنسبة إلى السائل خارج الخلية. تجدر الإشارة إلى أن أيونات الكالسيوم (Cl -) تميل إلى التراكم خارج الخلية لأنها تصدها بروتينات سالبة الشحنة داخل السيتوبلازم.
| أيون | تركيز خارج الخلية (مم) | تركيز داخل الخلايا (مم) | نسبة الخارج/الداخل |
|---|---|---|---|
| نا + | 145 | 12 | 12 |
| ك + | 4 | 155 | 0.026 |
| كلور - | 120 | 4 | 30 |
| الأنيونات العضوية (A−) | — | 100 |
إمكانية العمل
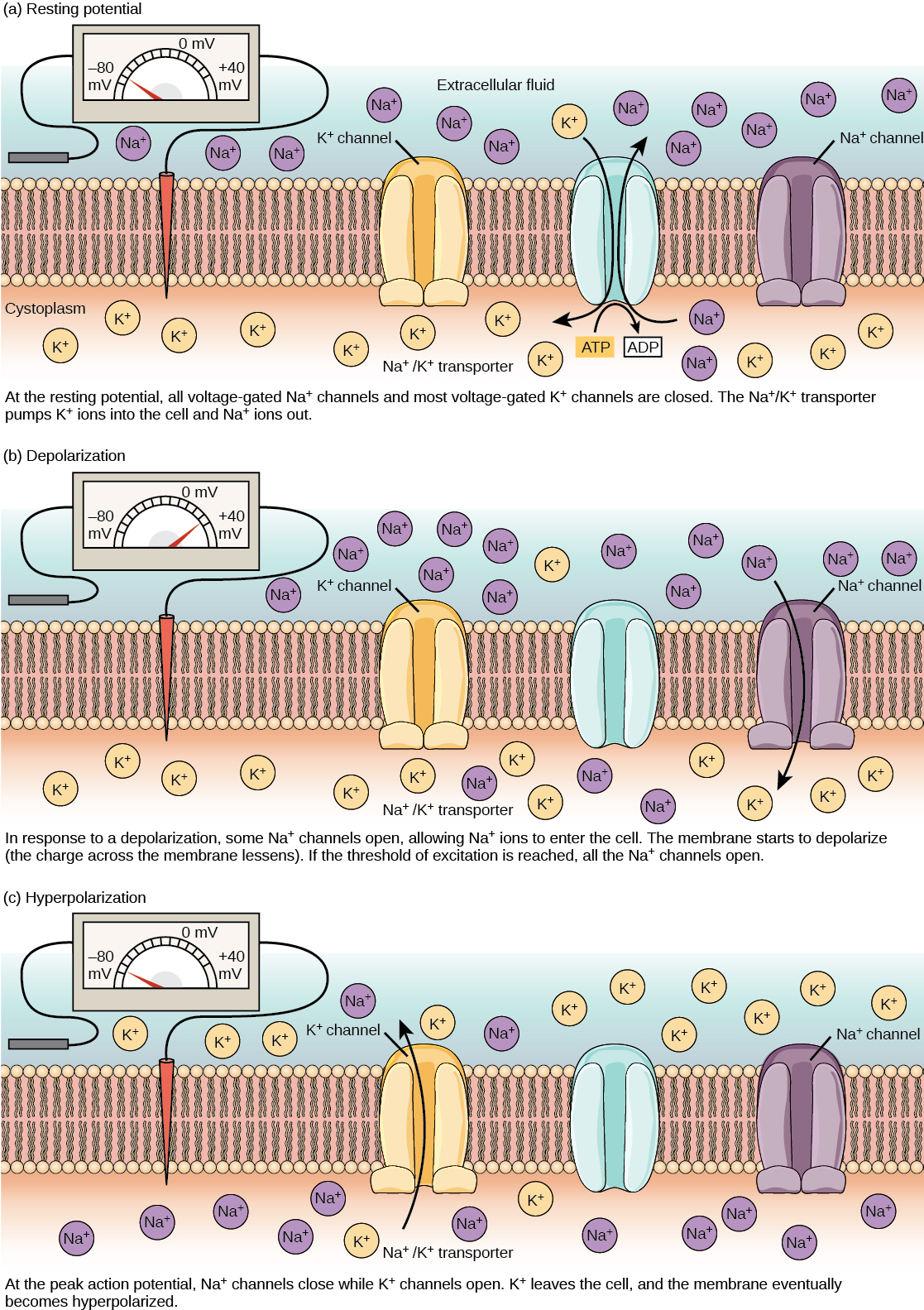
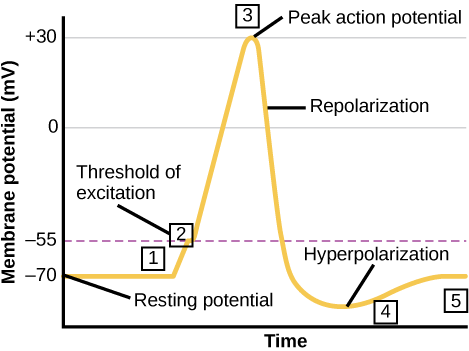
يمكن للخلايا العصبية أن تستقبل المدخلات من الخلايا العصبية الأخرى، وإذا كانت هذه المدخلات قوية بما يكفي، فترسل الإشارة إلى الخلايا العصبية السفلية. يتم نقل الإشارة بين الخلايا العصبية بشكل عام بواسطة مادة كيميائية تسمى الناقل العصبي. يتم نقل الإشارة داخل الخلايا العصبية (من التغصن إلى طرف المحور) عن طريق انعكاس قصير لإمكانات الغشاء النائم يسمى جهد الفعل. عندما ترتبط جزيئات الناقل العصبي بالمستقبلات الموجودة على تشعبات الخلايا العصبية، تفتح القنوات الأيونية. في نقاط الاشتباك العصبي المثيرة، تسمح هذه الفتحة للأيونات الموجبة بالدخول إلى الخلايا العصبية وتؤدي إلى إزالة الاستقطاب من الغشاء - انخفاض في الفرق في الجهد بين داخل وخارج الخلية العصبية. يعمل التحفيز من خلية حسية أو خلية عصبية أخرى على إزالة الاستقطاب من الخلية العصبية المستهدفة إلى إمكاناتها القصوى (-55 mV). يتم فتح قنوات Na + في تلة المحور، مما يسمح للأيونات الموجبة بدخول الخلية (الشكل\(\PageIndex{3}\) والشكل\(\PageIndex{4}\)). بمجرد فتح قنوات الصوديوم، تتحلل الخلايا العصبية تمامًا إلى إمكانات غشائية تبلغ حوالي +40 mV. تعتبر إمكانات العمل حدثًا «الكل أو لا شيء»، حيث أنه بمجرد الوصول إلى الحد الأقصى المحتمل، تختفي الخلايا العصبية دائمًا من الاستقطاب تمامًا. بمجرد اكتمال إزالة الاستقطاب، يجب على الخلية الآن «إعادة ضبط» جهد الغشاء مرة أخرى إلى إمكانات الراحة. ولتحقيق ذلك، يتم إغلاق قنوات Na + ولا يمكن فتحها. يبدأ هذا فترة مقاومة الخلايا العصبية، حيث لا يمكنها إنتاج إمكانات عمل أخرى لأن قنوات الصوديوم الخاصة بها لن تفتح. في الوقت نفسه، يتم فتح قنوات K + ذات الجهد الكهربائي، مما يسمح لـ K + بمغادرة الخلية. عندما تغادر أيونات K + الخلية، تصبح إمكانات الغشاء سالبة مرة أخرى. يؤدي انتشار K + خارج الخلية في الواقع إلى زيادة الاستقطاب في الخلية، حيث تصبح إمكانات الغشاء أكثر سلبية من إمكانات الراحة الطبيعية للخلية. عند هذه النقطة، ستعود قنوات الصوديوم إلى حالة الراحة، مما يعني أنها جاهزة للفتح مرة أخرى إذا تجاوزت إمكانات الغشاء مرة أخرى الحد الأقصى المحتمل. في نهاية المطاف تنتشر أيونات K + الإضافية خارج الخلية عبر قنوات تسرب البوتاسيوم، مما يعيد الخلية من حالة الاستقطاب المفرط، إلى قدرتها الغشائية على الراحة.
آرت كونيكشن
حاصرات قنوات البوتاسيوم، مثل الأميودارون والبروكاييناميد، والتي تستخدم لعلاج النشاط الكهربائي غير الطبيعي في القلب، والذي يسمى اضطراب ضربات القلب، تعيق حركة K + من خلال قنوات K + ذات الجهد. أي جزء من إمكانات الحركة تتوقع أن تؤثر عليه قنوات البوتاسيوم؟
رابط إلى التعلم
يقدم هذا الفيديو نظرة عامة على إمكانات العمل.
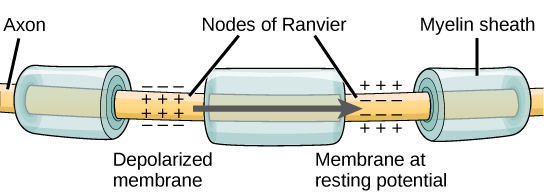
الميالين وانتشار إمكانات العمل
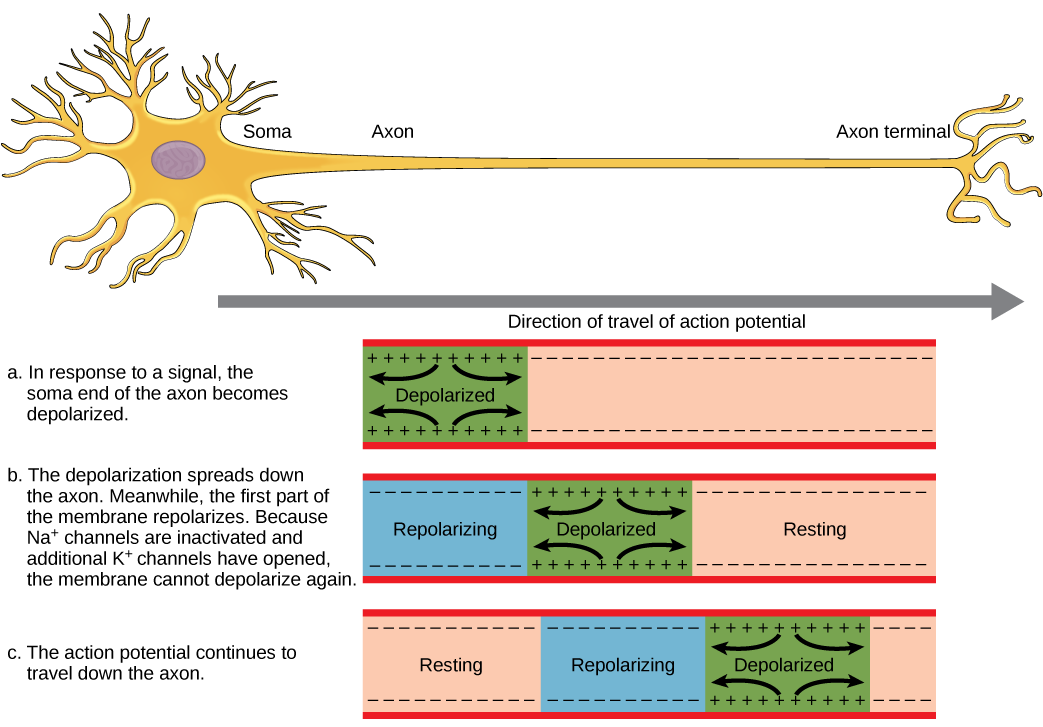
للحصول على إمكانية نقل المعلومات إلى خلية عصبية أخرى، يجب أن تنتقل على طول المحور العصبي وتصل إلى أطراف المحور العصبي حيث يمكنها بدء إطلاق الناقل العصبي. تتأثر سرعة توصيل جهد الحركة على طول المحور العصبي بكل من قطر المحور ومقاومة المحور العصبي لتسرب التيار. يعمل الميالين كعازل يمنع التيار من الخروج من المحور؛ وهذا يزيد من سرعة التوصيل المحتمل للحركة. في الأمراض المزيلة للميالين مثل التصلب المتعدد، يتباطأ التوصيل المحتمل للحركة بسبب تسرب التيار من مناطق المحاور العصبية المعزولة سابقًا. عُقد رانفير، الموضحة في الشكل،\(\PageIndex{5}\) عبارة عن فجوات في غلاف الميالين على طول المحور. يبلغ طول هذه المساحات غير المليئة بالميالين حوالي ميكرومتر واحد وتحتوي على قنوات Na + و K + ذات بوابات الجهد. يؤدي تدفق الأيونات عبر هذه القنوات، وخاصة قنوات Na +، إلى تجديد إمكانات الحركة مرارًا وتكرارًا على طول المحور. هذا «القفز» لإمكانات الحركة من عقدة إلى أخرى يسمى التوصيل الملحي. إذا لم تكن عقد Ranvier موجودة على طول محور عصبي، فسوف تنتشر إمكانات الحركة ببطء شديد نظرًا لأن قنوات Na + و K + ستضطر إلى تجديد إمكانات الحركة باستمرار في كل نقطة على طول المحور بدلاً من نقاط محددة. توفر عُقد Ranvier أيضًا الطاقة للخلايا العصبية نظرًا لأن القنوات تحتاج فقط إلى التواجد في العقد وليس على طول المحور الرئيسي بأكمله.
انتقال متشابك
المشبك أو «الفجوة» هو المكان الذي تنتقل فيه المعلومات من خلية عصبية إلى أخرى. عادة ما تتشكل نقاط الاشتباك العصبي بين أطراف المحاور والأشواك الجذعية، ولكن هذا ليس صحيحًا عالميًا. هناك أيضًا مشابك عصبية إلى محور عصبي، وتشنج إلى تشوندريت، ومشابك عصبية في الجسم من محور إلى خلية. يُطلق على العصبون الذي يرسل الإشارة اسم الخلايا العصبية ما قبل المشبكية، وتسمى الخلية العصبية التي تستقبل الإشارة بالخلايا العصبية ما بعد التشابك. لاحظ أن هذه التسميات مرتبطة بمشبك معين - فمعظم الخلايا العصبية تكون في مرحلة ما قبل التشابك وما بعد التشابك. هناك نوعان من نقاط الاشتباك العصبي: الكيميائية والكهربائية.
تشابك كيميائي
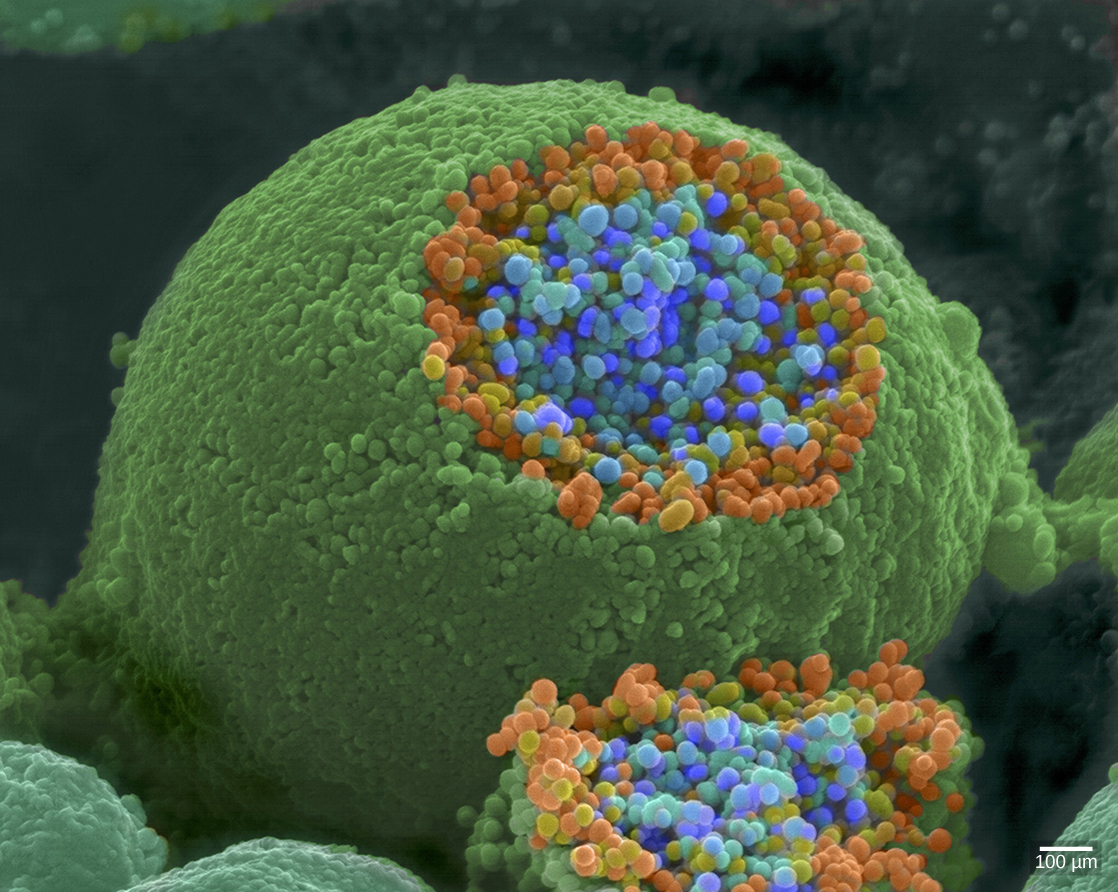
عندما تصل إمكانات الحركة إلى طرف المحور، فإنها تزيل الاستقطاب عن الغشاء وتفتح قنوات Na + ذات الجهد. تدخل أيونات Na + الخلية، مما يزيد من إزالة استقطاب الغشاء قبل التشابك. يؤدي إلغاء الاستقطاب هذا إلى فتح قنوات Ca 2+ ذات الجهد. تبدأ أيونات الكالسيوم التي تدخل الخلية في سلسلة إشارات تؤدي إلى اندماج حويصلات صغيرة مرتبطة بالغشاء، تسمى الحويصلات المشبكية، تحتوي على جزيئات الناقل العصبي مع الغشاء ما قبل المشبكي. تظهر الحويصلات المشبكية في الشكل\(\PageIndex{6}\)، وهي صورة من مجهر المسح الإلكتروني.
يؤدي اندماج الحويصلة مع غشاء ما قبل المشبك إلى إطلاق ناقل عصبي في الشق المشبكي، وهو الفضاء خارج الخلية بين الأغشية قبل المشبكية وما بعد التشابك، كما هو موضح في الشكل\(\PageIndex{7}\). ينتشر الناقل العصبي عبر الشق المشبكي ويرتبط ببروتينات المستقبل على غشاء ما بعد التشابك.
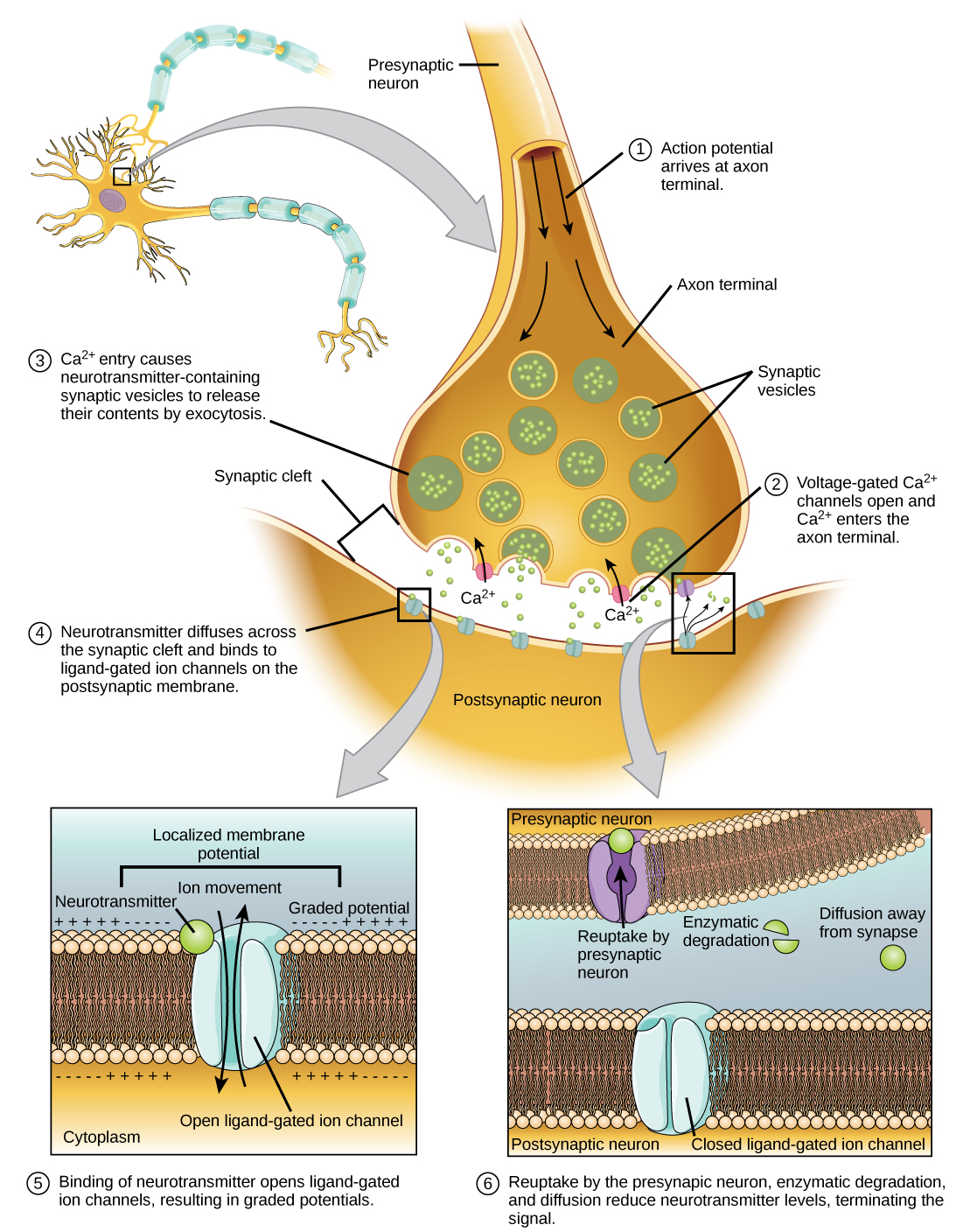
يؤدي ربط ناقل عصبي معين إلى فتح قنوات أيونية معينة، في هذه الحالة قنوات مربوطة، على غشاء ما بعد التشابك. يمكن أن يكون للناقلات العصبية تأثيرات مثيرة أو مثبطة على غشاء ما بعد التشابك، كما هو مفصل في الجدول أدناه. على سبيل المثال، عندما يتم إطلاق الأسيتيل كولين في المشبك بين العصب والعضلة (يسمى التقاطع العصبي العضلي) بواسطة خلية عصبية ما قبل المشبكية، فإنه يتسبب في فتح قنوات Na + بعد التشابك. يدخل Na + إلى خلية ما بعد التشابك ويتسبب في إزالة الاستقطاب في غشاء ما بعد التشابك. يُطلق على عملية إزالة الاستقطاب هذه اسم إمكانات ما بعد التشابك المثيرة (EPSP) وتجعل الخلايا العصبية بعد التشابك أكثر عرضة لإطلاق إمكانات الفعل. يؤدي إطلاق الناقل العصبي عند المشابك المثبطة إلى إمكانات ما بعد التشابك المثبطة (IPSPs)، وهي فرط استقطاب الغشاء قبل التشابك. على سبيل المثال، عندما يتم إطلاق الناقل العصبي GABA (حمض غاما-أمينوبوتيريك) من خلية عصبية ما قبل المشبكية، فإنه يرتبط بقنوات Cl ويفتحها. تدخل أيونات Cl إلى الخلية وتؤدي إلى فرط استقطاب الغشاء، مما يجعل الخلايا العصبية أقل عرضة لإطلاق إمكانات العمل.
بمجرد حدوث النقل العصبي، يجب إزالة الناقل العصبي من الشق المشبكي حتى يتمكن غشاء ما بعد التشابك من «إعادة ضبط» ويكون جاهزًا لاستقبال إشارة أخرى. يمكن تحقيق ذلك بثلاث طرق: يمكن للناقل العصبي أن ينتشر بعيدًا عن الشق المشبكي، ويمكن أن يتحلل بسبب الإنزيمات الموجودة في الشق المشبكي، أو يمكن إعادة تدويره (يسمى أحيانًا إعادة الامتصاص) بواسطة الخلايا العصبية قبل المشبكية. تعمل العديد من الأدوية في هذه الخطوة من النقل العصبي. على سبيل المثال، تعمل بعض الأدوية التي تُعطى لمرضى الزهايمر عن طريق تثبيط أستيل كولينستريز، وهو الإنزيم الذي يحلل الأسيتيل كولين. هذا التثبيط للإنزيم يزيد بشكل أساسي من الانتقال العصبي عند نقاط الاشتباك العصبي التي تطلق الأسيتيل كولين. بمجرد إطلاقه، يبقى الأسيتيل كولين في الشق ويمكنه الارتباط وفك الارتباط باستمرار بمستقبلات ما بعد التشابك.
| ناقل عصبي | مثال | الموقع |
|---|---|---|
| أستيل كولين | — | CNS و/أو PNS |
| أمين حيوي | الدوبامين والسيروتونين والنورادرينالين | CNS و/أو PNS |
| حمض أميني | الجلايسين، الغلوتامات، الأسبارتات، حمض جاما أمينوبوتيريك | CNS |
| نيوروببتيد | مادة P، الإندورفين | CNS و/أو PNS |
تشابك كهربائي
في حين أن المشابك الكهربائية أقل عددًا من المشابك الكيميائية، إلا أنها توجد في جميع الأجهزة العصبية وتلعب أدوارًا مهمة وفريدة من نوعها. تختلف طريقة النقل العصبي في المشابك الكهربائية تمامًا عن تلك الموجودة في المشابك الكيميائية. في المشبك الكهربائي، تكون الأغشية ما قبل المشبكية وما بعد التشابك قريبة جدًا من بعضها البعض وترتبط فعليًا ببروتينات القناة التي تشكل تقاطعات الفجوة. تسمح تقاطعات الفجوة للتيار بالمرور مباشرة من خلية إلى أخرى. بالإضافة إلى الأيونات التي تحمل هذا التيار، يمكن لجزيئات أخرى، مثل ATP، أن تنتشر عبر مسام الوصلة ذات الفجوة الكبيرة.
هناك اختلافات رئيسية بين نقاط الاشتباك العصبي الكيميائية والكهربائية. نظرًا لأن المشابك الكيميائية تعتمد على إطلاق جزيئات الناقل العصبي من الحويصلات المشبكية لتمرير إشاراتها، فهناك تأخير قدره ميلي ثانية تقريبًا بين وقت وصول جهد المحور العصبي إلى الطرف قبل التشابك والوقت الذي يؤدي فيه الناقل العصبي إلى فتح قنوات أيونية ما بعد التشابك. . بالإضافة إلى ذلك، تكون هذه الإشارة أحادية الاتجاه. في المقابل، تكون الإشارات في المشابك الكهربائية فورية تقريبًا (وهو أمر مهم للمشابك العصبية المشاركة في ردود الفعل الرئيسية)، وبعض نقاط الاشتباك العصبي الكهربائية تكون ثنائية الاتجاه. تعتبر المشابك الكهربائية أيضًا أكثر موثوقية لأنها أقل عرضة للانسداد، كما أنها مهمة لمزامنة النشاط الكهربائي لمجموعة من الخلايا العصبية. على سبيل المثال، يُعتقد أن المشابك الكهربائية في المهاد تنظم النوم البطيء، ويمكن أن يتسبب اضطراب هذه المشابك في حدوث نوبات.
تلخيص الإشارة
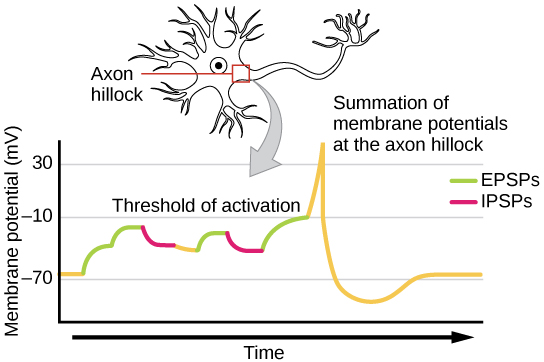
في بعض الأحيان يكون EPSP واحدًا قويًا بما يكفي لتحفيز إمكانات العمل في الخلايا العصبية ما بعد التشابك، ولكن في كثير من الأحيان يجب أن تخلق مدخلات ما قبل التشابك المتعددة EPSPs في نفس الوقت تقريبًا حتى يتم إزالة الاستقطاب من الخلايا العصبية بعد التشابك بشكل كافٍ لإطلاق إمكانات الفعل. هذه العملية تسمى التلخيص وتحدث عند تلة المحور، كما هو موضح في الشكل\(\PageIndex{8}\). بالإضافة إلى ذلك، غالبًا ما تحتوي إحدى الخلايا العصبية على مدخلات من العديد من الخلايا العصبية قبل المشبكية - بعضها مثير وبعضها مثبط - لذلك يمكن لـ IPSPs إلغاء EPSPs والعكس صحيح. إن التغيير الصافي في جهد الغشاء بعد التشابك هو الذي يحدد ما إذا كانت خلية ما بعد التشابك قد وصلت إلى عتبة الإثارة اللازمة لإطلاق إمكانات الحركة. يعمل الجمع المشبكي وعتبة الإثارة معًا كمرشح بحيث لا يتم نقل «الضوضاء» العشوائية في النظام كمعلومات مهمة.
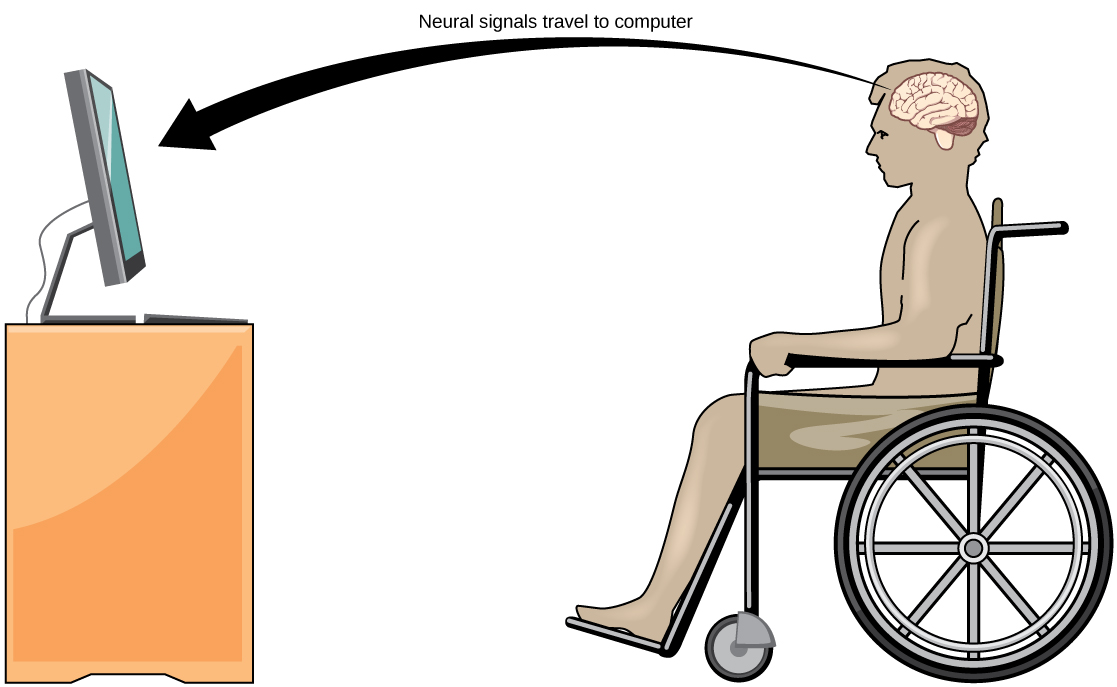
الاتصال اليومي: واجهة الدماغ والحاسوب
التصلب الجانبي الضموري (ALS، المعروف أيضًا باسم مرض Lou Gehrig) هو مرض عصبي يتميز بانحطاط الخلايا العصبية الحركية التي تتحكم في الحركات الإرادية. يبدأ المرض بضعف العضلات ونقص التنسيق ويدمر في النهاية الخلايا العصبية التي تتحكم في الكلام والتنفس والبلع؛ في النهاية، يمكن أن يؤدي المرض إلى الشلل. في هذه المرحلة، يحتاج المرضى إلى المساعدة من الآلات ليتمكنوا من التنفس والتواصل. تم تطوير العديد من التقنيات الخاصة للسماح للمرضى «المحبوسين» بالتواصل مع بقية العالم. تسمح إحدى التقنيات، على سبيل المثال، للمرضى بكتابة الجمل عن طريق ارتعاش خدهم. يمكن بعد ذلك قراءة هذه الجمل بصوت عالٍ بواسطة الكمبيوتر.
هناك خط بحث جديد نسبيًا لمساعدة المرضى المصابين بالشلل، بما في ذلك أولئك الذين يعانون من ALS، على التواصل والحفاظ على درجة من الاكتفاء الذاتي يسمى تقنية واجهة الدماغ والحاسوب (BCI) وهو موضح في الشكل\(\PageIndex{9}\). تبدو هذه التكنولوجيا وكأنها شيء من الخيال العلمي: فهي تسمح للمرضى المصابين بالشلل بالتحكم في الكمبيوتر باستخدام أفكارهم فقط. هناك عدة أشكال من BCI. تستخدم بعض النماذج تسجيلات EEG من أقطاب كهربائية مسجلة على الجمجمة. تحتوي هذه التسجيلات على معلومات من مجموعات كبيرة من الخلايا العصبية التي يمكن فك تشفيرها بواسطة الكمبيوتر. تتطلب الأشكال الأخرى من BCI زرع مجموعة من الأقطاب الكهربائية أصغر من طابع البريد في منطقة الذراع واليد في القشرة الحركية. هذا الشكل من BCI، على الرغم من أنه أكثر توغلاً، إلا أنه قوي جدًا حيث يمكن لكل قطب كهربائي تسجيل إمكانات العمل الفعلية من خلية عصبية واحدة أو أكثر. يتم بعد ذلك إرسال هذه الإشارات إلى جهاز كمبيوتر تم تدريبه على فك تشفير الإشارة وتغذيتها بأداة - مثل المؤشر على شاشة الكمبيوتر. هذا يعني أن المريض المصاب بمرض التصلب الجانبي الضموري يمكنه استخدام البريد الإلكتروني وقراءة الإنترنت والتواصل مع الآخرين من خلال التفكير في تحريك يده أو ذراعه (على الرغم من أن المريض المشلول لا يستطيع القيام بهذه الحركة الجسدية). وقد سمحت التطورات الأخيرة لمريضة مشلولة مقفلة أصيبت بسكتة دماغية قبل 15 عامًا بالتحكم في ذراع روبوتية وحتى بإطعام نفسها القهوة باستخدام تقنية BCI.
على الرغم من التطورات المذهلة في تقنية BCI، إلا أنها تعاني أيضًا من قيود. يمكن أن تتطلب هذه التقنية ساعات طويلة من التدريب وفترات طويلة من التركيز المكثف للمريض؛ يمكن أن تتطلب أيضًا جراحة الدماغ لزرع الأجهزة.
رابط إلى التعلم
شاهد هذا الفيديو الذي تستخدم فيه امرأة مشلولة ذراعًا روبوتيًا يتحكم فيه الدماغ لجلب مشروب إلى فمها، من بين صور أخرى لتقنية واجهة الدماغ والحاسوب أثناء العمل.
اللدونة المشبكية
نقاط الاشتباك العصبي ليست هياكل ثابتة. يمكن إضعافها أو تقويتها. يمكن كسرها، ويمكن صنع مشابك جديدة. تسمح اللدونة المشبكية بهذه التغييرات، وكلها ضرورية للجهاز العصبي الفعال. في الواقع، اللدونة المشبكية هي أساس التعلم والذاكرة. هناك عمليتان على وجه الخصوص، التقوية طويلة المدى (LTP) والاكتئاب طويل الأمد (LTD) هما شكلان مهمان من اللدونة المشبكية التي تحدث في نقاط الاشتباك العصبي في الحصين، وهي منطقة دماغية تشارك في تخزين الذكريات.
التقوية طويلة الأجل (LTP)
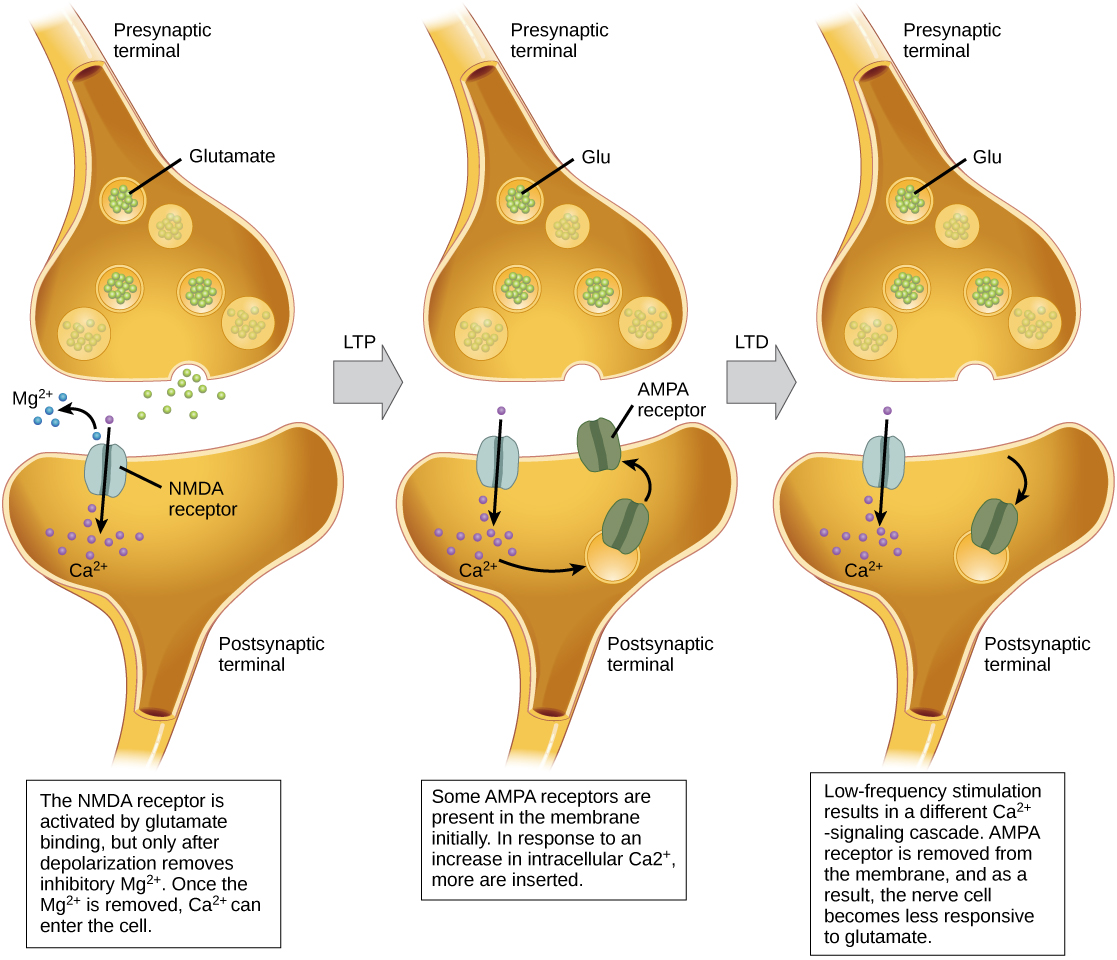
التقوية طويلة المدى (LTP) هي تقوية مستمرة للاتصال المشبكي. يعتمد LTP على مبدأ Hebbian: الخلايا التي تطلق معًا الأسلاك معًا. هناك العديد من الآليات، غير المفهومة تمامًا، وراء التقوية المشبكية التي تظهر مع LTP. تتضمن إحدى الآليات المعروفة نوعًا من مستقبلات الغلوتامات بعد التشابك، تسمى مستقبلات NMDA (N-methyl-D-aspartate)، كما هو موضح في الشكل\(\PageIndex{10}\). عادة ما يتم حظر هذه المستقبلات بواسطة أيونات المغنيسيوم؛ ومع ذلك، عندما يتم إزالة استقطاب الخلايا العصبية بعد التشابك بواسطة مدخلات مسبقة متعددة في تتابع سريع (إما من خلية عصبية واحدة أو خلايا عصبية متعددة)، يتم إجبار أيونات المغنيسيوم على الخروج مما يسمح لأيونات الكالسيوم بالمرور إلى خلية ما بعد التشابك. بعد ذلك، تبدأ أيونات Ca 2+ التي تدخل الخلية في سلسلة إشارات تؤدي إلى إدخال نوع مختلف من مستقبلات الغلوتامات، يسمى مستقبلات AMPA (ألفا أمينو-3-هيدروكسي-5-ميثيل-4-isoxazolepropionic acid)، في غشاء ما بعد التشابك، لأن مستقبلات AMPA النشطة تسمح للأيونات الموجبة بالدخول الخلية. لذلك، في المرة القادمة التي يتم فيها إطلاق الغلوتامات من الغشاء ما قبل المشبكي، سيكون له تأثير مثير أكبر (EPSP) على خلية ما بعد التشابك لأن ارتباط الغلوتامات بمستقبلات AMPA هذه سيسمح بدخول المزيد من الأيونات الإيجابية إلى الخلية. يؤدي إدخال مستقبلات AMPA الإضافية إلى تقوية التشابك العصبي ويعني أن الخلايا العصبية بعد التشابك أكثر عرضة لإطلاق النار استجابة لإطلاق الناقل العصبي قبل التشابك. تختار بعض عقاقير التعاطي مسار LTP، ويمكن أن يؤدي هذا التقوية المشبكية إلى الإدمان.
الاكتئاب طويل الأمد (LTD)
الاكتئاب طويل الأمد (LTD) هو في الأساس عكس LTP: إنه ضعف طويل الأمد للاتصال المشبكي. إحدى الآليات المعروفة بتسببها في LTD تتضمن أيضًا مستقبلات AMPA. في هذه الحالة، يبدأ الكالسيوم الذي يدخل من خلال مستقبلات NMDA سلسلة إشارات مختلفة، مما يؤدي إلى إزالة مستقبلات AMPA من غشاء ما بعد التشابك، كما هو موضح في الشكل\(\PageIndex{10}\). إن الانخفاض في مستقبلات AMPA في الغشاء يجعل الخلايا العصبية ما بعد التشابك أقل استجابة للجلوتامات المنبعثة من الخلايا العصبية ما قبل المشبكية. على الرغم من أن الأمر قد يبدو غير بديهي، إلا أن LTD قد يكون مهمًا للتعلم والذاكرة مثل LTP. يسمح ضعف وتشذيب نقاط الاشتباك العصبي غير المستخدمة بفقدان الاتصالات غير المهمة ويجعل نقاط الاشتباك العصبي التي خضعت لـ LTP أقوى بكثير بالمقارنة.
ملخص
تحتوي الخلايا العصبية على أغشية مشحونة بسبب وجود تركيزات مختلفة من الأيونات داخل وخارج الخلية. تتحكم القنوات الأيونية ذات الجهد في حركة الأيونات داخل وخارج الخلايا العصبية. عندما يتم إزالة الاستقطاب من الغشاء العصبي إلى عتبة الإثارة على الأقل، يتم إطلاق إمكانات الفعل. ثم يتم نشر إمكانات الفعل على طول محور عصبي ميالين إلى أطراف المحور. في التشابك الكيميائي، تتسبب إمكانات الفعل في إطلاق جزيئات الناقل العصبي في الشق المشبكي. من خلال الارتباط بمستقبلات ما بعد التشابك، يمكن للناقل العصبي أن يسبب إمكانات مثيرة أو تثبيطية بعد التشابك عن طريق إزالة الاستقطاب أو فرط الاستقطاب، على التوالي، غشاء ما بعد التشابك. في المشابك الكهربائية، يتم نقل إمكانات الفعل مباشرة إلى خلية ما بعد التشابك من خلال وصلات الفجوة - بروتينات القناة الكبيرة التي تربط الأغشية قبل وبعد التشابك. نقاط الاشتباك العصبي ليست هياكل ثابتة ويمكن تقويتها وإضعافها. هناك آليتان من آليات اللدونة المشبكية هما التقوية طويلة المدى والاكتئاب طويل الأمد.
اتصالات فنية
الشكل\(\PageIndex{3}\): حاصرات قنوات البوتاسيوم، مثل الأميودارون والبروكاييناميد، والتي تستخدم لعلاج النشاط الكهربائي غير الطبيعي في القلب، والذي يسمى اضطراب ضربات القلب، تعيق حركة K + من خلال قنوات K + ذات الجهد. أي جزء من إمكانات الحركة تتوقع أن تؤثر عليه قنوات البوتاسيوم؟
- إجابة
-
تعمل حاصرات قنوات البوتاسيوم على إبطاء مرحلة إعادة الاستقطاب، ولكن ليس لها أي تأثير على إزالة الاستقطاب.
مسرد المصطلحات
- إمكانية العمل
- التغيير اللحظي المنتشر ذاتيًا في الإمكانات الكهربائية لغشاء الخلايا العصبية (أو العضلات)
- إزالة الاستقطاب
- تغيير في إمكانات الغشاء إلى قيمة سلبية أقل
- إمكانات ما بعد التشابك المثيرة (EPSP)
- إزالة الاستقطاب لغشاء ما بعد التشابك الناجم عن جزيئات الناقل العصبي المنبعثة من خلية ما قبل المشبكية
- فرط الاستقطاب
- تغيير في إمكانات الغشاء إلى قيمة أكثر سلبية
- إمكانات ما بعد التشابك المثبطة (IPSP)
- فرط الاستقطاب لغشاء ما بعد التشابك الناجم عن جزيئات الناقل العصبي المنبعثة من خلية ما قبل المشبكية
- الاكتئاب طويل الأمد (LTD)
- انخفاض مطول في الاقتران المشبكي بين خلية ما قبل وما بعد التشابك
- التقوية طويلة الأجل (LTP)
- زيادة مطولة في الاقتران المشبكي بين خلية ما قبل وما بعد التشابك
- إمكانات الغشاء
- الفرق في الجهد الكهربائي بين داخل وخارج الخلية
- فترة المقاومة
- فترة ما بعد إمكانية الفعل عندما يكون من الصعب أو المستحيل إطلاق إمكانية حدوث فعل؛ بسبب تعطيل قنوات الصوديوم وتفعيل قنوات البوتاسيوم الإضافية للغشاء
- التوصيل الملحي
- «القفز» لإمكانات الحركة على طول محور عصبي من عقدة رانفير إلى الأخرى
- خلاصة
- عملية إدخال متعددة قبل التشابك تخلق EPSPs في نفس الوقت تقريبًا حتى يتم إزالة الاستقطاب من الخلايا العصبية بعد التشابك بشكل كافٍ لإطلاق إمكانات الفعل
- شق متشابك
- المسافة بين الأغشية ما قبل المشبكية وما بعد التشابك
- حويصلة متشابكة
- هيكل كروي يحتوي على ناقل عصبي
- عتبة الإثارة
- مستوى إزالة الاستقطاب المطلوب لعمل محتمل لإطلاق النار


