2.2: الماء
- Page ID
- 195984
المهارات اللازمة للتطوير
- وصف خصائص المياه التي تعتبر ضرورية للحفاظ على الحياة
- اشرح لماذا الماء مذيب ممتاز
- قدم أمثلة على خصائص الماء المتماسكة واللاصقة
- ناقش دور الأحماض والقواعد والعوازل في التوازن
لماذا يقضي العلماء وقتًا في البحث عن الماء على كواكب أخرى؟ ما سبب أهمية الماء؟ ذلك لأن الماء ضروري للحياة كما نعرفها. الماء هو أحد الجزيئات الأكثر وفرة والأكثر أهمية للحياة على الأرض. يتكون ما يقرب من 60-70 بالمائة من جسم الإنسان من الماء. بدونها، لن تكون الحياة كما نعرفها ببساطة موجودة.
إن قطبية جزيء الماء والترابط الهيدروجيني الناتج عنه تجعل الماء مادة فريدة ذات خصائص خاصة مرتبطة ارتباطًا وثيقًا بعمليات الحياة. تطورت الحياة في الأصل في بيئة مائية، وتحدث معظم الكيمياء الخلوية والتمثيل الغذائي للكائن الحي داخل المحتويات المائية للسيتوبلازم الخلوي. الخصائص الخاصة للمياه هي قدرتها الحرارية العالية وحرارة التبخير، وقدرتها على إذابة الجزيئات القطبية، وخصائصها المتماسكة واللاصقة، وتفككها إلى أيونات تؤدي إلى توليد درجة الحموضة. يساعد فهم خصائص المياه هذه على توضيح أهميتها في الحفاظ على الحياة.
قطبية الماء
من أهم خصائص الماء أنه يتكون من جزيئات قطبية: يشكل الهيدروجين والأكسجين داخل جزيئات الماء (H 2 O) روابط تساهمية قطبية. على الرغم من عدم وجود شحنة صافية لجزيء الماء، فإن قطبية الماء تخلق شحنة موجبة قليلاً على الهيدروجين وشحنة سالبة قليلاً على الأكسجين، مما يساهم في خصائص جاذبية الماء. تتولد شحنات الماء لأن الأكسجين أكثر سالبة للكهرباء من الهيدروجين، مما يزيد من احتمالية العثور على إلكترون مشترك بالقرب من نواة الأكسجين مقارنة بنواة الهيدروجين، مما يولد الشحنة السالبة الجزئية بالقرب من الأكسجين.
نتيجة قطبية الماء، يجذب كل جزيء مائي جزيئات الماء الأخرى بسبب الشحنات المعاكسة بين جزيئات الماء، مما يشكل روابط هيدروجينية. يجذب الماء أيضًا أو ينجذب إلى الجزيئات والأيونات القطبية الأخرى. يُشار إلى المادة القطبية التي تتفاعل بسهولة مع الماء أو تذوب فيه على أنها محبة للماء (hydro - = «الماء»؛ -philic = «المحبة»). في المقابل، لا تتفاعل الجزيئات غير القطبية مثل الزيوت والدهون بشكل جيد مع الماء، كما هو موضح في الشكل\(\PageIndex{1}\) وتنفصل عنه بدلاً من الذوبان فيه، كما نرى في ضمادات السلطة التي تحتوي على الزيت والخل (محلول مائي حمضي). تسمى هذه المركبات غير القطبية الكارهة للماء (المائية = «الماء»؛ -phobic = «الخوف»).

حالات الماء: الغاز والسائل والصلب
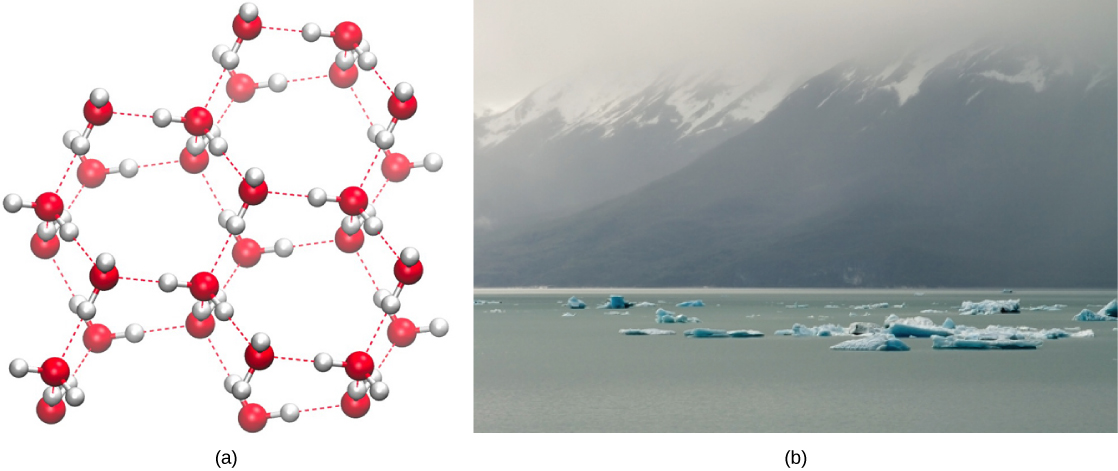
يعد تكوين الروابط الهيدروجينية جودة مهمة للمياه السائلة التي تعتبر ضرورية للحياة كما نعرفها. نظرًا لأن جزيئات الماء تصنع روابط هيدروجينية مع بعضها البعض، فإن الماء يكتسب بعض الخصائص الكيميائية الفريدة مقارنة بالسوائل الأخرى، وبما أن الكائنات الحية تحتوي على نسبة عالية من الماء، فإن فهم هذه الميزات الكيميائية هو المفتاح لفهم الحياة. في الماء السائل، تتشكل الروابط الهيدروجينية باستمرار وتتكسر عندما تنزلق جزيئات الماء عبر بعضها البعض. يحدث كسر هذه الروابط بسبب الحركة (الطاقة الحركية) لجزيئات الماء بسبب الحرارة الموجودة في النظام. عندما ترتفع الحرارة مع غليان الماء، تؤدي الطاقة الحركية العالية لجزيئات الماء إلى كسر الروابط الهيدروجينية تمامًا وتسمح لجزيئات الماء بالتسرب إلى الهواء كغاز (بخار أو بخار ماء). من ناحية أخرى، عندما تنخفض درجة حرارة الماء ويتجمد الماء، تشكل جزيئات الماء بنية بلورية تحافظ عليها الرابطة الهيدروجينية (لا توجد طاقة كافية لكسر الروابط الهيدروجينية) التي تجعل الثلج أقل كثافة من الماء السائل، وهي ظاهرة لا تظهر في تصلب الآخرين سوائل.
يرجع انخفاض كثافة الماء في شكله الصلب إلى الطريقة التي يتم بها توجيه الروابط الهيدروجينية أثناء تجمدها: يتم دفع جزيئات الماء بعيدًا عن بعضها البعض مقارنة بالماء السائل. في معظم السوائل الأخرى، يتضمن التصلب عند انخفاض درجة الحرارة خفض الطاقة الحركية بين الجزيئات، مما يسمح لها بالتغليف بشكل أكثر إحكامًا من الشكل السائل وإعطاء المادة الصلبة كثافة أكبر من السائل.
يؤدي انخفاض كثافة الثلج، الموضح والمصور في الشكل\(\PageIndex{2}\)، وهو شذوذ، إلى طوفه على سطح الماء السائل، كما هو الحال في جبل جليدي أو في مكعبات الثلج في كوب من الماء المثلج. في البحيرات والبرك، سيتشكل الجليد على سطح الماء مما يخلق حاجزًا عازلًا يحمي الحيوانات والحياة النباتية في البركة من التجمد. بدون هذه الطبقة من الثلج العازل، ستتجمد النباتات والحيوانات التي تعيش في البركة في الكتلة الصلبة من الجليد ولا يمكنها البقاء على قيد الحياة. يحدث التأثير الضار للتجميد على الكائنات الحية بسبب توسع الجليد بالنسبة للمياه السائلة. تؤدي بلورات الثلج التي تتشكل عند التجمد إلى تمزق الأغشية الرقيقة الضرورية لوظيفة الخلايا الحية، مما يؤدي إلى إتلافها بشكل لا رجعة فيه. يمكن للخلايا أن تنجو من التجمد فقط إذا تم استبدال الماء الموجود فيها مؤقتًا بسائل آخر مثل الجلسرين.
رابط إلى التعلم

فيديو: انقر هنا لمشاهدة رسم متحرك ثلاثي الأبعاد لهيكل شبكة جليدية. (مصدر الصورة: جين ويتني. تم إنشاء الصورة باستخدام برنامج Visual Molical Dynamics 2)
السعة الحرارية العالية للمياه
السعة الحرارية العالية للماء هي خاصية ناتجة عن ارتباط الهيدروجين بين جزيئات الماء. يتمتع الماء بأعلى سعة حرارية محددة مقارنة بأي سوائل. تُعرّف الحرارة النوعية بأنها كمية الحرارة التي يجب أن يمتصها أو يفقدها جرام واحد من المادة لتغيير درجة حرارته بدرجة مئوية واحدة. بالنسبة للمياه، هذه الكمية هي سعر حراري واحد. لذلك يستغرق الماء وقتًا طويلاً لتسخينه ووقتًا طويلاً حتى يبرد. في الواقع، تبلغ السعة الحرارية المحددة للمياه حوالي خمس مرات أكثر من تلك الموجودة في الرمل. هذا يفسر سبب تبريد الأرض بشكل أسرع من البحر. نظرًا لسعتها الحرارية العالية، تستخدم الحيوانات ذات الدم الدافئ الماء لتوزيع الحرارة بشكل متساوٍ في أجسامها: فهو يعمل بطريقة مماثلة لنظام تبريد السيارة، حيث ينقل الحرارة من الأماكن الدافئة إلى الأماكن الباردة، مما يجعل الجسم يحافظ على درجة حرارة أكثر توازنًا.
حرارة تبخير الماء
يحتوي الماء أيضًا على حرارة عالية من التبخر، وهي كمية الطاقة المطلوبة لتغيير جرام واحد من مادة سائلة إلى غاز. هناك حاجة إلى كمية كبيرة من الطاقة الحرارية (586 سعرة حرارية) لإنجاز هذا التغيير في الماء. تحدث هذه العملية على سطح الماء. مع ارتفاع درجة حرارة الماء السائل، يجعل الترابط الهيدروجيني من الصعب فصل جزيئات الماء السائل عن بعضها البعض، وهو أمر ضروري لدخول مرحلتها الغازية (البخار). ونتيجة لذلك، يعمل الماء كخافض للحرارة أو خزان للحرارة ويتطلب حرارة أكثر بكثير حتى يغلي مقارنة بسائل مثل الإيثانول (كحول الحبوب)، الذي يكون ارتباطه الهيدروجيني بجزيئات الإيثانول الأخرى أضعف من ارتباط الهيدروجين بالماء. في النهاية، عندما يصل الماء إلى نقطة الغليان البالغة 100 درجة مئوية (212 درجة فهرنهايت)، تكون الحرارة قادرة على كسر روابط الهيدروجين بين جزيئات الماء، وتسمح الطاقة الحركية (الحركة) بين جزيئات الماء لها بالهروب من السائل كغاز. حتى عندما تكون أقل من نقطة الغليان، تكتسب جزيئات الماء الفردية طاقة كافية من جزيئات الماء الأخرى بحيث يمكن لبعض جزيئات المياه السطحية الهروب والتبخر: تُعرف هذه العملية باسم التبخر.
إن حقيقة الحاجة إلى كسر الروابط الهيدروجينية حتى تتبخر المياه تعني استخدام كمية كبيرة من الطاقة في هذه العملية. عندما يتبخر الماء، تستهلك العملية الطاقة، مما يؤدي إلى تبريد البيئة التي يحدث فيها التبخر. في العديد من الكائنات الحية، بما في ذلك البشر، يسمح تبخر العرق، الذي يمثل 90 في المائة من الماء، للكائن الحي بالتبريد بحيث يمكن الحفاظ على توازن درجة حرارة الجسم.
خصائص مذيب الماء
نظرًا لأن الماء عبارة عن جزيء قطبي بشحنات موجبة قليلاً وسالبة قليلاً، يمكن للأيونات والجزيئات القطبية أن تذوب فيه بسهولة. لذلك، يشار إلى الماء كمذيب، وهو مادة قادرة على إذابة الجزيئات القطبية والمركبات الأيونية الأخرى. ستشكل الشحنات المرتبطة بهذه الجزيئات روابط هيدروجينية بالماء، تحيط بالجسيم بجزيئات الماء. يشار إلى هذا باسم كرة الترطيب، أو غلاف الترطيب، كما هو موضح في الشكل
شاهد هذا الفيديو للحصول على شرح مباشر لدرجة الحموضة ومقياس اللوغاريتمي الخاص بها.
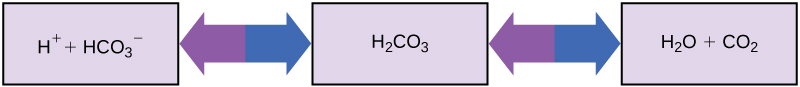
إذن كيف يمكن للكائنات الحية التي تتطلب أجسامها درجة حموضة شبه محايدة أن تبتلع المواد الحمضية والأساسية (الإنسان الذي يشرب عصير البرتقال، على سبيل المثال) وتعيش؟ المخازن المؤقتة هي المفتاح. تمتص المواد العازلة بسهولة زيادة H + أو OH -، مع الحفاظ على درجة الحموضة في الجسم بعناية في النطاق الضيق المطلوب للبقاء على قيد الحياة. يعد الحفاظ على درجة حموضة ثابتة في الدم أمرًا بالغ الأهمية لرفاهية الشخص. يتضمن المخزن المؤقت الذي يحافظ على درجة الحموضة في دم الإنسان حمض الكربونك (H 2 CO 3) وأيون البيكربونات (HCO 3 -) وثاني أكسيد الكربون (CO 2). عندما تتحد أيونات البيكربونات مع أيونات الهيدروجين الحرة وتصبح حمض كربوني، تتم إزالة أيونات الهيدروجين، مما يؤدي إلى تعديل تغيرات درجة الحموضة. وبالمثل، كما هو موضح في الشكل\(\PageIndex{8}\)، يمكن تحويل حمض الكربوميك الزائد إلى غاز ثاني أكسيد الكربون والزفير عبر الرئتين. هذا يمنع الكثير من أيونات الهيدروجين الحرة من التراكم في الدم وتقليل درجة الحموضة في الدم بشكل خطير. وبالمثل، إذا تم إدخال الكثير من OH - في النظام، فسوف يتحد حمض الكربونك معه لإنتاج البيكربونات، مما يؤدي إلى خفض درجة الحموضة. بدون هذا النظام العازل، ستتقلب درجة الحموضة في الجسم بدرجة كافية لتعريض البقاء على قيد الحياة للخطر.
ومن الأمثلة الأخرى على المواد العازلة مضادات الحموضة المستخدمة لمكافحة حمض المعدة الزائد. تعمل العديد من هذه الأدوية التي لا تستلزم وصفة طبية بنفس الطريقة التي تعمل بها مخازن الدم، وعادة ما تحتوي على أيون واحد على الأقل قادر على امتصاص الهيدروجين وتعديل درجة الحموضة، مما يخفف من آلام أولئك الذين يعانون من «حرقة المعدة» بعد تناول الطعام. تعتبر الخصائص الفريدة للمياه التي تساهم في هذه القدرة على موازنة درجة الحموضة - بالإضافة إلى الخصائص الأخرى للمياه - ضرورية للحفاظ على الحياة على الأرض.
رابط إلى التعلم

لمعرفة المزيد عن الماء. قم بزيارة قسم علوم المياه التابع للمسح الجيولوجي الأمريكي للمدارس «كل شيء عن الماء»! الموقع الإلكتروني.
ملخص
يحتوي الماء على العديد من الخصائص الضرورية للحفاظ على الحياة. إنه جزيء قطبي يسمح بتكوين روابط هيدروجينية. تسمح الروابط الهيدروجينية للأيونات والجزيئات القطبية الأخرى بالذوبان في الماء. لذلك، الماء مذيب ممتاز. تتسبب الروابط الهيدروجينية بين جزيئات الماء في امتلاك الماء لسعة حرارية عالية، مما يعني أن الأمر يتطلب الكثير من الحرارة المضافة لرفع درجة حرارته. مع ارتفاع درجة الحرارة، تنكسر الروابط الهيدروجينية بين الماء باستمرار وتتشكل من جديد. هذا يسمح لدرجة الحرارة الإجمالية بالبقاء مستقرة، على الرغم من إضافة الطاقة إلى النظام. يُظهر الماء أيضًا حرارة عالية من التبخر، وهو أمر أساسي لكيفية تبريد الكائنات الحية عن طريق تبخر العرق. تسمح قوى الماء المتماسكة بخاصية التوتر السطحي، بينما تظهر خواصه اللاصقة عندما يرتفع الماء داخل الأنابيب الشعرية. قيمة الأس الهيدروجيني هي مقياس لتركيز أيون الهيدروجين في المحلول وهي واحدة من العديد من الخصائص الكيميائية التي يتم تنظيمها بشكل كبير في الكائنات الحية من خلال التوازن. يمكن للأحماض والقواعد تغيير قيم الأس الهيدروجيني، لكن المخازن المؤقتة تميل إلى تعديل التغييرات التي تسببها. ترتبط خصائص الماء هذه ارتباطًا وثيقًا بالعمليات البيوكيميائية والفيزيائية التي تقوم بها الكائنات الحية، وستكون الحياة مختلفة جدًا إذا تم تغيير هذه الخصائص، إذا كان من الممكن وجودها على الإطلاق.
الحواشي
- 1 دبليو همفري دبليو، أ. دالك، وك شولتن، «VMD - الديناميكا الجزيئية المرئية»، مجلة الرسومات الجزيئية 14 (1996): 33-38.
- 2 دبليو همفري دبليو، أ. دالك، وك شولتن، «VMD - الديناميكا الجزيئية المرئية»، مجلة الرسومات الجزيئية 14 (1996): 33-38.
مسرد المصطلحات
- حامض
- جزيء يتبرع بأيونات الهيدروجين ويزيد من تركيز أيونات الهيدروجين في محلول
- التصاق
- التجاذب بين جزيئات الماء والجزيئات الأخرى
- أساس
- جزيء يتبرع بأيونات الهيدروكسيد أو يربط أيونات الهيدروجين الزائدة ويقلل تركيز أيونات الهيدروجين في المحلول
- مخفف صدمة
- مادة تمنع التغيير في درجة الحموضة عن طريق امتصاص أو إطلاق أيونات الهيدروجين أو الهيدروكسيد
- السعرات الحرارية
- كمية الحرارة المطلوبة لتغيير درجة حرارة جرام واحد من الماء بدرجة واحدة مئوية
- عمل الشعيرات الدموية
- يحدث بسبب جذب جزيئات الماء للشحنات على الأسطح الداخلية للهياكل الأنبوبية الضيقة مثل الأنابيب الزجاجية، مما يجذب جزيئات الماء إلى جوانب الأنابيب
- التماسك
- القوى الجزيئية بين جزيئات الماء الناتجة عن الطبيعة القطبية للمياه؛ المسؤولة عن التوتر السطحي
- التفكك
- إطلاق أيون من جزيء بحيث يتكون الجزيء الأصلي الآن من أيون والبقايا المشحونة للأصل، مثل عندما يتفكك الماء إلى H + و OH -
- تبخر
- فصل الجزيئات الفردية عن سطح الجسم المائي أو أوراق النبات أو جلد الكائن الحي
- حرارة تبخير الماء
- كمية عالية من الطاقة اللازمة لتحويل الماء السائل إلى بخار ماء
- محبة للماء
- يصف الأيونات أو الجزيئات القطبية التي تتفاعل جيدًا مع الجزيئات القطبية الأخرى مثل الماء
- نافرة من الماء
- يصف الجزيئات غير القطبية غير المشحونة التي لا تتفاعل جيدًا مع الجزيئات القطبية مثل الماء
- ورق عباد الشمس
- (أيضًا ورق الأس الهيدروجيني) ورق الترشيح الذي تمت معالجته بصبغة طبيعية قابلة للذوبان في الماء والتي تغير لونها مع تغير درجة الحموضة في البيئة بحيث يمكن استخدامه كمؤشر للأس الهيدروجيني
- ورق لقياس درجة الحموضة
- انظر ورقة عباد الشمس
- مقياس درجة الحموضة
- مقياس يتراوح من صفر إلى 14 يتناسب عكسيًا مع تركيز أيونات الهيدروجين في محلول
- مذيب
- مادة قادرة على إذابة مادة أخرى
- سعة حرارية محددة
- كمية الحرارة التي يجب أن يمتصها غرام واحد من المادة أو يفقدها لتغيير درجة حرارتها بمقدار درجة مئوية واحدة
- مجال الترطيب
- عندما يحيط جزيء الماء القطبي بالجزيئات المشحونة أو القطبية مما يبقيها مذابة وفي محلول
- التوتر السطحي
- توتر على سطح جسم سائل يمنع الجزيئات من الانفصال؛ ناتج عن القوى المتماسكة الجذابة بين جزيئات السائل


