2.1: الذرات والنظائر والأيونات والجزيئات - اللبنات الأساسية
- Page ID
- 196003
المهارات اللازمة للتطوير
- تعريف المادة والعناصر
- وصف العلاقة المتبادلة بين البروتونات والنيوترونات والإلكترونات
- قارن الطرق التي يمكن من خلالها التبرع بالإلكترونات أو مشاركتها بين الذرات
- اشرح الطرق التي تتحد بها العناصر التي تحدث بشكل طبيعي لتكوين الجزيئات والخلايا والأنسجة وأنظمة الأعضاء والكائنات الحية
في أبسط مستوياتها، تتكون الحياة من المادة. المادة هي أي مادة تحتل الفضاء ولها كتلة. العناصر هي أشكال فريدة من المواد ذات الخصائص الكيميائية والفيزيائية المحددة التي لا يمكن تقسيمها إلى مواد أصغر من خلال التفاعلات الكيميائية العادية. هناك 118 عنصرًا، ولكن 92 عنصرًا فقط تحدث بشكل طبيعي. يتم تصنيع العناصر المتبقية في المختبرات وهي غير مستقرة.
يتم تحديد كل عنصر برمزه الكيميائي، وهو حرف كبير واحد أو، عندما يكون الحرف الأول «مأخوذ» بالفعل بواسطة عنصر آخر، مزيج من حرفين. تتبع بعض العناصر المصطلح الإنجليزي للعنصر، مثل C للكربون و Ca للكالسيوم. الرموز الكيميائية للعناصر الأخرى مشتقة من أسمائها اللاتينية؛ على سبيل المثال، رمز الصوديوم هو Na، في إشارة إلى natrium، الكلمة اللاتينية للصوديوم.
العناصر الأربعة المشتركة بين جميع الكائنات الحية هي الأكسجين (O) والكربون (C) والهيدروجين (H) والنيتروجين (N). في العالم غير الحي، توجد العناصر بنسب مختلفة، وبعض العناصر الشائعة للكائنات الحية نادرة نسبيًا على الأرض ككل، كما هو موضح في الجدول\(\PageIndex{1}\). على سبيل المثال، الغلاف الجوي غني بالنيتروجين والأكسجين ولكنه يحتوي على القليل من الكربون والهيدروجين، في حين أن قشرة الأرض، على الرغم من احتوائها على الأكسجين وكمية صغيرة من الهيدروجين، تحتوي على القليل من النيتروجين والكربون. على الرغم من الاختلافات في الوفرة، فإن جميع العناصر والتفاعلات الكيميائية بينها تخضع لنفس القوانين الكيميائية والفيزيائية بغض النظر عما إذا كانت جزءًا من العالم الحي أو غير الحي.
| العنصر | الحياة (البشر) | الغلاف الجوي | قشرة الأرض |
|---|---|---|---|
| أكسجين (O) | 65% | 21% | 46% |
| كربون (ج) | 18% | أثر | أثر |
| هيدروجين (ح) | 10% | أثر | 0.1% |
| نيتروجين (N) | 3% | 78% | أثر |
هيكل الذرة
لفهم كيفية تجمع العناصر معًا، يجب علينا أولاً مناقشة أصغر مكون أو كتلة بناء لعنصر، الذرة. الذرة هي أصغر وحدة من المادة تحتفظ بجميع الخصائص الكيميائية للعنصر. على سبيل المثال، تحتوي ذرة الذهب الواحدة على جميع خصائص الذهب من حيث أنها معدن صلب في درجة حرارة الغرفة. العملة الذهبية هي ببساطة عدد كبير جدًا من ذرات الذهب المصبوبة على شكل عملة معدنية وتحتوي على كميات صغيرة من العناصر الأخرى المعروفة باسم الشوائب. لا يمكن تقسيم ذرات الذهب إلى أي شيء أصغر مع الاحتفاظ بخصائص الذهب.
تتكون الذرة من منطقتين: النواة، التي تقع في مركز الذرة وتحتوي على البروتونات والنيوترونات، والمنطقة الخارجية للذرة التي تحتفظ بإلكتروناتها في مدار حول النواة، كما هو موضح في الشكل\(\PageIndex{1}\). تحتوي الذرات على البروتونات والإلكترونات والنيوترونات، من بين الجسيمات دون الذرية الأخرى. الاستثناء الوحيد هو الهيدروجين (H)، الذي يتكون من بروتون واحد وإلكترون واحد بدون نيوترونات.
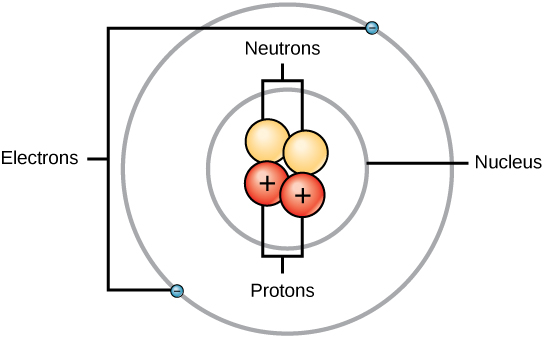
للبروتونات والنيوترونات نفس الكتلة تقريبًا، حوالي 1.67 × 10 -24 جرامًا. يعرّف العلماء بشكل تعسفي هذه الكمية من الكتلة كوحدة كتلة ذرية واحدة (amu) أو دالتون واحدة، كما هو موضح في الجدول\(\PageIndex{2}\). على الرغم من التشابه في الكتلة، تختلف البروتونات والنيوترونات في شحنتها الكهربائية. يتم شحن البروتون بشكل إيجابي بينما النيوترون غير مشحون. لذلك، يساهم عدد النيوترونات في الذرة بشكل كبير في كتلتها، ولكن ليس في شحنتها. الإلكترونات أصغر بكثير في الكتلة من البروتونات، حيث تزن فقط 9.11 × 10-28 جرامًا، أو حوالي 1/1800 من وحدة الكتلة الذرية. وبالتالي، فإنها لا تساهم كثيرًا في الكتلة الذرية الإجمالية للعنصر. لذلك، عند النظر إلى الكتلة الذرية، من المعتاد تجاهل كتلة أي إلكترونات وحساب كتلة الذرة بناءً على عدد البروتونات والنيوترونات وحدها. على الرغم من أنها لا تساهم بشكل كبير في الكتلة، إلا أن الإلكترونات تساهم بشكل كبير في شحنة الذرة، حيث أن كل إلكترون له شحنة سالبة تساوي الشحنة الموجبة للبروتون. في الذرات المحايدة غير المشحونة، يكون عدد الإلكترونات التي تدور حول النواة مساويًا لعدد البروتونات داخل النواة. في هذه الذرات، تلغي الشحنات الموجبة والسالبة بعضها البعض، مما يؤدي إلى ذرة بدون شحنة صافية.
نظرًا لأحجام البروتونات والنيوترونات والإلكترونات، فإن معظم حجم الذرة - الأكبر من 99 بالمائة - هو في الواقع مساحة فارغة. مع كل هذه المساحة الفارغة، قد يتساءل المرء لماذا لا تمر الأجسام الصلبة المزعومة عبر بعضها البعض. والسبب في ذلك هو أن الإلكترونات التي تحيط بجميع الذرات مشحونة سلبًا والشحنات السالبة تتنافر مع بعضها البعض.
| الشحنة | ماس (كامو) | الموقع | |
|---|---|---|---|
| بروتون | +1 | 1 | نواة |
| نيوترون | 0 | 1 | نواة |
| إلكترون | —1 | 0 | المدارات |
العدد الذري والكتلة
تحتوي ذرات كل عنصر على عدد مميز من البروتونات والإلكترونات. يحدد عدد البروتونات العدد الذري للعنصر ويستخدم لتمييز عنصر عن آخر. ويتغير عدد النيوترونات، وينتج عن ذلك نظائر، وهي أشكال مختلفة لنفس الذرة تختلف فقط في عدد النيوترونات التي تمتلكها. يحدد عدد البروتونات وعدد النيوترونات معًا عدد كتلة العنصر، كما هو موضح في الشكل\(\PageIndex{2}\). لاحظ أنه يتم تجاهل المساهمة الصغيرة للكتلة من الإلكترونات عند حساب العدد الكتلي. يمكن استخدام تقريب الكتلة هذا لحساب عدد النيوترونات الموجودة في العنصر بسهولة عن طريق طرح عدد البروتونات من العدد الكتلي. نظرًا لأن نظائر العنصر سيكون لها أرقام كتلة مختلفة قليلاً، يحدد العلماء أيضًا الكتلة الذرية، وهي المتوسط المحسوب للرقم الكتلي لنظائره التي تحدث بشكل طبيعي. في كثير من الأحيان، يحتوي الرقم الناتج على كسر. على سبيل المثال، تبلغ الكتلة الذرية للكلور (Cl) 35.45 لأن الكلور يتكون من عدة نظائر، بعضها (الأغلبية) بكتلة ذرية 35 (17 بروتونًا و 18 نيوترونًا) وبعضها بكتلة ذرية 37 (17 بروتونًا و 20 نيوترونًا).
آرت كونيكشن
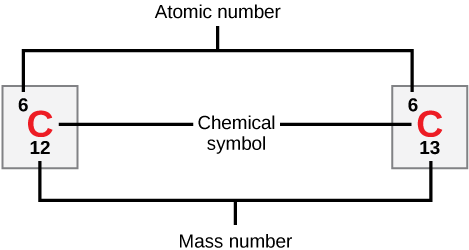
ما عدد النيوترونات التي يحتويها الكربون-12 والكربون 13، على التوالي؟
نظائر
النظائر هي أشكال مختلفة لعنصر لها نفس عدد البروتونات ولكن عددًا مختلفًا من النيوترونات. تحتوي بعض العناصر - مثل الكربون والبوتاسيوم واليورانيوم - على نظائر طبيعية. يحتوي الكربون 12 على ستة بروتونات وستة نيوترونات وستة إلكترونات؛ لذلك، يبلغ عدد كتله 12 (ستة بروتونات وستة نيوترونات). يحتوي الكربون 14 على ستة بروتونات وثمانية نيوترونات وستة إلكترونات؛ كتلته الذرية هي 14 (ستة بروتونات وثمانية نيوترونات). هذان الشكلان البديلان من الكربون هما النظائر. قد تصدر بعض النظائر النيوترونات والبروتونات والإلكترونات، وتحقق تكوينًا ذريًا أكثر استقرارًا (مستوى أقل من الطاقة الكامنة)؛ هذه هي نظائر مشعة أو نظائر مشعة. يصف التحلل الإشعاعي (النيوترونات المفقودة للكربون 14 لتصبح في النهاية كربون-12) فقدان الطاقة الذي يحدث عندما تطلق نواة ذرة غير مستقرة إشعاعًا.
اتصال التطور: تأريخ الكربون
يوجد الكربون عادة في الغلاف الجوي في شكل مركبات غازية مثل ثاني أكسيد الكربون والميثان. الكربون 14 (\(\ce C^{14}\)) هو نظير مشع طبيعي يتم إنشاؤه في الغلاف الجوي من الغلاف الجوي\(\ce N^{14}\) (النيتروجين) بإضافة نيوترون وفقدان البروتون بسبب الأشعة الكونية. هذه عملية مستمرة، لذلك\(\ce C^{14}\) يتم دائمًا إنشاء المزيد. عندما يتم دمج الكائن الحي في\(\ce C^{14}\) البداية كثاني أكسيد الكربون الثابت في عملية التمثيل الضوئي، فإن الكمية النسبية\(\ce C^{14}\) في جسمه تساوي تركيزه\(\ce C^{14}\) في الغلاف الجوي. عندما يموت كائن حي، فإنه لم يعد يبتلع\(\ce C^{14}\)، وبالتالي فإن النسبة بين\(\ce C^{14}\)\(\ce C^{12}\) وذاك ستنخفض مع\(\ce C^{14}\) تحللها تدريجيًا إلى\(\ce N^{14}\) عملية تسمى تحلل بيتا - انبعاث الإلكترونات أو البوزيترونات. يعطي هذا الاضمحلال الطاقة في عملية بطيئة.
بعد حوالي 5730 عامًا،\(\ce C^{14}\) سيتم تحويل نصف تركيز البداية إلى\(\ce N^{14}\). يُطلق على الوقت الذي يستغرقه نصف التركيز الأصلي للنظير ليتحلل مرة أخرى إلى شكله الأكثر استقرارًا اسم نصف العمر. نظرًا لأن عمر\(\ce C^{14}\) النصف طويل، يتم استخدامه لتأريخ الكائنات الحية سابقًا مثل العظام القديمة أو الخشب. وبمقارنة نسبة\(\ce C^{14}\) التركيز الموجود في جسم ما إلى الكمية\(\ce C^{14}\) المكتشفة في الغلاف الجوي، يمكن تحديد كمية النظائر التي لم تتحلل بعد. على أساس هذه الكمية، يمكن حساب عمر المادة، مثل الماموث القزم الموضح في الشكل\(\PageIndex{3}\)، بدقة إذا لم يكن عمرها أكبر بكثير من حوالي 50000 عام. تحتوي العناصر الأخرى على نظائر ذات نصف عمر مختلف. على سبيل المثال، يبلغ عمر النصف لـ\(\ce K^{40}\) (البوتاسيوم 40) 1.25 مليار سنة، ويبلغ عمر النصف لـ\(\ce U^{235}\) (اليورانيوم 235) حوالي 700 مليون سنة. من خلال استخدام التأريخ الإشعاعي، يمكن للعلماء دراسة عمر الحفريات أو بقايا الكائنات الحية المنقرضة لفهم كيفية تطور الكائنات الحية من الأنواع السابقة.

رابط إلى التعلم

فيديو: لمعرفة المزيد عن الذرات والنظائر وكيفية التمييز بين نظير وآخر، قم بزيارة هذا الموقع وقم بتشغيل المحاكاة.
الجدول الدوري
يتم تنظيم العناصر المختلفة وعرضها في الجدول الدوري. صمم الجدول الكيميائي الروسي دميتري مندلييف (1834-1907) في عام 1869، ويضم الجدول العناصر التي، على الرغم من أنها فريدة، تشترك في خصائص كيميائية معينة مع عناصر أخرى. خصائص العناصر مسؤولة عن حالتها الفيزيائية في درجة حرارة الغرفة: قد تكون غازات أو مواد صلبة أو سوائل. تحتوي العناصر أيضًا على تفاعل كيميائي محدد، والقدرة على الاندماج والترابط كيميائيًا مع بعضها البعض.
في الجدول الدوري، كما هو موضح في الشكل
فيديو: شاهد هذه الرسوم المتحركة المرئية لرؤية الترتيب المكاني لمدارات p و s.
التفاعلات الكيميائية والجزيئات
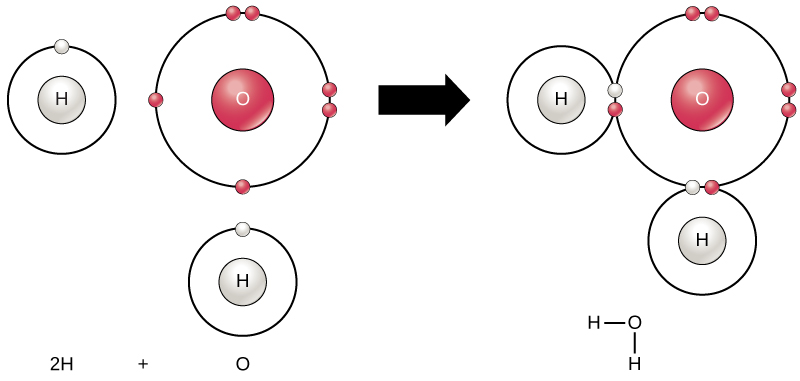
تكون جميع العناصر أكثر استقرارًا عندما يمتلئ غلافها الخارجي بالإلكترونات وفقًا لقاعدة الثمانية. هذا لأنه من الملائم جدًا أن تكون الذرات في هذا التكوين وتجعلها مستقرة. ومع ذلك، نظرًا لعدم احتواء جميع العناصر على إلكترونات كافية لملء أصدافها الخارجية، فإن الذرات تشكل روابط كيميائية مع ذرات أخرى وبالتالي تحصل على الإلكترونات التي تحتاجها لتحقيق تكوين إلكتروني مستقر. عندما ترتبط ذرتان أو أكثر كيميائيًا مع بعضها البعض، يكون التركيب الكيميائي الناتج عبارة عن جزيء. يتكون جزيء الماء المألوف، H 2 O، من ذرتي هيدروجين وذرة أكسجين واحدة؛ وترتبط هذه الذرات معًا لتكوين الماء، كما هو موضح في الشكل\(\PageIndex{8}\). يمكن للذرات تكوين جزيئات عن طريق التبرع بالإلكترونات أو قبولها أو مشاركتها لملء غلافها الخارجي.
تحدث التفاعلات الكيميائية عندما تترابط ذرتان أو أكثر معًا لتكوين جزيئات أو عندما تتكسر الذرات المرتبطة. المواد المستخدمة في بداية التفاعل الكيميائي تسمى المواد المتفاعلة (عادة ما توجد على الجانب الأيسر من المعادلة الكيميائية)، وتعرف المواد الموجودة في نهاية التفاعل بالمنتجات (عادة ما توجد على الجانب الأيمن من المعادلة الكيميائية). عادةً ما يتم رسم سهم بين المواد المتفاعلة والمنتجات للإشارة إلى اتجاه التفاعل الكيميائي؛ هذا الاتجاه ليس دائمًا «طريقًا أحادي الاتجاه». لإنشاء جزيء الماء الموضح أعلاه، ستكون المعادلة الكيميائية:
\[\ce{2H + O \rightarrow H_2O} \nonumber\]
مثال على التفاعل الكيميائي البسيط هو تكسير جزيئات بيروكسيد الهيدروجين، والتي تتكون كل منها من ذرتين هيدروجين مرتبطتين بذرتين من الأكسجين (H 2 O 2). يتحلل بيروكسيد الهيدروجين المتفاعل إلى ماء يحتوي على ذرة أكسجين واحدة مرتبطة بذرتين هيدروجين (H 2 O) وأكسجين يتكون من ذرتي أكسجين مرتبطتين (O 2). في المعادلة أدناه، يشتمل التفاعل على جزيئين من بيروكسيد الهيدروجين وجزيئين من الماء. هذا مثال لمعادلة كيميائية متوازنة، حيث يكون عدد ذرات كل عنصر هو نفسه على كل جانب من المعادلة. وفقًا لقانون الحفاظ على المادة، يجب أن يكون عدد الذرات قبل التفاعل الكيميائي وبعده متساويًا، بحيث لا يتم إنشاء ذرات أو تدميرها في الظروف العادية.
\[\ce{2H_2O_2\: (hydrogen\: peroxide) \rightarrow 2H_2O\: (water) + O_2\: (oxygen)} \nonumber\]
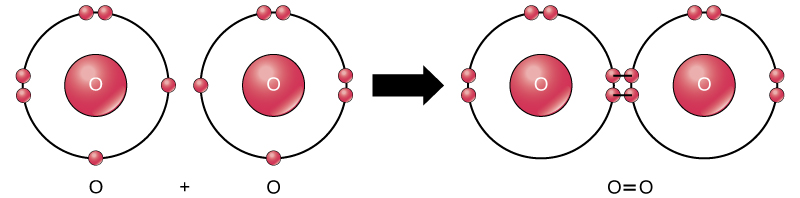
على الرغم من أن جميع المواد المتفاعلة ومنتجات هذا التفاعل عبارة عن جزيئات (تظل كل ذرة مرتبطة بذرة أخرى على الأقل)، إلا أنه في هذا التفاعل يكون بيروكسيد الهيدروجين والماء فقط ممثلين للمركبات: فهي تحتوي على ذرات من أكثر من نوع واحد من العناصر. من ناحية أخرى، يتكون الأكسجين الجزيئي، كما هو موضح في الشكل\(\PageIndex{9}\)، من ذرتي أكسجين مرتبطتين بشكل مزدوج ولا يتم تصنيفه كمركب ولكن كجزيء أحادي النواة.
يمكن أن تستمر بعض التفاعلات الكيميائية، مثل تلك الموضحة أعلاه، في اتجاه واحد حتى يتم استنفاد جميع المواد المتفاعلة. تحتوي المعادلات التي تصف هذه التفاعلات على سهم أحادي الاتجاه ولا يمكن التراجع عنها. ردود الفعل العكسية هي تلك التي يمكن أن تسير في أي اتجاه. في التفاعلات العكسية، يتم تحويل المواد المتفاعلة إلى منتجات، ولكن عندما يتجاوز تركيز المنتج حدًا معينًا (سمة التفاعل المحدد)، سيتم تحويل بعض هذه المنتجات مرة أخرى إلى متفاعلات؛ عند هذه النقطة، يتم عكس تسميات المنتجات والمواد المتفاعلة. يستمر هذا ذهابًا وإيابًا حتى يحدث توازن نسبي معين بين المواد المتفاعلة والمنتجات - وهي حالة تسمى التوازن. غالبًا ما يتم الإشارة إلى حالات التفاعلات العكسية هذه بمعادلة كيميائية بسهم مزدوج الرأس يشير إلى كل من المواد المتفاعلة والمنتجات.
على سبيل المثال، في دم الإنسان، ترتبط أيونات الهيدروجين الزائدة (H +) بأيونات البيكربونات (HCO 3 -) لتشكل حالة توازن مع حمض الكربونك (H 2 CO 3). إذا تمت إضافة حمض الكربونك إلى هذا النظام، فسيتم تحويل جزء منه إلى أيونات البيكربونات والهيدروجين.
\[\ce{HCO^{-}_3 + H^+ \leftrightarrow H_2CO_3} \nonumber\]
ولكن في التفاعلات البيولوجية، نادرًا ما يتم الحصول على التوازن لأن تركيزات المواد المتفاعلة أو المنتجات أو كليهما تتغير باستمرار، وغالبًا ما يكون ناتج تفاعل ما هو عامل تفاعل لآخر. للعودة إلى مثال أيونات الهيدروجين الزائدة في الدم، سيكون تكوين حمض الكربونك هو الاتجاه الرئيسي للتفاعل. ومع ذلك، يمكن لحمض الكربوبيك أيضًا أن يغادر الجسم كغاز ثاني أكسيد الكربون (عن طريق الزفير) بدلاً من تحويله مرة أخرى إلى أيون البيكربونات، مما يؤدي إلى التفاعل إلى اليمين بموجب القانون الكيميائي المعروف باسم قانون العمل الشامل. ردود الفعل هذه مهمة للحفاظ على توازن الدم.
\[\ce{HCO_3^- + H^+ \leftrightarrow H_2CO_3 \leftrightarrow CO_2 + H_2O} \nonumber\]
الأيونات والروابط الأيونية
تكون بعض الذرات أكثر استقرارًا عندما تكتسب أو تفقد إلكترونًا (أو ربما اثنين) وتشكل أيونات. هذا يملأ غلافها الإلكتروني الخارجي ويجعلها أكثر استقرارًا من حيث الطاقة. نظرًا لأن عدد الإلكترونات لا يساوي عدد البروتونات، فإن كل أيون له شحنة صافية. الكاتيونات هي أيونات موجبة تتشكل بفقدان الإلكترونات. تتكون الأيونات السالبة من خلال اكتساب الإلكترونات وتسمى الأنيونات. يتم تحديد الأنيونات من خلال تغيير اسمها الأولي لينتهي بـ «-ide»: أنيون الكلور يسمى الكلوريد، وأنيون الكبريت يسمى كبريتيد، على سبيل المثال.
يشار إلى حركة الإلكترونات هذه من عنصر إلى آخر باسم نقل الإلكترون. كما\(\PageIndex{10}\) يوضح الشكل، يحتوي الصوديوم (Na) على إلكترون واحد فقط في غلافه الإلكتروني الخارجي. يتطلب الصوديوم طاقة أقل للتبرع بهذا الإلكترون الواحد مقارنة بقبول سبعة إلكترونات أخرى لملء الغلاف الخارجي. إذا فقد الصوديوم إلكترونًا، فإنه يحتوي الآن على 11 بروتونًا، و11 نيوترونًا، و10 إلكترونات فقط، مما يجعله يحمل شحنة إجمالية قدرها +1. يشار إليه الآن باسم أيون الصوديوم. يحتوي الكلور (Cl) في أدنى حالة طاقة له (تسمى الحالة الأرضية) على سبعة إلكترونات في غلافه الخارجي. مرة أخرى، يعد اكتساب الكلور إلكترون واحدًا أكثر كفاءة في استخدام الطاقة بدلاً من فقدان سبعة. لذلك، تميل إلى اكتساب إلكترون لتكوين أيون يحتوي على 17 بروتونًا و 17 نيوترونًا و 18 إلكترونًا، مما يمنحه شحنة سالبة صافية (—1). يشار إليه الآن باسم أيون الكلوريد. في هذا المثال، سيتبرع الصوديوم بإلكترون واحد لتفريغ غلافه، وسيقبل الكلور هذا الإلكترون لملء غلافه. يستوفي كلا الأيونين الآن قاعدة الثمانية ولديهما أصداف خارجية كاملة. نظرًا لأن عدد الإلكترونات لم يعد يساوي عدد البروتونات، أصبح كل منها الآن أيون وله شحنة +1 (كاتيون الصوديوم) أو —1 (أنيون الكلوريد). لاحظ أن هذه المعاملات لا يمكن أن تتم عادةً إلا في وقت واحد: لكي تفقد ذرة الصوديوم إلكترونًا، يجب أن تكون في وجود متلقي مناسب مثل ذرة الكلور.
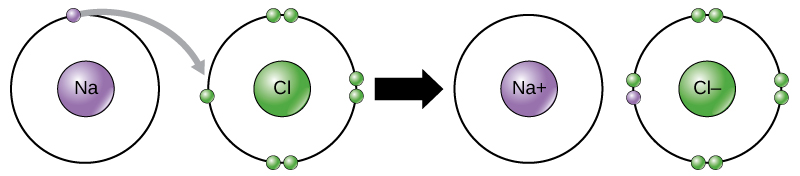
تتكون الروابط الأيونية بين الأيونات ذات الشحنات المعاكسة. على سبيل المثال، تترابط أيونات الصوديوم ذات الشحنة الموجبة وأيونات الكلوريد سالبة الشحنة معًا لتكوين بلورات من كلوريد الصوديوم، أو ملح الطعام، لتكوين جزيء بلوري بشحنة صافية صفرية.
يشار إلى بعض الأملاح في علم وظائف الأعضاء باسم الإلكتروليتات (بما في ذلك الصوديوم والبوتاسيوم والكالسيوم) والأيونات اللازمة لتوصيل النبضات العصبية وتقلصات العضلات وتوازن الماء. توفر العديد من المشروبات الرياضية والمكملات الغذائية هذه الأيونات لتحل محل تلك المفقودة من الجسم عن طريق التعرق أثناء التمرين.
السندات التساهمية والسندات والتفاعلات الأخرى
هناك طريقة أخرى يمكن من خلالها تلبية قاعدة الثمانية وهي مشاركة الإلكترونات بين الذرات لتكوين روابط تساهمية. هذه الروابط أقوى وأكثر شيوعًا من الروابط الأيونية في جزيئات الكائنات الحية. توجد الروابط التساهمية بشكل شائع في الجزيئات العضوية القائمة على الكربون، مثل الحمض النووي والبروتينات. توجد الروابط التساهمية أيضًا في الجزيئات غير العضوية مثل H 2 O و CO 2 و O 2. يمكن مشاركة زوج واحد أو اثنين أو ثلاثة أزواج من الإلكترونات، مما يؤدي إلى تكوين روابط مفردة ومزدوجة وثلاثية على التوالي. كلما زادت الروابط التساهمية بين ذرتين، زادت قوة ارتباطهما. وبالتالي، فإن السندات الثلاثية هي الأقوى.
تعد قوة المستويات المختلفة من الترابط التساهمي أحد الأسباب الرئيسية التي تجعل الكائنات الحية تواجه صعوبة في الحصول على النيتروجين لاستخدامه في بناء جزيئاتها، على الرغم من أن النيتروجين الجزيئي، N 2، هو الغاز الأكثر وفرة في الغلاف الجوي. يتكون النيتروجين الجزيئي من ذرتين من النيتروجين مرتبطتين ثلاثيًا ببعضهما البعض، وكما هو الحال مع جميع الجزيئات، فإن مشاركة هذه الأزواج الثلاثة من الإلكترونات بين ذرتي النيتروجين تسمح بملء أغلفة الإلكترون الخارجية، مما يجعل الجزيء أكثر استقرارًا من ذرات النيتروجين الفردية. هذه الرابطة الثلاثية القوية تجعل من الصعب على الأنظمة الحية تفكيك هذا النيتروجين من أجل استخدامه كمكونات للبروتينات والحمض النووي.
يوفر تكوين جزيئات الماء مثالاً على الترابط التساهمي. ترتبط ذرات الهيدروجين والأكسجين التي تتحد لتكوين جزيئات الماء معًا بواسطة روابط تساهمية، كما هو موضح في الشكل\(\PageIndex{8}\). يقسم الإلكترون من الهيدروجين وقته بين الغلاف الخارجي غير المكتمل لذرات الهيدروجين والغلاف الخارجي غير المكتمل لذرات الأكسجين. لملء الغلاف الخارجي للأكسجين بالكامل، الذي يحتوي على ستة إلكترونات في غلافه الخارجي ولكنه سيكون أكثر استقرارًا بثمانية، هناك حاجة إلى إلكترونين (واحد من كل ذرة هيدروجين): ومن هنا جاءت الصيغة المعروفة H 2 O. يتم تقاسم الإلكترونات بين العنصرين لملء الغلاف الخارجي لـ كل منهما، مما يجعل كلا العنصرين أكثر استقرارًا.
رابط إلى التعلم
فيديو: شاهد هذا الفيديو القصير لمشاهدة الرسوم المتحركة للترابط الأيوني والتساهمي.
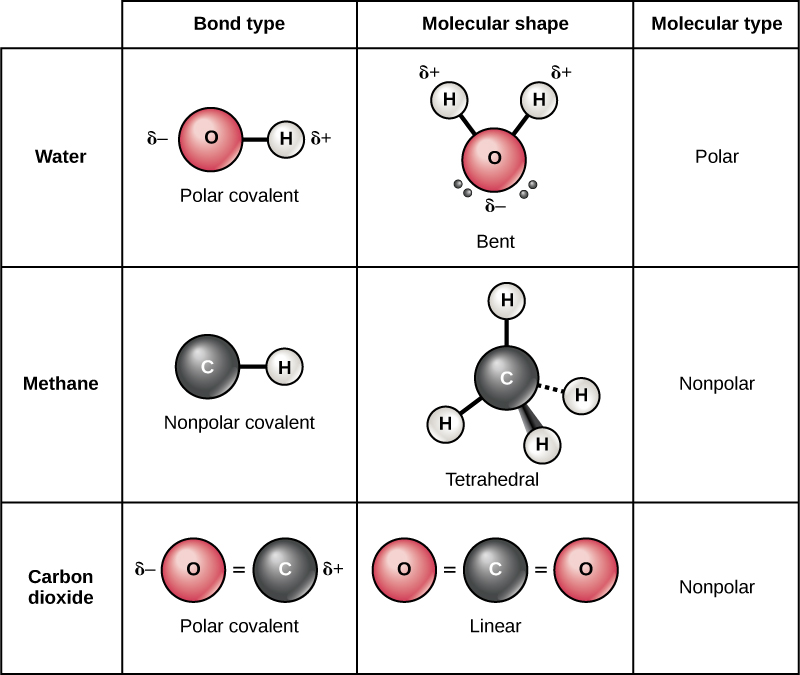
السندات التساهمية القطبية
هناك نوعان من الروابط التساهمية: القطبية وغير القطبية. في الرابطة التساهمية القطبية، الموضحة في الشكل\(\PageIndex{11}\)، تشترك الذرات في الإلكترونات بشكل غير متساوٍ وتنجذب إلى نواة واحدة أكثر من الأخرى. بسبب التوزيع غير المتكافئ للإلكترونات بين ذرات العناصر المختلفة، تتطور شحنة موجبة قليلاً (+) أو سالبة قليلاً (—). هذه الشحنة الجزئية هي خاصية مهمة للمياه وتمثل العديد من خصائصها.
الماء عبارة عن جزيء قطبي، حيث تكتسب ذرات الهيدروجين شحنة موجبة جزئية والأكسجين شحنة سالبة جزئية. يحدث هذا لأن نواة ذرة الأكسجين أكثر جاذبية لإلكترونات ذرات الهيدروجين من نواة الهيدروجين لإلكترونات الأكسجين. وبالتالي فإن الأكسجين يتمتع بسلبية إلكترونية أعلى من الهيدروجين، وتقضي الإلكترونات المشتركة وقتًا أطول بالقرب من نواة الأكسجين مما تقضيه بالقرب من نواة ذرات الهيدروجين، مما يعطي ذرات الأكسجين والهيدروجين شحنات سلبية وإيجابية قليلاً، على التوالي. هناك طريقة أخرى لتوضيح ذلك وهي أن احتمال العثور على إلكترون مشترك بالقرب من نواة الأكسجين أكثر احتمالًا من العثور عليه بالقرب من نواة الهيدروجين. وفي كلتا الحالتين، تساهم السالبة الكهربائية النسبية للذرة في تطوير الشحنات الجزئية عندما يكون أحد العناصر أكثر سالبة كهربية بشكل ملحوظ من الآخر، ويمكن بعد ذلك استخدام الشحنات الناتجة عن هذه الروابط القطبية لتكوين روابط هيدروجينية على أساس جاذبية العكس. رسوم جزئية. (الروابط الهيدروجينية، التي تمت مناقشتها بالتفصيل أدناه، هي روابط ضعيفة بين ذرات الهيدروجين ذات الشحنة الإيجابية قليلاً والذرات ذات الشحنة السالبة قليلاً في الجزيئات الأخرى.) نظرًا لأن الجزيئات الكبيرة غالبًا ما تحتوي على ذرات بداخلها تختلف في السلبية الإلكترونية، فإن الروابط القطبية غالبًا ما تكون موجودة في الجزيئات العضوية.
السندات التساهمية غير القطبية
تتكون الروابط التساهمية غير القطبية بين ذرتين من نفس العنصر أو بين عناصر مختلفة تشترك في الإلكترونات بالتساوي. على سبيل المثال، الأكسجين الجزيئي (O 2) غير قطبي لأن الإلكترونات ستكون موزعة بالتساوي بين ذرتي الأكسجين.
مثال آخر على الرابطة التساهمية غير القطبية هو الميثان (CH 4)، كما هو موضح في الشكل\(\PageIndex{11}\). يحتوي الكربون على أربعة إلكترونات في غلافه الخارجي ويحتاج إلى أربعة إلكترونات أخرى لملئه. تحصل على هذه الأربعة من أربع ذرات هيدروجين، وتوفر كل ذرة واحدة، مما يجعل غلافًا خارجيًا مستقرًا من ثمانية إلكترونات. لا يحتوي الكربون والهيدروجين على نفس السلبية الإلكترونية ولكنهما متشابهان؛ وبالتالي تتشكل الروابط غير القطبية. تحتاج كل ذرة من ذرات الهيدروجين إلى إلكترون واحد لغلافها الخارجي، والذي يمتلئ عندما يحتوي على إلكترونين. تشترك هذه العناصر في الإلكترونات بالتساوي بين ذرات الكربون وذرات الهيدروجين، مما يؤدي إلى تكوين جزيء تساهمي غير قطبي.
الروابط الهيدروجينية وتفاعلات فان دير فال
تتطلب الروابط الأيونية والتساهمية بين العناصر طاقة للكسر. الروابط الأيونية ليست قوية مثل التساهمية التي تحدد سلوكها في الأنظمة البيولوجية. ومع ذلك، ليست كل الروابط روابط أيونية أو تساهمية. يمكن أن تتشكل الروابط الأضعف أيضًا بين الجزيئات. هناك رابطتان ضعيفتان تحدثان بشكل متكرر وهما الروابط الهيدروجينية وتفاعلات فان دير فال. بدون هذين النوعين من الروابط، لن تكون الحياة كما نعرفها موجودة. توفر الروابط الهيدروجينية العديد من الخصائص الحيوية التي تحافظ على الحياة للمياه، كما تعمل على استقرار هياكل البروتينات والحمض النووي، وهو اللبنة الأساسية للخلايا.
عندما تتكون الروابط التساهمية القطبية التي تحتوي على الهيدروجين، يكون للهيدروجين الموجود في تلك الرابطة شحنة موجبة قليلاً لأن إلكترون الهيدروجين يتم سحبه بقوة أكبر نحو العنصر الآخر وبعيدًا عن الهيدروجين. نظرًا لأن الهيدروجين إيجابي قليلاً، فسوف ينجذب إلى الشحنات السالبة المجاورة. عندما يحدث هذا، يحدث تفاعل ضعيف بين + للهيدروجين من جزيء واحد و - الشحنة على الذرات الأكثر سالبة لجزيء آخر، عادةً الأكسجين أو النيتروجين، أو داخل نفس الجزيء. هذا التفاعل يسمى رابطة الهيدروجين. هذا النوع من الروابط شائع ويحدث بانتظام بين جزيئات الماء. الروابط الهيدروجينية الفردية ضعيفة وسهلة الكسر؛ ومع ذلك، فإنها تحدث بأعداد كبيرة جدًا في الماء والبوليمرات العضوية، مما يخلق قوة كبيرة مجتمعة. الروابط الهيدروجينية مسؤولة أيضًا عن ربط اللولب المزدوج للحمض النووي معًا.
مثل الروابط الهيدروجينية، تعتبر تفاعلات فان دير فال عوامل جذب أو تفاعلات ضعيفة بين الجزيئات. يمكن أن تحدث عوامل الجذب في Van der Waals بين أي جزيئين أو أكثر وتعتمد على تقلبات طفيفة في كثافات الإلكترون، والتي لا تكون دائمًا متماثلة حول الذرة. لكي تحدث عوامل الجذب هذه، يجب أن تكون الجزيئات قريبة جدًا من بعضها البعض. تساهم هذه الروابط - جنبًا إلى جنب مع الروابط الأيونية والتساهمية والهيدروجينية - في البنية ثلاثية الأبعاد للبروتينات في خلايانا الضرورية لوظيفتها الصحيحة.
الاتصال الوظيفي: كيميائي صيدلاني
الكيميائيون الصيدليون مسؤولون عن تطوير أدوية جديدة ومحاولة تحديد طريقة عمل كل من الأدوية القديمة والجديدة. إنهم يشاركون في كل خطوة من خطوات عملية تطوير الدواء. يمكن العثور على الأدوية في البيئة الطبيعية أو يمكن تصنيعها في المختبر. في كثير من الحالات، يتم تغيير الأدوية المحتملة الموجودة في الطبيعة كيميائيًا في المختبر لجعلها أكثر أمانًا وفعالية، وأحيانًا تحل الإصدارات الاصطناعية من الأدوية محل النسخة الموجودة في الطبيعة.
بعد الاكتشاف الأولي أو تخليق الدواء، يقوم الكيميائي بعد ذلك بتطوير الدواء، وربما تغييره كيميائيًا، واختباره لمعرفة ما إذا كان الدواء سامًا، ثم تصميم طرق للإنتاج الفعال على نطاق واسع. ثم تبدأ عملية الحصول على الدواء المعتمد للاستخدام البشري. في الولايات المتحدة، تتم الموافقة على الأدوية من قبل إدارة الغذاء والدواء (FDA) وتتضمن سلسلة من التجارب واسعة النطاق باستخدام البشر للتأكد من أن الدواء ليس ضارًا ويعالج بشكل فعال الحالة التي يهدف إلى علاجها. غالبًا ما تستغرق هذه العملية عدة سنوات وتتطلب مشاركة الأطباء والعلماء، بالإضافة إلى الكيميائيين، لإكمال الاختبار والحصول على الموافقة.
مثال على دواء تم اكتشافه في الأصل في كائن حي هو Paclitaxel (Taxol)، وهو دواء مضاد للسرطان يستخدم لعلاج سرطان الثدي. تم اكتشاف هذا الدواء في لحاء شجرة الطقسوس في المحيط الهادئ. مثال آخر هو الأسبرين، المعزول أصلاً عن لحاء شجرة الصفصاف. غالبًا ما يعني العثور على الأدوية اختبار مئات العينات من النباتات والفطريات وأشكال الحياة الأخرى لمعرفة ما إذا كانت هناك أي مركبات نشطة بيولوجيًا بداخلها. في بعض الأحيان، يمكن للطب التقليدي إعطاء أدلة للطب الحديث عن المكان الذي يمكن العثور فيه على مركب نشط. على سبيل المثال، كان استخدام لحاء الصفصاف في صناعة الأدوية معروفًا منذ آلاف السنين، ويعود تاريخه إلى مصر القديمة. ومع ذلك، لم يتم تنقية جزيء الأسبرين، المعروف باسم حمض أسيتيل الساليسيليك، وتسويقه للاستخدام البشري حتى أواخر القرن التاسع عشر.
من حين لآخر، يتبين أن الأدوية المطورة للاستخدام مرة واحدة لها تأثيرات غير متوقعة تسمح باستخدام هذه الأدوية بطرق أخرى غير ذات صلة. على سبيل المثال، تم تطوير عقار مينوكسيديل (روجين) في الأصل لعلاج ارتفاع ضغط الدم. عند الاختبار على البشر، لوحظ أن الأفراد الذين يتناولون الدواء سوف ينمون شعرًا جديدًا. في نهاية المطاف تم تسويق الدواء للرجال والنساء المصابين بالصلع لاستعادة الشعر المفقود.
قد تشمل مهنة الكيميائي الصيدلاني العمل البوليسي والتجريب وتطوير الأدوية، كل ذلك بهدف جعل البشر أكثر صحة.
ملخص
المادة هي أي شيء يشغل الفضاء وله كتلة. وهي مكونة من عناصر. جميع العناصر الـ 92 التي تحدث بشكل طبيعي لها صفات فريدة تسمح لها بالاندماج بطرق مختلفة لتكوين الجزيئات، والتي بدورها تتحد لتشكيل الخلايا والأنسجة وأنظمة الأعضاء والكائنات الحية. الذرات، التي تتكون من البروتونات والنيوترونات والإلكترونات، هي أصغر وحدات العنصر الذي يحتفظ بجميع خصائص هذا العنصر. يمكن نقل الإلكترونات أو مشاركتها أو التسبب في تفاوتات في الشحنة بين الذرات لإنشاء روابط، بما في ذلك الروابط الأيونية والتساهمية والهيدروجينية، بالإضافة إلى تفاعلات فان دير فال.
اتصالات فنية
الشكل\(\PageIndex{2}\): ما عدد النيوترونات الموجودة في الكربون-12 والكربون 13، على التوالي؟
- إجابة
-
يحتوي الكربون 12 على ستة نيوترونات. يحتوي الكربون 13 على سبعة نيوترونات.
الشكل\(\PageIndex{6}\): قد تعطي الذرة الإلكترونات أو تأخذها أو تشاركها مع ذرة أخرى لتحقيق غلاف التكافؤ الكامل، وهو التكوين الإلكتروني الأكثر استقرارًا. بالنظر إلى هذا الشكل، ما عدد الإلكترونات التي تحتاج عناصر المجموعة 1 إلى فقدانها من أجل تحقيق تكوين إلكتروني مستقر؟ ما عدد الإلكترونات التي تحتاج العناصر في المجموعتين 14 و17 إلى اكتسابها لتحقيق تكوين مستقر؟
- إجابة
-
تحتاج العناصر في المجموعة 1 إلى فقدان إلكترون واحد لتحقيق تكوين إلكتروني مستقر. تحتاج العناصر في المجموعتين 14 و 17 إلى الحصول على أربعة إلكترونات وواحد، على التوالي، لتحقيق تكوين مستقر.
مسرد المصطلحات
- أنيون
- أيون سالب يتكون من ذرة تكتسب إلكترونًا واحدًا أو أكثر
- ذرة
- أصغر وحدة من المادة تحتفظ بجميع الخصائص الكيميائية للعنصر
- الكتلة الذرية
- المتوسط المحسوب للعدد الكتلي لنظائر العنصر
- عدد ذري
- إجمالي عدد البروتونات في الذرة
- معادلة كيميائية موزونة
- بيان التفاعل الكيميائي مع عدد كل نوع من الذرات بالتساوي لكل من المنتجات والمواد المتفاعلة
- كاتيون
- أيون إيجابي يتكون من ذرة تفقد إلكترونًا واحدًا أو أكثر
- رابطة كيميائية
- التفاعل بين اثنين أو أكثر من الذرات نفسها أو المختلفة مما يؤدي إلى تكوين جزيئات
- تفاعل كيميائي
- عملية تؤدي إلى إعادة ترتيب الذرات في الجزيئات
- التفاعل الكيميائي
- القدرة على الاندماج والترابط كيميائياً مع بعضها البعض
- مركب
- مادة تتكون من جزيئات تتكون من ذرات من عنصرين مختلفين على الأقل
- رابطة تساهمية
- نوع الرابطة القوية المتكونة بين عنصرين متشابهين أو عنصرين مختلفين؛ تتشكل عند مشاركة الإلكترونات بين الذرات
- بالكهرباء
- أيون ضروري لتوصيل النبضات العصبية وتقلصات العضلات وتوازن الماء
- إلكترون
- جسيم دون ذري سالب الشحنة يتواجد خارج النواة في مدار الإلكترون؛ يفتقر إلى الكتلة الوظيفية وله شحنة سالبة تبلغ -1 وحدة
- تكوين الإلكترون
- ترتيب الإلكترونات في الغلاف الإلكتروني للذرة (على سبيل المثال، 1s 2 2s 2 2p 6)
- مدار الإلكترون
- كيفية توزيع الإلكترونات مكانيًا حول النواة؛ المنطقة التي من المرجح أن يوجد فيها الإلكترون
- نقل الإلكترون
- حركة الإلكترونات من عنصر إلى آخر؛ مهمة في إنشاء الروابط الأيونية
- السالبة الإلكترونية
- قدرة بعض العناصر على جذب الإلكترونات (غالبًا من ذرات الهيدروجين)، والحصول على شحنات سالبة جزئية في الجزيئات وإنشاء شحنات موجبة جزئية على ذرات الهيدروجين
- جزء
- واحدة من 118 مادة فريدة لا يمكن تقسيمها إلى مواد أصغر؛ كل عنصر له خصائص فريدة وعدد محدد من البروتونات
- حالة توازن
- حالة ثابتة للمتفاعل النسبي وتركيز المنتج في التفاعلات الكيميائية العكسية في نظام مغلق
- رابطة هيدروجينية
- رابطة ضعيفة بين ذرات الهيدروجين ذات الشحنة الإيجابية قليلاً إلى الذرات ذات الشحنة السالبة قليلاً في الجزيئات الأخرى
- غاز خامل
- عنصر (أيضًا الغاز النبيل) مع غلاف إلكتروني خارجي مملوء لا يتفاعل مع الذرات الأخرى
- أيون
- ذرة أو مجموعة كيميائية لا تحتوي على أعداد متساوية من البروتونات والإلكترونات
- رابطة أيونية
- رابطة كيميائية تتكون بين الأيونات ذات الشحنات المعاكسة (الكاتيونات والأنيونات)
- تفاعل كيميائي لا رجعة فيه
- تفاعل كيميائي حيث تتقدم المواد المتفاعلة بشكل أحادي الاتجاه لتشكيل المنتجات
- نظير
- شكل واحد أو أكثر لعنصر يحتوي على أعداد مختلفة من النيوترونات
- قانون العمل الجماعي
- القانون الكيميائي الذي ينص على أن معدل التفاعل يتناسب مع تركيز المواد المتفاعلة
- رقم الكتلة
- إجمالي عدد البروتونات والنيوترونات في الذرة
- شيء
- أي شيء له كتلة ويحتل مساحة
- مركب
- ذرتان أو أكثر مرتبطتان كيميائيًا معًا
- النيوترون
- جسيم غير مشحون موجود في نواة الذرة؛ كتلته آمو واحد
- الغاز النبيل
- انظر الغاز الخامل
- رابطة تساهمية غير قطبية
- نوع الرابطة التساهمية التي تتكون بين الذرات عندما يتم تقاسم الإلكترونات بالتساوي بينها
- نواة
- نواة الذرة؛ تحتوي على البروتونات والنيوترونات
- قاعدة الثمانيات
- قاعدة أن الذرات تكون أكثر استقرارًا عندما تحمل ثمانية إلكترونات في أصدافها الخارجية
- المداري
- المنطقة المحيطة بالنواة؛ تحتوي على إلكترونات
- الجدول الدوري
- مخطط تنظيمي للعناصر يشير إلى العدد الذري والكتلة الذرية لكل عنصر؛ يوفر معلومات أساسية حول خصائص العناصر
- رابطة تساهمية قطبية
- نوع الرابطة التساهمية التي تتكون نتيجة المشاركة غير المتكافئة للإلكترونات، مما يؤدي إلى إنشاء مناطق مشحونة موجبة قليلاً وسلبية قليلاً للجزيء
- المنتج
- جزيء موجود على الجانب الأيمن من المعادلة الكيميائية
- بروتون
- جسيم موجبة الشحنة موجود في نواة الذرة؛ كتلته آمو واحد وشحنته +1
- النظائر المشعة
- نظير ينبعث منه إشعاع يتكون من جزيئات دون ذرية لتشكيل عناصر أكثر استقرارًا
- المتفاعل
- جزيء موجود على الجانب الأيسر من المعادلة الكيميائية
- تفاعل كيميائي معكوس
- تفاعل كيميائي يعمل ثنائي الاتجاه، حيث قد تتحول المنتجات إلى مواد تفاعلية إذا كان تركيزها كبيرًا بدرجة كافية
- قذيفة التكافؤ
- الغلاف الخارجي للذرة
- تفاعل فان دير فال
- تفاعل ضعيف جدًا بين الجزيئات بسبب الشحنات المؤقتة التي تجذب الذرات القريبة جدًا من بعضها


