17.1: النظائر المشعة
- Page ID
- 169284
تذكر أن الذرة هي أصغر مكون لعنصر يحتفظ بجميع الخصائص الكيميائية لهذا العنصر (انظر المادة). كما نوقش سابقًا، تحتوي الذرات على نيوترونات غير مشحونة وبروتونات موجبة الشحنة في النواة. تحيط الإلكترونات سالبة الشحنة بالنواة. يتم تحديد الكتلة الذرية للذرة من خلال عدد البروتونات والنيوترونات لأن كتلة الإلكترونات ضئيلة. يزن كل بروتون أو نيوترون وحدة كتلة ذرية واحدة (AMU). قيم الكتلة الذرية المعروضة في الجدول الدوري للعناصر ليست أرقامًا صحيحة لأنها تمثل متوسط الكتلة الذرية لذرات هذا العنصر (الشكل\(\PageIndex{a}\)). لا تحتوي ذرات العنصر نفسه بالضرورة على نفس الكتلة لأنها يمكن أن تختلف في عدد النيوترون.
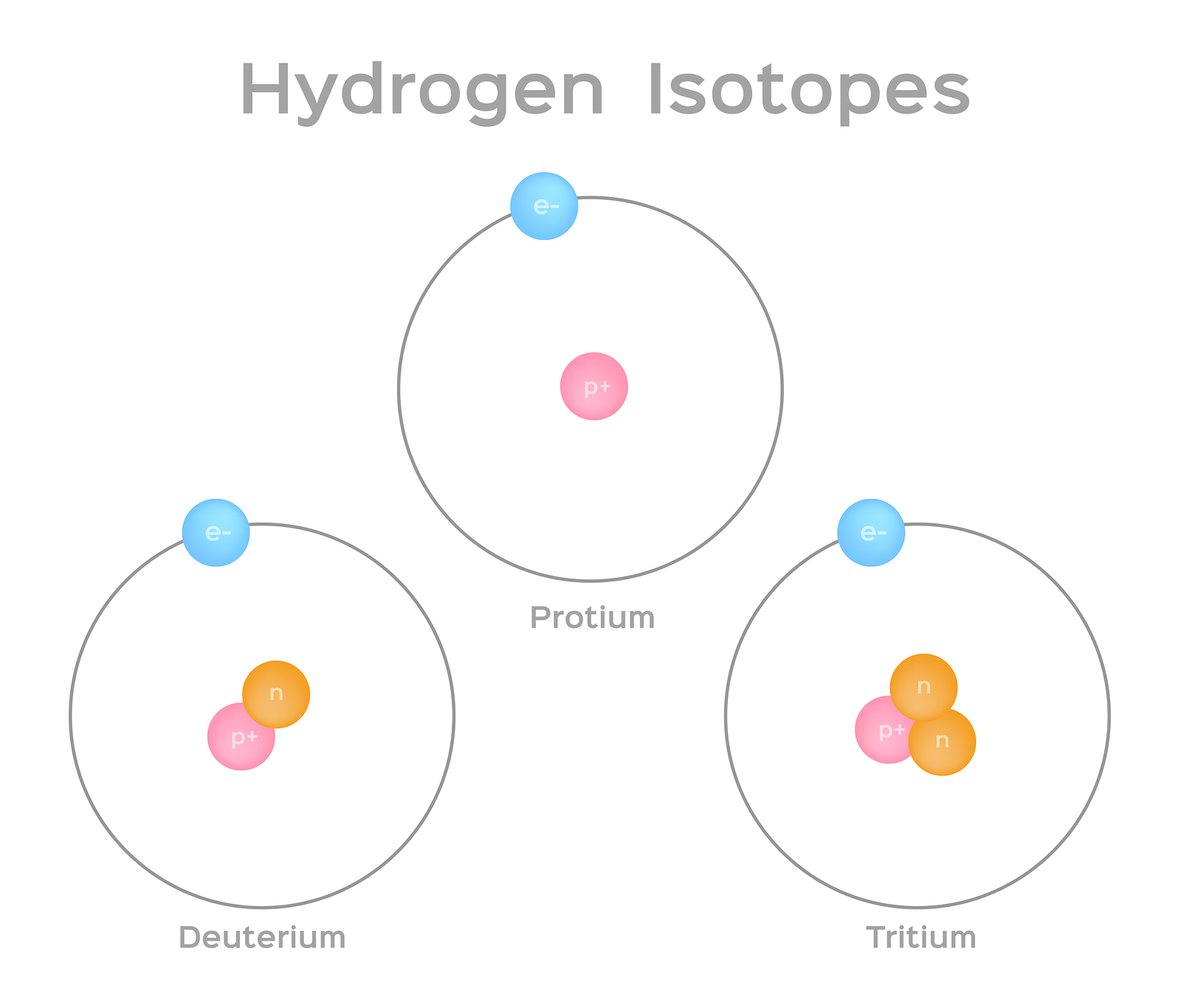
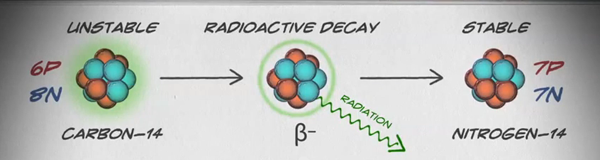
النظائر هي أشكال مختلفة من نفس العنصر لها نفس عدد البروتونات، ولكن عددًا مختلفًا من النيوترونات. تحتوي بعض العناصر، مثل الكربون والبوتاسيوم واليورانيوم، على نظائر طبيعية. يحتوي الكربون 12، وهو أكثر نظائر الكربون شيوعًا، على ستة بروتونات وستة نيوترونات. لذلك، يبلغ عدد كتلته 12 (ستة بروتونات وستة نيوترونات) وعدد ذري 6 (مما يجعله كربونًا). يحتوي الكربون 14 على ستة بروتونات وثمانية نيوترونات. لذلك، يبلغ عدد كتلته 14 (ستة بروتونات وثمانية نيوترونات) والعدد الذري 6، مما يعني أنه لا يزال عنصر الكربون. هذان الشكلان البديلان من الكربون هما النظائر. بعض النظائر غير مستقرة وتنبعث منها إشعاعات في شكل جزيئات وطاقة لتكوين عناصر أكثر استقرارًا. بعض أشكال الإشعاع خطيرة. وتسمى هذه النظائر المشعة أو النظائر المشعة (الشكل\(\PageIndex{b}\)). أثناء التحلل الإشعاعي، يمكن أن يتحول نوع واحد من الذرات إلى نوع آخر من الذرات بهذه الطريقة (الشكل\(\PageIndex{c}\)).
نصف الحياة
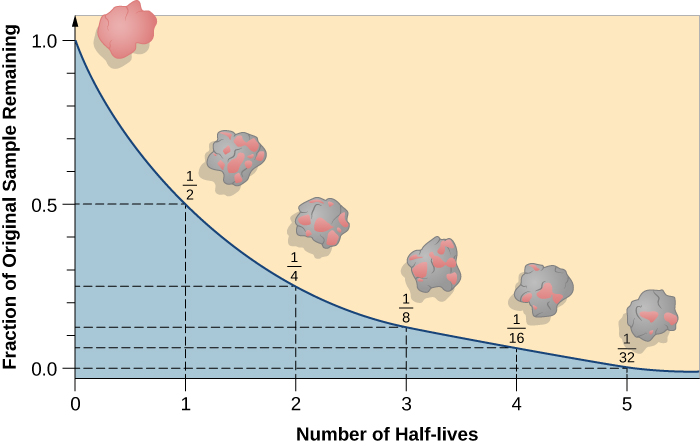
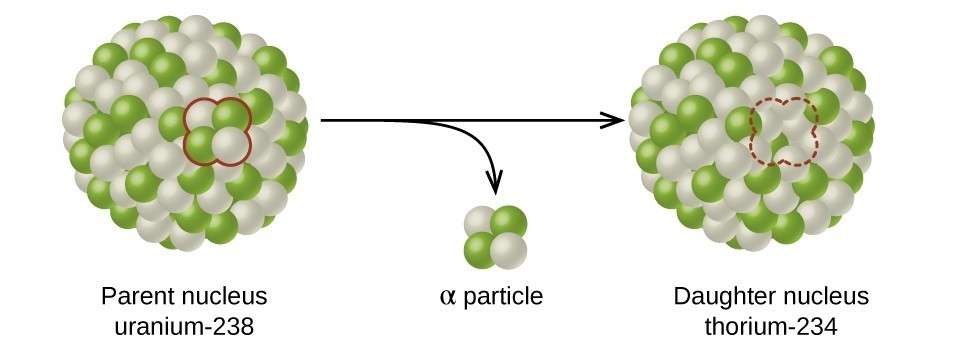
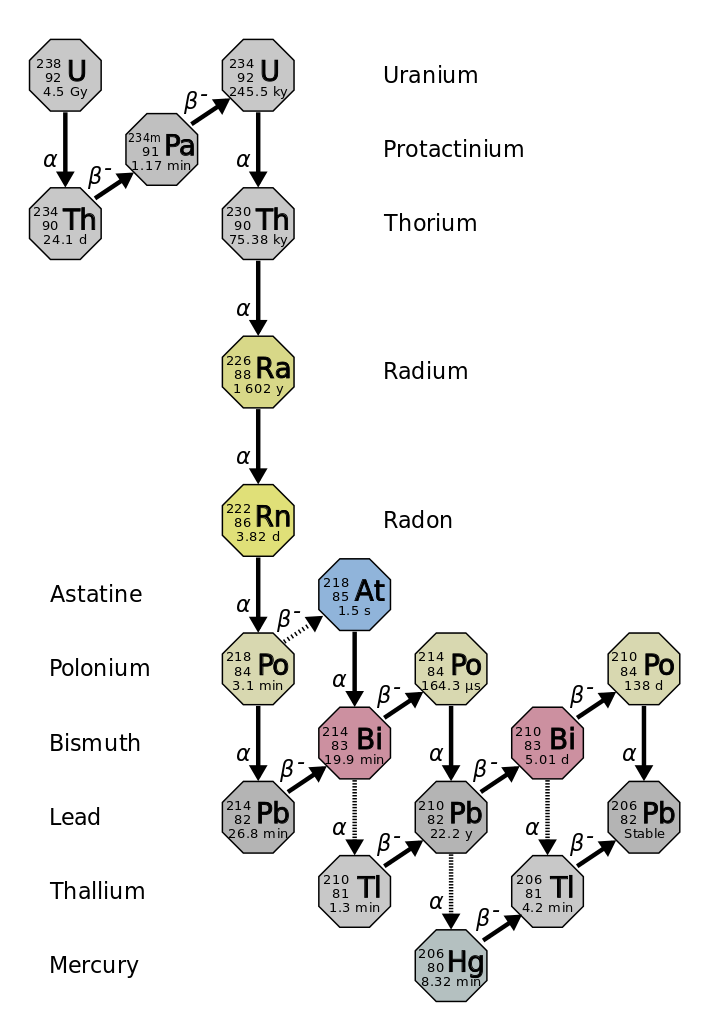
عمر النصف هو مقدار الوقت الذي يستغرقه نصف النظير المشع الأصلي للتحلل (الشكل\(\PageIndex{d}\)). على سبيل المثال، يبلغ نصف عمر اليورانيوم 238 حوالي 4.5 مليار سنة. بعد 4.5 مليار سنة، سيبقى فقط نصف (50٪) من الكمية الأصلية من اليورانيوم 238. سيتحلل الباقي إلى الثوريوم 234 (وهو أيضًا مادة مشعة ويتحلل بسرعة إلى سلسلة من النظائر المشعة، حتى يصبح في النهاية الرصاص 206، وهو أمر مستقر؛ الشكل\(\PageIndex{e-f}\)). بعد نصف عمر (9 مليارات سنة)، سيبقى نصف نسبة 50٪ فقط (25٪ من الأصل). بعد ثلاث فترات نصف عمر، سيبقى 12.5٪ فقط من اليورانيوم 238 الأصلي.
التطور في العمل: تأريخ الكربون
الكربون 14 (14 درجة مئوية) هو نظير مشع طبيعي يتم إنشاؤه في الغلاف الجوي بواسطة الأشعة الكونية. هذه عملية مستمرة، لذلك يتم دائمًا إنشاء المزيد من 14 درجة مئوية. مع تطور الكائن الحي، فإن المستوى النسبي لـ 14 درجة مئوية في جسمه يساوي تركيز 14 درجة مئوية في الغلاف الجوي. عندما يموت كائن حي، لم يعد يتناول 14 درجة مئوية، وبالتالي ستنخفض النسبة. تتحلل درجة حرارة 14 درجة مئوية إلى 14 نيوتن من خلال عملية تسمى تحلل بيتا؛ وتنتج الطاقة في هذه العملية البطيئة (الشكل\(\PageIndex{c}\)). بعد ما يقرب من 5730 عامًا، سيتم تحويل نصف تركيز البداية البالغ 14 درجة مئوية فقط إلى 14 نيوتن، ويُطلق على الوقت الذي يستغرقه نصف التركيز الأصلي للنظير للتحلل إلى شكله الأكثر استقرارًا اسم نصف عمره.
نظرًا لأن عمر النصف البالغ 14 درجة مئوية طويل، فإنه يُستخدم لتحديد عمر الكائنات الحية سابقًا، مثل الحفريات. باستخدام نسبة تركيز 14 درجة مئوية الموجود في جسم ما إلى كمية 14 درجة مئوية المكتشفة في الغلاف الجوي، يمكن تحديد كمية النظائر التي لم تتحلل بعد. بناءً على هذا المبلغ، يمكن حساب عمر الحفرية بحوالي 50000 عام (الشكل\(\PageIndex{g}\) أدناه). تستخدم النظائر ذات نصف العمر الأطول، مثل البوتاسيوم 40، لحساب أعمار الحفريات القديمة. من خلال استخدام التأريخ الكربوني، يمكن للعلماء إعادة بناء البيئة والجغرافيا الحيوية للكائنات الحية التي تعيش خلال 50,000 سنة الماضية.
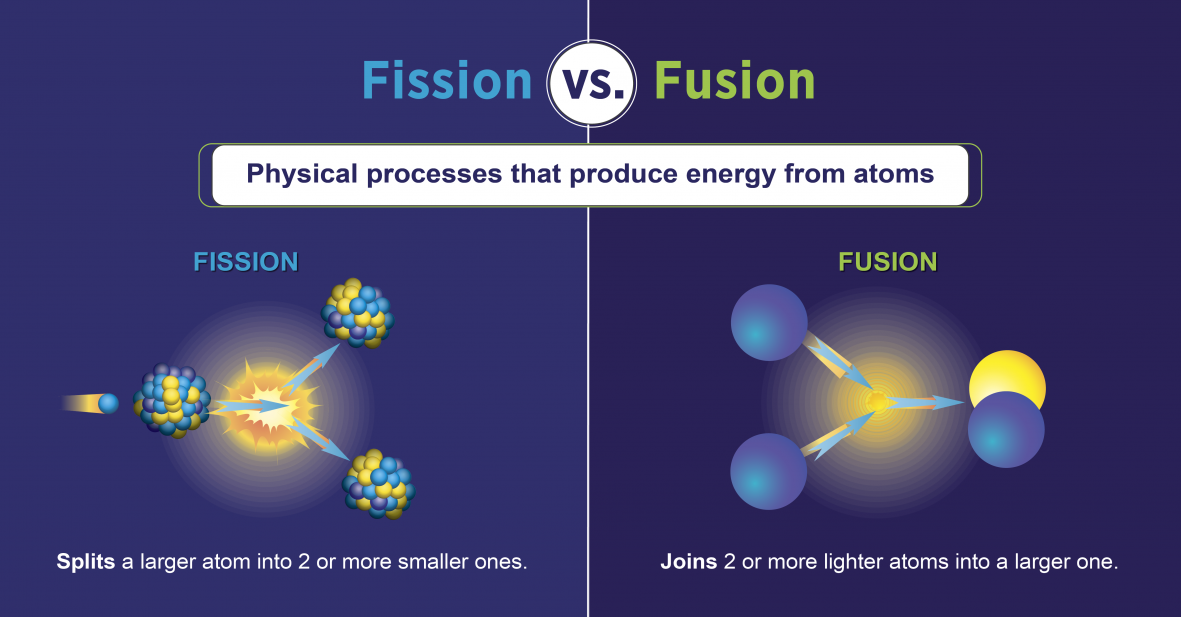
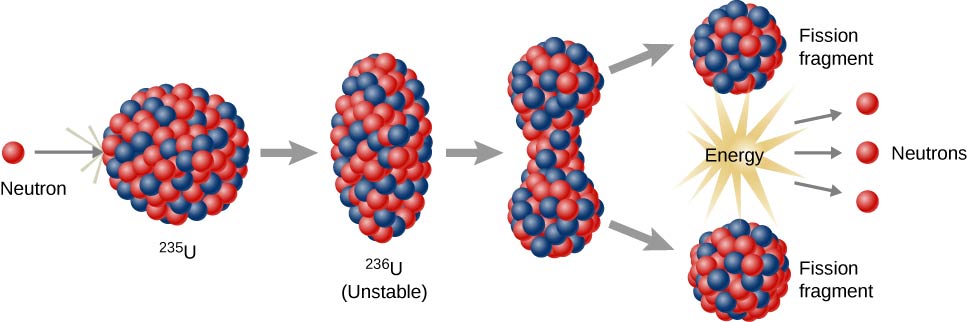
تفاعلات الانشطار النووي
تفاعلات الانشطار النووي هي تلك التي تنطوي على تقسيم نواة الذرة (الشكل\(\PageIndex{h}\)). يمكن استحداثها عن طريق تفجير العناصر المشعة بالنيوترونات. كما هو الحال مع التحلل الإشعاعي الطبيعي، فإن تفاعلات الانشطار النووي المستحثة تطلق الطاقة. يمكن استخدام الطاقة الحرارية المنبعثة عند الانشطار النووي لتوليد الكهرباء. هذا هو أساس الطاقة النووية. حاليًا، يتم استخدام اليورانيوم 235 (235 U؛ نظير اليورانيوم بكتلة ذرية 235) حاليًا كوقود لتفاعلات الانشطار النووي (الشكل\(\PageIndex{h}\)).