7.2: المسألة
- Page ID
- 169057
المادة هي «الأشياء» الموجودة في النظم البيئية. من الناحية الفنية، يتم تعريف المادة على أنها أي شيء يشغل مساحة أو يحتوي على كتلة. الكتلة هي مقاومة التسارع. بعبارة أكثر بساطة، الكتلة تشبه الوزن، لكن الوزن يفسر التسارع بسبب الجاذبية. تنتقل المادة بين مكونات النظام البيئي الحيوي وغير الحيوي من خلال الدورات البيوجيوكيميائية. يتطلب الفهم الكامل لهذه الدورات خلفية في الجسيمات التي تتكون منها المادة والذرات.
الذرات والجزيئات
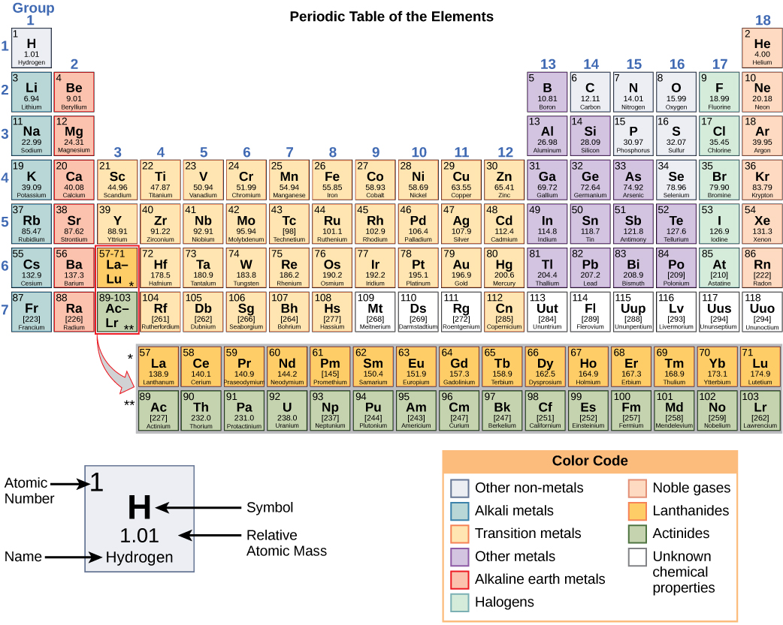
العناصر هي مواد لا يمكن تكسيرها أو تحويلها كيميائيًا إلى مواد أخرى (الشكل\(\PageIndex{a}\)). تم تحديد ما مجموعه 118 عنصرًا؛ ومع ذلك، يوجد 92 عنصرًا فقط بشكل طبيعي وأقل من 30 عنصرًا في الكائنات الحية. العناصر الـ 26 المتبقية غير مستقرة وبالتالي فهي غير موجودة لفترة طويلة جدًا أو نظرية ولم يتم اكتشافها بعد. يتم تحديد كل عنصر برمزه الكيميائي (مثل H و N و O و C و Na)، ويمتلك خصائص فريدة. تسمح هذه الخصائص الفريدة للعناصر بالاندماج والترابط مع بعضها البعض بطرق محددة.
الذرة هي أصغر مكون لعنصر يحتفظ بجميع الخصائص الكيميائية لهذا العنصر. على سبيل المثال، تحتوي ذرة هيدروجين واحدة على جميع خصائص عنصر الهيدروجين، مثل وجودها كغاز في درجة حرارة الغرفة وترتبط بالأكسجين لتكوين جزيء مائي. لا يمكن تقسيم ذرات الهيدروجين إلى أي شيء أصغر مع الاحتفاظ بخصائص الهيدروجين. إذا تم تقسيم ذرة الهيدروجين إلى جزيئات أصغر، فلن تعود لها خصائص الهيدروجين. على المستوى الأساسي، تتكون جميع الكائنات الحية من مزيج من العناصر. تحتوي على ذرات تتحد معًا لتكوين جزيئات. يمكن أن تتفاعل الجزيئات لتشكيل الخلايا والوحدات الهيكلية والوظيفية للحياة. في الكائنات متعددة الخلايا، مثل الحيوانات، تتحد هذه الخلايا لتشكل الأنسجة التي تشكل الأعضاء. تستمر هذه المجموعات حتى تتشكل كائنات حية متعددة الخلايا بأكملها.
تتحد الذرات لتشكل جزيئات. الجزيئات عبارة عن مواد كيميائية تتكون من ذرتين أو أكثر مرتبطة ببعضها البعض. بعض الجزيئات بسيطة للغاية، مثل O 2، والتي تتكون من ذرتين فقط من الأكسجين. بعض الجزيئات التي تستخدمها الكائنات الحية، مثل الحمض النووي، تتكون من ملايين الذرات. تحتوي جميع الذرات على البروتونات والإلكترونات والنيوترونات (الشكل\(\PageIndex{b}\)). الاستثناء الوحيد هو الهيدروجين (H)، والذي يتكون عادةً من بروتون واحد وإلكترون واحد فقط. البروتون هو جسيم ذو شحنة موجبة يتواجد في نواة الذرة (جوهر الذرة) وكتلته 1 وشحنته +1. الإلكترون هو جسيم سالب الشحنة ينتقل في الفضاء المحيط بالنواة. وبعبارة أخرى، فهي موجودة خارج النواة. كتلته ضئيلة وشحنته —1. توجد النيوترونات، مثل البروتونات، في نواة الذرة. لديهم كتلة 1 وبدون تكلفة. تعمل الشحنات الموجبة (البروتونات) والسالبة (الإلكترونات) على موازنة بعضها البعض في ذرة محايدة ذات شحنة صافية صفرية.
يحتوي كل عنصر على عدد مختلف من البروتونات والنيوترونات، مما يمنحه العدد الذري ورقم الكتلة الخاص به. العدد الذري للعنصر يساوي عدد البروتونات التي يحتوي عليها العنصر. العدد الكتلي هو عدد البروتونات بالإضافة إلى عدد النيوترونات لهذا العنصر. لذلك، من الممكن تحديد عدد النيوترونات بطرح العدد الذري من العدد الكتلي.
روابط كيميائية
تعتمد كيفية تفاعل العناصر مع بعضها البعض على عدد الإلكترونات وكيفية ترتيبها. عندما لا تحتوي الذرة على أعداد متساوية من البروتونات والإلكترونات، فإنها تسمى الأيون. نظرًا لأن عدد الإلكترونات لا يساوي عدد البروتونات، فإن كل أيون له شحنة صافية. على سبيل المثال، إذا فقد الصوديوم إلكترونًا، فإنه يحتوي الآن على 11 بروتونًا و10 إلكترونات فقط، مما يجعله يحمل شحنة إجمالية قدرها +1. تتكون الأيونات الموجبة عن طريق فقدان الإلكترونات وتسمى الكاتيونات. تتكون الأيونات السالبة من خلال اكتساب الإلكترونات وتسمى الأنيونات. يتم تغيير الأسماء الأنيونية الأولية لتنتهي بـ -ide. على سبيل المثال، عندما يصبح الكلور أيون، يشار إليه بالكلوريد.
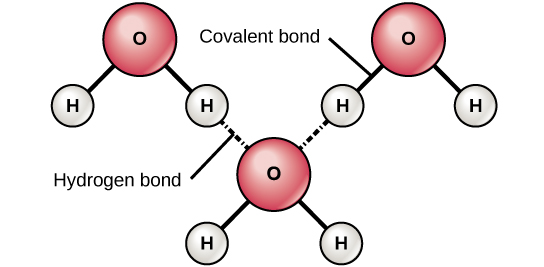
الروابط الأيونية والتساهمية هي روابط قوية تتكون بين ذرتين. تجمع هذه الروابط الذرات معًا في حالة مستقرة نسبيًا. تتكون الروابط الأيونية بين أيونين متعاكسين (أنيون وكاتيون). نظرًا لأن الشحنات الموجبة والسالبة تجتذب، يتم تجميع هذه الأيونات معًا تمامًا مثل مغناطيسين مشحونين معاكسين يلتصقان معًا. تتكون الروابط التساهمية عند مشاركة الإلكترونات بين ذرتين. تشترك كل ذرة في واحدة من إلكتروناتها، والتي تدور بعد ذلك حول نوى كلتا الذرتين، وتمسك الذرتين معًا. الروابط التساهمية هي الشكل الأقوى والأكثر شيوعًا للروابط الكيميائية في الكائنات الحية. على عكس معظم الروابط الأيونية، لا تتفكك الروابط التساهمية في الماء. تتكون الروابط الهيدروجينية عندما يكون للجزيئات توزيع غير متساوٍ للإلكترونات وبالتالي يكون لها نهايات إيجابية جزئيًا وسالبة جزئيًا. وبالتالي فهي تنجذب إلى بعضها البعض (الشكل\(\PageIndex{c}\)). من الناحية الفنية، تحدث الروابط الهيدروجينية فقط بين الهيدروجين والأكسجين (O) أو النيتروجين (N) أو الفلور (F). في بعض الأحيان تربط الروابط الهيدروجينية أجزاء مختلفة أو جزيئات كبيرة، كما هو الحال في الحمض النووي والبروتينات. الروابط الهيدروجينية أضعف من الروابط الأيونية والتساهمية ويمكن أن تنكسر بسهولة. (لاحظ أن الروابط الهيدروجينية هي من بين أقوى القوى بين الجزيئات، ولكن تلك التي تحدث بين الجزيئات.)
الجزيئات البيولوجية الكبيرة
تحتوي الكائنات الحية على جزيئات عضوية كبيرة تسمى الجزيئات البيولوجية الكبيرة. الجزيئات العضوية هي تلك التي تحتوي على الكربون المرتبط تساهميًا بالهيدروجين. (في المقابل، تفتقر الجزيئات غير العضوية إلى الكربون المرتبط بالهيدروجين وغالبًا ما تكون أبسط من الجزيئات العضوية.) بالإضافة إلى ذلك، قد تحتوي على الأكسجين والنيتروجين والفوسفور والكبريت وعناصر إضافية. هناك أربع فئات رئيسية من الجزيئات البيولوجية الكبيرة: الكربوهيدرات والدهون والبروتينات والأحماض النووية. كل منها مكون مهم للخلية ويقوم بمجموعة واسعة من الوظائف.
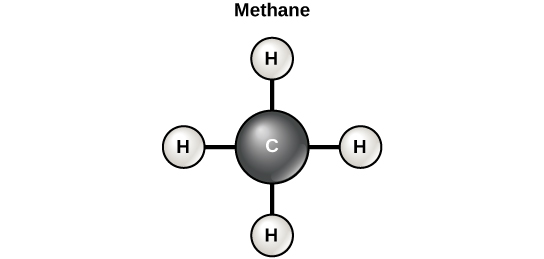
غالبًا ما يقال أن الحياة «قائمة على الكربون». وهذا يعني أن ذرات الكربون، المرتبطة بذرات الكربون الأخرى أو العناصر الأخرى، تشكل المكونات الأساسية للعديد من الجزيئات الموجودة بشكل فريد في الكائنات الحية. تلعب العناصر الأخرى أدوارًا مهمة في الجزيئات البيولوجية، لكن الكربون يعتبر بالتأكيد العنصر «الأساسي» للجزيئات في الكائنات الحية. إن خصائص الترابط لذرات الكربون هي المسؤولة عن دورها المهم. يمكن أن يشكل الكربون أربع روابط تساهمية مع ذرات أو جزيئات أخرى. أبسط جزيء كربون عضوي هو الميثان (CH 4)، حيث ترتبط أربع ذرات هيدروجين بذرة كربون (الشكل\(\PageIndex{d}\)).
تشمل الكربوهيدرات ما يشار إليه عادة بالسكريات البسيطة، مثل الجلوكوز، والكربوهيدرات المعقدة مثل النشا. في حين يتم استخدام العديد من أنواع الكربوهيدرات للطاقة، يتم استخدام بعضها للتركيب من قبل معظم الكائنات الحية، بما في ذلك النباتات والحيوانات. على سبيل المثال، السليلوز هو كربوهيدرات معقد يضيف صلابة وقوة للطبقة الخارجية للخلايا النباتية (جدران الخلايا).
تشتمل الدهون على مجموعة متنوعة من المركبات التي توحدها ميزة مشتركة: الدهون غير قابلة للذوبان في الماء. تؤدي الدهون العديد من الوظائف المختلفة في الخلية. تقوم الخلايا بتخزين الطاقة للاستخدام طويل الأمد في شكل دهون تسمى الدهون. توفر الدهون أيضًا عزلًا عن البيئة للنباتات والحيوانات. على سبيل المثال، تساعد في الحفاظ على جفاف الطيور والثدييات المائية بسبب طبيعتها المقاومة للماء. الدهون هي أيضًا اللبنات الأساسية للعديد من الهرمونات وهي مكون مهم للأغشية التي تحيط بالخلايا وتشكل العديد من هياكلها الداخلية.
البروتينات هي واحدة من أكثر الجزيئات العضوية وفرة في الأنظمة الحية ولديها مجموعة متنوعة من الوظائف لجميع الجزيئات الكبيرة. كلها بوليمرات من الأحماض الأمينية. وظائف البروتينات متنوعة للغاية لأن هناك 20 حمضًا أمينيًا مختلفًا متميزًا كيميائيًا تشكل سلاسل طويلة، ويمكن أن تكون الأحماض الأمينية بأي ترتيب. يمكن أن تعمل البروتينات في التفاعلات الكيميائية الميسرة في الكائنات الحية، مثل التمثيل الضوئي، ونقل الرسائل كهرمونات، مما يتسبب في تقلص العضلات، وأكثر من ذلك بكثير.
الأحماض النووية هي جزيئات كبيرة جدًا مهمة لاستمرارية الحياة. إنها تحمل المخطط الجيني للخلية وبالتالي التعليمات الخاصة بوظائفها. النوعان الرئيسيان من الأحماض النووية هما حمض الديوكسي ريبونوكلييك (DNA) وحمض الريبونوكلييك (RNA). الحمض النووي هو المادة الوراثية الموجودة في جميع الكائنات الحية، بدءًا من البكتيريا أحادية الخلية إلى الثدييات متعددة الخلايا. النوع الآخر من الحمض النووي، RNA، يشارك في الغالب في تخليق البروتين. يتكون الحمض النووي والحمض النووي الريبي من كتل بناء صغيرة تعرف باسم النيوكليوتيدات. يحتوي الحمض النووي على بنية حلزونية مزدوجة جميلة (الشكل\(\PageIndex{e}\)).


