11.7: ויסות גנים - תורת האופרון
- Page ID
- 208875
מטרות למידה
- השווה אופרונים הניתנים להשראה ואופרונים הניתנים להדחקה
- תאר מדוע ויסות האופרונים חשוב
כל תא בעל גרעין באורגניזם רב תאי מכיל עותקים של אותו DNA. באופן דומה, כל התאים בשתי תרביות חיידקים טהורות שחוסנו מאותה מושבה מתחילה מכילים את אותו DNA, למעט שינויים הנובעים ממוטציות ספונטניות. אם לכל תא באורגניזם רב תאי יש אותו DNA, אז איך זה שתאים בחלקים שונים בגוף האורגניזם מציגים מאפיינים שונים? באופן דומה, איך זה שאותם תאים חיידקיים בתוך שתי תרבויות טהורות החשופות לתנאי סביבה שונים יכולים להציג פנוטיפים שונים? בשני המקרים, כל תא זהה גנטית אינו מפעיל, או מבטא, את אותה קבוצת גנים. רק תת-קבוצה של חלבונים בתא בזמן נתון מתבטאת.
DNA גנומי מכיל גם גנים מבניים, המקודדים למוצרים המשמשים כמבנים תאיים או אנזימים, וגם גנים מווסתים, המקודדים למוצרים המווסתים את ביטוי הגנים. הביטוי של גן הוא תהליך מוסדר מאוד. בעוד ויסות ביטוי גנים באורגניזמים רב-תאיים מאפשר התמיינות תאית, באורגניזמים חד-תאיים כמו פרוקריוטים, הוא מבטיח בעיקר שמשאבי התא לא יתבזבזו בייצור חלבונים שהתא אינו זקוק להם באותו זמן.
הבהרת המנגנונים השולטים בביטוי הגנים חשובה להבנת בריאות האדם. תקלות בתהליך זה בבני אדם מובילות להתפתחות סרטן ומחלות אחרות. הבנת האינטראקציה בין ביטוי הגנים של פתוגן לזה של המארח האנושי שלו חשובה להבנת מחלה זיהומית מסוימת. ויסות גנים כרוך ברשת מורכבת של אינטראקציות בתוך תא נתון בין אותות מסביבת התא, מולקולות איתות בתוך התא וה- DNA של התא. אינטראקציות אלה מובילות לביטוי של גנים מסוימים ולדיכוי של אחרים, בהתאם לנסיבות.
פרוקריוטים ואיקריוטים חולקים כמה קווי דמיון במנגנונים שלהם לוויסות ביטוי הגנים; עם זאת, ביטוי גנים באוקריוטים מסובך יותר בגלל ההפרדה הזמנית והמרחבית בין תהליכי התעתיק והתרגום. לפיכך, למרות שרוב הוויסות של ביטוי הגנים מתרחש באמצעות בקרת תעתיק בפרוקריוטים, ויסות ביטוי הגנים באיקריוטים מתרחש ברמת התעתיק ופוסט-תעתיק (לאחר ביצוע התמליל העיקרי).
ויסות גנים פרוקריוטיים
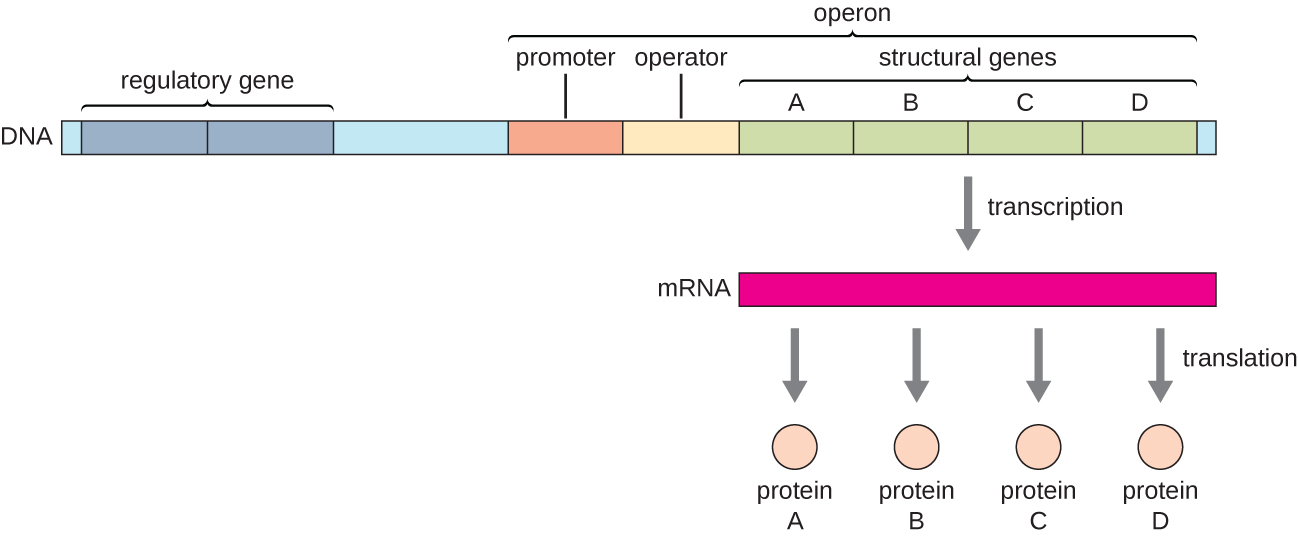
בחיידקים ובארכאה, חלבונים מבניים בעלי פונקציות קשורות מקודדים בדרך כלל יחד בתוך הגנום בבלוק הנקרא אופרון ומתועתקים יחד בשליטת מקדם יחיד, וכתוצאה מכך נוצר תמליל פוליציסטרוני (איור). \(\PageIndex{1}\) בדרך זו, ניתן לשלוט בו זמנית בוויסות התעתיק של כל הגנים המבניים המקודדים לאנזימים המזרזים את השלבים הרבים במסלול ביוכימי יחיד, מכיוון שכולם יהיו נחוצים בו זמנית, או שלא יהיה צורך באף אחד מהם. לדוגמה, ב אי - קולי, כל הגנים המבניים המקודדים לאנזימים הדרושים לשימוש בלקטוז כמקור אנרגיה נמצאים זה ליד זה באופרון הלקטוז (או lac) בשליטת מקדם יחיד, מקדם lac. המדענים הצרפתים פרנסואה ג'ייקוב (1920—2013) וז'אק מונוד במכון פסטר היו הראשונים שהראו את ארגון הגנים החיידקיים לאופרונים, באמצעות מחקריהם על lac אופרון של אי - קולי. על עבודה זו הם זכו בפרס נובל לפיזיולוגיה או לרפואה בשנת 1965. למרות שגנים אוקריוטיים אינם מאורגנים לאופרונים, אופרונים פרוקריוטיים הם מודלים מצוינים ללמידה על ויסות גנים באופן כללי. ישנם כמה צבירי גנים באוקריוטים שמתפקדים בדומה לאופרונים. ניתן ליישם רבים מהעקרונות על מערכות אוקריוטיות ולתרום להבנתנו את השינויים בביטוי הגנים באיקריוטים שעלולים לגרום לשינויים פתולוגיים כגון סרטן.
כל אופרון כולל רצפי DNA המשפיעים על התעתיק שלו; אלה ממוקמים באזור הנקרא האזור הרגולטורי. האזור הרגולטורי כולל את האמרגן ואת האזור המקיף את האמרגן, שאליו יכולים להיקשר גורמי שעתוק, חלבונים המקודדים על ידי גנים רגולטוריים. גורמי שעתוק משפיעים על הקישור של RNA פולימראז לפרומוטור ומאפשרים להתקדמותו לתמלל גנים מבניים. מדכא הוא גורם שעתוק המדכא שעתוק של גן בתגובה לגירוי חיצוני על ידי קישור לרצף DNA בתוך האזור הרגולטורי הנקרא אופרטור, הנמצא בין אתר הקישור של RNA פולימראז של הפרומוטור לאתר ההתחלה התעתיק של הגן המבני הראשון. קישור מדכא חוסם פיזית את RNA פולימראז מתמלל גנים מבניים. לעומת זאת, מפעיל הוא גורם שעתוק המגביר את התעתיק של גן בתגובה לגירוי חיצוני על ידי הקלת קישור RNA פולימראז לפרומוטור. מעורר, סוג שלישי של מולקולה רגולטורית, הוא מולקולה קטנה המפעילה או מדכאת שעתוק על ידי אינטראקציה עם מדכא או מפעיל.
בפרוקריוטים, ישנן דוגמאות לאופרונים שתוצרי הגנים שלהם נדרשים באופן עקבי למדי, ולכן הביטוי שלהם אינו מוסדר. אופרונים כאלה באים לידי ביטוי מכונן, כלומר הם מתועתקים ומתורגמים ברציפות כדי לספק לתא רמות ביניים קבועות של מוצרי החלבון. גנים כאלה מקודדים לאנזימים המעורבים בתפקודי משק הבית הנדרשים לתחזוקה תאית, כולל שכפול, תיקון וביטוי של DNA, כמו גם אנזימים המעורבים במטבוליזם הליבה. לעומת זאת, ישנם אופרונים פרוקריוטיים אחרים המתבטאים רק בעת הצורך ומווסתים על ידי מדכאים, מפעילים ומעוררים.
תרגיל \(\PageIndex{1}\)
- מהם החלקים ברצף ה-DNA של אופרון?
- אילו סוגים של מולקולות רגולטוריות יש?
רגולציה על ידי דיכוי
אופרונים פרוקריוטיים נשלטים בדרך כלל על ידי קישור של מדכאים לאזורי מפעיל, ובכך מונעים את שעתוק הגנים המבניים. אופרונים כאלה מסווגים כאופרונים הניתנים להדחקה או אופרונים הניתנים להשראה. אופרונים ניתנים להדחקה, כמו טריפטופן (trp) אופרון, מכילים בדרך כלל גנים המקודדים לאנזימים הנדרשים למסלול ביו-סינתטי. כל עוד תוצר המסלול, כמו טריפטופן, ממשיך להידרש על ידי התא, אופרון שניתן להדחיק ימשיך להתבטא. עם זאת, כאשר תוצר המסלול הביוסינתטי מתחיל להצטבר בתא, ומסיר את הצורך בתא להמשיך לייצר יותר, הביטוי של האופרון מודחק. לעומת זאת, אופרונים הניתנים להשראה, כמו lac אופרון של אי - קולי, מכילים לעתים קרובות גנים המקודדים לאנזימים במסלול המעורב בחילוף החומרים של מצע ספציפי כמו לקטוז. אנזימים אלה נדרשים רק כאשר המצע הזה זמין, ולכן ביטוי של האופרונים נגרם בדרך כלל רק בנוכחות המצע.
האופרון trp: אופרון שניתן להדחיק
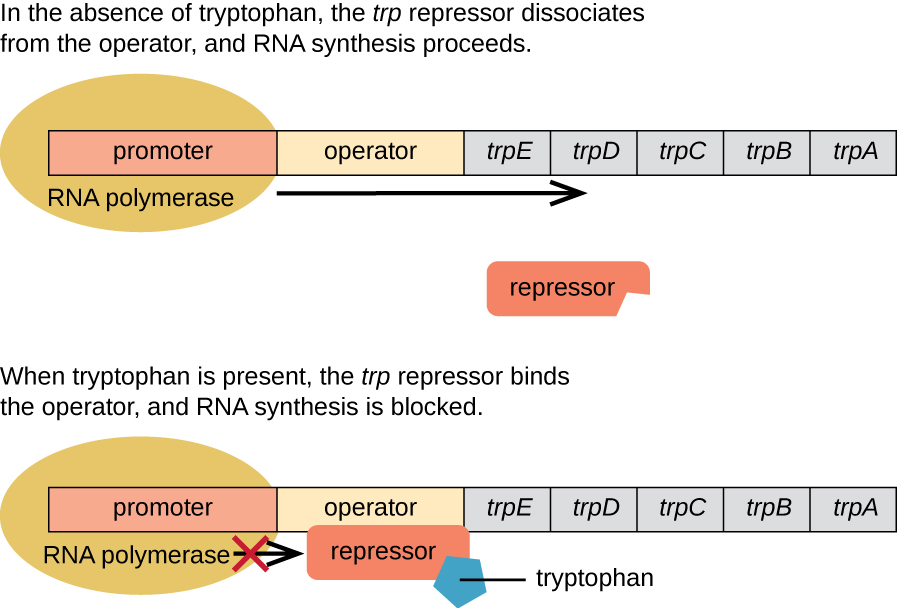
אי - קולי יכול לסנתז טריפטופן באמצעות אנזימים המקודדים על ידי חמישה גנים מבניים הממוקמים זה ליד זה באופרון trp (איור\(\PageIndex{2}\)). כאשר טריפטופן סביבתי נמוך, האופרון מופעל. המשמעות היא שתעתיק מתחיל, הגנים באים לידי ביטוי וטריפטופן מסונתז. עם זאת, אם טריפטופן קיים בסביבה, האופרון trp כבוי. התעתיק אינו מתרחש וטריפטופן אינו מסונתז.
כאשר טריפטופן אינו קיים בתא, המדכא כשלעצמו אינו נקשר למפעיל; לכן האופרון פעיל וטריפטופן מסונתז. עם זאת, כאשר טריפטופן מצטבר בתא, שתי מולקולות טריפטופן נקשרות למולקולת מדכא trp, שמשנה את צורתה, ומאפשרת לה להיקשר למפעיל trp. קישור זה של הצורה הפעילה של מדכא trp למפעיל חוסם RNA פולימראז מלתמלל את הגנים המבניים, ועוצר את ביטוי האופרון. לפיכך, התוצר בפועל של המסלול הביוסינתטי הנשלט על ידי האופרון מווסת את ביטוי האופרון.
צפה בסרטון זה כדי ללמוד עוד על האופרון trp.
האופרון לאק: אופרון מושרה
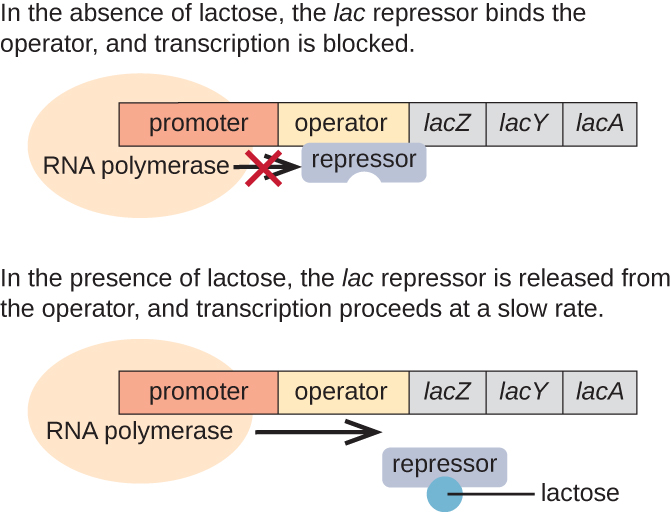
ה lac אופרון הוא דוגמה לאופרון הניתן להשראה שגם הוא נתון להפעלה בהיעדר גלוקוז (איור). \(\PageIndex{3}\) האופרון lac מקודד לשלושה גנים מבניים הדרושים לרכישה ועיבוד של הלקטוז הדו-סוכר מהסביבה, ומפרק אותו לסוכרים הפשוטים גלוקוז וגלקטוז. כדי שהלאק אופרון יבוא לידי ביטוי, לקטוז חייב להיות נוכח. זה הגיוני עבור התא כי זה יהיה בזבזני מבחינה אנרגטית ליצור את האנזימים לעיבוד לקטוז אם לקטוז לא היה זמין.
בהיעדר לקטוז, מדכא lac קשור לאזור המפעיל של lac אופרון, ומונע פיזית מ-RNA פולימראז לתמלל את הגנים המבניים. עם זאת, כאשר קיים לקטוז, הלקטוז שבתוך התא מומר לאולקטוזה. אלולקטוזה משמשת כמולקולת מעורר, נקשרת למדכא ומשנה את צורתה כך שהיא כבר לא תוכל להיקשר ל- DNA המפעיל. הסרת המדכא בנוכחות לקטוז מאפשרת ל-RNA פולימראז לנוע באזור המפעיל ולהתחיל בשעתוק של הגנים המבניים lac.
האופרון lac: הפעלה על ידי חלבון מפעיל קטבוליט
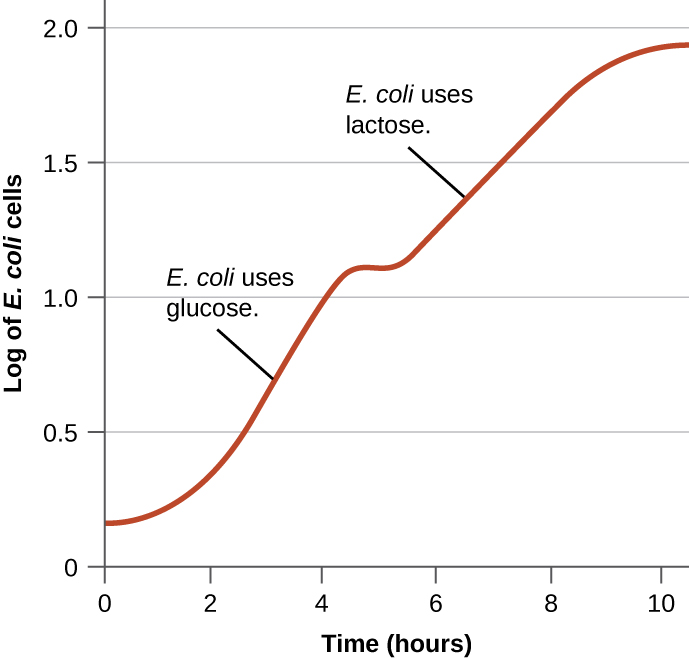
לחיידקים יש בדרך כלל את היכולת להשתמש במגוון מצעים כמקורות פחמן. עם זאת, מכיוון שגלוקוז עדיף בדרך כלל על מצעים אחרים, לחיידקים יש מנגנונים להבטיח כי משתמשים במצעים חלופיים רק כאשר הגלוקוז התרוקן. בנוסף, לחיידקים יש מנגנונים להבטיח שהגנים המקודדים לאנזימים לשימוש במצעים חלופיים יבואו לידי ביטוי רק כאשר המצע החלופי זמין. בשנות הארבעים, ז'אק מונוד היה הראשון שהדגים את העדפתם של מצעים מסוימים על פני אחרים באמצעות מחקריו על צמיחתו של אי - קולי כאשר הוא מתורבת בנוכחות שני מצעים שונים בו זמנית. מחקרים כאלה יצרו עקומות גדילה דיאוקסיות, כמו זו המוצגת באיור. \(\PageIndex{4}\) למרות שמשתמשים תחילה בגלוקוז המצע המועדף, E. coli גדל במהירות והאנזימים למטבוליזם של לקטוז נעדרים. עם זאת, ברגע שרמות הגלוקוז מתרוקנות, קצב הגדילה איטי, מה שגורם לביטוי האנזימים הדרושים לחילוף החומרים של המצע השני, לקטוז. שימו לב כיצד קצב הגדילה בלקטוז איטי יותר, כפי שמצוין על ידי התלילות הנמוכה יותר של עקומת הצמיחה.
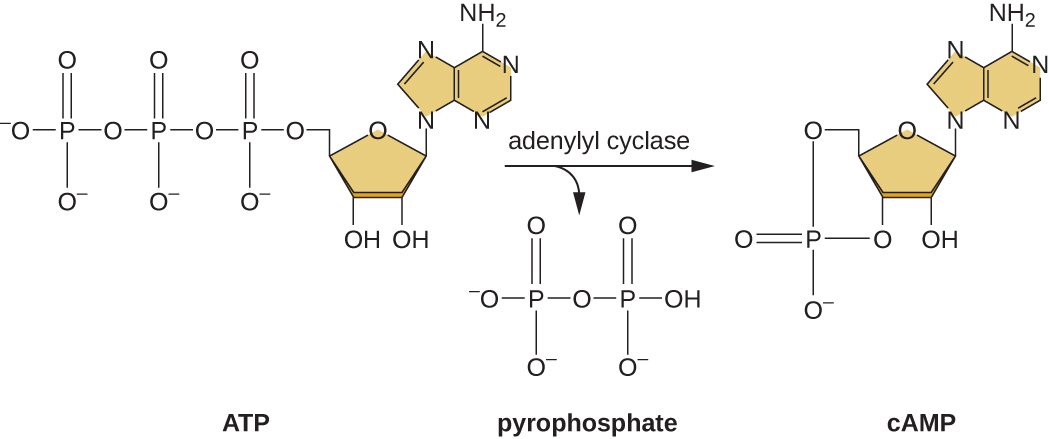
היכולת לעבור משימוש בגלוקוז למצע אחר כמו לקטוז היא תוצאה של פעילותו של אנזים הנקרא אנזים IIA (EIIA). כאשר רמות הגלוקוז יורדות, התאים מייצרים פחות ATP מקטבוליזם (ראה קטבוליזם של פחמימות), ו- EIIA הופך לפוספוריל. EIIA זרחני מפעיל אדניליל ציקלאז, אנזים הממיר חלק מה- ATP הנותר ל- AMP מחזורי (cAMP), נגזרת מחזורית של AMP ומולקולת איתות חשובה המעורבת במטבוליזם של גלוקוז ואנרגיה ב אי - קולי. כתוצאה מכך, רמות cAMP מתחילות לעלות בתא (איור\(\PageIndex{5}\)).
לאופרון lac יש גם תפקיד במעבר זה משימוש בגלוקוז לשימוש בלקטוז. כאשר הגלוקוז דל, ה- cAMP המצטבר הנגרם כתוצאה מפעילות מוגברת של אדניליל ציקלאז נקשר לחלבון מפעיל קטבוליט (CAP), המכונה גם חלבון קולטן cAMP (CRP). הקומפלקס נקשר לאזור האמרגן של lac אופרון (איור\(\PageIndex{6}\)). באזורים הרגולטוריים של אופרונים אלה, אתר קישור CAP ממוקם במעלה הזרם של אתר הקישור של RNA פולימראז בפרומוטור. קישור של קומפלקס CAP-cAMP לאתר זה מגביר את יכולת הקישור של RNA פולימראז לאזור האמרגן כדי ליזום את השעתוק של הגנים המבניים. לפיכך, במקרה של lac אופרון, כדי להתרחש שעתוק, לקטוז חייב להיות נוכח (הסרת החלבון lac repressor) ורמות הגלוקוז חייבות להתרוקן (מה שמאפשר קישור של חלבון מפעיל). כאשר רמות הגלוקוז גבוהות, יש דיכוי קטבוליטים של אופרונים המקודדים לאנזימים למטבוליזם של מצעים חלופיים. בגלל רמות cAMP נמוכות בתנאים אלה, אין כמות מספקת של קומפלקס CAP-cAMP להפעלת שעתוק של אופרונים אלה. ראה טבלה \(\PageIndex{1}\) לסיכום הרגולציה של lac אופרון.
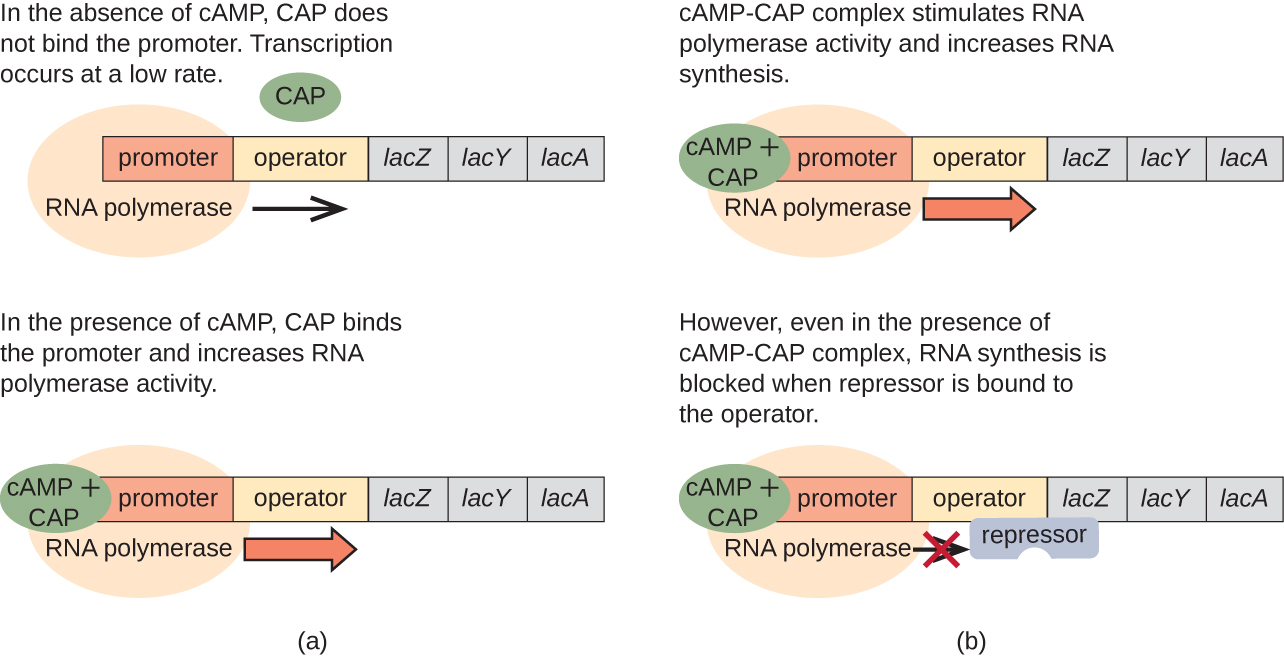
| גלוקוז | CAP נקשר | לקטוז | המדכא נקשר | תמלול |
|---|---|---|---|---|
| + | — | — | + | לא |
| + | — | + | — | חלק |
| — | + | — | + | לא |
| — | + | + | — | הן |
צפה במדריך מונפש על פעולתו של לאק אופרון כאן.
תרגיל \(\PageIndex{2}\)
- מה משפיע על הקישור של מדכא האופרון trp למפעיל?
- כיצד ומתי משתנה התנהגותו של חלבון מדכא lac?
- בנוסף להיותו ניתן להדחיק, איך אחרת מוסדר האופרון lac?
תגובות גלובליות של פרוקריוטים
בפרוקריוטים, ישנן גם מספר רמות גבוהות יותר של ויסות גנים שיש להן את היכולת לשלוט בתעתיק של אופרונים קשורים רבים בו זמנית בתגובה לאות סביבתי. קבוצה של אופרונים שכולם נשלטים בו זמנית נקראת רגולון.
אלרמונס
כאשר חשים מתח מתקרב, פרוקריוטים משנים את הביטוי של מגוון רחב של אופרונים להגיב בתיאום. הם עושים זאת באמצעות ייצור של alarmones, שהם נגזרות נוקלאוטידים תאיים קטנים. אלרמונים משנים אילו גנים באים לידי ביטוי וממריצים את הביטוי של גנים ספציפיים לתגובת לחץ. נראה כי השימוש באלרמונים לשינוי ביטוי הגנים בתגובה ללחץ חשוב בחיידקים פתוגניים. כאשר נתקלים במנגנוני הגנה של המארח ובתנאים קשים אחרים במהלך ההדבקה, אופרונים רבים המקודדים לגנים של ארסיות מווסתים בתגובה לאיתות אזעקה. הכרת התגובות הללו היא המפתח ליכולת להבין היטב את תהליך ההדבקה של פתוגנים רבים ולפיתוח טיפולים להתמודדות עם תהליך זה.
גורמים חלופיים σ
מכיוון שתת-היחידה σ של פולימראז RNA חיידקי מקנה ספציפיות לגבי אילו מקדמים יש לתמלל, שינוי גורם σ המשמש הוא דרך נוספת לחיידקים לשנות במהירות ובעולם את מה שרגולונים מתועתקים בזמן נתון. גורם σ מזהה רצפים בתוך מקדם חיידקי, כך שגורמי σ שונים יזהו כל רצפי פרומטור שונים במקצת. באופן זה, כאשר התא חש בתנאים סביבתיים ספציפיים, הוא עשוי להגיב על ידי שינוי איזה גורם σ הוא מבטא, השפלה של הישן וייצור אחד חדש כדי לתמלל את האופרונים המקודדים לגנים שמוצריהם יהיו שימושיים בתנאי הסביבה החדש. לדוגמה, בחיידקים מסתובבים מהסוגים Bacillus ו- Clostridium (הכוללים פתוגנים רבים), קבוצה של גורמי σ שולטת בביטוי הגנים הרבים הדרושים לספורולציה בתגובה לאותות מעוררי ספורולציה.
תרגיל \(\PageIndex{3}\)
- מה השם שניתן לאוסף אופרונים שניתן להסדיר כקבוצה?
- איזה סוג של גירוי יעורר שעתוק של גורם σ אחר?
שיטות ויסות נוספות בחיידקים: הנחתה וריבוסוויצ'ים
למרות שרוב ביטוי הגנים מוסדר ברמת התחלת השעתוק בפרוקריוטים, ישנם גם מנגנונים לשליטה הן בהשלמת השעתוק והן בתרגום במקביל. מאז גילוים, הוכח כי מנגנונים אלה שולטים בהשלמת התעתיק והתרגום של אופרונים פרוקריוטים רבים. מכיוון שמנגנונים אלה מקשרים את ויסות התעתיק והתרגום ישירות, הם ספציפיים לפרוקריוטים, מכיוון שתהליכים אלה מופרדים פיזית באוקריוטים.
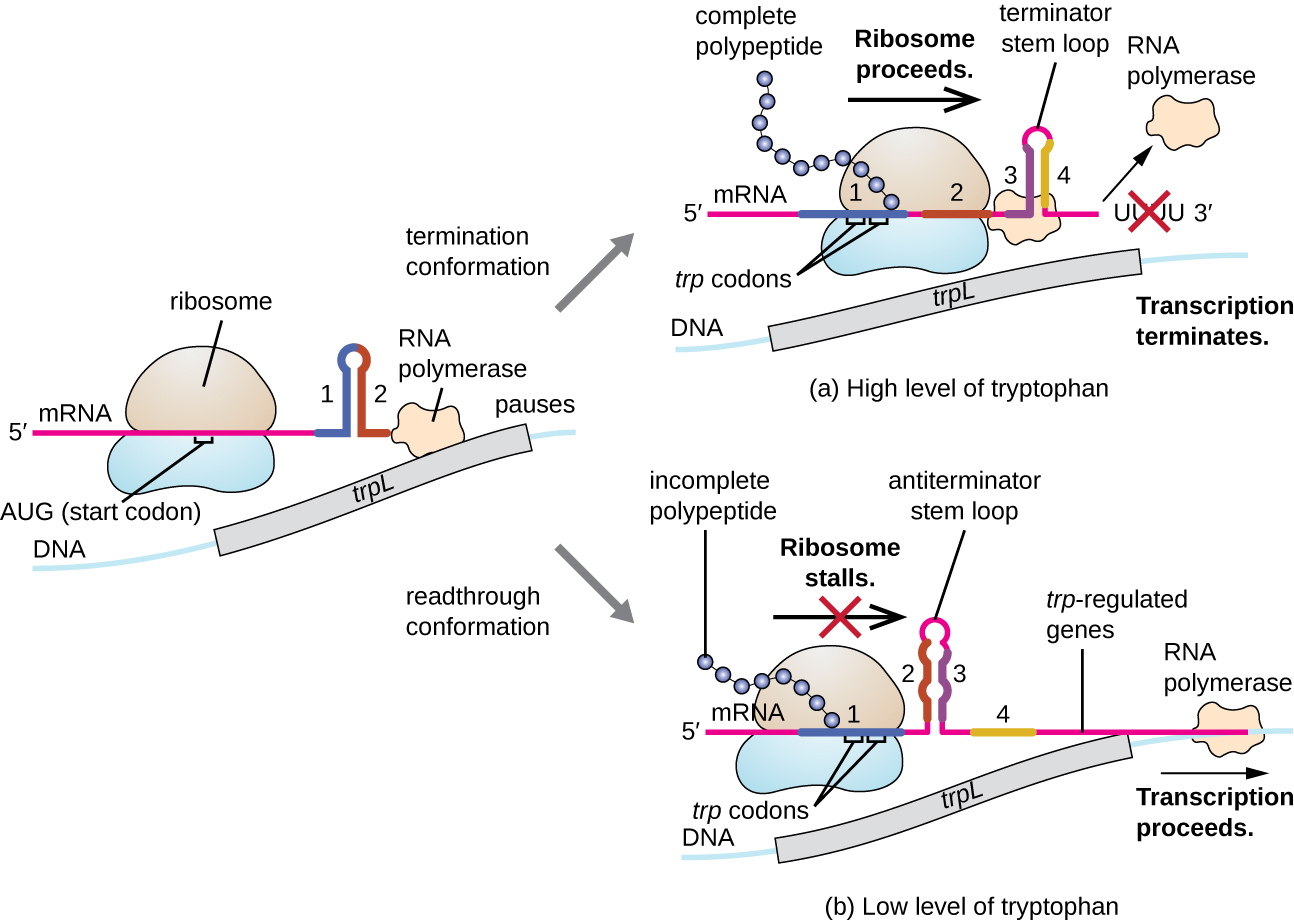
מערכת רגולטורית אחת כזו היא הנחתה, לפיה מבנים משניים של לולאת גזע הנוצרים בקצה 5 'של mRNA המתועתק קובעים אם שעתוק להשלמת הסינתזה של mRNA זה יתרחש ואם mRNA זה ישמש לתרגום. מעבר למנגנון ההדחקה התעתיק שכבר נדון, הנחתה שולטת גם בביטוי האופרון trp ב אי - קולי (איור). \(\PageIndex{7}\) האזור הרגולטורי של אופרון trp מכיל רצף מנהיג הנקרא trpL בין המפעיל לגן המבני הראשון, שיש לו ארבעה קטעי RNA שיכולים להתאים אחד לשני בשילובים שונים. כאשר נוצרת לולאת גזע טרמינטור, השעתוק מסתיים ומשחרר RNA פולימראז מה- mRNA. עם זאת, כאשר נוצרת לולאת גזע אנטי-טרמינטור, הדבר מונע היווצרות לולאת הגזע הטרמינטור, כך ש-RNA פולימראז יכול לתמלל את הגנים המבניים.
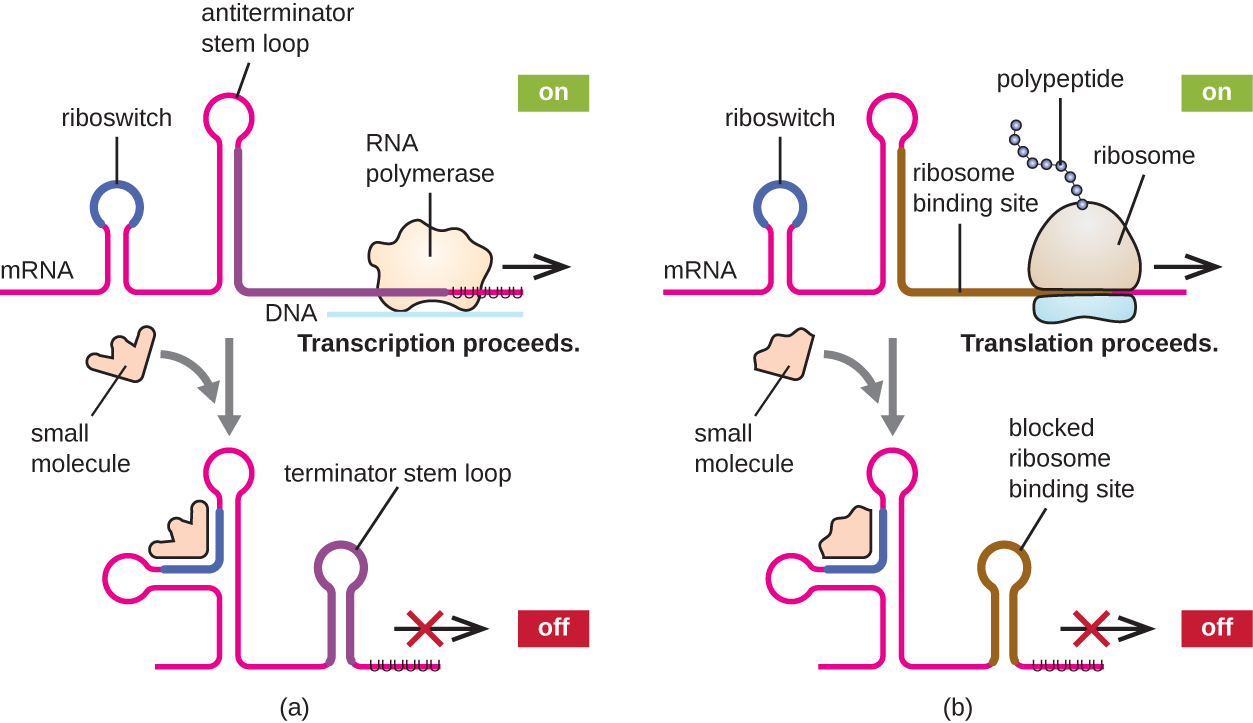
מנגנון קשור לוויסות במקביל של שעתוק ותרגום בפרוקריוטים הוא השימוש בריבוסוויץ ', אזור קטן של RNA לא מקודד שנמצא בקצה 5 'של כמה מולקולות mRNA פרוקריוטיות (איור). \(\PageIndex{8}\) ריבוסוויץ' עשוי להיקשר למולקולה תוך תאית קטנה כדי לייצב מבנים משניים מסוימים של מולקולת ה-mRNA. הקישור של המולקולה הקטנה קובע איזה מבנה לולאת גזע נוצר, ובכך משפיע על השלמת סינתזת mRNA וסינתזת חלבון.
גורמים אחרים המשפיעים על ביטוי גנים בפרוקריוטים ובאוקריוטים
למרות שההתמקדות בדיון שלנו בבקרת תעתיק השתמשה באופרונים פרוקריוטיים כדוגמאות, בקרת תעתיק אוקריוטית דומה במובנים רבים. כמו בפרוקריוטים, ניתן לשלוט בתעתיק אוקריוטי באמצעות קישור של גורמי שעתוק כולל מדכאים ומפעילים. מעניין לציין כי שעתוק אוקריוטי יכול להיות מושפע מקשירה של חלבונים לאזורי DNA, הנקראים משפרים, רחוקים למדי מהגן, באמצעות לולאת DNA הקלה בין המשפר למקדם (איור). \(\PageIndex{9}\) בסך הכל, ויסות שעתוק הוא דרך יעילה ביותר לשלוט בביטוי גנים הן בפרוקריוטים והן באיקריוטים. עם זאת, השליטה בביטוי הגנים באאוקריוטים בתגובה ללחצים סביבתיים ותאיים יכולה להתבצע בדרכים נוספות ללא קישור של גורמי שעתוק לאזורים רגולטוריים.
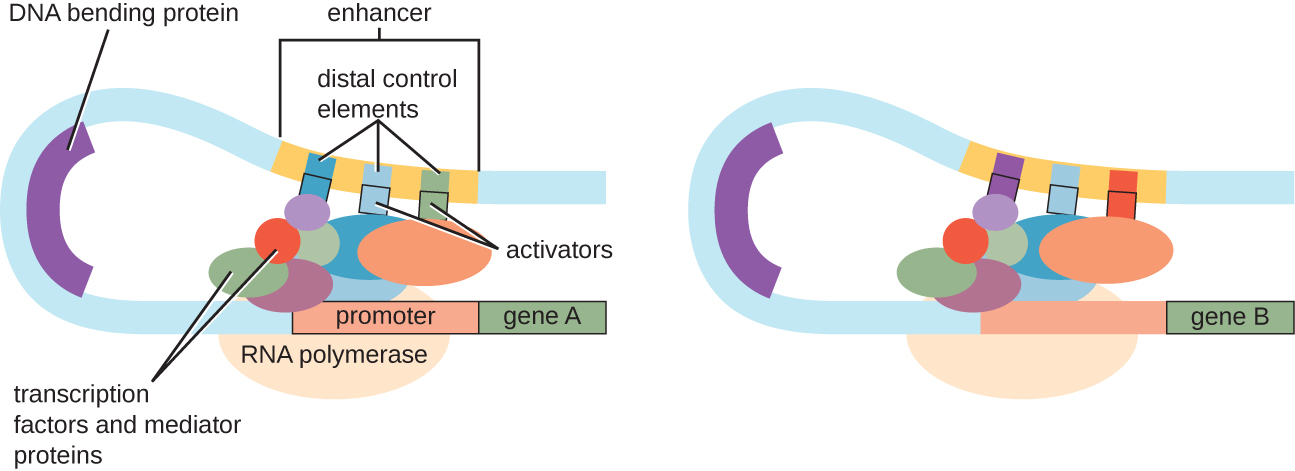
בקרת רמת ה- DNA
באיקריוטים ניתן לשנות כימית את מולקולות ה- DNA או ההיסטונים הנלווים באופן שישפיע על התעתיק; זה נקרא ויסות אפיגנטי. הוכח כי מתילציה של נוקלאוטידים ציטוזינים מסוימים ב-DNA בתגובה לגורמים סביבתיים משפיעה על השימוש ב-DNA כזה לצורך שעתוק, כאשר מתילציה של DNA מתאימה בדרך כלל לרמות מופחתות של ביטוי גנים. בנוסף, בתגובה לגורמים סביבתיים, חלבוני היסטון לאריזת DNA יכולים גם להשתנות כימית במספר דרכים, כולל אצטילציה ודה-אצטילציה, המשפיעים על מצב האריזה של ה-DNA ובכך משפיעים על זמינות ה-DNA הפצוע באופן רופף לשעתוק. לפעמים ניתן לשמור על שינויים כימיים אלה באמצעות סבבים מרובים של חלוקת תאים, מה שהופך לפחות חלק מהשינויים האפיגנטיים הללו לתורשה.
סרטון זה מתאר כיצד ויסות אפיגנטי שולט בביטוי הגנים.
תרגיל \(\PageIndex{}\)
- מה עוצר או מאפשר לתמלול להמשיך כאשר הנחתה פועלת?
- מה קובע את מצבו של ריבוסוויץ '?
- תאר את תפקודו של משפר.
- תאר שני מנגנונים של ויסות אפיגנטי באיקריוטים.
מיקוד קליני: רזולוציה
למרות שמארק שרד את ההתקף שלו עם fasciitis necrotizing, כעת הוא יצטרך לעבור ניתוח השתלת עור, ואחריו פיזיותרפיה ארוכת טווח. בהתבסס על כמות מסת השריר שאיבד, אין זה סביר שרגלו תחזור למלוא עוצמתה, אך הפיזיותרפיסט שלו אופטימי שהוא יחזיר לעצמו שימוש כלשהו ברגלו.
בדיקות מעבדה גילו כי הגורם הסיבתי לזיהום של מארק היה זן של סטרפטוקוקוס מקבוצה A (סטרפטוקוקוס מקבוצה A). כנדרש בחוק, המקרה של מארק דווח למחלקת הבריאות במדינה ובסופו של דבר למרכזים לבקרת מחלות ומניעתן (CDC). ב- CDC, הזן של סטרפט קבוצה A שבודד ממארק נותח בצורה יסודית יותר לעמידות למתיצילין.
עמידות למתיצילין מקודדת גנטית והופכת נפוצה יותר בדלקת קבוצה A באמצעות העברת גנים אופקית. ב-necrotizing fasciitis, זרימת הדם לאזור הנגוע מוגבלת בדרך כלל בגלל פעולתם של רעלים חיידקיים שונים המקודדים גנטית. זו הסיבה שבדרך כלל יש דימום מועט עד ללא דימום כתוצאה מבדיקת החתך. לרוע המזל, רעלנים חיידקיים אלה מגבילים את היעילות של אנטיביוטיקה תוך ורידית בניקוי זיהום מהעור ומהרקמה הבסיסית, כלומר עמידות לאנטיביוטיקה בלבד אינה מסבירה את חוסר היעילות של הטיפול של מארק. עם זאת, טיפול אנטיביוטי תוך ורידי היה מוצדק כדי לסייע למזער את התוצאה האפשרית של אלח דם, שהיא תוצאה שכיחה של fasciitis necrotizing. באמצעות ניתוח גנומי על ידי ה-CDC של הזן שבודד ממארק, הוכח כי כמה מהגנים החשובים של ארסיות מקודדים על נבואות, מה שמצביע על כך שהתמרה חשובה בהעברת הגנים האופקית של גנים אלה מתא חיידקי אחד למשנהו.
מושגי מפתח וסיכום
- ביטוי גנים הוא תהליך מוסדר היטב.
- ביטוי גנים בפרוקריוטים מוסדר במידה רבה בנקודת השעתוק. ביטוי גנים באיקריוטים מוסדר בנוסף לאחר תעתיק.
- גנים מבניים פרוקריוטיים בעלי תפקוד קשור מאורגנים לעתים קרובות לאופרונים, כולם נשלטים על ידי שעתוק ממקדם יחיד. האזור הרגולטורי של אופרון כולל את האמרגן עצמו ואת האזור המקיף את האמרגן שאליו יכולים גורמי שעתוק להיקשר כדי להשפיע על התעתיק.
- למרות שחלק מהאופרונים באים לידי ביטוי מכונן, רובם כפופים לוויסות באמצעות גורמי שעתוק (מדכאים ומפעילים). מדכא נקשר למפעיל, רצף DNA בתוך האזור הרגולטורי בין אתר הקישור של RNA פולימראז בפרומוטור לבין הגן המבני הראשון, ובכך חוסם פיזית את השעתוק של אופרונים אלה. מפעיל נקשר בתוך האזור הרגולטורי של אופרון, עוזר ל-RNA פולימראז להיקשר לפרומוטור, ובכך משפר את השעתוק של אופרון זה. מעורר משפיע על שעתוק באמצעות אינטראקציה עם מדכא או מפעיל.
- האופרון trp הוא דוגמה קלאסית לאופרון שניתן להדחיק. כאשר טריפטופן מצטבר, טריפטופן נקשר למדכא, אשר נקשר לאחר מכן למפעיל, ומונע שעתוק נוסף.
- ה lac אופרון הוא דוגמה קלאסית לאופרון הניתן להשראה. כאשר לקטוז קיים בתא, הוא מומר אלולקטוזה. אלולקטוזה פועל כמעורר, נקשר למדכא ומונע מהמדכא להיקשר למפעיל. זה מאפשר שעתוק של הגנים המבניים.
- אופרון lac כפוף גם להפעלה. כאשר רמות הגלוקוז מתרוקנות, חלק מה- ATP הסלולרי הופך ל- cAMP, הנקשר לחלבון מפעיל הקטבוליטים (CAP). קומפלקס cAMP-CAP מפעיל שעתוק של lac אופרון. כאשר רמות הגלוקוז גבוהות, נוכחותו מונעת שעתוק של lac אופרון ואופרונים אחרים על ידי דיכוי קטבוליטים.
- מולקולות תוך-תאיות קטנות הנקראות אלרמונים נוצרות בתגובה ללחצים סביבתיים שונים, ומאפשרות לחיידקים לשלוט בתעתיק של קבוצת אופרונים, הנקראים רגולון.
- לחיידקים יש את היכולת לשנות באיזה גורם σ של RNA פולימראז הם משתמשים בתגובה לתנאי הסביבה כדי לשנות במהירות ובעולם אילו רגולונים מתועתקים.
- לפרוקריוטים יש מנגנוני ויסות, כולל הנחתה ושימוש בריבוסוויצ'ים, כדי לשלוט בו זמנית על השלמת התעתיק והתרגום מאותו תמליל. מנגנונים אלה פועלים באמצעות יצירת לולאות גזע בקצה 5' של מולקולת mRNA המסונתזת כעת.
- ישנן נקודות ויסות נוספות של ביטוי גנים בפרוקריוטים ובאוקריוטים. באאוקריוטים, ויסות אפיגנטי על ידי שינוי כימי של DNA או היסטונים, וויסות עיבוד RNA הן שתי שיטות.


