4.1: אנרגיה ומטבוליזם
- Page ID
- 208983
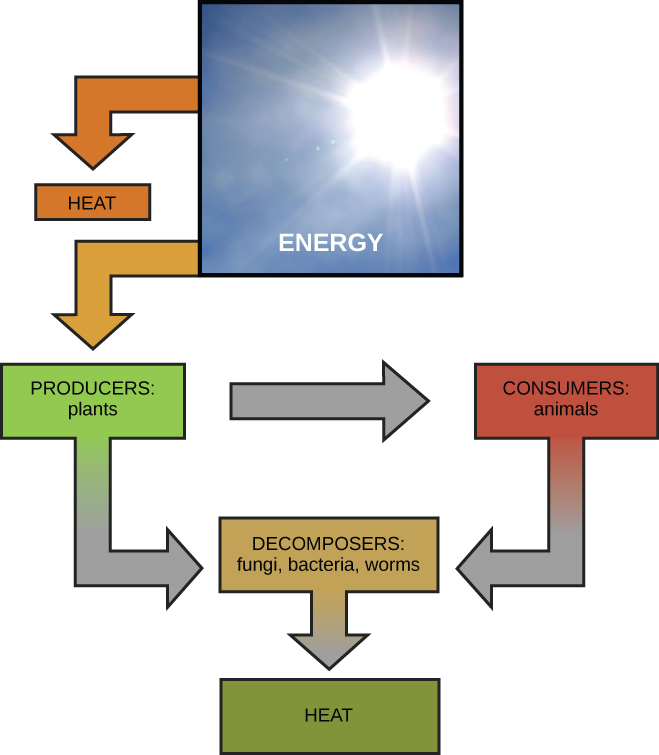
מדענים משתמשים במונח ביו-אנרגטיקה כדי לתאר את המושג זרימת אנרגיה (איור\(\PageIndex{1}\)) דרך מערכות חיות, כגון תאים. תהליכים סלולריים כגון בנייה ופירוק של מולקולות מורכבות מתרחשים באמצעות תגובות כימיות בשלבים. חלק מהתגובות הכימיות הללו הן ספונטניות ומשחררות אנרגיה, בעוד שאחרות דורשות אנרגיה כדי להמשיך. כשם שיצורים חיים חייבים לצרוך מזון ללא הרף כדי לחדש את אספקת האנרגיה שלהם, התאים חייבים לייצר ללא הרף יותר אנרגיה כדי לחדש את זו המשמשת את התגובות הכימיות הרבות הדורשות אנרגיה המתרחשות ללא הרף. יחד, כל התגובות הכימיות המתרחשות בתוך התאים, כולל אלה הצורכות או מייצרות אנרגיה, מכונות חילוף החומרים של התא.
מסלולים מטבוליים
שקול את חילוף החומרים של הסוכר. זוהי דוגמה קלאסית לאחד התהליכים הסלולריים הרבים המשתמשים ומייצרים אנרגיה. יצורים חיים צורכים סוכרים כמקור אנרגיה עיקרי, מכיוון שלמולקולות סוכר יש אנרגיה רבה המאוחסנת בקשרים שלהן. לרוב, אורגניזמים פוטוסינתטיים כמו צמחים מייצרים סוכרים אלה. במהלך הפוטוסינתזה, צמחים משתמשים באנרגיה (במקור מאור השמש) כדי להמיר גז פחמן דו חמצני (CO 2) למולקולות סוכר (כמו גלוקוז: C 6 H 12 O 6). הם צורכים פחמן דו חמצני ומייצרים חמצן כתוצר פסולת. תגובה זו מסוכמת כ:
\[\ce{6CO2 + 6H2O -> C6H12O6 + 6O2}\nonumber\]
מכיוון שתהליך זה כולל סינתזה של מולקולה אוגרת אנרגיה, הוא דורש קלט אנרגיה כדי להמשיך. במהלך תגובות האור של הפוטוסינתזה, האנרגיה מסופקת על ידי מולקולה הנקראת אדנוסין טריפוספט (ATP), שהיא מטבע האנרגיה העיקרי של כל התאים. כשם שהדולר משמש כמטבע לקניית סחורות, תאים משתמשים במולקולות של ATP כמטבע אנרגיה לביצוע עבודה מיידית. לעומת זאת, מולקולות אגירת אנרגיה כגון גלוקוז נצרכות רק כדי להתפרק כדי להשתמש באנרגיה שלהן. ניתן לסכם את התגובה הקוצרת את האנרגיה של מולקולת סוכר בתאים הדורשים חמצן כדי לשרוד על ידי התגובה ההפוכה לפוטוסינתזה. בתגובה זו נצרך חמצן ומשתחרר פחמן דו חמצני כתוצר פסולת. התגובה מסוכמת כ:
\[\ce{C6H12O6 + 6O2 -> 6H2O + 6CO2}\nonumber\]
שתי התגובות הללו כרוכות בצעדים רבים.
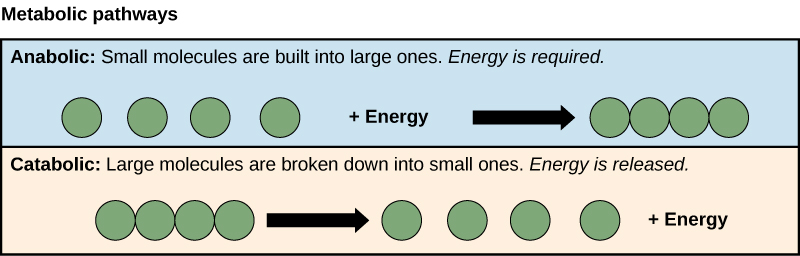
תהליכי ייצור ופירוק מולקולות סוכר ממחישים שתי דוגמאות למסלולים מטבוליים. מסלול מטבולי הוא סדרה של תגובות כימיות שלוקחות מולקולה התחלתית ומשנה אותה, שלב אחר שלב, באמצעות סדרה של תוצרי ביניים מטבוליים, ובסופו של דבר מניבות תוצר סופי. בדוגמה של חילוף החומרים של הסוכר, המסלול המטבולי הראשון סינתז סוכר ממולקולות קטנות יותר, והמסלול השני פירק סוכר למולקולות קטנות יותר. שני התהליכים ההפוכים הללו - הראשון הדורש אנרגיה והשני מייצר אנרגיה - מכונים מסלולים אנבוליים (בניית פולימרים) ומסלולים קטבוליים (פירוק פולימרים למונומרים שלהם), בהתאמה. כתוצאה מכך, חילוף החומרים מורכב מסינתזה (אנבוליזם) והשפלה (קטבוליזם) (איור). \(\PageIndex{2}\)
חשוב לדעת שהתגובות הכימיות של מסלולים מטבוליים אינן מתרחשות מעצמן. כל שלב תגובה מתאפשר, או מזורז, על ידי חלבון הנקרא אנזים. אנזימים חשובים לזרז את כל סוגי התגובות הביולוגיות - אלה הדורשות אנרגיה כמו גם אלה שמשחררות אנרגיה.
אנרגיה
תרמודינמיקה מתייחסת לחקר האנרגיה והעברת האנרגיה הכרוכה בחומר פיזי. החומר הרלוונטי למקרה מסוים של העברת אנרגיה נקרא מערכת, וכל מה שמחוץ לחומר זה נקרא הסביבה. לדוגמה, בעת חימום סיר מים על הכיריים, המערכת כוללת את הכיריים, הסיר והמים. אנרגיה מועברת בתוך המערכת (בין הכיריים, הסיר והמים). ישנם שני סוגים של מערכות: פתוח וסגור. במערכת פתוחה ניתן להחליף אנרגיה עם סביבתה. מערכת הכיריים פתוחה מכיוון שאפשר לאבד חום לאוויר. מערכת סגורה אינה יכולה להחליף אנרגיה עם סביבתה.
אורגניזמים ביולוגיים הם מערכות פתוחות. אנרגיה מוחלפת בינם לבין סביבתם כאשר הם משתמשים באנרגיה מהשמש לביצוע פוטוסינתזה או צורכים מולקולות אוגרות אנרגיה ומשחררים אנרגיה לסביבה על ידי ביצוע עבודה ושחרור חום. כמו כל הדברים בעולם הפיזי, האנרגיה כפופה לחוקים פיזיקליים. חוקי התרמודינמיקה קובעים את העברת האנרגיה בתוך ובין כל המערכות ביקום.
באופן כללי, אנרגיה מוגדרת כיכולת לבצע עבודה, או ליצור שינוי כלשהו. אנרגיה קיימת בצורות שונות. לדוגמה, אנרגיה חשמלית, אנרגיית אור ואנרגיית חום הם כולם סוגים שונים של אנרגיה. כדי להעריך את האופן שבו אנרגיה זורמת אל מערכות ביולוגיות ומחוצה להן, חשוב להבין שניים מהחוקים הפיזיקליים השולטים באנרגיה.
תרמודינמיקה
החוק הראשון של התרמודינמיקה קובע שכמות האנרגיה הכוללת ביקום קבועה ושמורה. במילים אחרות, תמיד הייתה, ותמיד תהיה, בדיוק אותה כמות אנרגיה ביקום. אנרגיה קיימת בצורות רבות ושונות. על פי החוק הראשון של התרמודינמיקה, אנרגיה עשויה להיות מועברת ממקום למקום או להפוך אותה לצורות שונות, אך לא ניתן ליצור אותה או להרוס אותה. ההעברות והטרנספורמציות של האנרגיה מתרחשות סביבנו כל הזמן. נורות הופכות אנרגיה חשמלית לאנרגיית אור וחום. תנורי גז הופכים אנרגיה כימית מגז טבעי לאנרגיית חום. צמחים מבצעים את אחת מתמורות האנרגיה השימושיות ביותר מבחינה ביולוגית על פני כדור הארץ: זו של המרת אנרגיית אור השמש לאנרגיה כימית המאוחסנת בתוך מולקולות אורגניות (איור\(\PageIndex{1}\)). כמה דוגמאות של טרנספורמציות אנרגיה מוצגות באיור\(\PageIndex{3}\).
האתגר של כל האורגניזמים החיים הוא להשיג אנרגיה מסביבתם בצורות שהם יכולים להעביר או להפוך לאנרגיה שמישה לביצוע עבודה. תאים חיים התפתחו כדי לעמוד באתגר זה. אנרגיה כימית המאוחסנת בתוך מולקולות אורגניות כגון סוכרים ושומנים מועברת והופכת באמצעות סדרה של תגובות כימיות תאיות לאנרגיה בתוך מולקולות ATP. אנרגיה במולקולות ATP נגישה בקלות לביצוע עבודה. דוגמאות לסוגי העבודה שהתאים צריכים לבצע כוללות בניית מולקולות מורכבות, הובלת חומרים, הפעלת תנועת ריסים או דגלים והתכווצות סיבי שריר ליצירת תנועה.

המשימות העיקריות של תא חי להשיג, לשנות ולהשתמש באנרגיה לביצוע עבודה עשויות להיראות פשוטות. עם זאת, החוק השני של התרמודינמיקה מסביר מדוע משימות אלה קשות מכפי שהן נראות. כל העברות האנרגיה והטרנספורמציות לעולם אינן יעילות לחלוטין. בכל העברת אנרגיה, כמות מסוימת של אנרגיה הולכת לאיבוד בצורה שאינה שמישה. ברוב המקרים, צורה זו היא אנרגיית חום. מבחינה תרמודינמית, אנרגיית החום מוגדרת כאנרגיה המועברת ממערכת אחת לאחרת שאינה עבודה. לדוגמה, כאשר נורה דולקת, חלק מהאנרגיה המומרת מאנרגיה חשמלית לאנרגיית אור הולכת לאיבוד כאנרגיית חום. באופן דומה, אנרגיה מסוימת הולכת לאיבוד כאנרגיית חום במהלך תגובות מטבוליות תאיות.
מושג חשוב במערכות פיזיות הוא זה של סדר ואי סדר. ככל שהולכת לאיבוד יותר אנרגיה על ידי מערכת לסביבתה, המערכת פחות מסודרת ואקראית יותר. מדענים מתייחסים למדד האקראיות או ההפרעה בתוך מערכת כאנטרופיה. אנטרופיה גבוהה פירושה הפרעה גבוהה ואנרגיה נמוכה. למולקולות ולתגובות כימיות יש גם אנטרופיה משתנה. לדוגמה, האנטרופיה עולה ככל שמולקולות בריכוז גבוה במקום אחד מתפזרות ומתפשטות. החוק השני של התרמודינמיקה אומר שאנרגיה תמיד תאבד כחום בהעברות אנרגיה או טרנספורמציות.
יצורים חיים מסודרים מאוד, הדורשים קלט אנרגיה קבוע להישמר במצב של אנטרופיה נמוכה.
אנרגיה פוטנציאלית וקינטית
כאשר אובייקט נמצא בתנועה, יש אנרגיה הקשורה לאובייקט זה. תחשוב על כדור הריסה. אפילו כדור הריסה איטי יכול לגרום נזק רב לחפצים אחרים. אנרגיה הקשורה לאובייקטים בתנועה נקראת אנרגיה קינטית (איור\(\PageIndex{4}\)). כדור דוהר, אדם מהלך ותנועה מהירה של מולקולות באוויר (המייצרת חום) לכולם יש אנרגיה קינטית.
עכשיו מה אם אותו כדור הריסה ללא תנועה מורם שתי קומות מעל פני האדמה בעזרת מנוף? אם כדור ההריסה התלוי אינו זז, האם יש אנרגיה הקשורה אליו? התשובה היא כן. האנרגיה שנדרשה להרים את הכדור ההורס לא נעלמה, אלא מאוחסנת כעת בכדור ההריסה מתוקף מיקומו וכוח הכובד הפועל עליו. סוג זה של אנרגיה נקרא אנרגיה פוטנציאלית (איור\(\PageIndex{4}\)). אם הכדור היה נופל, האנרגיה הפוטנציאלית תהפוך לאנרגיה קינטית עד שכל האנרגיה הפוטנציאלית תמצה כאשר הכדור נח על הקרקע. כדורי הריסה מתנדנדים גם הם כמו מטוטלת; דרך הנדנדה יש שינוי מתמיד של אנרגיה פוטנציאלית (הגבוהה ביותר בראש הנדנדה) לאנרגיה קינטית (הגבוהה ביותר בתחתית הנדנדה). דוגמאות אחרות לאנרגיה פוטנציאלית כוללות את אנרגיית המים המוחזקת מאחורי סכר או אדם שעומד לצנוח מחוץ למטוס.

אנרגיה פוטנציאלית אינה קשורה רק למיקום החומר, אלא גם למבנה החומר. אפילו למעיין על הקרקע יש אנרגיה פוטנציאלית אם הוא דחוס; כך גם רצועת גומי שנמשכת מתוחה. ברמה המולקולרית, הקשרים המחזיקים את אטומי המולקולות יחד קיימים במבנה מסוים שיש לו אנרגיה פוטנציאלית. זכור כי מסלולים תאיים אנבוליים דורשים אנרגיה כדי לסנתז מולקולות מורכבות מפשוטות יותר ומסלולים קטבוליים משחררים אנרגיה כאשר מולקולות מורכבות מתפרקות. העובדה שניתן לשחרר אנרגיה על ידי פירוק קשרים כימיים מסוימים מרמזת שלקשרים אלה יש אנרגיה פוטנציאלית. למעשה, קיימת אנרגיה פוטנציאלית המאוחסנת בקשרים של כל מולקולות המזון שאנו אוכלים, שבסופו של דבר נרתמת לשימוש. הסיבה לכך היא שקשרים אלה יכולים לשחרר אנרגיה כאשר הם נשברים. סוג האנרגיה הפוטנציאלית הקיימת בתוך קשרים כימיים, ומשתחרר כאשר קשרים אלה נשברים, נקרא אנרגיה כימית. אנרגיה כימית אחראית לספק לתאים חיים אנרגיה מהמזון. שחרור האנרגיה מתרחש כאשר הקשרים המולקולריים בתוך מולקולות המזון נשברים.
מושג בפעולה
בקר באתר ובחר "מטוטלת" מתפריט "עבודה ואנרגיה" כדי לראות את האנרגיה הקינטית והפוטנציאלית המשתנה של מטוטלת בתנועה.
אנרגיה חופשית והפעלה
לאחר שנודע שתגובות כימיות משחררות אנרגיה כאשר נשברים קשרים אוגרי אנרגיה, שאלה חשובה הבאה היא הבאה: כיצד מכמתים ומתבטאים האנרגיה הקשורה לתגובות כימיות אלו? כיצד ניתן להשוות את האנרגיה המשתחררת מתגובה אחת לזו של תגובה אחרת? מדידה של אנרגיה חופשית משמשת לכימות העברות אנרגיה אלה. נזכיר כי על פי החוק השני של התרמודינמיקה, כל העברות האנרגיה כרוכות באובדן כמות מסוימת של אנרגיה בצורה בלתי שמישה כמו חום. אנרגיה חופשית מתייחסת ספציפית לאנרגיה הקשורה לתגובה כימית הזמינה לאחר התחשבות בהפסדים. במילים אחרות, אנרגיה חופשית היא אנרגיה שמישה, או אנרגיה הזמינה לעבודה.
אם משתחררת אנרגיה במהלך תגובה כימית, השינוי באנרגיה החופשית, המסומן כ- ∆G (דלתא G) יהיה מספר שלילי. שינוי שלילי באנרגיה החופשית אומר גם שלתוצרי התגובה יש פחות אנרגיה חופשית מהמגיבים, מכיוון שהם משחררים קצת אנרגיה חופשית במהלך התגובה. תגובות שיש להן שינוי שלילי באנרגיה החופשית וכתוצאה מכך משחררות אנרגיה חופשית נקראות תגובות אקסרגוניות. תחשוב: ארגוני לשעבר פירושו שאנרגיה היא מעבר למערכת. תגובות אלו מכונות גם תגובות ספונטניות, ולתוצרים שלהן יש פחות אנרגיה מאוחסנת מאשר המגיבים. יש להבחין בין המונח ספונטני לבין הרעיון של תגובה כימית המתרחשת באופן מיידי. בניגוד לשימוש היומיומי במונח, תגובה ספונטנית אינה כזו שמתרחשת פתאום או במהירות. חלודה של ברזל היא דוגמה לתגובה ספונטנית המתרחשת לאט, לאט לאט, לאורך זמן.
אם תגובה כימית סופגת אנרגיה במקום משחררת אנרגיה באיזון, אז ה- ∆G לתגובה זו יהיה ערך חיובי. במקרה זה, למוצרים יש יותר אנרגיה חופשית מאשר המגיבים. לפיכך, ניתן לחשוב על תוצרי התגובות הללו כמולקולות אוגרות אנרגיה. תגובות כימיות אלו נקראות תגובות אנדרגוניות והן אינן ספונטניות. תגובה אנדרגונית לא תתרחש מעצמה ללא תוספת אנרגיה חופשית.
חיבור אמנות

התבונן בכל אחד מהתהליכים המוצגים והחליט אם הוא אנדרגוני או אקסרגוני.
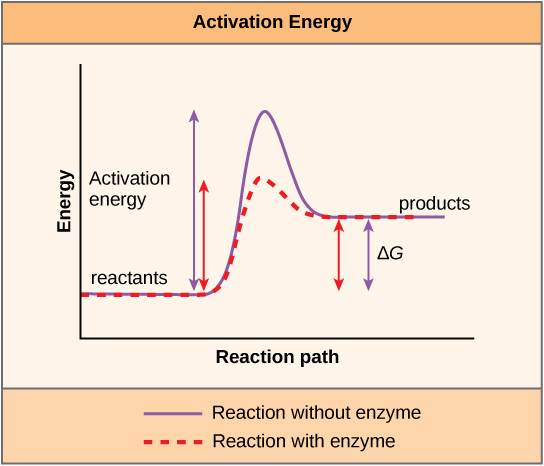
יש מושג חשוב נוסף שיש לקחת בחשבון לגבי תגובות אנדרגוניות ואקסרגוניות. תגובות אקסרגוניות דורשות כמות קטנה של קלט אנרגיה כדי להתחיל, לפני שהן יכולות להמשיך בצעדים שלהן לשחרור אנרגיה. לתגובות אלו יש שחרור נטו של אנרגיה, אך עדיין דורשות מעט קלט אנרגיה בהתחלה. כמות קטנה זו של קלט אנרגיה הדרושה להתרחשות כל התגובות הכימיות נקראת אנרגיית ההפעלה.
מושג בפעולה
צפו באנימציה של המעבר מאנרגיה חופשית למצב מעבר של התגובה.
אנזימים
חומר המסייע לתגובה כימית להתרחש נקרא זרז, והמולקולות המזרזות תגובות ביוכימיות נקראות אנזימים. רוב האנזימים הם חלבונים ומבצעים את המשימה הקריטית של הורדת אנרגיות ההפעלה של תגובות כימיות בתוך התא. רוב התגובות הקריטיות לתא חי מתרחשות לאט מדי בטמפרטורות רגילות מכדי להועיל לתא. ללא אנזימים כדי להאיץ את התגובות הללו, החיים לא יכלו להימשך. אנזימים עושים זאת על ידי קשירה למולקולות המגיבות והחזקתן באופן שיגרום לתהליכי שבירת הקשר והיווצרות הכימיים להתרחש ביתר קלות. חשוב לזכור כי אנזימים אינם משתנים אם תגובה היא אקסרגונית (ספונטנית) או אנדרגונית. הסיבה לכך היא שהם אינם משנים את האנרגיה החופשית של המגיבים או המוצרים. הם רק מפחיתים את אנרגיית ההפעלה הנדרשת כדי שהתגובה תתקדם (איור\(\PageIndex{6}\)). בנוסף, אנזים עצמו אינו משתנה על ידי התגובה שהוא מזרז. לאחר שזרז תגובה אחת, האנזים מסוגל להשתתף בתגובות אחרות.
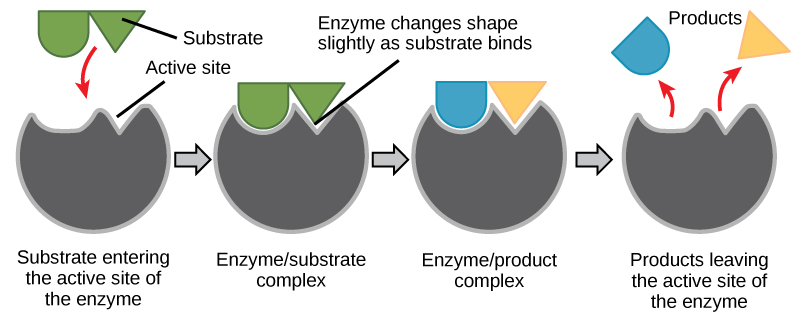
המגיבים הכימיים שאליהם נקשר אנזים נקראים מצעי האנזים. יתכנו מצעים אחד או יותר, תלוי בתגובה הכימית המסוימת. בתגובות מסוימות, מצע מגיב יחיד מתפרק למספר מוצרים. באחרים, שני מצעים עשויים להתאחד כדי ליצור מולקולה אחת גדולה יותר. שני מגיבים עשויים גם להיכנס לתגובה ושניהם משתנים, אך הם משאירים את התגובה כשני מוצרים. המיקום בתוך האנזים שבו המצע נקשר נקרא האתר הפעיל של האנזים. האתר הפעיל הוא המקום בו מתרחשת "הפעולה". מכיוון שאנזימים הם חלבונים, קיים שילוב ייחודי של שרשראות צד של חומצות אמינו בתוך האתר הפעיל. כל שרשרת צדדית מאופיינת בתכונות שונות. הם יכולים להיות גדולים או קטנים, חומציים חלשים או בסיסיים, הידרופיליים או הידרופוביים, טעונים חיוביים או שליליים, או ניטרליים. השילוב הייחודי של שרשראות צד יוצר סביבה כימית מאוד ספציפית בתוך האתר הפעיל. סביבה ספציפית זו מתאימה להיקשר למצע כימי ספציפי אחד (או מצעים).
אתרים פעילים כפופים להשפעות של הסביבה המקומית. הגדלת הטמפרטורה הסביבתית בדרך כלל מגבירה את קצבי התגובה, מזורזת אנזים או אחרת. עם זאת, טמפרטורות מחוץ לטווח אופטימלי מפחיתות את הקצב שבו אנזים מזרז תגובה. טמפרטורות חמות יגרמו בסופו של דבר לאנזימים לדנטורציה, שינוי בלתי הפיך בצורה התלת מימדית ולכן לתפקוד האנזים. אנזימים מתאימים גם לתפקוד הטוב ביותר בטווח pH וריכוז מלח מסוים, וכמו בטמפרטורה, pH קיצוני וריכוזי מלח יכולים לגרום לאנזימים להתנתק.
במשך שנים רבות, מדענים חשבו שקשירת אנזים-מצע מתרחשת בצורה פשוטה של "מנעול ומפתח". מודל זה קבע כי האנזים והמצע משתלבים זה בזה בצורה מושלמת בשלב מיידי אחד. עם זאת, המחקר הנוכחי תומך במודל הנקרא התאמה מושרה (איור\(\PageIndex{7}\)). מודל ההתאמה המושרה מרחיב את מודל הנעילה והמפתח על ידי תיאור קישור דינמי יותר בין אנזים למצע. כאשר האנזים והמצע מתאחדים, האינטראקציה שלהם גורמת לשינוי קל במבנה האנזים היוצר סידור קישור אידיאלי בין אנזים למצע.
מושג בפעולה
הצג אנימציה של התאמה מושרה.
כאשר אנזים קושר את המצע שלו, נוצר קומפלקס אנזים-סובסטרט. קומפלקס זה מוריד את אנרגיית ההפעלה של התגובה ומקדם את התקדמותה המהירה באחת מכמה דרכים אפשריות. ברמה הבסיסית, אנזימים מקדמים תגובות כימיות הכוללות יותר ממצע אחד על ידי קירוב המצעים בכיוון אופטימלי לתגובה. דרך נוספת שבה אנזימים מקדמים את תגובת המצעים שלהם היא על ידי יצירת סביבה אופטימלית בתוך האתר הפעיל להתרחשות התגובה. התכונות הכימיות העולות מהסידור המסוים של קבוצות חומצות אמינו R בתוך אתר פעיל יוצרות את הסביבה המושלמת לתגובת המצעים הספציפיים של האנזים.
קומפלקס האנזים-סובסטרט יכול גם להוריד את אנרגיית ההפעלה על ידי פגיעה במבנה הקשר כך שיהיה קל יותר לשבור אותו. לבסוף, אנזימים יכולים גם להוריד את אנרגיות ההפעלה על ידי השתתפות בתגובה הכימית עצמה. במקרים אלו, חשוב לזכור כי האנזים תמיד יחזור למצבו המקורי על ידי השלמת התגובה. אחת מתכונות ההיכר של אנזימים היא שהם נשארים בסופו של דבר ללא שינוי על ידי התגובות שהם מזרזים. לאחר שאנזים זירז תגובה, הוא משחרר את המוצר/ים שלו ויכול לזרז תגובה חדשה.
נראה אידיאלי לקיים תרחיש שבו כל האנזימים של האורגניזם היו קיימים באספקה בשפע ותפקדו בצורה מיטבית בכל התנאים התאיים, בכל התאים, בכל עת. עם זאת, מגוון מנגנונים מבטיח שזה לא יקרה. הצרכים והתנאים הסלולריים משתנים כל הזמן מתא לתא, ומשתנים בתוך תאים בודדים לאורך זמן. האנזימים הנדרשים של תאי הקיבה שונים מאלו של תאי אחסון שומן, תאי עור, תאי דם ותאי עצב. יתר על כן, תא איבר עיכול עובד הרבה יותר קשה לעבד ולפרק חומרים מזינים במהלך הזמן העוקב מקרוב אחר ארוחה בהשוואה לשעות רבות לאחר הארוחה. ככל שהדרישות והתנאים הסלולריים הללו משתנים, כך גם הכמויות והפונקציונליות של אנזימים שונים חייבים להשתנות.
מכיוון ששיעורי התגובות הביוכימיות נשלטים על ידי אנרגיית הפעלה, ואנזימים מורידים וקובעים אנרגיות הפעלה לתגובות כימיות, הכמויות היחסיות והתפקוד של מגוון האנזימים בתוך התא קובעים בסופו של דבר אילו תגובות ימשיכו ובאיזה קצב. קביעה זו נשלטת היטב בתאים. בסביבות תאיות מסוימות, פעילות האנזים נשלטת בחלקה על ידי גורמים סביבתיים כמו pH, טמפרטורה, ריכוז מלח, ובמקרים מסוימים, קופקטורים או קו-אנזימים.
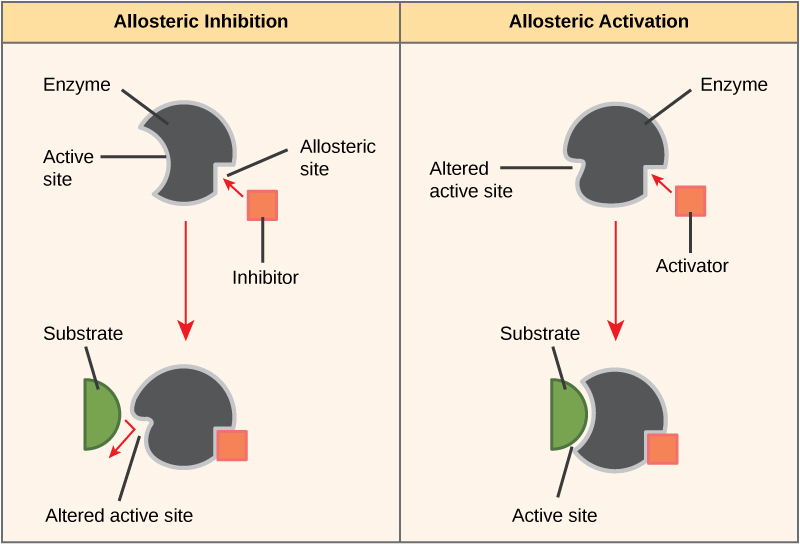
ניתן לווסת אנזימים גם בדרכים המקדמות או מפחיתות את פעילות האנזים. ישנם סוגים רבים של מולקולות המעכבות או מקדמות את תפקוד האנזים, ומנגנונים שונים שבאמצעותם הם עושים זאת. במקרים מסוימים של עיכוב אנזים, מולקולת מעכב דומה מספיק למצע שהיא יכולה להיקשר לאתר הפעיל ופשוט לחסום את המצע מלהיקשר. כאשר זה קורה, האנזים מעוכב באמצעות עיכוב תחרותי, מכיוון שמולקולת מעכב מתחרה במצע על הקישור לאתר הפעיל.
מצד שני, בעיכוב לא תחרותי, מולקולת מעכב נקשרת לאנזים במיקום שאינו האתר הפעיל, הנקרא אתר אלוסטרי, אך עדיין מצליחה לחסום את קישור המצע לאתר הפעיל. חלק ממולקולות המעכבות נקשרות לאנזימים במיקום שבו הקישור שלהן גורם לשינוי קונפורמטיבי המפחית את הזיקה של האנזים למצע שלו. סוג זה של עיכוב נקרא עיכוב אלוסטרי (איור\(\PageIndex{8}\)). רוב האנזימים המווסתים באופן אלוסטרי מורכבים מיותר מפוליפפטיד אחד, כלומר יש להם יותר מתת-יחידת חלבון אחת. כאשר מעכב אלוסטרי נקשר לאזור באנזים, כל האתרים הפעילים ביחידות המשנה של החלבון משתנים מעט כך שהם קושרים את המצעים שלהם בפחות יעילות. ישנם מפעילים אלוסטריים כמו גם מעכבים. מפעילים אלוסטריים נקשרים למיקומים באנזים הרחק מהאתר הפעיל, וגורמים לשינוי קונפורמטיבי המגביר את הזיקה של האתרים הפעילים של האנזים למצע (ים) שלו (איור). \(\PageIndex{8}\)
קריירה בפעולה: מפתח תרופות פרמצבטיות

אנזימים הם מרכיבים מרכזיים במסלולים מטבוליים. ההבנה כיצד פועלים אנזימים וכיצד ניתן לווסת אותם הם עקרונות מפתח מאחורי פיתוחן של רבות מהתרופות הפרמצבטיות הקיימות כיום בשוק. ביולוגים העובדים בתחום זה משתפים פעולה עם מדענים אחרים לעיצוב תרופות (איור\(\PageIndex{9}\)).
קחו למשל סטטינים - סטטינים הוא השם שניתן לסוג אחד של תרופות שיכולות להפחית את רמות הכולסטרול. תרכובות אלה הן מעכבי האנזים HMG-CoA reductase, שהוא האנזים המסנתז כולסטרול משומנים בגוף. על ידי עיכוב אנזים זה, רמת הכולסטרול מסונתז בגוף יכול להיות מופחת. באופן דומה, אצטמינופן, המשווק באופן פופולרי תחת שם המותג טיילנול, הוא מעכב של האנזים cyclooxygenase. למרות שהוא משמש להקלה מחום ודלקת (כאב), מנגנון הפעולה שלו עדיין לא מובן לחלוטין.
כיצד מתגלים סמים? אחד האתגרים הגדולים ביותר בגילוי תרופות הוא זיהוי יעד תרופתי. יעד תרופתי הוא מולקולה שהיא ממש המטרה של התרופה. במקרה של סטטינים, רדוקטאז HMG-CoA הוא יעד התרופה. מטרות סמים מזוהות באמצעות מחקר קפדני במעבדה. זיהוי המטרה בלבד אינו מספיק; מדענים צריכים גם לדעת כיצד המטרה פועלת בתוך התא ואילו תגובות משתבשות במקרה של מחלה. לאחר זיהוי המטרה והמסלול, מתחיל התהליך בפועל של עיצוב תרופות. בשלב זה, כימאים וביולוגים עובדים יחד כדי לתכנן ולסנתז מולקולות שיכולות לחסום או להפעיל תגובה מסוימת. עם זאת, זו רק ההתחלה: אם וכאשר אב טיפוס של תרופה מצליח לבצע את תפקידו, הוא נתון לבדיקות רבות מניסויים חוץ גופיים ועד ניסויים קליניים לפני שהוא יכול לקבל אישור ממנהל המזון והתרופות האמריקני להיות בשוק.
אנזימים רבים אינם פועלים בצורה אופטימלית, או אפילו בכלל, אלא אם כן הם קשורים למולקולות עוזרות ספציפיות אחרות שאינן חלבוניות. הם עשויים להיקשר באופן זמני באמצעות קשרים יוניים או מימן, או לצמיתות באמצעות קשרים קוולנטיים חזקים יותר. קשירה למולקולות אלו מקדמת צורה ותפקוד מיטביים של האנזימים שלהם. שתי דוגמאות לסוגים אלה של מולקולות עוזרות הן קופקטורים וקו-אנזימים. קופקטורים הם יונים אנאורגניים כמו יוני ברזל ומגנזיום. קואנזימים הם מולקולות עוזרות אורגניות, אלו בעלות מבנה אטומי בסיסי המורכב מפחמן ומימן. בדומה לאנזימים, מולקולות אלה משתתפות בתגובות מבלי להשתנות בעצמן ובסופו של דבר ממוחזרות ומשתמשות בהן מחדש. ויטמינים הם המקור של קואנזימים. ויטמינים מסוימים הם מבשרי הקואנזימים ואחרים פועלים ישירות כקואנזימים. ויטמין C הוא קואנזים ישיר לאנזימים מרובים שלוקחים חלק בבניית רקמת החיבור החשובה, קולגן. לכן, תפקוד האנזים מוסדר, בחלקו, על ידי שפע של קופקטורים וקו-אנזימים שונים, אשר עשויים להיות מסופקים על ידי תזונה של אורגניזם או, במקרים מסוימים, המיוצר על ידי האורגניזם.
עיכוב משוב במסלולים מטבוליים
מולקולות יכולות לווסת את תפקוד האנזים בדרכים רבות. השאלה העיקרית נותרה, עם זאת: מהן המולקולות הללו ומאיפה הן מגיעות? חלקם הם קופקטורים וקו-אנזימים, כפי שלמדת. אילו מולקולות אחרות בתא מספקות ויסות אנזימטי כגון אפנון אלוסטרי ועיכוב תחרותי ולא תחרותי? אולי המקורות הרלוונטיים ביותר למולקולות רגולטוריות, ביחס למטבוליזם תאי אנזימטי, הם תוצרי התגובות המטבוליות התאיות עצמן. בצורה היעילה והאלגנטית ביותר, תאים התפתחו לשימוש בתוצרי התגובות שלהם לעיכוב משוב של פעילות האנזים. עיכוב משוב כרוך בשימוש במוצר תגובה כדי לווסת את המשך הייצור שלו (איור\(\PageIndex{10}\)). התא מגיב לשפע של המוצרים על ידי האטת הייצור במהלך תגובות אנבוליות או קטבוליות. תוצרי תגובה כאלה עשויים לעכב את האנזימים שזרזו את ייצורם באמצעות המנגנונים שתוארו לעיל.
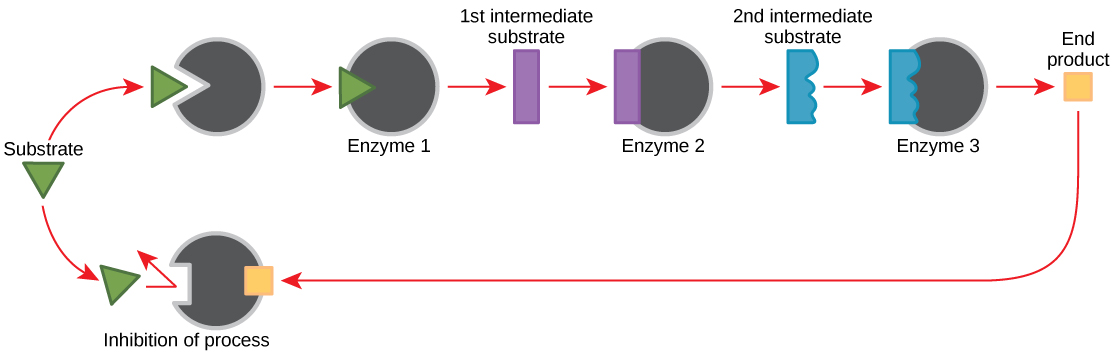
הייצור של חומצות אמינו ונוקלאוטידים נשלט באמצעות עיכוב משוב. בנוסף, ATP הוא מווסת אלוסטרי של חלק מהאנזימים המעורבים בפירוק הקטבולי של הסוכר, התהליך שיוצר ATP. באופן זה, כאשר ATP נמצא בשפע, התא יכול למנוע ייצור ATP. מצד שני, ADP משמש כווסת אלוסטרי חיובי (מפעיל אלוסטרי) עבור חלק מאותם אנזימים המעוכבים על ידי ATP. לפיכך, כאשר הרמות היחסיות של ADP גבוהות בהשוואה ל- ATP, התא מופעל לייצר יותר ATP באמצעות קטבוליזם של סוכר.
סיכום המדור
תאים מבצעים את תפקודי החיים באמצעות תגובות כימיות שונות. חילוף החומרים של התא מתייחס לשילוב של תגובות כימיות המתרחשות בתוכו. תגובות קטבוליות מפרקות כימיקלים מורכבים לפשוטים יותר וקשורים לשחרור אנרגיה. תהליכים אנבוליים בונים מולקולות מורכבות מפשוטות יותר ודורשים אנרגיה.
בלימוד אנרגיה המונח מערכת מתייחס לחומר ולסביבה המעורבים בהעברת אנרגיה. אנטרופיה היא מדד להפרעה של מערכת. החוקים הפיזיקליים המתארים את העברת האנרגיה הם חוקי התרמודינמיקה. החוק הראשון קובע כי כמות האנרגיה הכוללת ביקום קבועה. החוק השני של התרמודינמיקה קובע כי כל העברת אנרגיה כרוכה באיבוד מסוים של אנרגיה בצורה בלתי שמישה, כגון אנרגיית חום. אנרגיה מגיעה בצורות שונות: קינטית, פוטנציאלית וחופשית. השינוי באנרגיה החופשית של תגובה יכול להיות שלילי (משחרר אנרגיה, אקסרגוני) או חיובי (צורך אנרגיה, אנדרגוני). כל התגובות דורשות הזנה ראשונית של אנרגיה כדי להמשיך, הנקראת אנרגיית ההפעלה.
אנזימים הם זרזים כימיים המזרזים תגובות כימיות על ידי הורדת אנרגיית ההפעלה שלהם. לאנזימים יש אתר פעיל עם סביבה כימית ייחודית המתאימה למגיבים כימיים מסוימים לאותו אנזים, הנקרא מצעים. סבורים כי אנזימים ומצעים נקשרים על פי מודל התאמה מושרה. פעולת האנזים מוסדרת כדי לחסוך במשאבים ולהגיב בצורה מיטבית לסביבה.
חיבורי אמנות
איור\(\PageIndex{5}\): התבונן בכל אחד מהתהליכים המוצגים והחליט אם הוא אנדרגוני או אקסרגוני.
- תשובה
-
ערימת קומפוסט המתפרקת היא תהליך אקסרגוני. תינוק המתפתח מביצית מופרית הוא תהליך אנדרגוני. תה מתמוסס למים הוא תהליך אקסרגוני. כדור המתגלגל במורד הוא תהליך אקסרגוני.
רשימת מילים
- אנרגיית הפעלה
- כמות האנרגיה הראשונית הדרושה להתרחשות התגובות
- אתר פעיל
- אזור ספציפי באנזים שבו המצע נקשר
- עיכוב אלוסטרי
- המנגנון לעיכוב פעולת האנזים בו מולקולה רגולטורית נקשרת לאתר שני (לא לאתר הפעיל) ויוזמת שינוי קונפורמציה באתר הפעיל, ומונעת קישור עם המצע
- אנבוליים
- מתאר את המסלול הדורש קלט אנרגיה נטו כדי לסנתז מולקולות מורכבות מפשוטות יותר
- ביו-אנרגטיקה
- הרעיון של זרימת אנרגיה דרך מערכות חיות
- קטבולי
- מתאר את המסלול שבו מולקולות מורכבות מתפרקות לפשוטות יותר, ומניבות אנרגיה כתוצר נוסף של התגובה
- עיכוב תחרותי
- מנגנון כללי של ויסות פעילות האנזים שבו מולקולה שאינה המצע של האנזים מסוגלת לקשור את האתר הפעיל ולמנוע מהמצע עצמו להיקשר, ובכך לעכב את קצב התגובה הכולל של האנזים
- אנדרגוני
- מתאר תגובה כימית המביאה למוצרים המאחסנים יותר אנרגיה פוטנציאלית כימית מאשר המגיבים
- אנזים
- מולקולה המזרזת תגובה ביוכימית
- אקסרגוני
- מתאר תגובה כימית המביאה למוצרים עם פחות אנרגיה פוטנציאלית כימית מהמגיבים, בתוספת שחרור אנרגיה חופשית
- עיכוב משוב
- מנגנון של ויסות פעילות האנזים שבו תוצר התגובה או התוצר הסופי של סדרה של תגובות עוקבות מעכב אנזים לשלב מוקדם יותר בסדרת התגובות
- אנרגיית חום
- האנרגיה המועברת ממערכת אחת לאחרת שאינה עובדת
- אנרגיה קינטית
- סוג האנרגיה הקשורה לאובייקטים בתנועה
- חילוף חומרים
- כל התגובות הכימיות המתרחשות בתוך התאים, כולל אלה שמשתמשות באנרגיה וכאלה שמשחררות אנרגיה
- עיכוב לא תחרותי
- מנגנון כללי של ויסות פעילות האנזים בו מולקולה רגולטורית נקשרת לאתר שאינו האתר הפעיל ומונעת מהאתר הפעיל לקשור את המצע; לפיכך, מולקולת המעכב אינה מתחרה במצע על האתר הפעיל; עיכוב אלוסטרי הוא סוג של עיכוב לא תחרותי
- אנרגיה פוטנציאלית
- סוג האנרגיה המתייחס לפוטנציאל לבצע עבודה
- מצע
- מולקולה שעליה פועל האנזים
- תרמודינמיקה
- מדע היחסים בין חום, אנרגיה ועבודה


