2.1: חומר
- Page ID
- 207868
אטומים, מולקולות ותרכובות
ברמה הבסיסית ביותר, החיים עשויים מחומר. חומר הוא משהו שתופס מקום ויש לו מסה. כל החומר מורכב מאלמנטים, חומרים שלא ניתן לפרק או להפוך כימית לחומרים אחרים. כל יסוד עשוי מאטומים, שלכל אחד מהם מספר קבוע של פרוטונים ותכונות ייחודיות. בסך הכל הוגדרו 118 יסודות; עם זאת, רק 92 מתרחשים באופן טבעי ופחות מ -30 נמצאים בתאים חיים. 26 האלמנטים הנותרים אינם יציבים ולכן אינם קיימים זמן רב מאוד או שהם תיאורטיים וטרם התגלו. כל יסוד מסומן על ידי הסמל הכימי שלו (כגון H, N, O, C ו- Na), ובעל תכונות ייחודיות. מאפיינים ייחודיים אלה מאפשרים לאלמנטים לשלב ולהיקשר זה עם זה בדרכים ספציפיות.
אטום הוא המרכיב הקטן ביותר של יסוד השומר על כל התכונות הכימיות של אותו יסוד. לדוגמה, לאטום מימן אחד יש את כל התכונות של היסוד מימן, כמו שהוא קיים כגז בטמפרטורת החדר והוא נקשר לחמצן ליצירת מולקולת מים. לא ניתן לפרק אטומי מימן למשהו קטן יותר תוך שמירה על תכונות המימן. אם אטום מימן היה מתפרק לחלקיקים תת-אטומיים, כבר לא היו לו תכונות של מימן. ברמה הבסיסית ביותר, כל האורגניזמים עשויים משילוב של אלמנטים. הם מכילים אטומים המתחברים יחד ליצירת מולקולות. באורגניזמים רב-תאיים, כמו בעלי חיים, מולקולות יכולות לקיים אינטראקציה ליצירת תאים המשתלבים ליצירת רקמות המרכיבות איברים. שילובים אלה נמשכים עד שנוצרים אורגניזמים רב-תאיים שלמים.
כל החומר, בין אם זה סלע או אורגניזם, עשוי מאטומים. לעתים קרובות, אטומים אלה משתלבים ויוצרים מולקולות. מולקולה הם כימיקלים העשויים משני אטומים או יותר המחוברים זה לזה. חלק מהמולקולות פשוטות מאוד, כמו O2, המורכב משני אטומי חמצן בלבד. חלק מהמולקולות המשמשות אורגניזמים, כגון DNA, עשויות ממיליונים רבים של אטומים. כל האטומים מכילים פרוטונים, אלקטרונים ונויטרונים (דמות \(\PageIndex{1}\) לְהַלָן). היוצא מן הכלל היחיד הוא מימן (H), העשוי מפרוטון אחד ואלקטרון אחד. פרוטון הוא חלקיק טעון חיובי השוכן בגרעין (ליבת האטום) של אטום ובעל מסה של 1 ומטען של +1. אלקטרון הוא חלקיק טעון שלילי הנע בחלל סביב הגרעין. במילים אחרות, הוא שוכן מחוץ לגרעין. יש לו מסה זניחה ויש לו מטען של -1. נויטרונים, כמו פרוטונים, שוכנים בגרעין האטום. יש להם מסה של 1 וללא תשלום. המטענים החיוביים (פרוטונים) ושליליים (אלקטרונים) מאזנים זה את זה באטום ניטרלי, שיש לו מטען אפס נטו.
כל יסוד מכיל מספר שונה של פרוטונים ונויטרונים, מה שמקנה לו מספר אטומי ומספר מסה משלו. המספר האטומי של יסוד שווה למספר הפרוטונים שהיסוד מכיל. מספר המסה הוא מספר הפרוטונים בתוספת מספר הנויטרונים של אותו יסוד. לכן, ניתן לקבוע את מספר הנייטרונים על ידי הפחתת המספר האטומי ממספר המסה.
איזוטופים הם צורות שונות של אותו יסוד שיש להם מספר זהה של פרוטונים, אך מספר שונה של נויטרונים. לחלק מהיסודות, כמו פחמן, אשלגן ואורניום, יש איזוטופים טבעיים. פחמן 12, האיזוטופ הנפוץ ביותר של פחמן, מכיל שישה פרוטונים ושישה נויטרונים. לכן יש לו מספר מסה של 12 (שישה פרוטונים ושישה נויטרונים) ומספר אטומי של 6 (מה שהופך אותו לפחמן). פחמן 14 מכיל שישה פרוטונים ושמונה נויטרונים. לכן יש לו מספר מסה של 14 (שישה פרוטונים ושמונה נויטרונים) ומספר אטומי של 6, כלומר הוא עדיין היסוד פחמן. שתי צורות חלופיות אלה של פחמן הן איזוטופים. איזוטופים מסוימים אינם יציבים ויאבדו פרוטונים, חלקיקים תת אטומיים אחרים או אנרגיה ליצירת יסודות יציבים יותר. אלה נקראים איזוטופים רדיואקטיביים או רדיואיזוטופים.
אבולוציה בפעולה: תיארוך פחמן
פחמן-14 (14C) הוא רדיואיזוטופ טבעי שנוצר באטמוספירה על ידי קרניים קוסמיות. זהו תהליך מתמשך, כך שתמיד נוצר יותר 14C. ככל שמתפתח אורגניזם חי, הרמה היחסית של 14C בגופו שווה לריכוז 14C באטמוספירה. כאשר אורגניזם מת, הוא כבר לא בולע 14C, ולכן היחס יירד. 14C מתפורר ל 14N על ידי תהליך שנקרא ריקבון בטא; זה נותן אנרגיה בתהליך איטי זה. לאחר כ-5,730 שנים, רק מחצית מהריכוז ההתחלתי של 14C יומר ל-14N. הזמן שלוקח למחצית מהריכוז המקורי של איזוטופ להתפרק לצורתו היציבה יותר נקרא מחצית החיים שלו.
מכיוון שזמן מחצית החיים של 14C ארוך, הוא משמש ליישון חפצים חיים בעבר, כגון מאובנים. באמצעות היחס בין ריכוז 14C שנמצא באובייקט לכמות 14C שזוהתה באטמוספירה, ניתן לקבוע את כמות האיזוטופ שטרם התפרק. בהתבסס על כמות זו, ניתן לחשב את גיל המאובן לכ- 50,000 שנה (דמות \(\PageIndex{2}\) לְהַלָן). איזוטופים עם מחצית חיים ארוכה יותר, כגון אשלגן -40, משמשים לחישוב הגילאים של מאובנים ישנים יותר. באמצעות שימוש בתארוך פחמן, מדענים יכולים לשחזר את האקולוגיה והביוגיאוגרפיה של אורגניזמים החיים במהלך 50,000 השנים האחרונות.
איגרות חוב כימיות
האופן שבו אלמנטים מתקשרים זה עם זה תלוי במספר האלקטרונים ובאופן סידורם. כאשר אטום אינו מכיל מספר שווה של פרוטונים ואלקטרונים הוא נקרא יון. מכיוון שמספר האלקטרונים אינו שווה למספר הפרוטונים, לכל יון יש מטען נטו. לדוגמה, אם נתרן מאבד אלקטרון, יש לו כעת 11 פרוטונים ורק 10 אלקטרונים, מה שמשאיר אותו עם מטען כולל של +1. יונים חיוביים נוצרים על ידי איבוד אלקטרונים ונקראים קטיונים. יונים שליליים נוצרים על ידי השגת אלקטרונים ונקראים אניונים. שמות אניוניים יסודיים משתנים כדי להסתיים ב- -ide. כדוגמה, כאשר כלור הופך ליון הוא מכונה כלוריד.
קשרים יוניים וקוולנטיים הם קשרים חזקים הנוצרים בין שני אטומים. קשרים אלה מחזיקים אטומים יחד במצב יציב יחסית. קשרים יוניים נוצרים בין שני יונים טעונים מנוגדים (אניון וקטיון). מכיוון שמטענים חיוביים ושליליים מושכים, יונים אלה מוחזקים יחד כמו ששני מגנטים טעונים מנוגדים היו נדבקים זה לזה. קשרים קוולנטיים נוצרים כאשר אלקטרונים משותפים בין שני אטומים. כל אטום חולק את אחד האלקטרונים שלהם, שמקיף את הגרעינים של שני האטומים, ומחזיק את שני האטומים זה בזה. קשרים קוולנטיים הם הצורה החזקה והנפוצה ביותר של קשר כימי באורגניזמים. בניגוד לרוב הקשרים היוניים, קשרים קוולנטיים אינם מתנתקים במים.
קשרים קוולנטיים מגיעים בשני סוגים: קוטביים ולא קוטביים. קשר קוולנטי לא קוטבי מתרחש כאשר האלקטרונים מחולקים באופן שווה בין שני האטומים. קשרים קוולנטיים קוטביים נוצרים כאשר האלקטרונים משותפים באופן לא שווה. מדוע זה קורה? לכל יסוד יש אלקטרושליליות ידועה: מדד לזיקה שלהם לאלקטרונים. חלק מהיסודות, כמו חמצן, הם מאוד אלקטרונגטיביים מכיוון שהם מושכים מאוד אלקטרונים מאטומים אחרים. למימן, בינתיים, יש אלקטרושליליות נמוכה ולכן מושך חלש אלקטרונים, בהשוואה. קשרים קוולנטיים קוטביים נוצרים כאשר לשני האטומים המעורבים יש אלקטרושליליות שונות באופן משמעותי. במערכות ביולוגיות זה קורה כאשר חמצן נקשר למימן וכאשר חנקן (גם די אלקטרונגטיבי) נקשר למימן.
כאשר חמצן ומימן נקשרים, למשל, האלקטרונים המשותפים נמשכים חזק יותר לעבר חמצן ובכך רחוקים יותר מגרעין המימן. מכיוון שהאלקטרונים מתרחקים יותר ממימן, הוא הופך להיות טעון מעט חיובי (δ+). החמצן הופך טעון מעט שלילי ככל שהאלקטרונים מתקרבים אליו (δ—). אם שתי מולקולות בעלות קשרים קוולנטיים קוטביים מתקרבות זו לזו, הן יכולות לקיים אינטראקציה עקב משיכה של מטענים חשמליים מנוגדים. לדוגמה, המטען החיובי הקל של מימן במולקולת מים יכול להימשך למטען השלילי הקל של חמצן במולקולת מים אחרת (איור\(\PageIndex{3}\)). אינטראקציה זו בין שתי מולקולות קוטביות נקראת קשר מימן. קשר מסוג זה נפוץ מאוד באורגניזמים. יש לציין כי קשרי מימן מעניקים למים את התכונות הייחודיות המקיימות חיים. אלמלא קשירת מימן, מים היו גז ולא נוזל בטמפרטורת החדר.
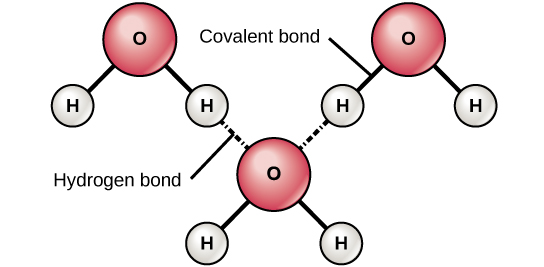
מים חיוניים לשמירה על החיים
האם תהית אי פעם מדוע מדענים מבלים זמן בחיפוש אחר מים בכוכבי לכת אחרים? הסיבה לכך היא שמים חיוניים לחיים; אפילו עקבות זעירים ממנו בכוכב אחר יכולים להצביע על כך שחיים יכולים או היו קיימים בכוכב הלכת ההוא. מים הם אחת המולקולות השופעות יותר בתאים חיים וזו הקריטית ביותר לחיים כפי שאנו מכירים אותם. כ- 60-70 אחוז מגופך מורכב ממים. בלי זה, החיים פשוט לא היו קיימים.
- מים הם קוטביים. אטומי המימן והחמצן בתוך מולקולות המים יוצרים קשרים קוולנטיים קוטביים. האלקטרונים המשותפים מבלים זמן רב יותר בקשר לאטום החמצן מאשר לאטומי מימן. אין מטען כולל למולקולת מים, אך יש מטען חיובי קל על כל אטום מימן ומטען שלילי קל על אטום החמצן. בגלל המטענים הללו, אטומי המימן החיוביים מעט דוחים זה את זה ויוצרים את הצורה הייחודית. כל מולקולת מים מושכת מולקולות מים אחרות בגלל המטענים החיוביים והשליליים בחלקים השונים של המולקולה. מים מושכים גם מולקולות קוטביות אחרות (כגון סוכרים) שיכולות להתמוסס במים ומכונות הידרופיליות ("אוהבות מים").
- מים מייצב טמפרטורה. קשרי המימן במים מאפשרים לו לספוג ולשחרר אנרגיית חום לאט יותר מחומרים רבים אחרים. טמפרטורה היא מדד לתנועה (אנרגיה קינטית) של מולקולות. ככל שהתנועה עולה, האנרגיה גבוהה יותר ולכן הטמפרטורה גבוהה יותר. מים סופגים אנרגיה רבה לפני שהטמפרטורה שלהם עולה. אנרגיה מוגברת משבשת את קשרי המימן בין מולקולות מים. מכיוון שניתן ליצור ולהפריע לקשרים אלו במהירות, מים סופגים עלייה באנרגיה והטמפרטורה משתנה באופן מינימלי בלבד. המשמעות היא שמים ממתנים את שינויי הטמפרטורה בתוך אורגניזמים ובסביבתם.
- מים הם ממס מצוין. מכיוון שהמים הם קוטביים, עם מטענים חיוביים ושליליים קלים, תרכובות יוניות ומולקולות קוטביות יכולות להתמוסס בהם בקלות. מים הם, אם כן, מה שמכונה ממס - חומר המסוגל להמיס חומר אחר. החלקיקים הטעונים ייצרו קשרי מימן עם שכבה מסביב של מולקולות מים.
- מים מלוכדים. האם אי פעם מילאת כוס מים עד החלק העליון ואז הוספת לאט לאט עוד כמה טיפות? לפני שהם עולים על גדותיהם, המים יוצרים למעשה צורה דמוית כיפה מעל שפת הזכוכית. מים אלה יכולים להישאר מעל הזכוכית בגלל תכונת הלכידות. בלכידות, מולקולות מים נמשכות זו לזו (בגלל קשר מימן), ושומרות את המולקולות יחד בממשק הנוזל-אוויר (גז), אם כי אין יותר מקום בכוס. לכידות מולידה מתח פנים, יכולתו של חומר לעמוד בקרע כאשר הוא ממוקם תחת מתח או לחץ. כשאתה מפיל פיסת נייר קטנה על טיפת מים, הנייר צף על גבי טיפת המים, אם כי החפץ צפוף יותר (כבד יותר) מהמים. זה קורה בגלל מתח הפנים שנוצר על ידי מולקולות המים. לכידות ומתח פני השטח שומרים על מולקולות המים שלמות והפריט צף למעלה. אפשר אפילו "לצוף" מחט פלדה על גבי כוס מים אם מניחים אותה בעדינות, מבלי לשבור את מתח הפנים. כוחות מלוכדים אלה קשורים גם לתכונת ההידבקות של המים, או למשיכה בין מולקולות מים למולקולות אחרות. זה נצפה כאשר מים "מטפסים" במעלה קש המונח בכוס מים. תבחין כי נראה שהמים גבוהים יותר בצידי הקש מאשר באמצע. הסיבה לכך היא שמולקולות המים נמשכות לקש ולכן נצמדות אליו. כוחות מלוכדים ודביקים חשובים לקיום החיים. לדוגמה, בגלל כוחות אלה, מים יכולים לזרום מהשורשים לצמרות הצמחים כדי להאכיל את הצמח.
מאגרים, pH, חומצות ובסיסים
ה - pH של תמיסה הוא מדד לחומציות או לבסיסיות שלה. סולם ה-pH נע בין 0 ל-14. שינוי של יחידה אחת בסולם ה- pH מייצג שינוי בריכוז יוני המימן בפקטור 10, שינוי בשתי יחידות מייצג שינוי בריכוז יוני המימן בפקטור 100. לפיכך, שינויים קטנים ב- pH מייצגים שינויים גדולים בריכוזי יוני המימן. מים טהורים הם ניטרליים. הוא אינו חומצי ואינו בסיסי ובעל pH של 7.0. כל דבר מתחת ל -7.0 (שנע בין 0.0 ל -6.9) הוא חומצי, וכל דבר מעל 7.0 (בין 7.1 ל -14.0) הוא אלקליין. הדם בעורקים שלך מעט בסיסי (pH = 7.4). הסביבה בבטן שלך חומצית מאוד (pH = 1 עד 2). מיץ תפוזים הוא חומצי קל (pH = כ -3.5), ואילו סודה לשתייה היא בסיסית (pH = 9.0).
חומצות הן חומרים המספקים יוני מימן (H+) ו- pH נמוך יותר, ואילו בסיסים מספקים יוני הידרוקסיד (OH—) ומעלים את ה- pH. ככל שהחומצה חזקה יותר, כך היא תורמת בקלות רבה יותר H+. לדוגמה, חומצה הידרוכלורית ומיץ לימון הם חומציים מאוד ומוותרים בקלות על H+ כאשר מוסיפים אותם למים. לעומת זאת, בסיסים הם אותם חומרים התורמים בקלות OH—. יוני OH משתלבים עם H+ כדי לייצר מים, מה שמעלה את ה- pH של החומר. נתרן הידרוקסיד וחומרי ניקוי ביתיים רבים הם בסיסיים מאוד ומוותרים על OH - במהירות כאשר הם מונחים במים, ובכך מעלים את ה- pH.
איך זה שאנחנו יכולים לבלוע או לשאוף חומרים חומציים או בסיסיים ולא למות? מאגרים הם המפתח. מאגרים סופגים בקלות עודף H+ או OH—, ושומרים על ה- pH של הגוף נשמר בקפידה בטווח הצר הנ"ל. פחמן דו חמצני הוא חלק ממערכת חיץ בולטת בגוף האדם; זה שומר על ה- pH בטווח הנכון. מערכת חיץ זו כוללת חומצה פחמנית (H 2 CO 3) ואניון ביקרבונט (HCO 3 -). אם יותר מדי H+ נכנס לגוף, ביקרבונט ישתלב עם ה- H+ ליצירת חומצה פחמנית ולהגביל את הירידה ב- pH. באופן דומה, אם יותר מדי OH— מוכנס למערכת, חומצה פחמנית תשתלב איתה ליצירת ביקרבונט ותגביל את עליית ה- pH. בעוד שחומצה פחמנית היא מוצר חשוב בתגובה זו, נוכחותה חולפת מכיוון שהחומצה הפחמנית משתחררת מהגוף כגז פחמן דו חמצני בכל פעם שאנו נושמים. ללא מערכת חיץ זו, ה- pH בגופנו היה משתנה יותר מדי ולא היינו מצליחים לשרוד.
מולקולות ביולוגיות
מלבד מים, המולקולות הדרושות לחיים הן אורגניות. מולקולות אורגניות הן אלו המכילות פחמן הקשור באופן קוולנטי למימן. בנוסף, הם עשויים להכיל חמצן, חנקן, זרחן, גופרית ואלמנטים נוספים. ישנם ארבעה סוגים עיקריים של מולקולות אורגניות: פחמימות, שומנים, חלבונים וחומצות גרעין. כל אחד מהם הוא מרכיב חשוב בתא ומבצע מגוון רחב של פונקציות.
לעתים קרובות אומרים שהחיים הם "מבוססי פחמן". המשמעות היא שאטומי פחמן, הקשורים לאטומי פחמן אחרים או ליסודות אחרים, מהווים את המרכיבים הבסיסיים של רבות מהמולקולות המצויות באופן ייחודי ביצורים חיים. אלמנטים אחרים ממלאים תפקידים חשובים במולקולות ביולוגיות, אך פחמן בהחלט כשיר כיסוד "הבסיס" למולקולות ביצורים חיים. תכונות הקשר של אטומי הפחמן הן שאחראיות לתפקידו החשוב.
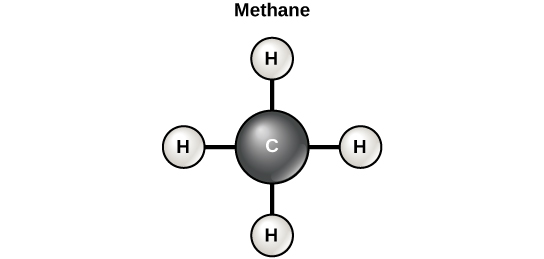
פחמן יכול ליצור ארבעה קשרים קוולנטיים עם אטומים או מולקולות אחרות. מולקולת הפחמן האורגנית הפשוטה ביותר היא מתאן (CH4), שבו ארבעה אטומי מימן נקשרים לאטום פחמן (איור\(\PageIndex{5}\)). פחמימות כוללות את מה שמכונה בדרך כלל סוכרים פשוטים, כמו גלוקוז, ופחמימות מורכבות כמו עמילן. בעוד שסוגים רבים של פחמימות משמשים לאנרגיה, חלקם משמשים למבנה על ידי רוב האורגניזמים, כולל צמחים ובעלי חיים. לדוגמא, תאית היא פחמימה מורכבת המוסיפה קשיחות וחוזק לדפנות התא של הצמחים. הסיומת "-ose" מציינת פחמימה, אך שימו לב שלא כל הפחמימות קיבלו סיומת זו כאשר שמות (למשל עמילן).
ליפידים כוללים קבוצה מגוונת של תרכובות המאוחדות על ידי תכונה משותפת. ליפידים הם הידרופוביים ("חוששים ממים"), או בלתי מסיסים במים, מכיוון שהם מולקולות לא קוטביות (מולקולות המכילות קשרים קוולנטיים לא קוטביים). ליפידים מבצעים פונקציות רבות ושונות בתא. תאים אוגרים אנרגיה לשימוש ארוך טווח בצורה של שומנים הנקראים שומנים. ליפידים מספקים גם בידוד מהסביבה לצמחים ובעלי חיים. לדוגמה, הם עוזרים לשמור על יובש של ציפורים ויונקים ימיים בגלל אופיים הדוחה מים. ליפידים הם גם אבני הבניין של הורמונים רבים ומהווים מרכיב חשוב בממברנות התא. ליפידים כוללים שומנים, שמנים, שעווה, פוספוליפידים וסטרואידים.
חלבונים הם אחת המולקולות האורגניות הנפוצות ביותר במערכות חיות ויש להם את מגוון הפונקציות המגוון ביותר של כל המקרומולקולות. כולם פולימרים של חומצות אמינו. תפקידי החלבונים מגוונים מאוד מכיוון שישנן 20 חומצות אמינו שונות מבחינה כימית היוצרות שרשראות ארוכות, וחומצות האמינו יכולות להיות בכל סדר. חלבונים יכולים לתפקד כאנזימים, הורמונים, סיבים מתכווצים, מוטות שלד ועוד ועוד. אנזימים חיוניים לחיים מכיוון שהם פועלים כזרז בתגובות ביוכימיות (כמו עיכול). כל אנזים הוא ספציפי למצע (מגיב הנקשר לאנזים) שעליו הוא פועל. אנזימים יכולים לתפקד לשבירת קשרים מולקולריים, לסדר מחדש קשרים או ליצירת קשרים חדשים.
חומצות גרעין הן מולקולות גדולות מאוד החשובות להמשכיות החיים. הם נושאים את התוכנית הגנטית של תא ובכך את ההוראות לפונקציונליות שלו. שני הסוגים העיקריים של חומצות גרעין הם חומצה דאוקסיריבונוקלאית (DNA) וחומצה ריבונוקלאית (RNA). DNA הוא החומר הגנטי המצוי בכל האורגניזמים, החל מחיידקים חד תאיים ועד יונקים רב תאיים. הסוג השני של חומצת גרעין, RNA, מעורב בעיקר בסינתזת חלבונים. מולקולות ה- DNA לעולם אינן עוזבות את הגרעין, אלא משתמשות במתווך RNA כדי לתקשר עם שאר התא. סוגים אחרים של RNA מעורבים גם בסינתזת חלבון ובוויסות שלה. DNA ו- RNA מורכבים מאבני בניין קטנות המכונות נוקלאוטידים. הנוקלאוטידים משתלבים זה בזה ויוצרים פולינוקלאוטיד: DNA או RNA. כל נוקלאוטיד מורכב משלושה מרכיבים: בסיס חנקני, סוכר פנטוז (חמישה פחמן) ופוספט. ל-DNA יש מבנה דו-סלילי יפהפה (איור\(\PageIndex{6}\)).
משאבים נוספים:

ייחוס
- מושגי ביולוגיה מאת OpenStax מורשה תחת CC BY 4.0. שונה מהמקור על ידי מתיו ר 'פישר.


