35.2: כיצד נוירונים מתקשרים
- Page ID
- 205951
מיומנויות לפיתוח
- תאר את הבסיס לפוטנציאל הממברנה המנוחה
- הסבר את השלבים של פוטנציאל פעולה וכיצד מופצים פוטנציאל הפעולה
- הסבר את הדמיון וההבדלים בין סינפסות כימיות וחשמליות
- תאר פוטנציאל לטווח ארוך ודיכאון ארוך טווח
כל הפונקציות המבוצעות על ידי מערכת העצבים - מרפלקס מוטורי פשוט ועד פונקציות מתקדמות יותר כמו קבלת זיכרון או החלטה - דורשות נוירונים לתקשר זה עם זה. בעוד שבני אדם משתמשים במילים ובשפת גוף כדי לתקשר, נוירונים משתמשים באותות חשמליים וכימיים. בדיוק כמו אדם בוועדה, נוירון אחד בדרך כלל מקבל ומסנתז מסרים ממספר נוירונים אחרים לפני שהוא "מקבל את ההחלטה" לשלוח את המסר לנוירונים אחרים.
העברת דחף עצבי בתוך נוירון
כדי שמערכת העצבים תתפקד, נוירונים חייבים להיות מסוגלים לשלוח ולקבל אותות. אותות אלה אפשריים מכיוון שלכל נוירון יש קרום תאי טעון (הפרש מתח בין הפנים לחוץ), והמטען של קרום זה יכול להשתנות בתגובה למולקולות נוירוטרנסמיטר המשתחררות מנוירונים אחרים וגירויים סביבתיים. כדי להבין כיצד נוירונים מתקשרים, יש להבין תחילה את הבסיס של מטען הממברנה הבסיסי או ה'מנוחה'.
ממברנות טעונות עצביות
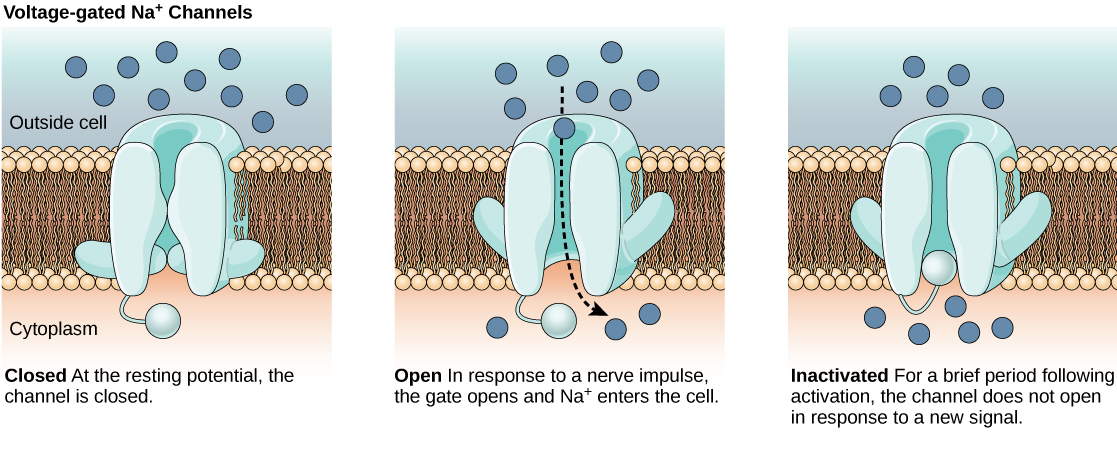
הממברנה הדו-שכבתית השומנית המקיפה נוירון אטומה למולקולות או יונים טעונים. כדי להיכנס או לצאת מהנוירון, יונים חייבים לעבור דרך חלבונים מיוחדים הנקראים תעלות יונים המשתרעות על הממברנה. לערוצי יונים יש תצורות שונות: פתוחות, סגורות ולא פעילות, כפי שמודגם באיור\(\PageIndex{1}\). יש להפעיל כמה תעלות יונים על מנת להיפתח ולאפשר ליונים לעבור לתא או לצאת ממנו. תעלות יונים אלו רגישות לסביבה ויכולות לשנות את צורתן בהתאם. תעלות יונים שמשנות את המבנה שלהן בתגובה לשינויי מתח נקראות תעלות יונים בשער מתח. תעלות יונים בשער מתח מווסתות את הריכוזים היחסיים של יונים שונים בתוך התא ומחוצה לו. ההבדל במטען הכולל בין החלק הפנימי והחיצוני של התא נקרא פוטנציאל הממברנה.
קישור ללמידה
סרטון זה דן בבסיס פוטנציאל הממברנה המנוחה.
פוטנציאל ממברנה במנוחה
נוירון במנוחה טעון שלילי: החלק הפנימי של התא שלילי בערך 70 מיליוולט מבחוץ (-70 mV, שימו לב שמספר זה משתנה לפי סוג הנוירון ולפי מינים). מתח זה נקרא פוטנציאל הממברנה המנוחה; הוא נגרם על ידי הבדלים בריכוזי היונים בתוך התא ומחוצה לו. אם הממברנה הייתה חדירה באותה מידה לכל היונים, כל סוג של יון היה זורם על פני הממברנה והמערכת הייתה מגיעה לשיווי משקל. מכיוון שיונים אינם יכולים פשוט לחצות את הממברנה כרצונם, ישנם ריכוזים שונים של מספר יונים בתוך התא ומחוצה לו, כפי שמוצג בטבלה שלהלן. ההבדל במספר יוני האשלגן הטעונים חיובי (K +) בתוך התא ומחוצה לו שולט בפוטנציאל הממברנה המנוחה (איור\(\PageIndex{2}\)). כאשר הממברנה במנוחה, יוני K+ מצטברים בתוך התא עקב תנועה נטו עם שיפוע הריכוז. פוטנציאל הממברנה המנוחה השלילי נוצר ומתוחזק על ידי הגדלת ריכוז הקטיונים מחוץ לתא (בנוזל החוץ תאי) ביחס לתא (בציטופלזמה). המטען השלילי בתוך התא נוצר על ידי קרום התא חדיר יותר לתנועת יוני אשלגן מאשר תנועת יוני נתרן. בנוירונים, יוני אשלגן נשמרים בריכוזים גבוהים בתוך התא בעוד יוני נתרן נשמרים בריכוזים גבוהים מחוץ לתא. לתא יש תעלות דליפת אשלגן ונתרן המאפשרות לשני הקטיונים להתפזר במורד שיפוע הריכוז שלהם. עם זאת, לנוירונים יש הרבה יותר תעלות דליפת אשלגן מאשר תעלות דליפת נתרן. לכן, אשלגן מתפזר אל מחוץ לתא בקצב מהיר בהרבה ממה שנתרן דולף פנימה. מכיוון שיותר קטיונים עוזבים את התא ממה שנכנסים, הדבר גורם לחלקו הפנימי של התא להיות טעון שלילי ביחס לחלק החיצוני של התא. הפעולות של משאבת אשלגן הנתרן עוזרות לשמור על פוטנציאל המנוחה, לאחר שהוקם. נזכיר כי משאבות אשלגן נתרן מכניסות שני יוני K+ לתא תוך הסרת שלושה יוני Na + לכל ATP הנצרך. ככל שיותר קטיונים גורשים מהתא מאשר נלקחים פנימה, החלק הפנימי של התא נשאר טעון שלילי ביחס לנוזל החוץ תאי. יש לציין כי יוני סידן (Cl —) נוטים להצטבר מחוץ לתא מכיוון שהם נדחים על ידי חלבונים טעונים שלילית בתוך הציטופלזמה.
| יון | ריכוז חוץ תאי (mM) | ריכוז תוך תאי (mM) | יחס בחוץ/בפנים |
|---|---|---|---|
| נה + | 145 | 12 | 12 |
| K + | 4 | 155 | 0.026 |
| Cl - | 120 | 4 | 30 |
| אניונים אורגניים (A−) | — | 100 |
פוטנציאל פעולה
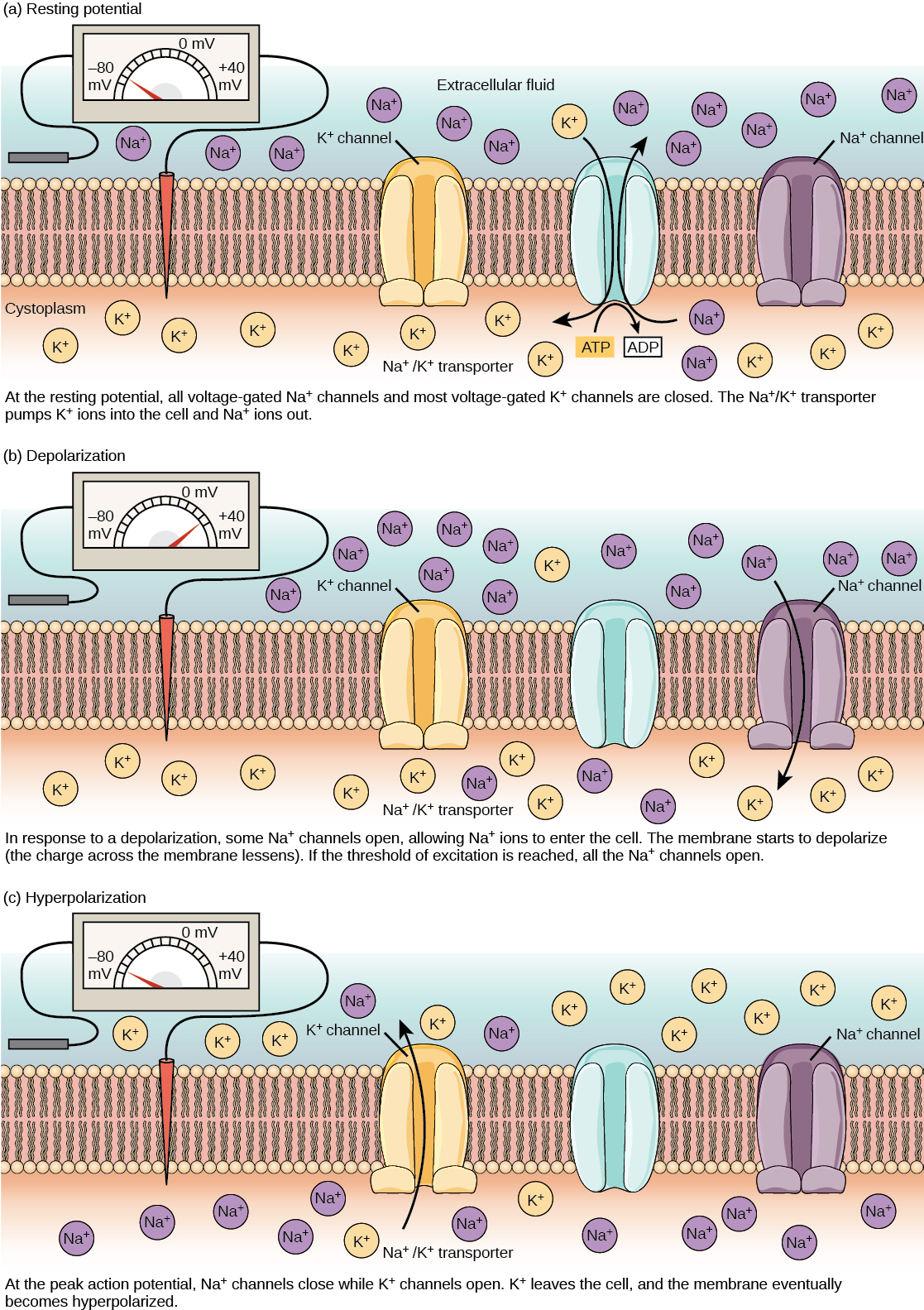
נוירון יכול לקבל קלט מנוירונים אחרים, ואם קלט זה חזק מספיק, לשלוח את האות לנוירונים במורד הזרם. העברת אות בין נוירונים מתבצעת בדרך כלל על ידי חומר כימי הנקרא נוירוטרנסמיטר. העברת אות בתוך נוירון (מדנדריט למסוף האקסון) מתבצעת על ידי היפוך קצר של פוטנציאל הממברנה המנוחה הנקרא פוטנציאל פעולה. כאשר מולקולות נוירוטרנסמיטר נקשרות לקולטנים הממוקמים על הדנדריטים של נוירון, תעלות יונים נפתחות. בסינפסות מעוררות, פתח זה מאפשר ליונים חיוביים להיכנס לנוירון וגורם לדפולריזציה של הממברנה - ירידה בהפרש המתח בין החלק הפנימי והחיצוני של הנוירון. גירוי מתא חושי או נוירון אחר מפרק את נוירון המטרה לפוטנציאל הסף שלו (-55 mV). ערוצי Na + בגבעת האקסון נפתחים ומאפשרים ליונים חיוביים להיכנס לתא (איור \(\PageIndex{3}\) ואיור\(\PageIndex{4}\)). ברגע שתעלות הנתרן נפתחות, הנוירון מתפזר לחלוטין לפוטנציאל ממברנה של כ- +40 mV. פוטנציאל הפעולה נחשב לאירוע "הכל או כלום", בכך שברגע שמגיעים לפוטנציאל הסף, הנוירון תמיד מתפזר לחלוטין. לאחר השלמת הדפולריזציה, התא חייב כעת "לאפס" את מתח הממברנה שלו בחזרה לפוטנציאל המנוחה. כדי להשיג זאת, ערוצי Na + נסגרים ולא ניתן לפתוח אותם. זה מתחיל את תקופת העקשן של הנוירון, שבה הוא לא יכול לייצר פוטנציאל פעולה נוסף מכיוון שתעלות הנתרן שלו לא ייפתחו. במקביל נפתחים ערוצי K+ בשער מתח ומאפשרים ל- K+ לעזוב את התא. כאשר יוני K+ עוזבים את התא, פוטנציאל הממברנה שוב הופך לשלילי. הדיפוזיה של K+ אל מחוץ לתא למעשה מפיצה את התא, בכך שפוטנציאל הממברנה הופך לשלילי יותר מפוטנציאל המנוחה הרגיל של התא. בשלב זה, תעלות הנתרן יחזרו למצב המנוחה שלהן, כלומר הן מוכנות להיפתח שוב אם פוטנציאל הממברנה שוב יעלה על פוטנציאל הסף. בסופו של דבר יוני K+ הנוספים מתפזרים החוצה מהתא דרך תעלות דליפת האשלגן, ומביאים את התא ממצבו ההיפר-קוטבי, בחזרה לפוטנציאל הממברנה המנוחה שלו.
חיבור אמנות
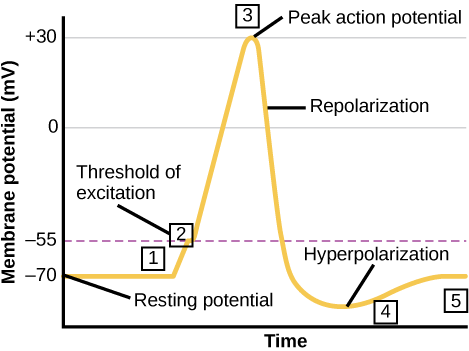
חוסמי תעלות אשלגן, כגון amiodarone ו- procainamide, המשמשים לטיפול בפעילות חשמלית חריגה בלב, הנקראת הפרעות קצב לב, מעכבים את תנועת K + דרך תעלות K + בשער מתח. על איזה חלק מפוטנציאל הפעולה היית מצפה שתעלות אשלגן ישפיעו?
קישור ללמידה
סרטון זה מציג סקירה כללית של פוטנציאל הפעולה.
המיאלין והתפשטות פוטנציאל הפעולה
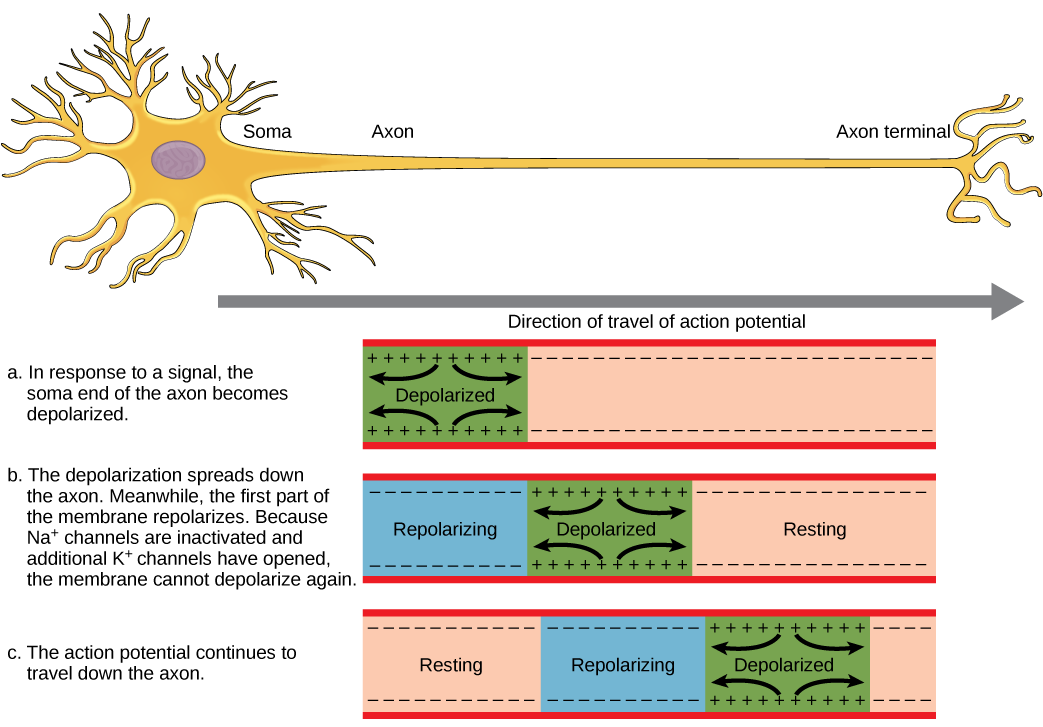
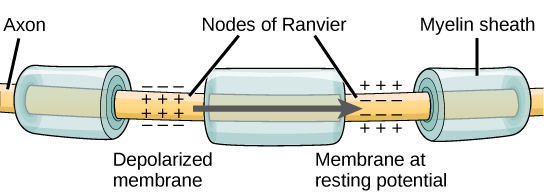
כדי שפוטנציאל פעולה יעביר מידע לנוירון אחר, עליו לנסוע לאורך האקסון ולהגיע למסופי האקסון שם הוא יכול ליזום שחרור נוירוטרנסמיטר. מהירות ההולכה של פוטנציאל פעולה לאורך אקסון מושפעת הן מקוטר האקסון והן מהתנגדות האקסון לדליפת זרם. המיאלין פועל כמבודד המונע מהזרם לצאת מהאקסון; זה מגביר את מהירות ההולכה הפוטנציאלית לפעולה. במחלות דה-מיאלינציה כמו טרשת נפוצה, ההולכה הפוטנציאלית לפעולה מואטת מכיוון שזרם דולף מאזורי אקסון מבודדים בעבר. הצמתים של Ranvier, המוצגים באיור \(\PageIndex{5}\) הם פערים במעטפת המיאלין לאורך האקסון. אורכם של חללים לא ממוינים אלה הוא כמיקרומטר אחד ומכילים ערוצי Na + ו- K + מגודרים במתח. זרימת יונים דרך ערוצים אלה, במיוחד ערוצי Na +, מחדשת את פוטנציאל הפעולה שוב ושוב לאורך האקסון. ה'קפיצה' הזו של פוטנציאל הפעולה מצומת אחד למשנהו נקראת הולכה מלוחה. אם צמתים של Ranvier לא היו קיימים לאורך אקסון, פוטנציאל הפעולה היה מתפשט לאט מאוד מכיוון שתעלות Na + ו- K + יצטרכו לחדש באופן רציף פוטנציאל פעולה בכל נקודה לאורך האקסון במקום בנקודות ספציפיות. צמתים של Ranvier גם חוסכים אנרגיה לנוירון מכיוון שהערוצים צריכים להיות נוכחים רק בצמתים ולא לאורך כל האקסון.
שידור סינפטי
הסינפסה או ה"פער "הוא המקום בו מועבר מידע מנוירון אחד למשנהו. סינפסות נוצרות בדרך כלל בין מסופי אקסון לקוצים דנדריטים, אך זה לא נכון באופן אוניברסלי. יש גם סינפסות גוף של אקסון לאקסון, דנדריט לדנדריט ואקסון לתא. הנוירון המעביר את האות נקרא הנוירון הפרסינפטי, והנוירון המקבל את האות נקרא הנוירון הפוסט -סינפטי. שים לב כי ייעודים אלה הם יחסית לסינפסה מסוימת - רוב הנוירונים הם פרסינפטיים ופוסט-סינפטיים כאחד. ישנם שני סוגים של סינפסות: כימיות וחשמליות.
סינפסה כימית
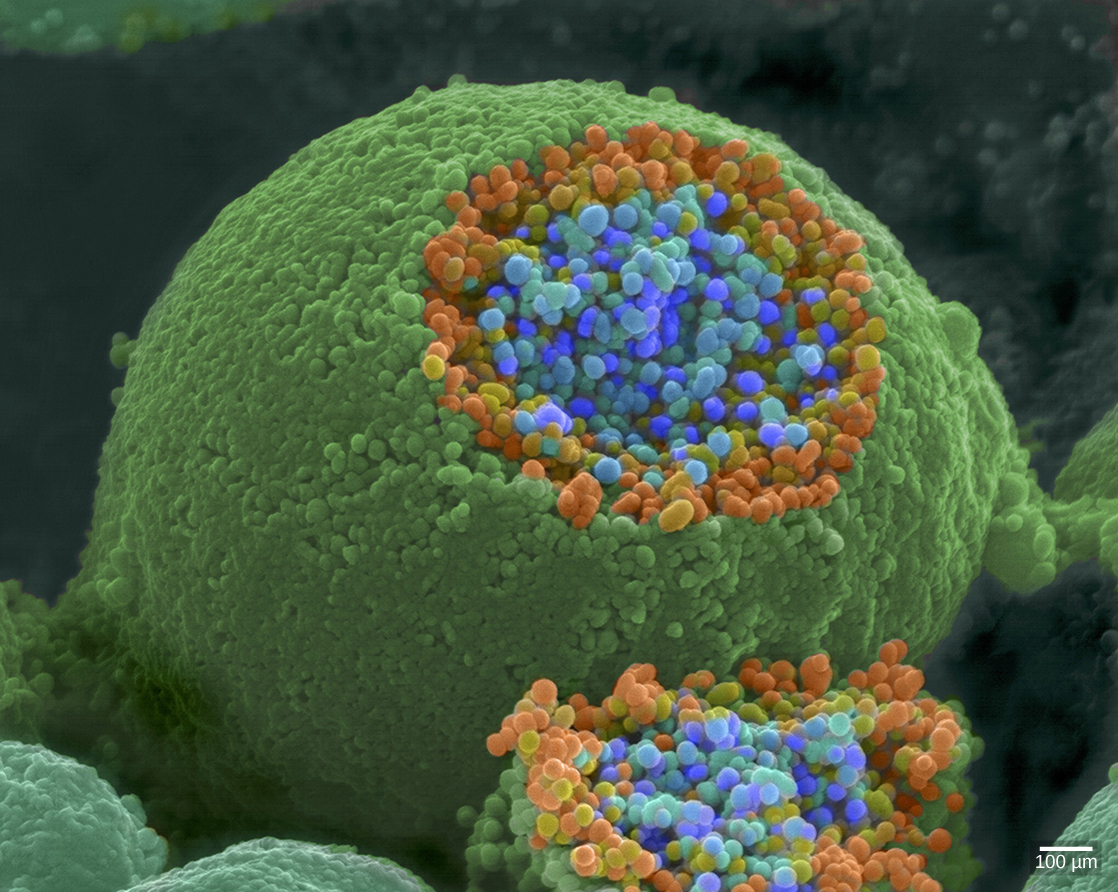
כאשר פוטנציאל פעולה מגיע למסוף האקסון הוא מבטל את הקוטב של הממברנה ופותח תעלות Na + בשער מתח. יוני Na + נכנסים לתא, ומפחיתים עוד יותר את הממברנה הפרסינפטית. דפולריזציה זו גורמת לפתיחת ערוצי Ca 2+ בשער מתח. יוני סידן הנכנסים לתא יוזמים מפל איתות הגורם לשלפוחיות קטנות הקשורות לממברנה, הנקראות שלפוחיות סינפטיות, המכילות מולקולות נוירוטרנסמיטר להתמזג עם הממברנה הפרסינפטית. שלפוחיות סינפטיות מוצגות באיור\(\PageIndex{6}\), שהוא תמונה ממיקרוסקופ אלקטרונים סורק.
מיזוג של שלפוחית עם הממברנה הפרסינפטית גורם לשחרור נוירוטרנסמיטר לתוך השסע הסינפטי, החלל החוץ -תאי בין הממברנות הפרסינפטיות והפוסט-סינפטיות, כפי שמודגם באיור. \(\PageIndex{7}\) המוליך העצבי מתפזר על פני השסע הסינפטי ונקשר לחלבוני קולטן על הממברנה הפוסט-סינפטית.
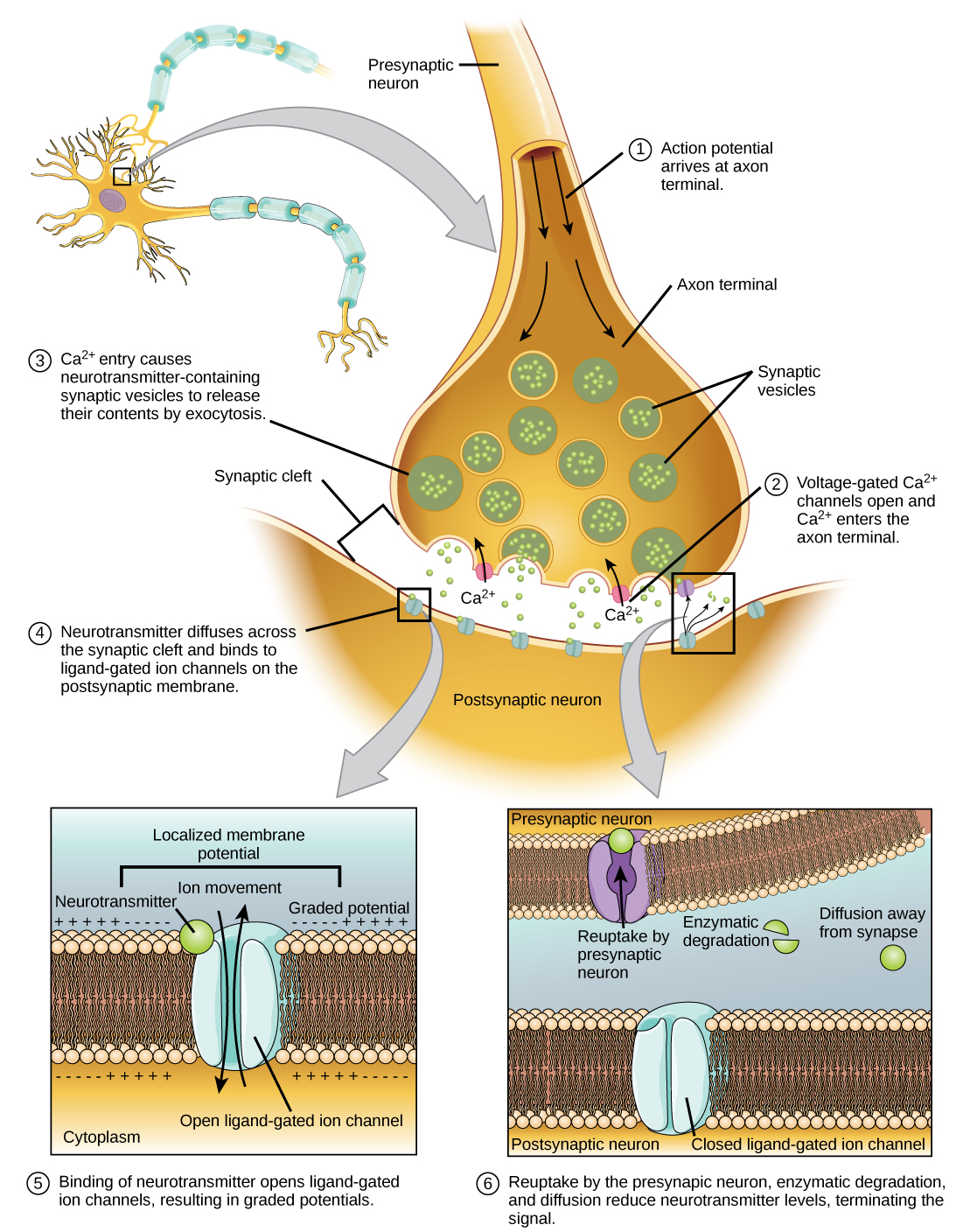
הקישור של מוליך עצבי ספציפי גורם לפתיחת תעלות יונים מסוימות, במקרה זה תעלות מגודרות ליגנד, על הממברנה הפוסט-סינפטית. נוירוטרנסמיטורים יכולים להיות בעלי השפעות מעוררות או מעכבות על הממברנה הפוסט-סינפטית, כמפורט בטבלה שלהלן. לדוגמה, כאשר אצטילכולין משתחרר בסינפסה שבין עצב לשריר (הנקרא צומת נוירו-שרירית) על ידי נוירון פרסינפטי, הוא גורם לפתיחת ערוצי Na + פוסט-סינפטיים. Na + נכנס לתא הפוסט -סינפטי וגורם לקרום הפוסט-סינפטי להתפזר. דפולריזציה זו נקראת פוטנציאל פוסט-סינפטי מעורר (EPSP) וגורמת לנוירון הפוסט-סינפטי לירות פוטנציאל פעולה. שחרור נוירוטרנסמיטר בסינפסות מעכבות גורם לפוטנציאלים פוסט-סינפטיים מעכבים (IPSPs), היפרפולריזציה של הממברנה הפרסינפטית. לדוגמה, כאשר המוליך העצבי GABA (חומצה גמא-אמינו-בוטירית) משתחרר מנוירון פרסינפטי, הוא נקשר ופותח תעלות Cl. Cl - יונים נכנסים לתא ומקוטבים את הממברנה, מה שהופך את הנוירון פחות לירות פוטנציאל פעולה.
לאחר שהתרחשה העברה עצבית, יש להסיר את המוליך העצבי מהשסע הסינפטי כדי שהממברנה הפוסט-סינפטית תוכל "להתאפס" ולהיות מוכנה לקבל אות נוסף. ניתן להשיג זאת בשלוש דרכים: המוליך העצבי יכול להתפזר הרחק מהשסע הסינפטי, הוא יכול להתפרק על ידי אנזימים בשסע הסינפטי, או שניתן למחזר אותו (נקרא לפעמים ספיגה חוזרת) על ידי הנוירון הפרסינפטי. מספר תרופות פועלות בשלב זה של העברה עצבית. לדוגמה, חלק מהתרופות הניתנות לחולי אלצהיימר פועלות על ידי עיכוב אצטילכולין אסטראז, האנזים המשפיל אצטילכולין. עיכוב זה של האנזים בעצם מגביר את ההעברה העצבית בסינפסות המשחררות אצטילכולין. לאחר שחרורו, האצטילכולין נשאר בשסע ויכול להיקשר ללא הרף ולנתק לקולטנים פוסט-סינפטיים.
| נוירוטרנסמיטר | דוגמא | מיקום |
|---|---|---|
| אצטילכולין | — | מערכת העצבים המרכזית ו/או PNS |
| אמין ביוגני | דופמין, סרוטונין, נוראדרנלין | מערכת העצבים המרכזית ו/או PNS |
| חומצת אמינו | גליצין, גלוטמט, אספרטט, חומצה גמא אמינו-בוטירית | מערכת העצבים המרכזית |
| נוירופפטיד | חומר P, אנדורפינים | מערכת העצבים המרכזית ו/או PNS |
סינפסה חשמלית
בעוד שסינפסות חשמליות פחות מספרן מאשר סינפסות כימיות, הן נמצאות בכל מערכות העצבים וממלאות תפקידים חשובים וייחודיים. אופן ההעברה העצבית בסינפסות חשמליות שונה בתכלית מזה בסינפסות כימיות. בסינפסה חשמלית, הממברנות הפרסינפטיות והפוסט-סינפטיות קרובות מאוד זו לזו ולמעשה מחוברות פיזית על ידי חלבוני תעלה היוצרים צומת פערים. צומת פערים מאפשרים לזרם לעבור ישירות מתא אחד למשנהו. בנוסף ליונים הנושאים זרם זה, מולקולות אחרות, כגון ATP, יכולות להתפזר דרך נקבוביות צומת הפער הגדולות.
ישנם הבדלים מרכזיים בין סינפסות כימיות וחשמליות. מכיוון שסינפסות כימיות תלויות בשחרור מולקולות נוירוטרנסמיטר מהשלפוחיות הסינפטיות כדי להעביר את האות שלהן, יש עיכוב של כאלפית השנייה בין כאשר פוטנציאל האקסון מגיע למסוף הפרסינפטי לבין כאשר המוליך העצבי מוביל לפתיחת תעלות יונים פוסט -סינפטיות. בנוסף, איתות זה הוא חד כיווני. איתות בסינפסות חשמליות, לעומת זאת, הוא כמעט מיידי (וזה חשוב לסינפסות המעורבות ברפלקסים מרכזיים), וחלק מהסינפסות החשמליות הן דו כיווניות. סינפסות חשמליות גם אמינות יותר מכיוון שהן נוטות פחות להיחסם, והן חשובות לסנכרון הפעילות החשמלית של קבוצת נוירונים. לדוגמה, סינפסות חשמליות בתלמוס נחשבות כמווסתות שינה בגל איטי, ושיבוש הסינפסות הללו עלול לגרום להתקפים.
סיכום אותות
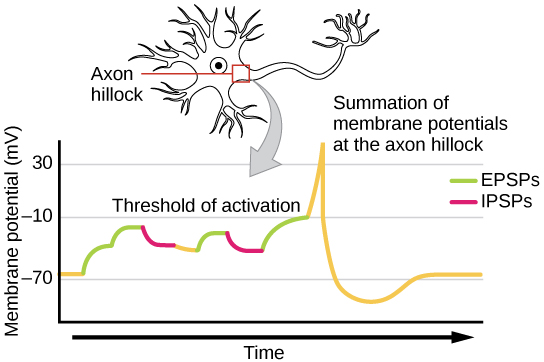
לפעמים EPSP יחיד חזק מספיק כדי לגרום לפוטנציאל פעולה בנוירון הפוסט -סינפטי, אך לעתים קרובות תשומות פרסינפטיות מרובות חייבות ליצור EPSPs בערך באותו זמן כדי שהנוירון הפוסט -סינפטי יהיה מקוטב מספיק כדי לירות פוטנציאל פעולה. תהליך זה נקרא סיכום ומתרחש בגבעת האקסון, כפי שמודגם באיור. \(\PageIndex{8}\) בנוסף, לנוירון אחד יש לעתים קרובות תשומות מנוירונים פרסינפטיים רבים - חלקם מעוררים וחלקם מעכבים - כך ש- IPSPs יכולים לבטל EPSPs ולהיפך. השינוי נטו במתח הממברנה הפוסט-סינפטית הוא שקובע אם התא הפוסט-סינפטי הגיע לסף העירור שלו הדרוש להפעלת פוטנציאל פעולה. יחד, סיכום סינפטי וסף העירור פועלים כמסנן כך ש"רעש "אקראי במערכת לא מועבר כמידע חשוב.
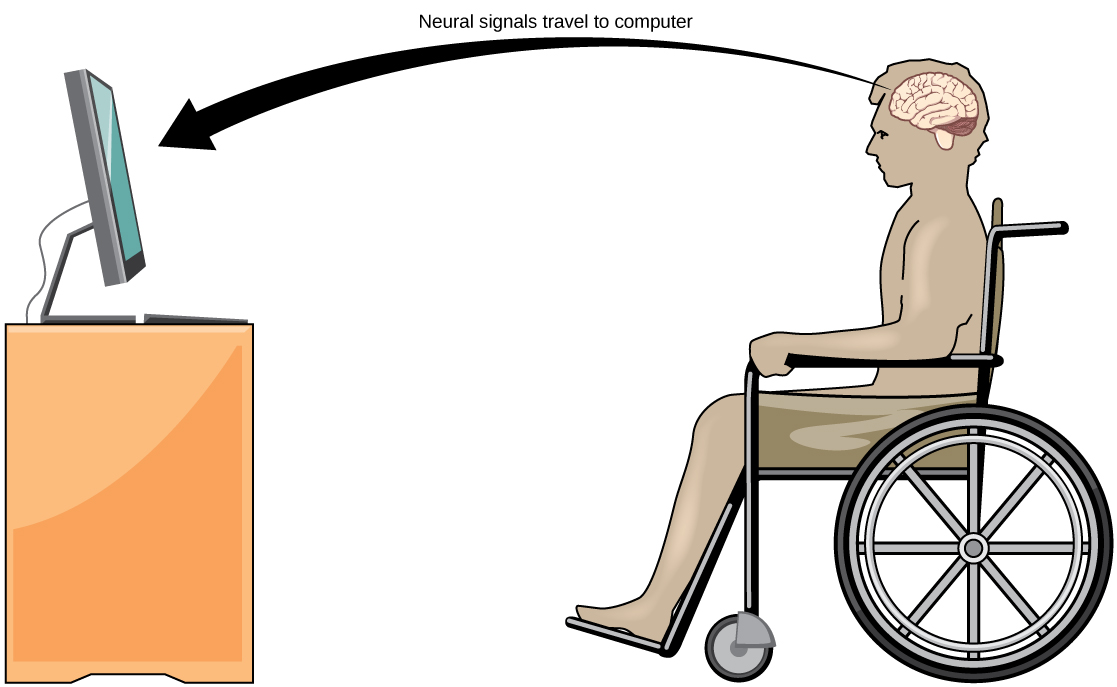
חיבור יומיומי: ממשק מוח-מחשב
טרשת לרוחב אמיוטרופית (ALS, המכונה גם מחלת לו גריג) היא מחלה נוירולוגית המאופיינת בניוון הנוירונים המוטוריים השולטים בתנועות מרצון. המחלה מתחילה בהיחלשות שרירים וחוסר קואורדינציה ובסופו של דבר הורסת את הנוירונים השולטים בדיבור, בנשימה ובבליעה; בסופו של דבר המחלה עלולה להוביל לשיתוק. בשלב זה, חולים זקוקים לסיוע ממכונות כדי להיות מסוגלים לנשום ולתקשר. מספר טכנולוגיות מיוחדות פותחו כדי לאפשר לחולים "נעולים" לתקשר עם שאר העולם. טכנולוגיה אחת, למשל, מאפשרת למטופלים להקליד משפטים על ידי עווית בלחי. לאחר מכן ניתן לקרוא משפטים אלה בקול רם על ידי מחשב.
קו מחקר חדש יחסית לסיוע לחולים משותקים, כולל אלה הסובלים מ- ALS, לתקשר ולשמור על מידה של עצמאות נקרא טכנולוגיית ממשק מוח-מחשב (BCI) ומודגם באיור. \(\PageIndex{9}\) טכנולוגיה זו נשמעת כמו משהו מתוך מדע בדיוני: היא מאפשרת לחולים משותקים לשלוט במחשב באמצעות מחשבותיהם בלבד. ישנן מספר צורות של BCI. צורות מסוימות משתמשות בהקלטות EEG מאלקטרודות המודבקות על הגולגולת. הקלטות אלה מכילות מידע מאוכלוסיות גדולות של נוירונים שניתן לפענח על ידי מחשב. צורות אחרות של BCI דורשות השתלה של מערך אלקטרודות קטן יותר מחותמת דואר באזור הזרוע והיד של קליפת המוח המוטורית. צורה זו של BCI, למרות שהיא פולשנית יותר, היא חזקה מאוד מכיוון שכל אלקטרודה יכולה לתעד פוטנציאל פעולה ממשי מנוירון אחד או יותר. אותות אלה נשלחים לאחר מכן למחשב, אשר הוכשר לפענח את האות ולהזינו אותו לכלי - כגון סמן על מסך מחשב. המשמעות היא שחולה עם ALS יכול להשתמש בדואר אלקטרוני, לקרוא באינטרנט ולתקשר עם אחרים על ידי מחשבה להזיז את ידו או זרועו (למרות שהמטופל המשותק אינו יכול לבצע את התנועה הגופנית הזו). ההתקדמות האחרונה אפשרה לחולה נעול משותק שסבל משבץ מוחי לפני 15 שנה לשלוט בזרוע רובוטית ואף להאכיל את עצמה בקפה בטכנולוגיית BCI.
למרות ההתקדמות המדהימה בטכנולוגיית BCI, יש לה גם מגבלות. הטכנולוגיה יכולה לדרוש שעות רבות של אימונים ותקופות ארוכות של ריכוז אינטנסיבי עבור המטופל; זה יכול גם לדרוש ניתוח מוח להשתלת המכשירים.
קישור ללמידה
צפו בסרטון זה בו אישה משותקת משתמשת בזרוע רובוטית מבוקרת מוח בכדי להביא משקה לפיה, בין תמונות אחרות של טכנולוגיית ממשק מוח-מחשב בפעולה.
פלסטיות סינפטית
סינפסות אינן מבנים סטטיים. הם יכולים להיות מוחלשים או מתחזקים. הם יכולים להישבר, וניתן לבצע סינפסות חדשות. הפלסטיות הסינפטית מאפשרת שינויים אלה, שכולם נחוצים למערכת עצבים מתפקדת. למעשה, פלסטיות סינפטית היא הבסיס ללמידה וזיכרון. שני תהליכים בפרט, פוטנציאל לטווח ארוך (LTP) ודיכאון לטווח ארוך (LTD) הם צורות חשובות של פלסטיות סינפטית המתרחשות בסינפסות בהיפוקמפוס, אזור מוח המעורב באחסון זיכרונות.
פוטנציאל לטווח ארוך (LTP)
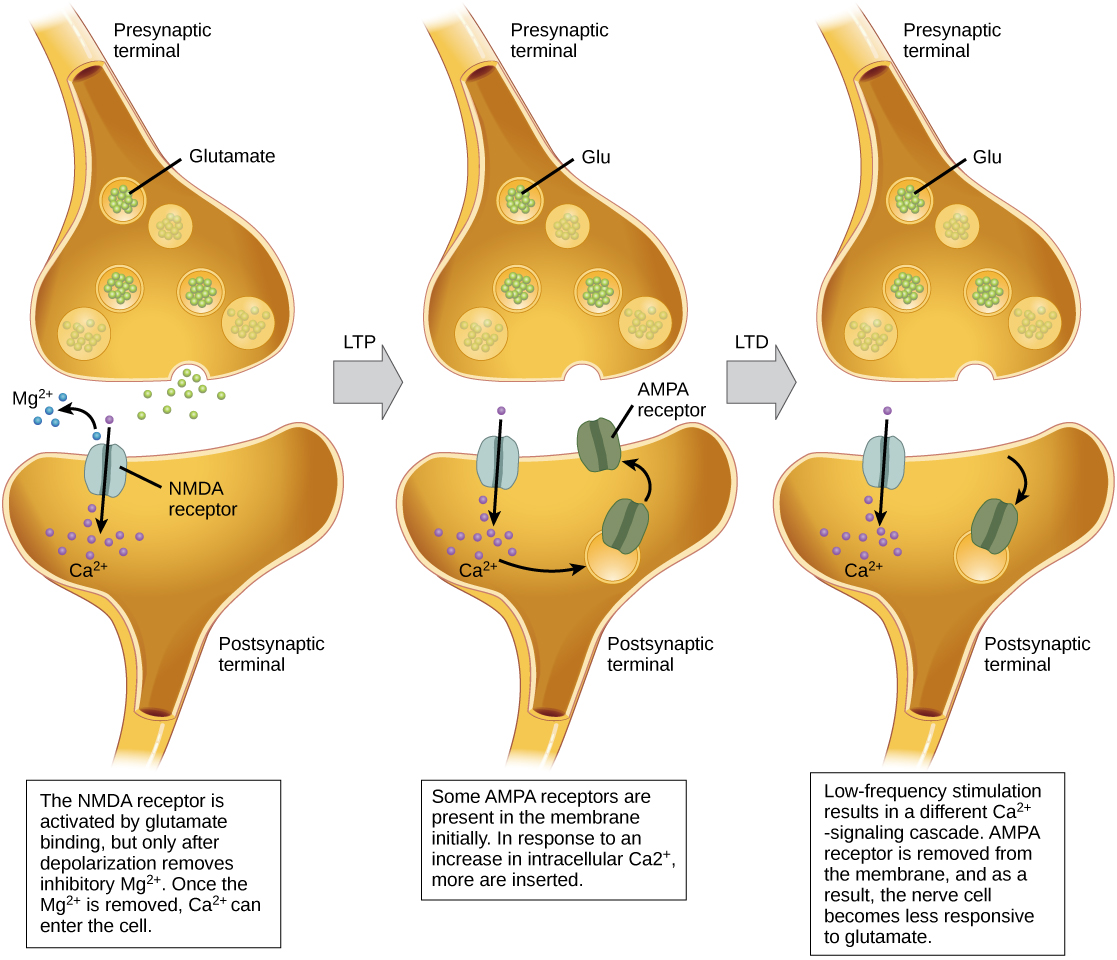
פוטנציאל לטווח ארוך (LTP) הוא חיזוק מתמשך של קשר סינפטי. LTP מבוסס על העיקרון הבבי: תאים שיורים יחד חוטים יחד. ישנם מנגנונים שונים, אף אחד לא מובן לחלוטין, מאחורי החיזוק הסינפטי שנראה עם LTP. מנגנון ידוע אחד כולל סוג של קולטן גלוטמט פוסט-סינפטי, הנקרא קולטני NMDA (N-methyl-D-aspartate), המוצג באיור. \(\PageIndex{10}\) קולטנים אלה נחסמים בדרך כלל על ידי יוני מגנזיום; עם זאת, כאשר הנוירון הפוסט-סינפטי מקוטב על ידי תשומות פרסינפטיות מרובות ברצף מהיר (בין נוירון אחד או ממספר נוירונים), יוני המגנזיום נאלצים לצאת ומאפשרים ליוני Ca לעבור לתא הפוסט-סינפטי. לאחר מכן, יוני Ca 2+ הנכנסים לתא יוזמים מפל איתות הגורם לסוג אחר של קולטן גלוטמט, הנקרא AMPA (α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid), להיות מוכנס לתוך הפוסט-סינפטי קרום, שכן קולטני AMPA מופעלים מאפשרים ליונים חיוביים להיכנס לתא. לכן, בפעם הבאה שגלוטמט ישתחרר מהממברנה הפרסינפטית, תהיה לו השפעה מעוררת גדולה יותר (EPSP) על התא הפוסט-סינפטי מכיוון שהקישור של גלוטמט לקולטני AMPA אלה יאפשר יונים חיוביים יותר לתא. החדרת קולטני AMPA נוספים מחזקת את הסינפסה ומשמעותה שהנוירון הפוסט-סינפטי נוטה יותר לירות בתגובה לשחרור נוירוטרנסמיטר פרסינפטי. כמה תרופות של שימוש לרעה משתפות במסלול ה- LTP, וחיזוק סינפטי זה יכול להוביל להתמכרות.
דיכאון לטווח ארוך (LTD)
דיכאון לטווח ארוך (LTD) הוא בעצם ההפך מ- LTP: זהו היחלשות ארוכת טווח של קשר סינפטי. מנגנון אחד הידוע כגורם LTD כולל גם קולטני AMPA. במצב זה, סידן שנכנס דרך קולטני NMDA יוזם מפל איתות שונה, מה שמביא להסרת קולטני AMPA מהממברנה הפוסט-סינפטית, כפי שמודגם באיור. \(\PageIndex{10}\) הירידה בקולטני AMPA בממברנה גורמת לנוירון הפוסט -סינפטי להגיב פחות לגלוטמט המשתחרר מהנוירון הפרסינפטי. למרות שזה אולי נראה לא אינטואיטיבי, LTD עשויה להיות חשובה לא פחות ללמידה וזיכרון כמו LTP. היחלשות וגיזום הסינפסות שאינן בשימוש מאפשרות לאבד קשרים לא חשובים והופכת את הסינפסות שעברו LTP לחזקות בהרבה בהשוואה.
סיכום
לנוירונים יש ממברנות טעונות מכיוון שיש ריכוזים שונים של יונים בתוך התא ומחוצה לו. תעלות יונים בשער מתח שולטות בתנועת היונים אל תוך נוירון ומחוצה לו. כאשר קרום עצבי עובר דפולריזציה לפחות לסף העירור, פוטנציאל פעולה נורה. פוטנציאל הפעולה מופץ לאחר מכן לאורך אקסון מיאליני אל מסופי האקסון. בסינפסה כימית, פוטנציאל הפעולה גורם לשחרור מולקולות נוירוטרנסמיטר לתוך השסע הסינפטי. באמצעות קישור לקולטנים פוסט-סינפטיים, המוליך העצבי יכול לגרום לפוטנציאלים פוסט-סינפטיים מעוררים או מעכבים על ידי דה-פולריזציה או היפרפולריזציה, בהתאמה, של הממברנה הפוסט-סינפטית. בסינפסות חשמליות, פוטנציאל הפעולה מועבר ישירות לתא הפוסט-סינפטי דרך צומת פערים-חלבוני ערוצים גדולים המחברים בין הממברנות הטרום-פוסט-סינפטיות. סינפסות אינן מבנים סטטיים וניתן לחזק ולהחליש אותן. שני מנגנונים של פלסטיות סינפטית הם פוטנציאל לטווח ארוך ודיכאון לטווח ארוך.
חיבורי אמנות
איור\(\PageIndex{3}\): חוסמי תעלות אשלגן, כגון אמיודרון ופרוקאינמיד, המשמשים לטיפול בפעילות חשמלית חריגה בלב, הנקראת הפרעות קצב לב, מעכבים את תנועת K+ דרך ערוצי K+ בשער מתח. על איזה חלק מפוטנציאל הפעולה היית מצפה שתעלות אשלגן ישפיעו?
- תשובה
-
חוסמי תעלות אשלגן מאטים את שלב הקיטוב מחדש, אך אין להם השפעה על הדפולריזציה.
רשימת מילים
- פוטנציאל פעולה
- שינוי רגעי המתפשט בעצמו בפוטנציאל החשמלי של קרום נוירון (או שריר)
- דפולריזציה
- שינוי בפוטנציאל הממברנה לערך פחות שלילי
- פוטנציאל פוסט-סינפטי מעורר (EPSP)
- דפולריזציה של קרום פוסט -סינפטי הנגרם על ידי מולקולות נוירוטרנסמיטר המשתחררות מתא פרסינפטי
- היפרפולריזציה
- שינוי בפוטנציאל הממברנה לערך שלילי יותר
- פוטנציאל פוסט-סינפטי מעכב (IPSP)
- היפרפולריזציה של קרום פוסט -סינפטי הנגרמת על ידי מולקולות נוירוטרנסמיטר המשתחררות מתא פרסינפטי
- דיכאון לטווח ארוך (LTD)
- ירידה ממושכת בצימוד הסינפטי בין תא טרום ופוסט-סינפטי
- פוטנציאל לטווח ארוך (LTP)
- עלייה ממושכת בצימוד הסינפטי בין תא טרום ופוסט-סינפטי
- פוטנציאל ממברנה
- הבדל בפוטנציאל החשמלי בין החלק הפנימי והחיצוני של התא
- תקופה עקשן
- תקופה לאחר פוטנציאל פעולה כאשר קשה יותר או בלתי אפשרי לירות פוטנציאל פעולה; נגרמת על ידי השבתה של תעלות נתרן והפעלה של תעלות אשלגן נוספות של הממברנה
- הולכה מלוחה
- "קפיצה" של פוטנציאל פעולה לאורך אקסון מצומת אחד של Ranvier למשנהו
- סיכום
- תהליך של כניסות פרה-סינפטיות מרובות היוצרות EPSPs בערך באותו זמן כדי שהנוירון הפוסט -סינפטי יהיה דה-קוטבי מספיק כדי לירות פוטנציאל פעולה
- שסע סינפטי
- מרווח בין הממברנות הפרסינפטיות והפוסט-סינפטיות
- שלפוחית סינפטית
- מבנה כדורי המכיל מוליך עצבי
- סף של עירור
- רמת הדפולריזציה הדרושה לפוטנציאל פעולה לירות


